Сообщение 1. Применение элементного фтора для синтеза фторорганических соединений"
Поступило в редакцию: Июль 2025
УДК 661.48
Fluorine Notes, 2025, 161, 1-2
НЕКОТОРЫЕ НАПРАВЛЕНИЯ ХИМИИ ФТОРА. СБОРНИК СООБЩЕНИЙ
СООБЩЕНИЕ 1. ПРИМЕНЕНИЕ ЭЛЕМЕНТНОГО ФТОРА ДЛЯ СИНТЕЗА ФТОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В.В. Корнилов
Аннотация: Рассмотрены возможные механизмы фторирования углеводородов и алкенов элементарным фтором. Проведен краткий обзор классических методов фторирования элементарным фтором. Приведены примеры использования элементарного фтора в промышленных процессах для синтеза фторорганических соединений.
Ключевые слова: элементный фтор, свободно-радикальные процессы, рекомбинация радикалов, фторирование, фторорганические соединения.
Введение
Статьи этой серии основаны на лекциях, подготовленных в 2018-2019 для выступлений перед студентами в Zhejiang Normal University (провинция Zhejiang, Jinhua, Китай).
Первоначальная идея таких лекций принадлежала профессорам базового факультета Ленинградского Технологического Института им. Ленсовета в ГИПХ (Государственный институт прикладной химии) Б.Н. Максимову, В.Г. Барабанову и И.Л. Серушкину, которые передавали в 80-х гг. прошлого столетия свои знания в области химии фтора студентам старших курсов, в том числе и автору статьи.
Такая форма обучения позволяла выпускать специалистов, которые к моменту получения диплома высшего учебного заведения уже имели хороший задел знаний в будущей работе по специальности. Поэтому хочу выразить признательность своим учителям за их научную и образовательную деятельность.
К публикации будет подготовлено часть наиболее интересных с точки зрения автора сообщений, в которых была сделана попытка учесть как современный уровень знаний в этой области, так и появившиеся в последние десятилетия новые направления применения фтора и его соединений.
1. Механизм фторирования элементным фтором
Реакции фторирования элементным фтором имеют все признаки свободно-радикальных процессов, механизм которых подобен известному механизму реакций фотохимического хлорирования (Таблица 1) [1]:
Таблица 1.
|
Chlorination |
ΔH kJ/mol |
Fluorination |
ΔH kJ/mol |
|
Chain Initiation: 1. Cl2 + hv→2Cl∙ |
242,83 |
Chain Initiation: 1a. F2 →2F∙ |
157,01 |
|
Chain Propagation and Transfer: 2. RH + Cl∙ → R∙ + HCl 3. R∙ + Cl2→RCl + Cl∙ |
-12,56 -96,29 |
Chain Propagation and Transfer: 2. RH + F∙ → R∙ + HF 3. R∙ + F2→RF + F∙ |
-142,35 -284,70 |
|
Chain Termination: 4. R∙ + Cl∙ →RCl 5. Cl∙ + Cl∙ → Cl2 6. R∙ + R∙ → R–R |
-334,91 -242,83 -347,46 |
Chain Termination 4. R∙ + F∙ →RF 5. F∙ + F∙ → F2 6. R∙ → Fragmentation |
-447÷ -468 -157,01 |
Низкое значение энергии диссоциации молекулы фтора обуславливает то, что в реакциях может участвовать значительное число атомов фтора даже при комнатной температуре.
Энергия, выделяющаяся при образовании связей F-H и C-F, тратится на диссоциацию атомов фтора. Поэтому элементный фтор бурно реагирует с органическими веществами, причем эти реакции в большинстве случаев не являются избирательными (Таблица 2).
Таблица 2. Селективность действия различных радикалов Х∙ на первичные, вторичные и третичные атомы водорода в алканах.
|
Радикал |
– CH3 |
– CH2 - | |
|
X=F∙ |
1 |
1,2 |
1,4 |
|
X=Cl∙ |
1 |
3,9 |
5,1 |
|
X=Br∙ |
1 |
82 |
1600 |
Серьезные трудности в использовании молекулярного фтора обусловлены также высокой энергией образования связей С-F и H-F ( 456 и 560 kJ/mol соответственно) [2]. Эта энергия превышает энергию связи С-С [347,46 kJ/mol], что приводит к фрагментации углеродного скелета органических соединений.
В 1956 г. Миллер [3] предложил схему (Схема 1), отличающуюся от общепринятого радикально-цепного механизма. В соответствии с предложенной схемой молекула фтора реагирует с молекулой углеводорода, давая алкильный радикал, фтористый водород и атом фтора.
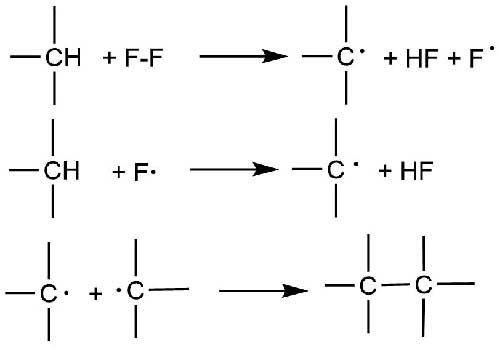
Схема 1.
Этот путь появления радикалов фтора (F∙) более энергетически предпочтителен, чем диссоциация молекулы фтора на атомы ( 16,3 kJ/mol [2] против 157,01 kJ/mol для диссоциации фтора) и может быть вполне вероятен, особенно при низких температурах фторирования (-40°С и ниже). Однако, четких экспериментальных доказательств приведено не было.
2. Взаимодействие элементного фтора с олефинами
Взаимодействие фтора с олефинами может происходить как по двойной связи, так и через замещение водорода. При этом, обычно, получается сложная смесь соединений. Однако в случае, если в олефине все атомы водорода замещены хлором и/или фтором, возможно проведение синтезов с получением целевых продуктов.
Были изучены параметры проведения таких процессов и предложен вероятный общий механизм реакций, который объяснял состав получаемых продуктов [4]. Реакции проводили при низкой температуре и перемешивании.
Ключевой чертой предложенного механизма было предположение того, что молекула фтора быстро реагирует с двойной связью олефина даже при низкой температуре с образованием фторированного радикала и атома фтора (Схема 2, реакция 1).
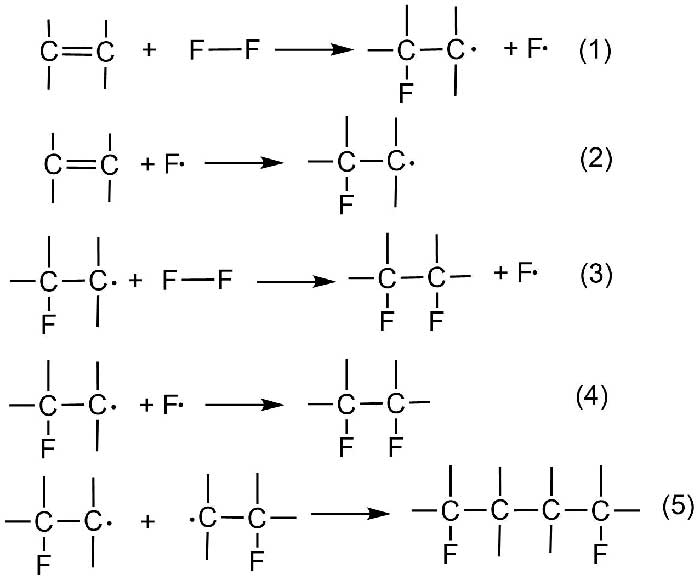
Схема 2.
Этот процесс инициирования цепи определяет общую скорость реакции. Далее атом фтора может реагировать либо с новой молекулой олефина с образованием нового фторированного радикала (реакция 2) или вступать в реакцию рекомбинации с фторированным радикалом (реакция 4). При этом по реакции 4 происходит обрыв цепи. Объединение радикалов, которые получаются по реакциям 1 и 2 приводит к получению продуктов димеризации (реакция 5).
Протекание реакций 1 и 2 было показано экспериментами, когда в реакциях с олефином участвовали кислород или хлор, а фтор присутствовал только в малых количествах, как инициатор. Так, сама по себе нереакционная смесь тетрахлорэтилена (2,8 моль) и хлора (1,1 моль) была превращена в гексахлорэтан (с выходом 85%) в присутствии следов фтора (0,02 моль) (Схема 3) [5].
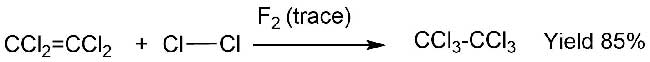
Схема 3.
Вся схема реакций 1-5 представлена в работе [6] (Рисунок 1). Было установлено, что образование более высоких продуктов рекомбинации, чем димеры, в процессе реакции перфторхлоролефинов с фтором не происходило (реакция 6).
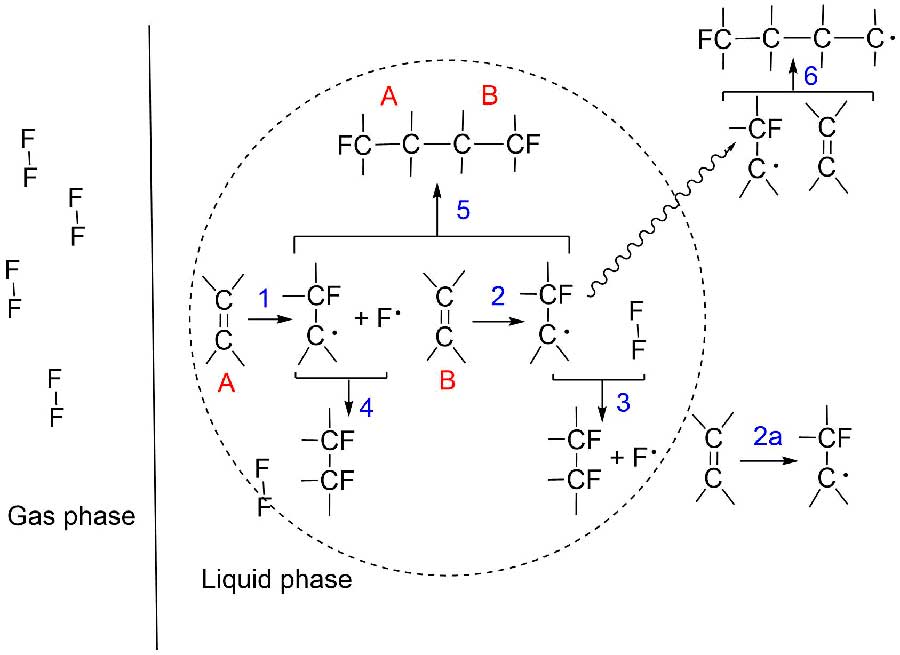
Рисунок 1. Возможные реакции при взаимодействии галогенированных олефинов с фтором [6].
Считается, что рекомбинация радикалов (путь 5) или взаимодействие с новой молекулой фтора более вероятны, чем присоединение алкильного радикала к новой молекуле олефина с образованием полимера.
Таким образом, с помощью регулирования концентрации и скорости подачи фтора, а также изменения температуры проведения синтеза, можно направлять процесс в нужную сторону.
В Таблице 3 представлены результаты фторирования фторхлорэтиленов при различных температурах и соотношениях фтор-азотной смеси [6]. Во всех экспериментах скорость подачи фтора составляла 0,8 г/час.
Таблица 3. Результаты фторирования фторхлорэтиленов при различных температурах и соотношениях фтор-азотной смеси.
|
Алкен |
N2/F2 Соотношение |
Темп. °C |
Соотношение (мол.) C2F2X4/C4F2X8 |
Выход димера (%) |
|
CFCl=CFCl |
8:1 8:1 |
-75 -110 |
0,8 0,5 |
35 52 |
|
CF2=CCl2 |
8:1 45:1 |
-110 -110 |
0,3 0,3 |
77 79 |
|
CF2=CFCl |
8:1 8:1 45:1 |
-110 -150 -150 |
2 0,7 0,4 |
14 48 64 |
Открытые закономерности процесса фторирования гелогеналкенов элементным фтором имеют практическое применение (см. 4.1).
3. Методы фторирования
Наиболее полно обзоры классических методов фторирования элементным фтором представлены Теддером в книге «Успехи химии фтора» [7], а также в «Методах органической химии» Houben-Weyl [8].
Главной задачей при прямом фторировании является отвод тепла реакции. Это достигается следующими путями:
1) пропусканием смеси фтора и инертного газа через охлажденную жидкость,
2) проведением реакции в присутствии измельченной металлической насадки,
3) проведением реакции в паровой фазе при разбавлении смеси большим количеством инертного газа.
В первом случае смесь фтора с инертным газом или чистый фтор барботируют через исходное соединение, растворенный в инертном растворителе, либо в отсутствии растворителя при пониженной температуре.
Применение инертных растворителей (хлорфторуглероды, фторуглероды, фтористый водород и др.) облегчает процесс, но вносит дополнительные сложности. Например, четыреххлористый углерод является хорошим растворителем, но он недостаточно инертен, в то же время фторуглероды хотя и инертны, но являются более слабыми растворителями органических соединений.
Метод в присутствии измельченной металлической насадки, состоит в пропускании паров органических соединений и разбавленного азотом фтора через реактор с насадкой из раздробленного металла. Назначение металлической насадки состоит в рассеивании тепла реакции, и поэтому фторирование протекает при низкой или умеренной температуре. Если фторирование проводят при высокой температуре, то не исключается, что на поверхности металла образуется слой фторидов элементов, и уже фторированная поверхность может действовать как фторирующий агент.
В различных исследованиях процессов фторирования температура процесса и степень разбавления азотом варьировалась в широких пределах.
Существуют и другие методики проведения фторирования элементным фтором (прямое аэрозольное фторирование и т.д.). Примеры фторирования с использованием современных методов можно найти в работах [2, 9].
Интерес к прямому фторированию объясняется тем, что в этом случае не требуется сложный многостадийный синтез для получения целевого соединения. Можно сконструировать углеводородную молекулу, взяв за основу доступные компоненты, а потом попробовать заместить необходимые атомы водорода на фтор.
Так в работе Ш. Розена [10] описано замещение водорода на фтор у третичного атома углерода в сложных молекулах при низких температурах.
Например, при обработке транс-4-метилциклогексил p-нитробензоата (1) смесью 3-4% фтора и азота в качестве главного продукта был идентифицирован транс-4-фтор-4-метилциклогексил p- нитробензоат (2) с 60%м выходом (Схема 4).
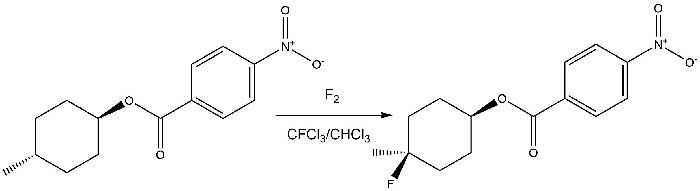
Схема 4.
Также в этой работе предложен метод получения важного класса фторированных соединений, а именно перфторалкилвиниловых эфиров ((RfOCF=CF2) согласно Схеме 5:
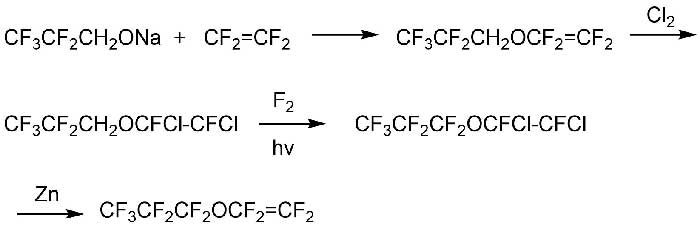
Схема 5.
Из 1,1,1,2,2 -пентафторпропанола и гидрида натрия получали соль, которая затем взаимодействовала с тетрафторэтиленом с образованием винилового эфира. Для защиты двойной связи проводили хлорирование методом барботирования газообразного хлора при 10-15 °С.
Полученный продукт подвергали фторированию элементным фтором при следующих условиях:
- температура -10 °С
- фторирующий реагент 25% F2+ 75% N2
- растворитель перфторполиэфир Krytox GPL 100 + 5 g мелкодисперсного NaF для поглощения образующегося HF.
- облучение ртутной лампой 450 W
Выход продукта – перфторпропилвинилового эфира - составлял около 70%.
Тем не менее, несмотря на кажущуюся простоту метода и отдельные хорошие результаты, сложности в работе с элементным фтором приводят к тому, что в промышленности элементный фтор используется в ограниченном количестве процессов получения фторсодержащих органических соединений.
Особую сложность представляет фторирование соединений с функциональными группами (гидроксил, карбонил, амины и т.д), которое в большинстве случаев заканчивается деструкцией исходных соединений с потерей функциональных групп.
4. Примеры практического применения фторирования элементным фтором
4.1. Получение перфторполиэфиров (ПФПЭ) через инициирование фтором
Жидкофазное окисление перфторолефинов используют в промышленности для получения перфторполиэфиров (ПФПЭ), которые известны c 1960-х гг. под торговой маркой Fomblin® (Solvay).
Процесс окисления тетрафторэтилена (TFE) и гексафторпропилена (HFP) проводят молекулярным кислородом при пониженной температуре в присутствии инициатора с получением олигомерных продуктов (Схема 6).
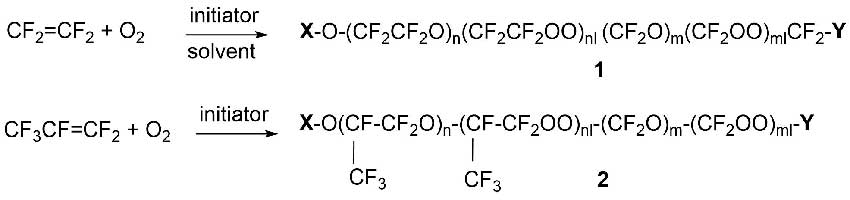
Схема 6
Группы X и Yна схеме 6 являются перфторалкильными или ацилфторидными (в большинстве случаев группы -CF3, -CF2CF3, -COF или -CF2COF).
Элементный фтор может выступать как один из химических инициаторов этих процессов [11,12].
Например, процесс окисления HFP схематично представлен на Схеме 7 [11]:
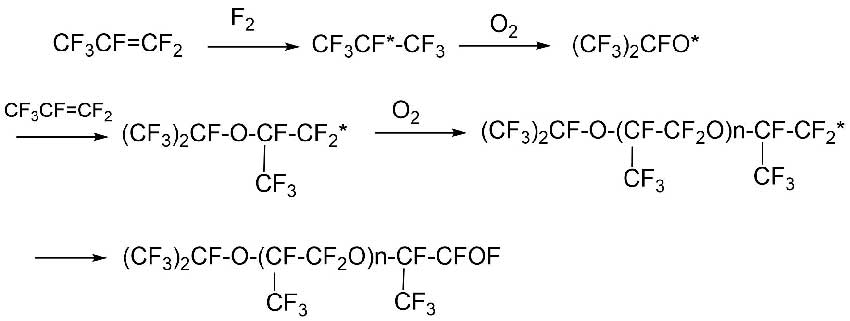
Схема 7.
4.2 Каталитическое фторирование оксида углерода [13]
Газофазное фторирование оксида углерода включает две стадии:
CO + F2= COF2 –525 кДж/моль
COF2 + F2= CF3OF –135 кДж/моль
Скорость второй стадии этого процесса – взаимодействия карбонилдифторида и фтора, может быть существенно увеличена при использовании катализатора или инициатора.
Полученный трифторметилгипофторит (ТФМГФ) может быть использован в процессах синтеза ПФПЭ в качестве инициатора [14] (Схема 6).
4.3. Очистка перфторуглеродных жидкостей от непредельных и водородсодержащих полифторированных соединений газофазным фторированием [13].
В работе [13] приведено описание метода очистки полифторированных соединений от остаточного водорода и непредельных связей. В качестве примера приведен процесс фторирования Перфторметилциклогексана (ПФМЦГ), который содержал примеси водородсодержащих и непредельных соединений (Схема 8).
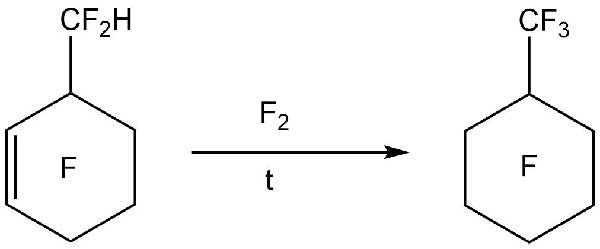
Схема 8.
В Таблице 4 приведены результаты фторирования ПФМЦГ на насадке NiF2/α-Al2O3. (мольное отношение ПФМЦГ : фтор = 1,4).
Таблица 4. Результаты фторирования ПФМЦГ на насадке NiF2/α-Al2O3 [13].
|
№ оп. |
Насадка |
Температура, К |
Степень деструкции субстрата, % |
Степень очистки от недофторирированных примесей, % |
|
1 |
NiF2/α-Al2O3 |
573 |
0,1 |
99,2 |
|
2 |
-«- |
573 |
0,2 |
99,2 |
|
3 |
-«- |
623 |
0,2 |
99,5 |
|
4 |
-«- |
623 |
0,2 |
99,5 |
|
5 |
-«- |
673 |
0,3 |
99,8 |
|
6 |
-«- |
673 |
0,2 |
99,9 |
4.4 Получение нейтральных перфторполиэфиров (ПФПЭ)
Процесс получения нейтральных ПФПЭ заключается в замене оконечных ацилфторидных групп (X и/или Y, схема 6), которые получаются в процессе жидкофазного окисления TFE или HFP (см. п. 4.1), на полностью фторированные (Схема 9) [15].
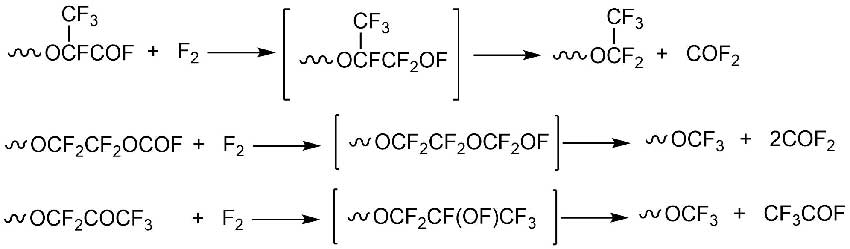
Схема 9 [15].
Реакции осуществляют путем барботирования фтор-азотной смеси через слой исходного ПФПЭ с ацилфторидными группами при небольшом повышенном давлении, либо при повышенной температуре (часто превышающей 200ºС), либо при температуре ниже 100 ºC с одновременным УФ-облучением.
Предполагается, что процесс проходит через промежуточную стадию образования гипофторитов (Схема 9).
Литература
- A Sheppard W.A., Sharts C.M., Organic Fluorine Chemistry, W.A. Benjamin, New York, 1969.
- Chambers R., Fluorine in Organic Chemistry, Blackwell Publishing Ltd, 2004, ISBN 1-4051-0787-1.
- Miller W., Dittman A. The Mechanism of Fluorination. I. Fluorine Sensitized Oxidation of Trichloro- and Tetrachloroethylene// J.Am.Chem.Soc.-1956.- v.78-p. 2793; b)
- Miller W., Koch S. The mechanism of Fluorination III// J.Am.Chem.Soc.-1957.- v.79- p.3084.
- Miller, William T., Koch, Stanley D., McLafferty, Fred W. The Mechanism of Fluorination. II. Free Radical Initiation Reactions. Fluorine-sensitized Chlorination and Oxidation// J.Am.Chem.Soc.-1956.-V. 78., Iss. 19.DOI: 10.1021/ja01600a050
- Miller, William T., Stoffer James, Fuller George and Currie Andrew. The Mechanism of Fluorination IV. The Effect of Temperature and of Fluorine Concentration upon the Olefin Dimerization Reaction. A New Fluorination Apparatus. // J.Am.Chem.Soc.-1964-V. 86 – p.51
- Tedder J.M., The fluorination of organic compounds using elementary fluorine. In: M. Stacey, J. C. Tatlow, and A. G. Sharpe (Eds.). Advances in Fluorine Chem. 2, 104–137 (1961).
- Houben-Weyl Methods of Organic Chemistry Vol. E 10a, 4th Edition Supplement: Organo-Fluorine Compounds - Fluorinating Agents and Their Application in Organic Synthesis, eds. Bernd Baasner, Thieme, 2014, ISBN 3131815442, 9783131815446.
- Okazoe, T. (2018). Perfluorination with F2. In: Hu, J., Umemoto, T. (eds) Fluorination. Synthetic Organofluorine Chemistry. Springer, Singapore, DOI: 10.1007/978-981-10-1855-8_22-1.
- Rozen S., Direct Fluorination of Organic Compounds with Elemental Fluorine. //Efficient Preparations of Fluorine Compounds, First Edition. Edited by Herbert W. Roesky, 2013, John Wiley & Sons, Inc., p. 146.
- B.N. Maksimov, V.V. Kornilov, B.A. Melnichenko, L.N. Kosareva. Perfluoropolyethers. Synthesis and Application. // Russian Journal of Applied Chemistry, 2009, Vol. 82, No. 9, pp. 1706−1710. DOI: 10.1134/S107042720909033X.
- D. Sianesi, P. A. Guarda, G. Marchionni, A Kinetic and Mechanistic Study of the Low-Temperature Fluorine-Initiated Copolymerization of Tetrafluoroethylene with Oxygen, Macromolecules, 1999, Vol. 32, Iss. 23, pp. 7768-7780, DOI: 10.1021/ma9906985..
- Vladimir Y. Zakharov. Chemistry and Technology of Polyfluorinated Organic Compounds Based on New Aggression Resistant Catalysts. // Fluorine Notes, Iss. 4(95), 2014, http://en.notes.fluorine1.ru/public/2014/4_2014/retro/index.html.
- Pat. US5258110, Process for preparing peroxidic perfluoropolyethers, 1993.
- Sianesi, D., Marchionni, G., De Pasquale, R.J. Perfluoropolyethers (PFPEs) from Perfluoroolefin Photooxidation. In: Banks, R.E., Smart, B.E., Tatlow, J.C. (eds) Organofluorine Chemistry. Topics in Applied Chemistry. Springer, Boston, 1994, MA. DOI: 10.1007/978-1-4899-1202-2_21.
Статья рекомендована к публикации членом редколлегии
Fluorine Notes, 2025, 161, 1-2


