Поступило в редакцию: Декабрь 2024
УДК 542.06: 542.943-92: 543.612.3: 543.618: 547-31/-39: 543.632.559
Fluorine Notes, 2025, 158, 3-4
ПОЛУЧЕНИЕ ФТОРСУЛЬФОНИЛОКСАДИФТОРАЦЕТИЛФТОРИДА ПРИ ТЕРМИЧЕСКОМ ОКИСЛЕНИИ ПЕРФТОРАЛЛИЛФТОРСУЛЬФАТА МОЛЕКУЛЯРНЫМ КИСЛОРОДОМ
Чернявский Г.Г., Кулаченков С.А., Осетрова Л. В., Соколов Ю.П., Емельянов Г. А.
Научно-исследовательский институт синтетического каучука 198035, Санкт-Петербург, ул. Гапсальская, 1
Аннотация: Описано получение с высоким (более 90мольн. %) выходом фторсульфонилоксадифторацетилфторида ФСОАФ FSO2OCF2COF путем термического окисления перфтораллилфторсульфата АФС CF2=CFCF2OSO2F молекулярным кислородом. Данные ЯМР спектроскопии на ядрах 13С и 19F, а также ИК-исследование подтверждают строение полученного продукта ФСОАФ.
Ключевые слова: перфтораллилфторсульфат, фторированные полимеры.
При производстве компонентов современной техники для эксплуатации в экстремальных условиях требуются новые фторэластомеры и фторполимеры с более широким диапазоном рабочих температур по сравнению с результатами, достигнутым на настоящее время. Наиболее острой является задача производства бифункциональных фторорганических соединений – исходных реагентов для получения мономеров и сомономеров синтеза фторкаучуков (ФК), фторированных твердых полимеров (ФТП) - полимерных электролитов для водородной энергетики, содержащих функциональные группы, обеспечивающие возможность эффективной эксплуатации, а также структурирования и необходимого модифицирования синтезируемых продуктов.
Создание технологий синтеза бифункциональных фторорганических соединений, а также их производных, позволяет ликвидировать дефицит реагентов для получения современных термоморозоагрессивостойких каучуков и фторированных твердых полимеров (ФТП) - полимерных электролитов для водородной энергетики.
В начале 80-90х годов появились первые сообщения о синтезе и свойствах нового интересного продукта перфтораллилфторсульфата CF2=CFCF2OSO2F (АФС) [1-4.]
К 2011 году вышел большой обзор [5], где углубленно рассматривались различные аспекты реакционной способности нового синтона. Кроме вопросов собственно синтеза АФС, главный акцент в данной статье делается на его взаимодействии с нуклеофильными и радикальными реагентами, причем подчеркиваются как широкий спектр перспектив осуществления разнообразных превращений исходного продукта, так и возможность достижения высоких выходов целевых веществ при хорошей конверсии исходных.
К настоящему времени накоплен значительный материал об участии АФС и его производных также и в полимеризационных процессах с получением весьма интересных продуктов [6]. Однако в открытых источниках в значительно меньшей степени освещены процессы, связанные с оксигенацией перфтораллилфторсульфата. Так в патентах [7-8] речь идет о получении малонилдифторида в результате разложения окиси пефтораллилфторсульфата, получаемой при взаимодействии АФС с кислородом. Аналогичные вопросы более подробно изучены в работе [9].
Кратко процессы, отражающие свойства АФС при окислении кислородом показаны на схеме 1:
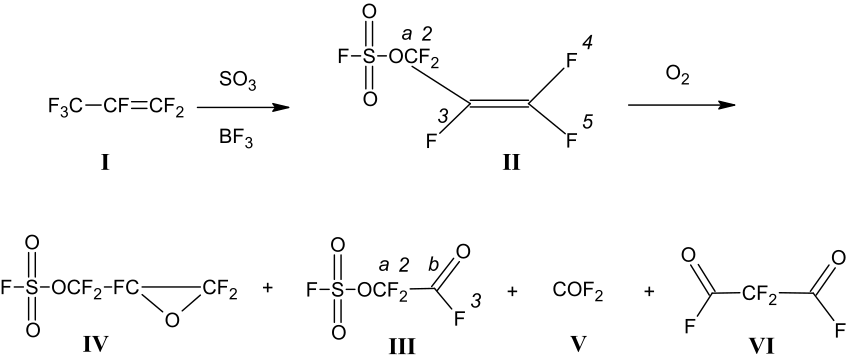
Схема 1. Процессы, отражающие свойства АФС при окислении кислородом.
При каталитическом сульфотриоксидировании гексафторпропена (I) образуется перфтораллилфторсульфат АФС CF2=CFCF2OSO2F (II) [1-4], который при окислении кислородом образует оксиран (IV), фторсульфонилоксадифторацетилфторид (III), карбонилфторид(V) и малонилдифторид FOCCF2COF (VI) [7-9].
В результате оксигенации (II) получается смесь соединений (III), (V), (IV), (VI) и продуктов олигомеризации оксирана (IV). По мнению авторов работы [9], фторангидрид (III) может являться продуктом термического разложения оксирана (IV). В этой работе [9] процесс термического разложения соединения (IV) при воздействии различных нуклеофильных агентов был подробно изучен, причем фторангидрид (III) среди продуктов реакции был идентифицирован спектрально, а его выход установлен как 0,5 мольных %. Температура кипения, плотность и другие физико-химические характеристики установлены не были.
В патенте [10] был достигнут существенно более высокий выход целевого продукта (более 90 мольных процента) но жесткие условия процесса (высокая температура (190-220°С), многократный избыток кислорода (до пятикратного) при наличии индукционного эффекта начала процесса делала его непригодным для безопасного промышленного масштабирования.
Для устранения вышеуказанных проблем, ограничивающих промышленное внедрение процесса, в настоящей работе нами была рассмотрена задача лабораторного исследования указанного процесса, представленного на схеме 1, для установления влияния температуры и ряда других факторов на ход этой реакции (см. таблицу 1).
Таблица 1. Влияние температуры на выход продуктов термического окисления молекулярным кислородом перфтораллилфторсульфата (II)a.
|
Температура, °С |
Выход, % |
|||
|
III |
IV |
олигомеры |
Конверсия соединения (II), % |
|
|
60-80б 80-100б 100-120в 120-140в 140-160в 160-165в 160-165гд 170-175ге |
6 8 14 21 31 52 96 95 |
62 68 74 70 59 41 2 2 |
29 22 17 12 9 6 2 3 |
43 58 73 88 100 100 100 100 |
а – выход, % мольных в расчете на конвертированное соединение (II), при полуторном мольном избытке кислорода;
б–имеется индукционный период;
в – имеется незначительный индукционный период;
г – индукционный период практически отсутствует;
д – добавлено 3 мольных % дибромида гексафторпропилена.
е – добавлено 7 мольных % дибромида тетрафторэтилена.
Как видно из таблицы 1, для получения соединения (III) методом термического окисления кислородом оптимальной является температура 160-165°С при добавлении 0,03 мольных % дибромида гексафторпропилена.
Кроме температуры, важным фактором при разработке методики синтеза может быть выбор растворителя. Так высококипящие инертные растворители, такие как C3F7OCF(CF3)CF(CF3)OC3F7 (VII) или другие фтороксауглероды или фторуглероды (перфтордекалин, перфторциклогексан и др.), используются в процессах термического окисления с целью подавления цепных реакций и уменьшения возможного чрезмерного экзотермического эффекта. Однако при значительном индукционном периоде их применение может вести к неконтролируемому течению процесса. В результате осуществления реакции целевого получения ФСОАФ в течение 4 ч при 195-200°С было установлено, что с увеличением доли растворителя (VII) в шихте с 10 до 50% выход соединения (III) практически не возрастает, а индукционный период продолжает иметь место. Таким образом, от применения высококипящих инертных растворителей, таких как (VII) в данной реакции можно отказаться. Среди интересных моментов, которые были экспериментально опробованы, является возможность использования в реакционной смеси от 3 до 7 мольных процента дибромида тетрафторэтилена или гексафторпропилена, когда индукционный период при окислении практически не наблюдается, как это имеет место для двух последних случаев, показанных в таблице 1.
Экспериментальная часть
Перфтораллилфторсульфат АФС (II) получали по методике [4] с чистотой 95-97% (контролируя при очистке температуру кипения продукта в районе точки отбора основной фракции при ректификации 63,5-64,0°С), а также с помощью спектроскопии ЯМР 19F и ГЖХ. Чистоту соединения (II) определяли при помощи ГЖХ на приборе ЛХМ-80. Условия хроматографического анализа соединения (II): колонка: 3000 х 3 мм, неподвижная фаза: 5% смеси перфторированных продуктов полимеризации окиси гексафторпропена общей формулы CF3(CF2)2O[CF(CF3)CF2O]nCF(CF3)COF на носителе Inerton AW–HMDS, (размер зерна 0.25-0.315 мм), детектор по теплопроводности, газ-носитель-гелий, скорость 40 см3/мин, температура термостата колонок 50°С, испарителя 100°С, детектора 100°С.
Структура полученного нами соединения (II) подтверждается данными ЯМР – спектров 19F и 13С. Спектр ЯМР 19F соединения (II) содержит пять сложных мультиплетных сигналов от ядер F со сдвигами δ1 +47.0 т.д., δ2 -73.2 д.д.д., δ3-192.7 д.д.т., δ4 – 103.7 д.д.т., δ5 – 90.1 д.д.т. и КССВ (Гц): 7.7 (J1,2=J2,1), 1.5 (J1,3=J3,1), 27.3 (J2,4=J4,2), 14.2 (J2,3=J3,2), 7.4 (J2,5=J5,2), 118.1 (J3,4=J4,3, транс), 39.0 (J3,5=J5,3, цис), 44.5 (J4,5=J5,4, гем). Цифры, соответствующие номерам атомов, соответствуют обозначениям на схеме 1.
Сигналы от ядер 13С соединения (II) – три мультиплета со сдвигами δa+118.0 т.д.д.д.д., δb+120.8 д.д.т.д.д., δc+155.1 д.д.д.т.и КССВ (Гц): 277.8 т. (Ja,2), 31.0 д. (Ja,3), 7.6 д. (Ja,5), 6.2 д. (Ja,4), 1.3 д. (Ja,1); 241.7 д. (Jb,3), 44.0 д. (Jb,4), 39.3 т. (Jb,2), 25.5 д. (Jb,5), 1.2 д. (Jb,1); 297.1 д (Jc,5), 294.7 д. (Jc,4), 38.4 (Jc,3), 2.4 т. (Jc,2), <0.5 д. (Jc,1).
Фторсульфонилоксадифторацетилфторид (III) получали в лабораторном реакторе с рубашкой вместимостью 0,75л, снабженном мешалкой. Процесс термического окисления проводили при примерно при полуторном (мольном) избытке окислителя и длительности взаимодействия 4 часа. Реактор, в котором был создан вакуум, наполнили смесью соединений (II) (230 г) и дибромида гексафторпропилена (9,3 г, 0,03м). После герметизации автоклава включили нагрев и перемешивание. При 160°С и работающей мешалке начали подачу 48 г (1,5 моль) кислорода с такой скоростью, чтобы температура реакционной массы не превышала 165оС.
По мере протекания процесса рост температуры снимается хладогентом, циркулирующим в рубашке аппарата. После подачи окислителя шихту выдерживали при 165°С 2 часа.
После охлаждения реактора до комнатной температуры и стравливания газообразных продуктов сырой продукт подвергли ректификации на лабораторной колонне с эффективностью 15-20 теоретических тарелок, отбирая фракции до 39, 39-41, 41-63, 63–65°С. Более 90% (по массе) соединения (III) содержалось во фракции 39-41°С. Выход составил182 г (93%мольн.).
Фторсульфонилоксадифторацетилфторид ФСОАФ FSO2OCF2COF представляет собой прозрачную бесцветную жидкость с резким запахом, Ткип.39.4°С, d204=1.6279. Найдено: S 16.3. Вычислено: S 16.35.
Структура полученного нами соединения (III) также подтверждается данными ЯМР 19F и 13С. Спектр ЯМР 19F cодержит три мультиплетных сигнала от ядер Fсо сдвигами δ1 +50.01 т.д., δ2 -77.53 д.д., δ3 +15.76 т.д. с КССВ (Гц) 7.25 (Ј1,2= Ј2,1), 2.90 (Ј2,3= Ј3,2), 0.70 (Ј1,3= Ј3,1).
Сигналы от ядер 13С соединения (III) имеют химические сдвиги δa+111.7 т.д.д. и δb+146.0 д.т.д с КССВ (Гц) 289.35 (Јa,2), 94.80 (Јa,3), 1.45(Јa,1), 372.85 (Јb,3), 44.55 (Јb,2), 1.45 (Јb,1). Цифры, соответствующие номерам атомов, соответствуют обозначениям на схеме 1.
Чистоту соединения (III) определяли при помощи ГЖХ на приборе ЛХМ-80, аналогично тому, как это выполнено для продукта II.
Спектры 13С и19F соединений II, III регистрировали на спектрометре Bruker AM-500 (125.8 и 470.6 МГц соответственно) при комнатной температуре с CDCl3 с добавлением гексафторбензола в качестве внутреннего стандарта.
ИК спектр ФСОАФ: С=О: 1980см-1; S=O: 1486 см-1
Выводы
Описан эффективный способ получения с высоким выходом фтосульфонилоксадифторацетилфторида (ФСОАФ) FSO2OCF2COF, пригодный для масштабирования, в том числе промышленного.
Новый метод синтеза осуществлен путем термического окисления перфтораллилфторсульфата (АФС) CF2=CFCF2OSO2F молекулярным кислородом в присутствии от 3 до 7 мольных процентов дибромидов тетрафторэтилена или гексафторпропилена. Данный метод иллюстрирует особенности реакционного поведения перфторированных аллиловых эфиров при их взаимодействии с данным окислителем при различных температурах, как в присутствие инертных растворителей, так и без них. Выход продукта реакции ФСОАФ после ректификации составляет более 90% при чистоте получаемого продукта не менее 99,5% по данным ГЖХ. ЯМР спектроскопия 19F и 13С, а также метод ИК подтверждают строение целевого соединения. ФСОАФ представляет интерес как продукт, содержащий одновременно две функции – фторсульфатную и фторангидридную, что при последовательной или одновременной реализации их реакционной способности может иметь интересные синтетические перспективы при разработке фторорганических продуктов, в том числе для получения мономеров и полимеров, работающих при повышенных температурах и в условиях жестких воздействий (агрессивные химические среды, процессы происходящие при работе топливных элементов и других устройств водородной энергетики.)
Предложен эффективный способ получения с высоким выходом фторсульфонилоксадифторацетилфторида, пригодный для промышленной реализации.
Список литературы
- England D.C. Perfluoroallyl fluorosulfate and its sultone polymers : patent USA 4206138 / DuPont; appl. 1980.
- Krespan C.G., England D.C. Perfluoroallyl fluorosulfate, a reactive new perfluoroallylating agent / J. Am. Chem. Soc. - 1981. - Vol. 103. - P. 5598-5599.
- Banks R.E. et al. Perfluoroallyl fluorosulphonate—Preliminary note / J. Fluorine Chem. - 1982. - Vol. 20. - P. 133-134.
- Рондарев Д.С. и др. Способ получения перфтораллилфторсульфата: патент 1766912 СССР, MKI C07C 317/60; заявл. 27.12.1988; опубл. 23.06.1993, Бюл. №23.
- Wlassics I. et al. Perfluoro Allyl Fluorosulfate (PAFS): A Versatile Building Block for New Fluoroallylic Compounds / Molecules. - 2011. - Vol. 16, Iss. 8. - P. 6512-6540. - DOI: 10.3390/molecules16086512.
- Способ получения перфтораллилфторсульфата : патент 2443719 Россия, MKI C08F 214/00; заявл. 10.08.2010; опубл. 27.02.2012, Бюл. №6.
- Патент Японии JPH01149749A, 1989.
- Патент Японии JPH01163173A, 1987.
- Лебедев Н.В. и др. / Журнал прикладной химии. - 2009. - Т. 82, №3. - С. 455.
- Способ получения перфтораллилфторсульфата : патент 2484081 Россия; опубл. 27.12.2012, Бюл. №36.
Статья рекомендована к публикации к.х.н. О.В. Брызгаловой
Fluorine Notes, 2025, 158, 3-4


