Поступило в редакцию: Сентябрь 2024
УДК 547.874
Fluorine Notes, 2024, 156, 1-2
2,4,6-Трис(1,1,3,3-тетрафтораллил)-1,3,5-триазин - перспективный мономер для получения фторированных полимеров
А.В. Синько, В.Л. Дон, С.М. Игумнов
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119334, г. Москва, ул. Вавилова, д. 28, стр. 1
bООО НПО «ПиМ-Инвест», 119119, г. Москва, ул. Ленинский проспект, д. 42, корп. 1-2-3
Аннотация: синтезирован новый фторсодержащий триазиновый мономер
Ключевые слова: триазин, тетрафтораллилтриазин, фторсодержащий триазиновый мономер
Уникальные характеристики фторполимеров – химическая инертность, термостабильность, устойчивость к действию ультрафиолетового излучения, электроизоляционные свойства, способность отталкивать жидкости и грязь, низкий коэффициент трения – делают их незаменимыми материалами для химической промышленности, аэрокосмической отрасли, автомобильной, медицинской, электрической отрасли и электроники. Тем не менее непрерывно ведется работа по улучшению этих характеристик и поиску новых фторполимеров, наиболее полно отвечающих запросам современной техники [1].
Полифтортриазиновые полимеры характеризуются особенно высокой уcтойчивостью к химическим и термическим воздействиям [2]. Они отлично работают в качестве уплотнений, прокладок и формованных деталей в системах, которые подвергаются воздействию повышенных температур и/или агрессивных химических веществ.
При использовании в качестве добавок к эластомерам триазиновых мономеров их рассматривают в качестве модификаторов, улучшающих свойства эластомеров, в частности триазины используют в качестве добавок к фторированнным полиэфирам и сополимерам полиэфиров с тетрафторэтиленом [3], введение таких добавок при полимеризации повышает устойчивость полимеров к окислению при высоких температурах, особенно в присутствии металлов.
Известны две основные стратегии сшивки полимеров триазиновыми фрагментами. Можно использовать бифункциональные нитрилы - либо динитрилы, либо непредельные нитрилы, из них получают диамидины и затем вводят в процесс полимеризации, получая прошитые триазиновыми фрагментами полимеры. Другая стратегия заключается в использовании триазинов, содержащих способные к полимеризации заместители, что позволяет также вводить их в качестве добавок при полимеризации других коммерчески более доступных мономеров, получая таким образом полимеры с улучшенными свойствами [4].
Нам удалось найти в литературе лишь один пример подобных мономеров. Фторированные алкенилтриазины формул (I) и (II) и их применение в качестве вулканизирующих добавок для сшивания фторированных эластомеров описаны в заявке [5].
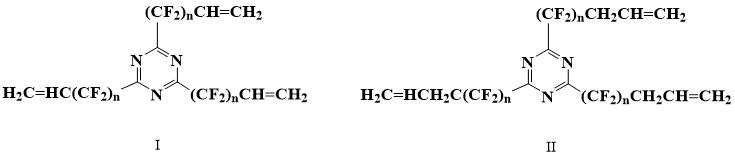
Перфтораллилтриазин известен, но нет данных о том, что он полимеризуется [6].
Таким образом, поставленная задача заключалась в получении триазинового мономера с высоким содержанием атомов фтора в боковых цепях, обладающего способностью к полимеризации с тем, чтобы в дальнейшем проверить возможность применения его в качестве мономера для гомополимеров и вулканизирующей добавки к эластомерам. Для этой цели был выбран 2,4,6-трис(1,1,3,3-тетрафтораллил)-1,3,5-триазин (III).
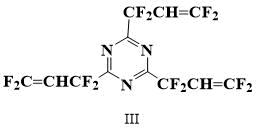
Выбор этого соединения в качестве мономера был обусловлен тем, что с одной стороны содержание фтора в молекуле соединения (III) велико, а с другой стороны двойная связь не полностью фторирована, что на основании изучения закономерностей полимеризации фторированных мономеров [7] позволило предположить, что такое соединение окажется способным к полимеризации, что и подтвердили предварительные эксперименты.
2,4,6-Трис(1,1,3,3-тетрафтораллил)-1,3,5-триазин (III) был получен из 2,4,6-трис(иоддифторметил)-1,3,5-триазина, получение которого взаимодействием нитрила иоддифторуксусной кислоты с аммиаком описано в [8].
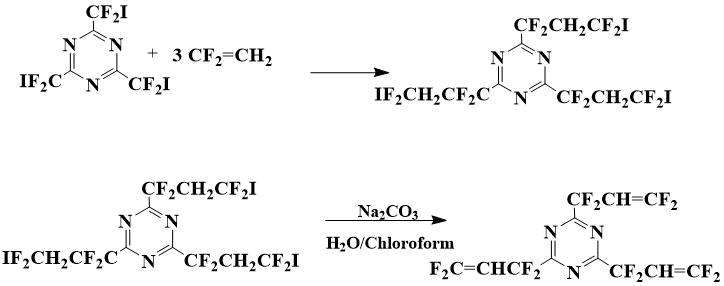
Cхема 1. Получение 2,4,6-трис(1,1,3,3-тетрафтораллил)-1,3,5-триазина
Сначала взаимодействием 2,4,6-трис(иоддифторметил)-1,3,5-триазина с фтористым винилиденом при нагревании в автоклаве получают 2,4,6-трис(3-иод-1,1,3,3-тетрафторпропил)-1,3,5-триазин. Его без предварительной очистки подвергают действию раствора соды в двухфазной системе хлороформ-вода в присутствии триэтилбензиламмоний хлорида (ТЭБАХ) в качестве межфазного переносчика, полученный 2,4,6-трис(1,1,3,3-тетрафтораллил)-1,3,5-триазин очищают перегонкой.
Предварительные эксперименты показали, что полученный триазин легко полимеризуется, в частности с использованием перекисных инициаторов.
Экспериментальная часть
1. 2,4,6-трис(3-иод -1,1,3,3-тетрафторпропил)-1,3,5-триазин
В стальной автоклав объемом 0,2 л с игольчатым вентилем загружают 120 г (0,197 моль) 2,4,6-трис(иоддифторметил)-1,3,5-триазина. Автоклав герметично закрывают, вакуумируют, охлаждают жидким азотом и через игольчатый вентиль из камеры загружают 60 г (0,937 моль) фтористого винилидена. Затем автоклав помещают в качающуюся печь и выдерживают при 200°С в течение 20 часов.
Автоклав охлаждают до комнатной температуры и сбрасывают избыточное давление через вентиль. Выгружают 147 г жидкости, представляющей собой согласно ЯМР 85% сырец 2,4,6-трис(3-иод-1,1,3,3-тетрафтораллил)-1,3,5-триазина, содержащий примесь 2,4-бис(3-иод-1,1,3,3-тетрафторпропил)-6-иоддифторметил-1,3,5-триазина. Сырец используют в следующей стадии без очистки.
Спектр 1H ЯМР (300 Мгц, CDCl3) 3,87 м.д. (м, 1H).
Спектр13С ЯМР (100 Мгц, CDCl3) 171,94 м.д. (м, C=N, 3С), 114,43 м.д. (т, JCF=240 Гц, N=C‑CF2, 3С), 89,57 м.д. (JCF=311 Гц, N=C-CF2-CH2, 3C), 52,66 (м, CH2, 3С).
Спектр 19F ЯМР (282 МГц, CFCl3, CDCl3) -37,52 м.д. (м, 2F, CF2I), -99,90 м.д. (м, 1F, CF2–C=N).
2. 2,4,6-Трис(1,1,3,3-тетрафтораллил)-1,3,5-триазин
В четырехгорлую колбу объемом 1 л, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, соединенным на выходе со склянкой Тищенко с водой, загружают 147 г сырца, полученного на предыдущей стадии, 200 мл хлороформа, 2 г ТЭБАХ и при перемешивании по каплям в течение 30 минут добавляют раствор 58 г (0,55 моль) Na2CO3 в 150 мл воды. При его добавлении реакционная масса немного пенится и нагревается до 35°С, происходит выделение углекислого газа. Реакционную массу кипятят до прекращения выделения газа около 6 часов, затем охлаждают, фильтруют, фильтрат переносят в делительную воронку, нижний слой отделяют, помещают в перегонную колбу и отгоняют хлороформ на водяной бане, нагревая ее до кипения. Затем заменяют приемную колбу и отгоняют остаток хлороформа с водой в вакууме водоструйного насоса. Оставшийся сырец перегоняют в вакууме масляного насоса 0,7-1 Торр, нагревая куб до 120°С. Получают 40 г сырца 2,4,6-трис(1,1,3,3-тетрафтораллил)-1,3,5-триазина чистотой около 80%, содержащего примесь 2,4-бис(1,1,3,3-тетрафтораллил)-6-иоддифторметил-1,3,5-триазина, полученную из соответствующей примеси, содержащейся в сырце, полученном на первой стадии. Сырец вторично перегоняют в вакууме 1 Торр, отбирая предгон, кипящий до 71°С (65 ‑71°С) и основную фракцию, кипящую 71-72°С, таким образом получают 31 г 2,4,6‑трис(1,1,3,3-тетрафтораллил)-1,3,5-триазина. Выход 38% на исходный 2,4,6‑трис(иоддифторметил)-1,3,5-триазин.
Спектр 1H ЯМР (300 Мгц, CDCl3) 5,23 м.д. (м, 1H).
Спектр13С ЯМР (100 Мгц, CDCl3) 172,97 м.д. (м, C=N, 3С), 159,00 м.д. (JCF=301 Гц, CF2=CH, 3C), 113,72 м.д. (т, JCF=257 Гц, N=C-CF2, 3С), 77,18 м.д. (м, CH, 3С).
Спектр 19F ЯМР (282 МГц, CFCl3, ст. CDCl3) -73,93 м.д. (м, 1F, CF2=CH), -77,01 м.д. (м, 1F, CF2=CH), -96,73 м.д. (д, JFH=11Гц, 2F, CF2-CH).
Благодарности
Работа выполнена в рамках Государственного задания №075-00277-24-00 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Литература
- Polyaddition of Fluorinated Vinyl Monomers, p.72, T. Narita in Fluorinated polymers v.2, 2017, RSC, edited by B. Ameduri and H. Sawada, The Royal Society of Chemistry, 2017.
- US 4434106 А (1984).
- US 5942598 А (1999).
- Shuaihua Zhang, Qian Yang, Chun Wang, Xiliang Luo, Jeonghun Kim, Zhi Wang, Yusuke Yamauchi, Adv. Sci., 2018, 5, 1801116.
- WO 9705122 (1997).
- Brown, Henry C.; Cheng, Ming T., Journal of Chemical and Engineering Data, 1968, 13(4), 560.
- L.A. Wall, (Ed.), Fluoropolymers, Wiley, NewYork, 1972; Narita, Tadashi, Macromolecular Rapid Communications, 2000, 21(10), 613-627.
- Ming-H. Hung, Lu Long, and Zhen-Yu Yang, J. Org. Chem., 2004, 69, 198-201.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2024, 156, 1-2


