Поступило в редакцию: Июнь 2024
УДК 541.64 :543.544
Fluorine Notes, 2024, 154, 5-6
СИНТЕЗ ЭФИРОВ 2-АКРИЛАМИНО-3,3,3-ТРИФТОРПРОПИОНОВЫХ КИСЛОТ
В. И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова РАН, Российская Федерация, 119334, г. Москва, ул. Вавилова, д.28, стр.1
Факс: (499) 135 5085. E-mail: vic-d.60@mail.ru
Аннотация: Реакцией эфиров 3,3,3-трифторпировиноградной кислоты с акриламидом получены исходные CF3-содержащие N-гидроксиметилакриламиды. При их кипячении в SOCl2 с высоким выходом синтезированы соответствующие хлорзамещенные акриламиды. Восстановление их цинком в уксусной кислоте приводит к образованию эфиров 2‑акриламино-3,3,3-трифторпропионовой кислоты. Вновь синтезированные CF3-содержащие акриламиды предлагаются как потенциальные мономеры.
Ключевые слова: акриламид, метил (этил) 3,3,3-трифторпируват, фторсодержащие мономеры, эфиры 2-акриламино-3,3,3-трифторпропионовой кислоты.
Полимеры и сополимеры, полученные на основе фторсодержащих акриламидов, обладают рядом ценных специфических свойств, которые не присущи нефторированным аналогам [1]. Помимо появления новых физико-химических свойств, некоторые из них обладают способностью реагировать на внешнее воздействие, что особенно востребовано в нанотехнологии для создания сенсоров, функциональных материалов и микроустройств [2-4].
Следует отметить, что в настоящее время среди фторсодержащих акриламидов имеется весьма ограниченное количество коммерчески доступных мономеров для проведения целенаправленных исследований в этой области. В связи с этим наиболее часто используются хорошо показавшие себя в этом направлении N-(2-фторэтил)акриламид (F1EA), N-(2,2-дифторэтил)акриламид (F2EA) и N-(2,2,2-трифторэтил)акриламид (F3EA) (рисунок 1) [5].
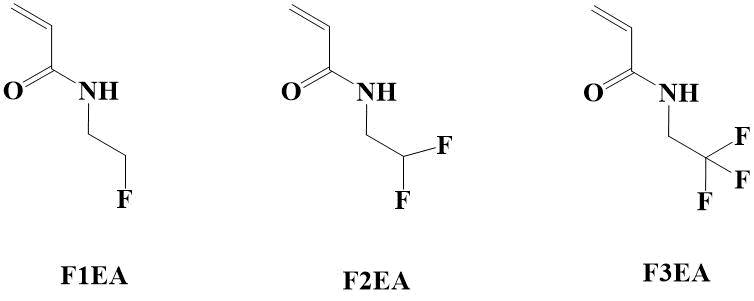
Рисунок 1. N-(2-фторэтилзамещенные) акриламиды.
Оказалось, что F3EA за счет влияния электроноакцепторной СF3-группы обладает резко усиленной и смещенной в красную область фотолюминесценцией, что не является характерным для такого рода малых молекул [6]. Причем показано, что квантовый выход фотолюминисценсии зависит от условий и среды (температура, катионы металлов), что является перспективным для использования в медицинской диагностике.
Многообещающими являются результаты сополимеризации дифторакриламида F2EA с N-(2-гидроксипропил)метакриламидом изложенные в работе [7]. Образующиеся при этом водорастворимые биосовместимые термочувствительные сополимеры и наногели были успешно использованы для МРТ 19F визуализации ангиогенеза и маркировки островков поджелудочной железы.
Весьма интересные результаты получены в результате RAFT-сополимеризации F1EA, F2EA и F3EA с N,N-диметиламиноэтилметакрилатом. Полученные на их основе статистические термочувствительные сополимеры при продувке способны многократно переключаться как на кислород, так и на углекислый газ [8].
Таким образом, анализ вышеизложенных научных исследований свидетельствует о перспективности синтеза новых СF3-содержащих акриламидов как мономеров для получения функциональных полимерных материалов.
Обычно N-фторалкилакриламиды формулы II получают взаимодействием фторсодержащих алкиламинов I с ангидридами (а) или хлорангидридами (b) акриловой кислоты в присутствии акцепторов (NЕt3, Py) выделяющихся в реакции кислот [9, 10] (схема 1).
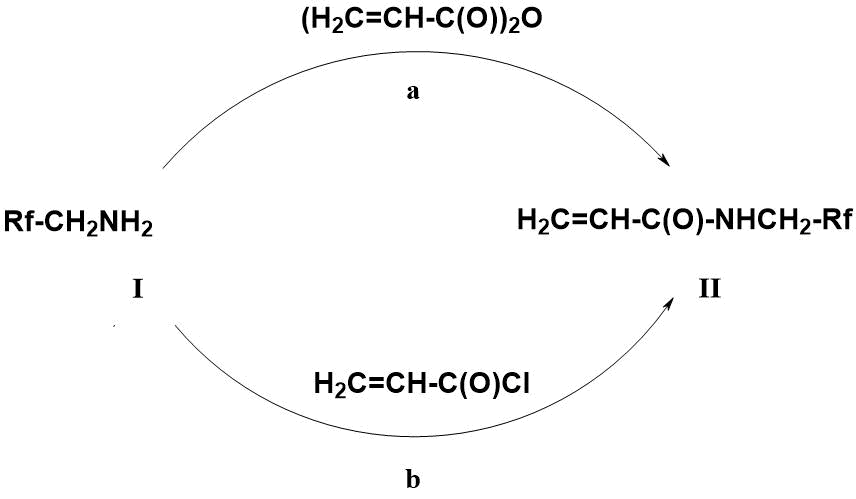
Схема 1. Получение N-фторалкилакриламидов
Необычность подхода к синтезу новых соединений, представленных в настоящей работе, заключается в том, что модификация аминной составляющей акриламида осуществляется непосредственно в самой его молекуле (схема 3).
Ранее было обнаружено, что полифторкарбонильные соединения (III), в отличие от их нефторированных аналогов, легко вступают в реакцию с амидами (IV) различных алифатических и ароматических карбоновых кислот, образуя стабильные N-амидоокси соединения (V) [11-15] (схема 2).
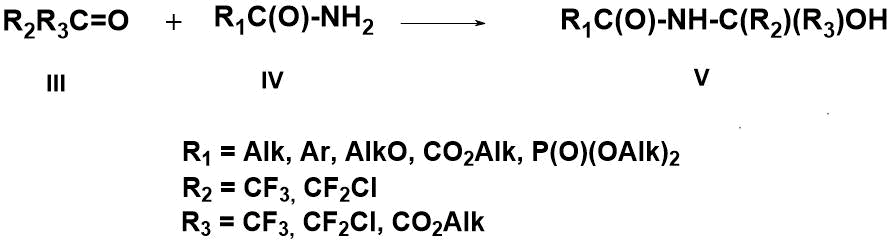
Схема 2. Получение N-амидоокси соединений (V).
Также показано, что ОН-группа в соединениях такого типа при действии SOCl2 легко замещается на хлор. Причем галоген в полученных аддуктах обладает достаточно высокой подвижностью и может быть легко восстановлен [15].
В то же время, вышеописанные превращения не были изучены применительно к (мет)акриламидам, которые широко используются в настоящее время и являются промышленно доступными. Действительно, полученные на их основе фторалкилсодержащие акриламиды могут быть востребованы в синтезе функциональных (со)полимеров, о чем было сказано выше [2-8].
Целью настоящей работы является получение новых CF3-содержащих мономеров - метил 2-акриламино-2-хлор-, этил 2-акриламино-2-хлор-, метил 2-акриламино- и этил 2‑акриламино-3,3,3-трифторпропионатов 4a,b и 5a,b соответственно (Рисунок 2).
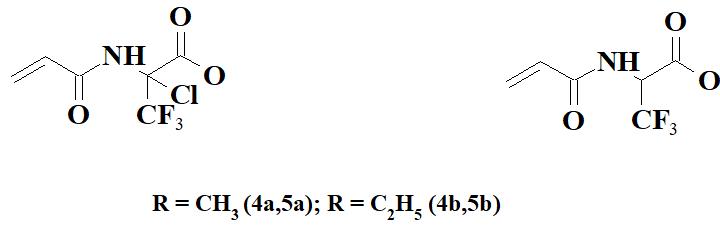
Рисунок 2. СF3-содержащие акриламиды.
Недавно нами было показано, что метиловый (2а) и этиловый (2b) эфиры 3,3,3‑трифторпировиноградной кислоты легко вступают в реакцию с акриламидом (1), образуя продукты N-оксиамидоалкилирования (3а,b). При этом в результате данных превращений метиловый (3a) и этиловый (3b) эфиры 2-акриламино-3,3,3-трифтор-2-гидроксипропионовой кислоты образуются с препаративным выходом более 90% (схема 3). Также показано, что при инициации АIBN 3а,b вступают в полимеризацию [16].
Нами установлено, что кипячение 3а в избытке тионилхлорида на протяжении 1,5‑2 часов приводит к количественному замещению ОН-группы на хлор. Течение реакции хорошо поддается ТСХ контролю в системе этилацетат – метилен хлористый = 1:3. Несмотря на агрессивную реакционную среду, связанную с обильным выделением НСl и SO2, заметного образования побочных продуктов и продуктов полимеризации не наблюдается.
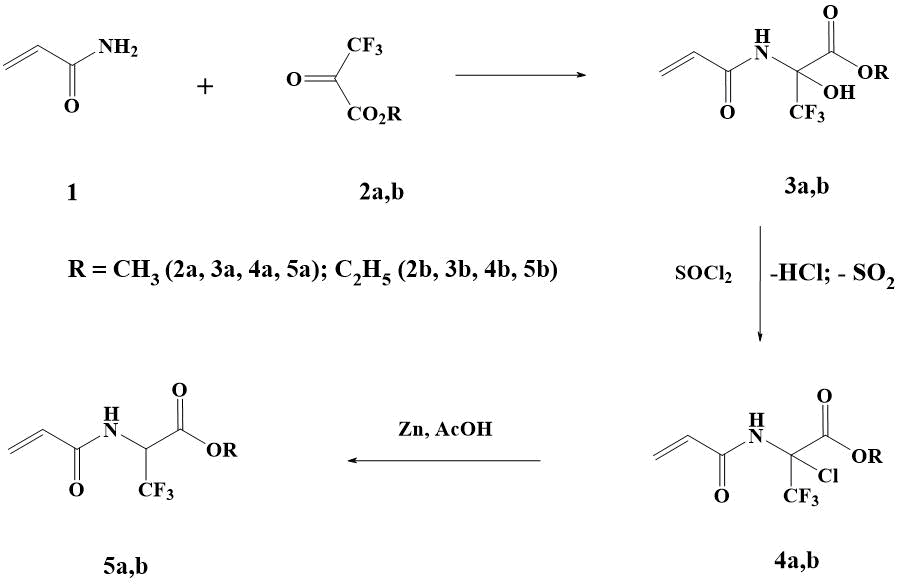
Схема 3. Получение СF3-содержащих акриламидов.
После удаления избытка SOCl2 и охлаждения продукт реакции самопроизвольно кристаллизуется. Спектрально чистый 4а получали с выходом 88% (схема 3). По аналогичной методике из амидооксисоединения 3b был получен этиловый эфир 2-акриламино-2-хлор-3,3,3-трифторпропионовой кислоты 4b с выходом 81% (схема 3).
Ранее было показано, что галоген, находящийся у соседнего с азотом атома углерода, в соединениях подобного строения легко подвергается восстановлению трифенилфосфином с выходом 57-85% [15]. В настоящей работе мы прибегли к более дешевому способу восстановления хлорпроизводных 4а,b цинком в уксусной кислоте. Обнаружено, что восстановление хлора в соединении 4а в этих условиях происходит экзотермически и нуждается в охлаждении реакционной массы. После стандартной процедуры выделения (см. экспериментальную часть) и перекристаллизации эфир 5а был получен с выходом 61% (схема 3). Аналогичным образом из 4b с выходом 62% был получен акрилат 5b.
Способность вновь синтезированных соединений 4а,b и 5а,b вступать в реакцию (со)полимеризации является предметом дальнейшего изучения.
Экспериментальная часть
Спектры ЯМР 1Н и 19F записаны в D6-DMSO и CDCI3 на приборе Bruker Avance 300 с рабочими частотами (300 и 282 МГц соответственно). Химические сдвиги в ЯМР-спектрах приведены в шкале δ (м.д.) относительно ТМС в качестве внутреннего стандарта (спектры ЯМР 1Н) и CCl3F в качестве внешнего стандарта (спектры ЯМР 19F). Константы спин-спинового взаимодействия приведены в Гц. Контроль протекания реакций осуществляли методом ТСХ на пластинах фирмы «Merck» (силикагель 60 F254, 0.25 мм). Значения RF синтезированных соединений определены в системе этилацетат – метилен хлористый = 1:3. Элементный анализ определяли в лаборатории микроанализа ИНЭОС РАН. Масс-спектры сняты на квадрупольном масс-спектрометре FINNIGAN MAT INCOS 50, прямой ввод, электронный удар, энергия ионизации 70 эВ.
Использованы промышленно доступные исходные реагенты - акриламид [CAS 79‑06‑1], тионилхлорид [CAS 7719-09-7], а также метиловый [CAS 13089-11-7] и этиловый [CAS 13089-18-0] эфиры 3,3,3-трифторпировиноградной кислоты ООО НПО «ПиМ-Инвест».
Метиловый эфир 2-акриламино-3,3,3-трифтор-2-гидроксипропионовой кислоты (3a)
Получали из акриламида 1 и метил 3,3,3-трифторпирувата 2а с выходом 95% с помощью метода, описанного ранее [16]. Т.пл. 125-126°С (бензол).
Этиловый эфир 2-акриламино-3,3,3-трифтор-2-гидроксипропионовой кислоты (3b)
Получали из акриламида 1 и этил 3,3,3-трифторпирувата 2b с выходом 90% с помощью метода, описанного ранее [16]. Т.пл. 95-96°С (бензол).
Метиловый эфир 2-акриламино-2-хлор-3,3,3-трифторпропионовой кислоты (4a)
В стеклянную грушевидную колбу, снабженную магнитной мешалкой с нагревом и обратным холодильником, помещали 2,95 г (13 ммоль) 3а и 6 мл SOCl2. Реакционную массу кипятили 2 часа при интенсивном перемешивании (до прекращения выделения НС1 и SO2). Избыток SOCl2 и летучие продукты реакции удаляли на роторном испарителе. Получали 3,1 г вязкого светло-желтого масла, кристаллизующегося при охлаждении. Сырой продукт растворяли в хлороформе и пропускали через слой силикагеля (D=20mm, h= 10 mm). Остатки продукта 2 раза смывали с колонки небольшим количеством хлороформа и упаривали на роторном испарителе до постоянного веса. Получали 2,8 г масла, кристаллизующегося при охлаждении. Выход 88%, т. пл. 85-86°С (СС14), Rf = 0,47.
Спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д., J/Гц): 7,08 (с, 1Н, NH), 6,22 (дд, 1Н, СН, 3JH-H(цис)=18, 3JH-H(транс)=12), 6,43 (уш.д, 1H, Н2С=, 3JH-H=18), 5,86 (уш.д, 1H, Н2С=, 3JH-H=12), 3,91 (с, 3 Н, ОСН3).
Спектр ЯМР 19F (282 МГц, CDCl3, δ, м.д., J/Гц): -76,06 (с, 3F, CF3).
Найдено, %: С 34,14; Η 2,94; N 5.81. С7Н7ClF3NO3. Вычислено, %: С 34,24; Η 2,87; N 5,70.
Этиловый эфир 2-акриламино-2-хлор-3,3,3-трифтор-пропионовой кислоты (4b)
В круглодонную стеклянную колбу, снабженную обратным холодильником с хлоркальциевой трубкой и магнитной мешалкой с нагревом, помещали 2,6 г (10 ммоль) 3b и 5 мл SOCl2. Реакционную массу кипятили 2 часа при интенсивном перемешивании до прекращения выделения SO2. После удаления на роторном испарителе избытка SOCl2 получали вязкое светло-желтого масло, кристаллизующееся при охлаждении. Сырой продукт растворяли в хлороформе и пропускали через слой силикагеля (D=15mm, h= 10 mm). Остатки продукта смывали с колонки хлороформом, а полученный фильтрат упаривали на роторном испарителе до постоянного веса. Полученный остаток кристаллизовали из циклогексана. Получали 2,1 г белого кристаллического вещества. Выход 81%, т. пл. 75-76°С, Rf= 0,52.
Спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д., J/Гц): 6,94 (с, 1Н, NH), 6,44 (уш.д, 1H, Н2С=, 3JH‑H=18), 6,21 (дд, 1Н, СН, 3JH-H(цис)=18, 3JH-H(транс)=9), 5,85 (уш.д, 1H, Н2С=, 3JH-H=9), 4,37 (кв, 2Н, ОСН2, 3JH-H=6), 1,32 (т, 3Н, СН3, 3JH-H=6).
Спектр ЯМР 19F (282 МГц, CDCl3, δ, м.д., J/Гц): -75,98 (с, 3F, CF3).
Масс-спектр, m/z, (%): 224 (1) [M+-35], 214 (3), 187 (3), 168 (8), 152 (28), 69 (6), 55 (100), 50 (1), 43 (2), 36 (2), 32 (6), 27 (48).
Найдено, %: С 36,94; Η 3,61; N 5.44; F 21,49. С8Н9ClF3NO3. Вычислено, %: С 37,01; Η 3,49; N 5,40; F 21,95.
Метиловый эфир 2-акриламино-3,3,3-трифторпропионовой кислоты (5a)
В круглодонную стеклянную колбу, снабженную обратным холодильником, хлоркальциевой трубкой и магнитной мешалкой, помещали 245 мг (1 ммоль) 4a и 1,1 мл ледяной уксусной кислоты. При интенсивном перемешивании и температуре 20°С в реакционную массу прибавляли 600 мг цинка в виде пыли. Реакцию проводили в этих условиях на протяжении 1 часа. Затем реакционную массу разбавляли уксусной кислотой и фильтровали. Фильтрат упаривали на роторном испарителе, получали стеклообразный остаток. Его растворяли в 10 мл СН3СN, обрабатывали 0,5 г SiO2 и полученную взвесь пропускали через тонкий слой силикагеля. После удаления растворителя на роторном испарителе получали 200 мг целевого продукта в виде белого твердого вещества, имеющего по данным ЯМР 19F следовые количества исходного реагента 1. Перекристаллизацией из водного метанола получали аналитически чистое соединение 5а в виде бесцветных продолговатых сыпучих кристаллов. Выход 61%, т.пл. 105-106°С, Rf = 0,59.
Спектр ЯМР 1Н (300 МГц, D6-DMSO, δ, м.д., J/Гц): 9,16 (д, 1Н, NH, 3JH-H=9), 6,42 (дд, 1Н, СН, 3JH-H(цис)=18, 3JH-H(транс)=9), 6,24 (уш.д, 1H, Н2С=, 3JH-H=18), 5,67 (уш.д, 1H, Н2С=, 3JH-H=9), 5,36 (гепт., 1Н, HС-CF3, 3JH-H=9, 3,82 (с, 3 Н, ОСН3).
Спектр ЯМР 19F (282 МГц, D6-DMSO, δ, м.д., J/Гц): -71,15 (с, 3F, CF3).
Масс-спектр, m/z, (%): 211 (1) [M]+, 180 (1), 152 (8), 135 (5), 98 (9), 69 (1), 59 (4), 55 (100), 44 (1).
Найдено, %: С 39.71; Η 4.02; N 6.67; F 26,81. С7Н8F3NO3. Вычислено, %: С 39,82; Η 3,82; N 6,63; F 26,99.
Этиловый эфир 2-акриламино-3,3,3-трифторпропионовой кислоты (5b)
В стеклянную круглодонную колбу, снабженную хлоркальциевой трубкой, магнитной мешалкой и водяной баней, помещали 260 мг (1ммоль) 4b и 1,1 мл ледяной уксусной кислоты. При интенсивном перемешивании и температуре 20°С в реакционную массу прибавляли по частям 600 мг цинковой пыли. Реакцию проводили в этих условиях на протяжении 30 минут. Затем реакционную массу разбавляли 5 мл уксусной кислоты, интенсивно перемешивали 5-10 минут при комнатной температуре и фильтровали. Фильтрат упаривали на роторном испарителе, получали прозрачный плотный остаток. Его кристаллизация из водного метанола приводит к образованию 140 мг спектрально и хроматографически чистого соединения 6 в виде белых пушистых кристаллов. Выход 62%, т.пл. 102-103°С, Rf=0,67.
Спектр ЯМР 1Н (300 МГц, D6-DMSO, δ, м.д., J/Гц): 9,34 (д, 1Н, NH, 3JH-H=9), 6,40 (дд, 1Н, СН, 3JH-H(цис)=16, 3JH-H(транс)=9), 6,23 (уш.д, 1H, Н2С=, 3JH-H=16), 5,77 (уш.д, 1H, Н2С=, 3JH-H=9), 5,47 (гепт., 1Н, HС-CF3, 3JH-H=9), 4,22 (кв, 2 Н, ОСН2, 3JH-H=6), 1,33 (т, 3 Н, СН3, 3JH-H=6).
Спектр ЯМР 19F (282 МГц, D6-DMSO, δ, м.д., J/Гц): -68,17 (с, 3F, CF3).
Масс-спектр, m/z, (%): 225 (1) [M]+, 180 (7), 153 (21), 84 (22), 69 (4), 55 (100), 50 (1), 43 (2), 28 (88).
Найдено, %: С 42.02; Η 4.77; N 6.29; F 24,53. С8Н10F3NO3. Вычислено, %: С 42,67; Η 4,48; N 6,22; F 25,31.
Благодарности
Работа выполнена в рамках Государственного задания № 075-03-2023-642 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Выражаем благодарность ООО НПО «ПиМ-Инвест» за представленный для исследованный этил 3,3,3-трифторпируват.
Список литературы
- M. Guerre, G. Lopez, В. Améduri, М. Semsarilar, V. Ladmiral, Polym. Chemistry, 2021, 12 (27), 3852–3877.
- K. Akamatsu, M. Shimada, T. Tsuruoka, H. Nawafune, S. Fujii and Y. Nakamura, Langmuir, 2010, 26, 1254–1259.
- K. Paek, H. Yang, J. Lee, J. Park and B. J. Kim, ACS Nano, 2014, 8, 2848–2856.
- R. J. Williams, A. M. Smith, R. Collins, N. Hodson, A. K. Das and R. V. Ulijn, Nat. Nanotechnol., 2009, 4, 19–24.
- Changkui Fu ∗, Ye Yu, Xin Xu, Qiaoyun Wang, Yixin Chang, Cheng Zhang, Jiacheng Zhao, Hui Peng, Andrew K. Whittaker, Progress in Polymer Science, 2020, 108, 101286.
- Jiayu Long, Jiankai Shan,Yaxin Zhao,Ying Ji,Hongwei Tan, and Huiliang Wang, Chem Asian J., 2021, 16, 2426 –2430.
- K. Kolouchova, O. Sedlacek, D. Jirak et al., Biomacromolecules, 2018, 19(8), 3515–3524.
- L. Lei, Qi Zhang, S. Shuxian, Z. Shiping, Polym. Chemistry, 2016, 7(34), 5456–5462.
- Патент US 2782184, 1953.
- Патент DE 1012920, 1957.
- Патент US 3324178, 1967.
- ПатентUS 3549705, 1970.
- S. N. Osipov, A. F. Kolomiets, A. V. Fokin, Bulletin of the Academy of Sciences of the USSR, Division of Сhemical Sciences, 1988, 3, 122-126.
- Патент DE 3917835, 1990.
- A. Yu. Aksinenko, A. N. Pushin, V. А. Sokolov, Russian Chemical Bulletin, 2002, 51(11), 2136-2138.
- О. А. Мельник, А. А. Корлюков, В. И. Дяченко, Fluorine Notes, 2023, 3(148), 1-2.
Статья рекомендована к публикации к.х.н. О.В. Брызгаловой
Fluorine Notes, 2024, 154, 5-6


