Поступило в редакцию: Июнь 2024
УДК 547.4
Fluorine Notes, 2024, 154, 3-4
СИНТЕЗ 5-ФТОРСУЛЬФОНИЛПЕРФТОРПЕНТИЛВИНИЛОВОГО ЭФИРА – НОВОГО МОНОМЕРА ДЛЯ ПЕРФТОРСУЛЬФОКИСЛОТНЫХ ИОНОМЕРОВ
A.A. Тютюновa,b,c, Г.А. Хромовa, С.М. Игумновa,b
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н.Несмеянова Российской академии наук, 119334, г. Москва, ул. Вавилова, д. 28, стр. 1
bООО НПО “ПиМ-Инвест”, 119119, г. Москва, ул. Ленинский проспект, д. 42, корп. 1-2-3
cООО “Центр Водородной Энергетики”, 142432, Московская обл., г. Черноголовка, пр-т Академика Семенова, д. 3, пом. 3
e-mail: tuytuynov@rambler.ru
Аннотация: Показано, что перфтораллилиодид термически присоединяется к тетрафторэтилену уже при температурах 70 – 90оС с образованием в качестве основного продукта 5-иодперфторпентена, который является ключевым полупродуктом для синтеза нового фторсульфонилперфторпентилвинилового эфира, представляющего интерес в качестве мономера для получения перфторсульфокислотных протонообменных мембран.
Ключевые слова: фторсульфонилперфторвиниловые эфиры, мономеры, перфторсульфокислотные мембраны.
Интенсивное развитие химии фторполимеров в середине 60-х годов прошлого века на фирме DuPont привело к созданию перфторсульфокислотных иономеров на основе сополимеров тетрафторэтилена с перфтор-2-(2-фторсульфонилэтокси)пропилвиниловым эфиром, которые начали производиться под торговым названием Nafion и применяться в качестве протонообменных мембран в различных электрохимических процессах, в том числе в водородных топливных элементах [1]. В результате последующих исследований компаниями Dow Chemical, Solvay Specialty Polymers, Asahi Glass, Asahi Kasei и 3M Fluoropolymers было организовано производство аналогичных нафионоподобных перфторсульфокислотных полимеров с использованием короткоцепочечных и среднецепочечных фторсульфонилперфтоалкилвиниловых эфиров [2-4].
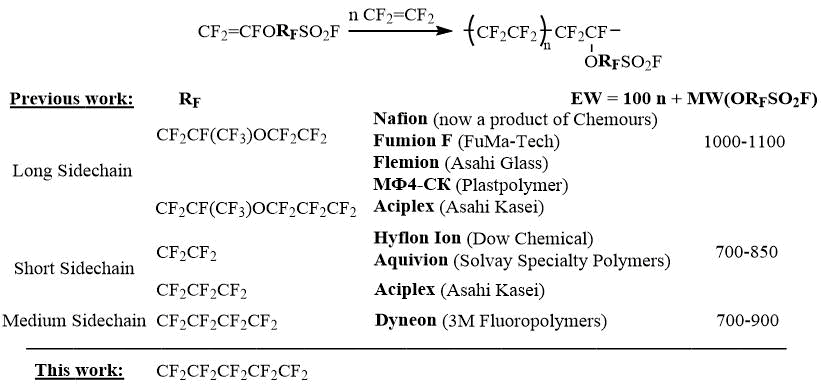
Многочисленные сравнительные исследования характеристик данных протонообменных мембран, выполненные за последние десятилетия, показали, что существует сложная взаимосвязь между молекулярной структурой и морфологией иономера, состоящего из разных фаз кристаллических (подобных ПТФЭ) и ионных (гидратированных сульфокислотных) доменов, а также его транспортными, механическими, и другими свойствами [5-6]. С точки зрения эффективности использования в топливных элементах, предпочтительными оказались перфторсульфокислотные мембраны, полученные из короткоцепочечных и среднецепочечных фторсульфонилперфторалкилвиниловых эфиров [7‑8]. Данные мембраны обладают меньшими эквивалентными массами (EW) (более высокой ионообменной емкостью), за счет чего возрастает мощность топливного элемента. Они могут работать при более высокой температуре и низкой влажности, что упрощает систему охлаждения и повышает устойчивость катализатора к загрязнениям в топливе. Однако все перфторсульфокислотные мембраны этого ряда требуют дополнительной модификации, направленной на повышение стабильности мембраны к воздействию окислительной среды водородной ячейки и повышению времени их службы [9].
Из этих данных следует, что дальнейшее увеличение длины перфторалкильного фрагмента в фторсульфонильном мономере должно приводить к увеличению эквивалентной массы перфторсульфокислотной мембраны и ухудшению ее характеристик. Однако для мономера CF2=CFO(CF2)5SO2F, в сравнении с тем же мономером фирмы 3М, EW иономеров в среднем возрастает только на 5%, и таким образом, решающим фактором в выборе того или иного мономера для получения перфторсульфокислотных мембран остается его синтетическая доступность. Поэтому целью данной работы явилась разработка препаративного пути синтеза нового 5-фторсульфонилперфторпентилвинилового эфира для осуществления дальнейших исследований свойств его полимеров [10-11].
В отличие от перфтор-2-(2-фторсульфонилэтокси)пропилвинилового эфира, который используют для производства мембран Nafion, и для которого существует практически единственный общеизвестный путь синтеза [1], для короткоцепочечных мономеров CF2=CFO(CF2)nSO2F, n = 2, 3 – разработано несколько путей синтеза, однако, большинство из них предполагает использование труднодоступных реагентов, например, окиси перфтораллилхлорида или молекулярного фтора и сложного оборудования [2]. В тоже время нами была разработана доступная технология получения CF2=CFOCF2CF2SO2F, основанная на сульфинатодегалогенировании перфторбромэтилвинилового эфира [12]. В свою очередь 3М мономер CF2=CFO(CF2)4SO2F может быть получен либо фторированием (ЭХФ или F2/N2) различных органических предшественников, либо окислением в автоклаве 4-фторсульфонилперфторбутена, что осуществимо только на специализированном производстве [13-14].
В качестве исходного фторорганического сырья для синтеза CF2=CFO(CF2)5SO2F мономера наиболее рационально использовать промышленно доступные фторолефины. Так, из гексафторпропилена по известному методу, который без сложностей реализуется на практике, может быть получен перфтораллилиодид (1) [15].
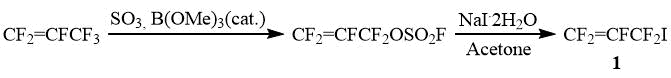
Несмотря на то, что перфтораллилиодид (1) известен сравнительно давно, его реакции с тетрафторэтиленом в литературе не описаны. Нами установлено, что 1 крайне легко уже при температурах 70÷90оС термически присоединяется к CF2=CF2 с образованием главным образом 5-иодперфторпентена (2) и незначительных количеств (5-7%) перфтор-1,5-гексадиена и 1,2-дииодтетрафторэтана. Дальнейшее превращение 2 в целевой мономер может быть осуществлено с помощью следующих стандартных химических превращений.
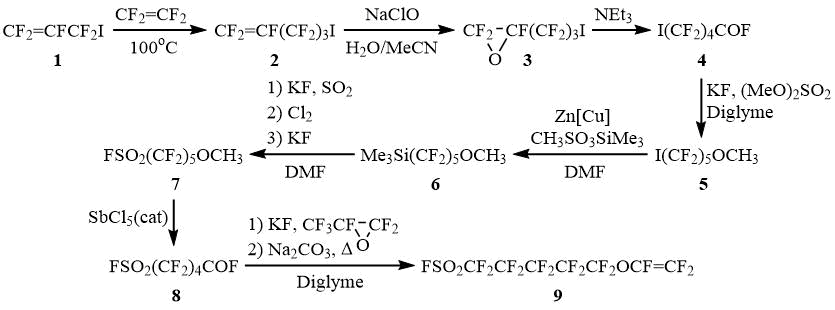
Следует отметить, что, несмотря на многостадийность этого синтеза, для проведения данных реакций не требуется использования сложного оборудования и опасных и труднодоступных реагентов. Кроме того, полупродукты, образующиеся на ряде стадий, представляют отдельный практический интерес и могут служить исходными реагентами для получения различных коммерчески востребованных фторорганических соединений. Так, продукт предпоследней стадии – FSO2(CF2)5OCF(CF3)COF – может быть использован для получения перфторированных ПАВ, что дополнительно расширяет области применения синтезируемых по этой схеме веществ.
Экспериментальная часть
ЯМР 1H, 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 300 и 282 MHz, соответственно, внешний стандарт CDCl3. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7,26) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение.
Использованный в работе перфтораллилфторсульфат получен стандартным способом из гексафторпропилена [15].
Перфтораллилиодид (1)
К суспензии 223 г (1,2 моль) NaI*2H2O в 750 мл ацетона при интенсивном перемешивании прибавляют 250 г (1,09 моль) CF2=CFCF2OSO2F с такой скоростью, чтобы температура смеси держалась в интервале 20 – 25°С. После чего реакционную смесь перемешивают в течение 3-х часов при температуре 25 – 30°С, выливают в равный объем ледяной воды, нижний слой отделяют, промывают 2 раза равным объемом ледяной воды и перегоняют из равного объема H2SO4 (конц.), собирая фракцию, кипящую 54 – 56°С.
Получают 225 г (выход 80%) CF2=CFCF2I.
ЯМР 19F, δ: -49,2 (ддд, 5 Гц, 21,5 Гц, 32 Гц, 2F, ICF2), -97 (тдд, 5 Гц, 38 Гц, 54 Гц, 1F, CF=CFcisFtrans), -106,1 (тдд, 32 Гц, 54,5 Гц, 116 Гц, 1F, CF=CFcisFtrans), -178,6 (тдд, 21 Гц, 38 Гц, 116 Гц, 1F, CF=CFcisFtrans).
5-Иодперфторпентен (2)
В стальной автоклав наливают 100 г (0,39 моль) CF2=CFCF2I, автоклав закрывают, охлаждают жидким азотом в течение 5 минут и вакуумируют до остаточного давления 0,1 ‑ 0,5 Торр. Далее вентиль автоклава закрывают, подсоединяют к нему резиновую камеру с CF2=CF2 объемом ~10 л (~0,44 моль), после чего вентиль автоклава отрывают и конденсируют CF2=CF2 в автоклав. Затем автоклав герметично закрывают и нагревают при температуре 90 – 100°С в течение 10 часов на механической качалке. Далее автоклав охлаждают до комнатной температуры, вскрывают и полученную смесь ректифицируют. В процессе ректификации собирают предгон, содержащий смесь непрореагировавшего CF2=CFCF2I и побочно образующегося CF2=CFCF2CF2CF=CF2 (т.кип. 60°С), которую можно использовать в повторных синтезах, и продукт с т.кип. 95 – 102°С, представляющий собой CF2=CF(CF2)3I с примесью ~20% ICF2CF2I (т.кип. 112 – 113°С; ЯМР 19F, δ: -54 (с)).
Получают 105 г (выход 60%) CF2=CF(CF2)3I, чистотой ~80%, который используют в следующей стадии без дополнительной очистки.
ЯМР 19F, δ: -59,8 (дт, 1,5 Гц, 3 Гц, 2F, ICF2), -90,5 (тдд, 6 Гц, 40 Гц, 52 Гц, 1F, CF=CFcisFtrans), -106,8 (тдд, 27 Гц, 52 Гц, 117,5 Гц, 1F, CF=CFcisFtrans), -116,3 (д, 2 Гц, 2F, ICF2CF2), -118,1 (дт, 4 Гц, 10,5 Гц, 2F, ICF2CF2CF2), -189,8 (ддд, 17 Гц, 22 Гц, 40 Гц, 1F, CF=CFcisFtrans).
Окись 5-иодперфторпентена (3)
К раствору 241 г (6 моль) NaOH в 960 мл воды при интенсивном перемешивании и температуре -25 – -20°С барботируют 194 г (2,73 моль) Cl2. Затем к полученному водному раствору NaClO приливают 466 г (1,3 моль в пересчете на чистый продукт) CF2=CF(CF2)3I, содержащего ~20% ICF2CF2I, и 300 мл ацетонитрила. Реакционную смесь продолжают интенсивно перемешивать, нагревая до температуры -5 – 2°С, при которой начинается экзотермическая реакция, в ходе которой температуру реакционной смеси поддерживают охлаждающей баней в пределах 5 – 10°С. Затем реакционную смесь перемешивают в течение часа при температуре ~15°С, разбавляют равным объемом воды, нижний слой отделяют, промывают равным объемом воды, 5% соляной кислоты и перегоняют над P2O5, собирая дистиллят, кипящий 90 – 100°С.
Получают 371 г (выход 61%) окиси 5-иодперфторпентена, содержащей ~20% ICF2CF2I, которую используют в следующей стадии без дополнительной очистки.
ЯМР 19F, δ: -63,3 (c, 2F, ICF2), -110,4 (ддд, 13 Гц, 30 Гц, 42 Гц, 1F, CFCFcisFtransO), -113,4 (дд, 18 Гц, 42 Гц, 1F, CFCFcisFtransO), -114,7 (дд, 13 Гц, 289 Гц, 1F, ICF2CFAFB), -116 (дд, 9 Гц, 292 Гц, 1F, ICF2CFAFB), -119,5 (дкв, 13,5 Гц, 41 Гц, 1F, ICF2CF2CFAFB), -124,6 (дд, 10 Гц, 293 Гц, 1F, ICF2CF2CFAFB), -152,3 (ддд проявляется как т, 16 Гц, 1F, CFCFcisFtransO).
5-Иодперфторпентаноилфторид (4)
К 5,4 г (0,05 моль) NEt3 при перемешивании добавляют по каплям 500 г (1,07 моль в пересчете на чистый продукт) окиси 5-иодперфторпентена, содержащей ~20% ICF2CF2I в процессе чего температура реакционной смеси повышается до 80 – 90°С. Далее смесь нагревают до кипения в течение 1 часа и перегоняют, собирая дистиллят, кипящий 90 ‑ 100°С.
Получают 438 г (выход 88%) I(CF2)4COF, содержащего ~20% ICF2CF2I, который используют в следующей стадии без дополнительной очистки.
ЯМР 19F, δ: 23,6 (т, 6 Гц, 1F, COF), -60,1 (т, 14 Гц, 2F, ICF2), -113,9 (м, 2F, CF2COF), -119,4 (кв, 11 Гц, 2F, CF2CF2), -122,9 (м, 2F, CF2CF2).
1-Иод-5-метоксиперфторпентан (5)
К суспензии 68 г (1,17 моль) прокаленного KF в 500 мл сухого диглима при перемешивании и температуре ~15°С прибавляют 400 г (0,86 моль в пересчете на чистый продукт) I(CF2)4COF, содержащего ~20% ICF2CF2I, и реакционную смесь перемешивают при комнатной температуре в течение часа. Далее при перемешивании и температуре 30 – 35°С добавляют 147 г (1,17 моль) (MeO)2SO2 и смесь перемешивают при 50 – 60°С в течение трех часов. Затем реакционную смесь охлаждают до комнатной температуры, выливают в 1 л холодной 5% соляной кислоты, нижний слой промывают 2 раза по 500 мл 5% соляной кислоты и ректифицируют.
Получают 280 г (выход 80%) I(CF2)5OCH3, т.кип. 65°С(10 Торр).
ЯМР 1H, δ: 3,5 (с, OCH3).
ЯМР 19F, δ: -59,4 (c, 2F, ICF2), -89,5 (с, 2F, CF2OCH3), -114,2 (c, 2F, CF2CF2), -122,4 (c, 2F, CF2CF2), -126,3 (c, 2F, CF2CF2OCH3).
(5-Метоксиперфторпентил)триметилсилан (6)
К суспензии 41,6 г (0,636 моль) порошка Zn и 3,2 г (0,032 моль) CuCl в 200 мл сухого ДМФА добавляют 3,2 г (0,03 моль) ClSiMe3 и смесь перемешивают 15 – 20 минут. Затем при температуре 5 – 10°С и перемешивании добавляют по каплям 90,4 г (0,54 моль) CH3SO3SiMe3 и далее при температуре 11 – 13°С добавляют по каплям 200 г (0,49 моль) I(CF2)5OCH3 после чего реакционную смесь перемешивают 30 минут при комнатной температуре, переливают в делительную воронку, дают смеси расслоиться, верхний слой отделяют, получают 156 г (выход ~80%) Me3Si(CF2)5OCH3, содержащего примесь ДМФА, Me3SiOSiMe3 и незначительное количество H(CF2)5OCH3, который используют в последующей стадии без дополнительной очистки.
ЯМР 1H, δ: 3,9 (с, 3H, OCH3), 0,5 (с, 9H, Si(CH3)3).
ЯМР 19F, δ: -89 (с, 2F, CF2OCH3), -119,8 (c, 2F, CF2CF2), -122,7 (c, 2F, CF2CF2), -125,9 (c, 2F, CF2CF2OCH3), -128,7 (т, 17 Гц, 2F, CF2SiMe3).
5-Метоксиперфторпентансульфонилфторид (7)
К суспензии 27 г (0,46 моль) прокаленного KF в 230 мл ДМФА при охлаждении холодной водой и перемешивании добавляют 108 г (0,46 моль SO2) 27,8% раствора SO2 в ДМФА. Далее при перемешивании и температуре 15 – 20°С добавляют 150 г (~0,38 моль) Me3Si(CF2)5OCH3, полученного вышеописанным способом, и смесь перемешивают при комнатной температуре в течение нескольких часов. Затем в реакционную смесь при интенсивном перемешивании и температуре 0 – 5оС барботируют 65 г (0,9 моль) Cl2, полученную смесь выливают в равный объем холодной 5% соляной кислоты, нижний слой отделяют, промывают 5% соляной кислотой, получают 112 г ClSO2(CF2)5OCH3, который далее смешивают с 200 мл предварительно расплавленного сульфолана и к полученной смеси прибавляют при перемешивании 48 г (0,83 моль) прокаленного KF. Реакционную смесь перемешивают при комнатной температуре в течение трех часов, выливают в 400 мл холодной 5% соляной кислоты, нижний слой отделяют, промывают равным объемом 5% соляной кислоты и ректифицируют.
Получают 77 г (выход 55%) FSO2(CF2)5OCH3, т.кип. 143 – 144°С.
ЯМР 1H, δ: 3,9 (с, OCH3).
ЯМР 19F, δ: 44,3 (с, 1F, SO2F), -90 (с, 2F, CF2OCH3), -109,1 (c, 2F, CF2SO2F), -121,4 (c, 2F, CF2CF2), -123,2 (c, 2F, CF2CF2), -126,6 (c, 2F, CF2CF2OCH3).
5-(Фторсульфонил)перфторпентаноилфторид (8)
К 6,3 г (0,021 моль) SbCl5 при перемешивании и температуре 80°С добавляют по каплям 77 г (0,21 моль) FSO2(CF2)5OCH3 с такой скоростью, чтобы реакционная смесь слабо кипела. После чего смесь продолжают нагревать до кипения в течение часа и перегоняют, собирая дистиллят с т.кип. 100°С.
Последующей ректификацией получают 55 г (выход 80%) FSO2(CF2)4COF, т.кип. 88 ‑ 90°С.
ЯМР 19F, δ: 44,9 (м, 1F, SO2F), 22,9 (т, 5 Гц, 1F, COF), -109,3 (т, 11 Гц, 2F, CF2SO2F), ‑119,4 (c, 2F, CF2COF), -121,1 (c, 2F, CF2CF2), -123,3 (c, 2F, CF2CF2).
5-(Фторсульфонил)перфторпентилвиниловый эфир (9)
К 8,8 г (0,15 моль) прокаленного KF в 300 мл сухого диглима добавляют при перемешивании и температуре 5 – 10°С 50 г (0,15 моль) FSO2(CF2)4COF и смесь перемешивают при комнатной температуре в течение часа. Далее при перемешивании и температуре -30°С конденсируют в реакционную смесь 25 г (0,15 моль) окиси гексафторпропилена, температуру смеси медленно повышают до комнатной и продолжают перемешивать смесь в течение часа. Затем в вакууме 10 Торр отгоняют дистиллят с т.кип. 30 – 60°С, представляющий собой смесь FSO2(CF2)5OCF(CF3)COF и диглима, который прибавляют при перемешивании и температуре 55 – 75°С к суспензии 15,9 г (0,15 моль) прокаленного Na2CO3 в 50 мл сухого диглима, с такой скоростью, чтобы газовыделение было не слишком интенсивным. После прекращения газовыделения температуру реакционной смеси повышают до 130 – 140°С и смесь перемешивают при этой температуре до прекращения газовыделения. Далее реакционную смесь охлаждают до комнатной температуры, выливают в 500 мл холодной 5% соляной кислоты, нижний слой отделяют, промывают несколько раз водой и подвергают ректификации.
Получают 41 г (65%) FSO2(CF2)5OCF=CF2, т.кип. 135 – 136°С.
Благодарности
Работа выполнена в рамках Государственного задания №075-00277-24-00 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН, а также при финансовой поддержке ПАО АФК “Система”.
Литература
- W. Grot, Fluorinated Ionomers, Second Edition, Elsevier Inc, 2011.
- R. Souzy, B. Ameduri, Prog. Polym. Sci., 2005, 30, 644-687.
- M. Odgaard, The Use of Per-Fluorinated Sulfonic Acid (PFSA) Membrane as Electrolyte in Fuel Cells, In: T. Nakajima, H. Groult (eds.), Advanced Fluoride-Based Materials for Energy Conversion. Elsevier Inc, 2015.
- T. Hirai, Y. Morizawa, Fluorinated Ionomers and Ionomer Membranes: Monomer and Polymer Synthesis and Applications, In: B. Ameduri, H. Sawada (eds.) Fluorinated Polymers, Volume 2: Applications, RSC Polymer Chemistry Series, 24, 2017.
- S.J. Hamrock, M.A. Yandrasits, J. Macromol. Sci., Part C, 2006, 46, 219-244.
- C.M. Orsino, Influence of Sidechain Structure and Interactions on the Physical Properties of Perfluorinated Ionomers, Dissertation submitted to the faculty of the Virginia Polytechnic Institute and State University, 2020.
- O.N. Primachenko, E.A. Marinenko, A.S. Odinokov, S.V. Kononova, Y.V. Kulvelis, V.T. Lebedev, Polym. Adv. Technol., 2021, 32, 1386-1408.
- N. Zhao, Z. Shi, F. Girard, Materials, 2022, 15, 78.
- D. Madhav, J. Wang, R. Keloth, J. Mus, F. Buysschaert, V. Vandeginste, Energies, 2024, 17, 998.
- CN107298647B (2019).
- J. Peng, X. Fan, G.A. Goenaga, C.M. Weiss, C.A. Neal, N. Cantillo, T.A. Jr. Zawodzinski, ACS Appl. Polym. Mater., 2023, 5, 9940-9951.
- S.M. Igumnov, A.A. Tyutyunov, RU2475477C1 (2013).
- M. Emery, M. Frey, M. Guerra, G. Haugen, K. Hintzer, K.H. Lochhaas, P. Pham, D. Pierpont, M. Schaberg, A. Thaler, ECS Trans., 2007, 11, 3-14.
- D.F. Mukhametshin, A.A. Deryabin, M.M. Tatarenkova, RU2800857C1 (2023).
- C.G. Krespan, D.V. England, J. Am. Chem. Soc., 1981, 103, 5598-5599.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2024, 154, 3-4


