Поступило в редакцию: Январь 2024
УДК 536.6:539.2:543.429.2:661.489
Fluorine Notes, 2024, 152, 1-2
СРАВНЕНИЕ ХАРАКТЕРИСТИК СТРУКТУРЫ, ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ ФТОРИРОВАННОГО ПОЛИЭФИРА ПЭФ-216 И ЕГО УГЛЕВОДОРОДНЫХ АНАЛОГОВ
Пеганова Н. В.1,2, Муравьев А. А.1,3, Мокрушин И. Г.2,4, Литвиненко Е. В.2, Воронина К. А.1, Кривчун М. Н. 5, Ибрагимова Р. И.1,6
1Федеральное государственное бюджетное учреждение высшего образования «Санкт-Петербургский государственный университет технологии и дизайна», ФГБОУВО СПбГУПТД
2Акционерное общество Российский научный центр «Прикладная химия (ГИПХ)», АО РНЦ «Прикладная химия (ГИПХ)»
3Федеральное государственное бюджетное учреждение науки Институт высокомолекулярных соединений Российской академии наук, ФГБОУН ИВС РАН.
4Федеральное государственное бюджетное учреждение высшего образования «Пермский государственный научно-исследовательский университет», ФГБОУВО ПГНИУ
5Федеральное государственное бюджетное учреждение высшего образования «Санкт-Петербургский государственный технологический институт (Технический университет)» ФГБОУВО СПбГТИ (ТУ)
6Акционерное общество «Полиметалл Инжиниринг», АО «Полиметалл Инжиниринг»
chem_se@mail.ru, antonmuravyev@list.ru, mig@psu.ru
Аннотация: Методом ядерного магнитного резонанса 19F и дифференциальной сканирующей калориметрии (ДСК) были уточнены структуры молекул и некоторые физико-химические характеристики перфторированных полиэфиров ПЭФ-216, получаемых методом электродимеризации. Проведены квантово-химические расчеты, которые показали соответствия между расчетной моделью и свойствами реальных молекул ПЭФ216.
Ключевые слова: фторированный эфир, температура стеклования, теплоёмкость, дифференциальная сканирующая калориметрия (ДСК), дипольный момент, квантово-химические методы расчёта, полиэфиры, ЯМР.
Технологии синтеза перфторированных органических соединений разрабатываются в ГИПХ несколько десятков лет [1]. Для нужд технологии и медицины необходимы новые растворители и эффективные поверхностно-активные вещества, свойства которых установлены в широком диапазоне параметров существования и, что немаловажно, их утилизации и деградации. Известно, что перфторированные соединения весьма стойки при нормальных условиях к температурным и химическим воздействиям, поэтому для уменьшения их стойкости и придания некоторых других особых свойств практикуется введение в углеродный скелет гетероатомов, таких, как кислород, азот, сера, фосфор и некоторых других. Для создания таких соединений приходится использовать комплекс нескольких методов [2], а получаемые соединения могут при этом отличаться по своей структуре [3;4]. Состав и строение получаемых соединений устанавливают методом спектроскопии ядерного магнитного резонанса, в т.ч. на ядрах фтора, в котором благодаря широкому диапазону химических сдвигов каждый сигнал может быть идентифицирован, а атомы фтора в ЯМР 19F имеют 100 % интенсивность [5]. Метод применим для качественного подтверждения структуры и количественной оценки содержания фторсодержащих соединений в любых смесях как в виде растворов, так и в эмульсиях.
Выпускаемый ГИПХ полиэфир ПЭФ-216 [2], разработанный взамен алифатических фторорганических жидкостей, является продуктом электродимеризации по уравнению
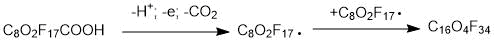
может иметь разную структуру (ПЭФ-216-1, ПЭФ-216-2 и ПЭФ-216-3), представленную ниже (рисунки 1–3) благодаря радикальным перегруппировкам. Побочные продукты характерны для этого типа радикальных реакций.

Рисунок 1. Структура возможного продукта ПЭФ-216-1 (1,1,1,2,2,3,3,5,6,6,8,9,11,11,12,14,14,15,15,16,16,16-докозафторо-5,8,9,12-тетракис(трифторметил)-4,7,10,13-тетраоксагексадекан).

Рисунок 2. Структура возможного продукта ПЭФ-216-2 (1,1,1,2,2,3,3,5,6,6,8,8,9,9,10,12,12,13,15,15,16,16,17,17,17-пентакозафторо-5,8,13-трикис(трифторметил)-4,7,11,14-тетраоксагептадекан).

Рисунок 3. Структура возможных продукта ПЭФ-216-3 (1,1,1,2,2,3,3,5,6,6,8,8,9,9,10,1011,11,13,13,14,16,16,17,1718,18,18-октакозафторо-5,14-бис(трифторметил)-4,7,12,15-тетраоксаоктадекан).
Структурные формулы изображены на рисунках 1-3. Отличия между ними сосредоточены в центральной части молекулы, расположенной между вторыми с любого конца молекулы эфирными кислородными группами: это или линейное строение центрального звена из групп CF2, или одна CF3 группа, или две CF3 группы. Общее количество атомов углерода и фтора в центральном звене при этом не меняется, но энергетические и электрические характеристики молекул должны изменяться. Набор такого рода изомеров типичен для соединений-продуктов радикальных реакций, но соотношение количества молекул конкретного строения может значительно различаться в зависимости от способов инициирования, растворителя, температуры синтеза.
Структуры молекул ПЭФ-216 уточняли методом ядерного магнитного резонанса 19F (спектрометр Bruker Avance III HD 400) [6] со стабилизацией по внешнему стандарту ДМСО (рисунок 4).
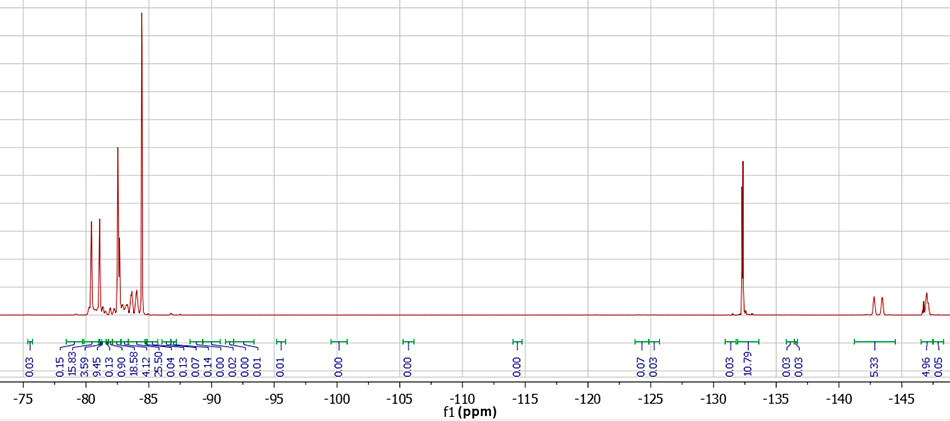
Рисунок 4. Спектр ЯМР 19F ПЭФ-216. Расшифровка спектра: 19F NMR (376 MHz, DMSO-d6) δ -80.77 (д, 6F, CF3 центральные, J = 240 Hz), -82.47 – -82.80 (м, 6F, CF3 полиэфирные), -80.14 – -84.21 (m), -84.40 – -84.55 (м, 6F, CF3 концевые), -132.33 (м, 4F, CF2 концевые), -143.11 (д, 2F, CF центральные, J = 240 Hz), -146.60 – -147.24 (м, 2F, CF полиэфирные).
По данным ЯМР преобладает структура ПЭФ-216-1 (рисунок 1), ПЭФ-216-2 около 1%. Изомер ПЭФ-216-3 зафиксирован в следовых количествах, поэтому далее не рассматривается.
Термическая стабильность конкретной молекулы во многом связана с природной способностью рассеивать внешнее энергетическое воздействие и зависит от ее природы. Одной из составляющих является теплоёмкость – важная практическая характеристика полифторированых эфиров. Благодаря строению и полной замене водородов на фтор, теплоёмкость фторзамещённых полиэфиров мало зависит от температуры, для подтверждения этого нами было проведено изучение зависимости теплоёмкости от температуры.
На рисунке 5 приведены результаты измерения зависимости теплоёмкости от температуры фторзамещённого полиэфира ПЭФ-216 на приборе дифференциальной сканирующей калориметрии (ДСК) Netsch DSC Polyma 214 методом сравнения с поликристаллическим корундовым эталоном. Теплоёмкость фторзамещённого ПЭ-216 была изучена в широком диапазоне температур от -135 до 120 °C в запаянном тигле. Обнаружен переход стеклования при -108°C. Плавление в условиях анализа ДСК не найдено, что говорит о том, что олигомер находится только в аморфной фазе. Анализ значений приведенной на рисунке 5 зависимости показывает, что теплоёмкость ПЭФ-216 в незначительной степени меняется при изменении температуры образца и является практически линейной в интервале -95 до 120 °C. Пик разложения в запаянном тигле 254 °C. Это значит, что включение кислородных мостиков в структуру молекулы действительно заметно понижает температуру деградации перфторированных молекул – политетрафторэтилен разрушается при температурах около 500 °C. Уточнение результатов измерения проводили на калориметре CalvetC80 фирмы Setaram с использованием ПО “CalistoDataAcqusition” и “Calistoprocessing”. Установлена температура начала испарения образца в открытом тигле 45 °C, температура кипения 216 °C.
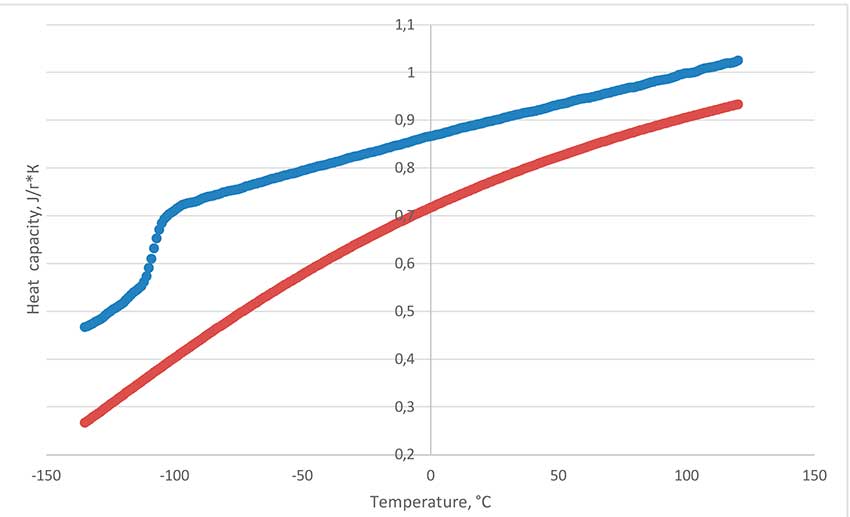
Рисунок 5. Зависимость теплоёмкости полиэфира (сверху, синий) и корунда (снизу, красный) от температуры
На основе калориметрических измерений получено уравнение зависимости теплоемкости при постоянном давлении от температуры для ПЭФ-216 в интервале -95 до 120 °C:
Cp = 0,86323 + 0,00137 ∙ T, R2=0.99905
где: Сp – теплоёмкость при постоянном давлении, Дж/г К;
Т – абсолютная температура, К;
R2 – величина достоверности аппроксимации;
По линейному внешнему виду и коэффициентам этого уравнения можно судить о малой зависимости свойств теплоемкости [7] от температуры жидкого ПЭФ-216 в изученном диапазоне температур, что служит доказательством постоянства состава жидкости в этих условиях и, по-видимому, отсутствия надмолекулярных образований между молекулами жидкости, что в целом можно предсказать априори, исходя из суперсопряжения между атомами фтора внутри каждой индивидуальной отдельной молекулы ПЭФ, что часто приводит к возгонке кристаллических перфторированных соединений из-за слабого когезионного взаимодействия между молекулами одной фазы. Коэффициенты в уравнении теплоёмкости служат для предсказания влияния температуры на возможность поглощения и передачи/рассеивания энергии массой вещества: положительный или отрицательный первый коэффициент указывает на характер увеличения теплоемкости с ростом температуры. Это находится в согласии с тем, что галогенные связи найдены только в кристаллах с хлором, бромом и йодом [8], галогенные связи между атомами фтора разных молекул не были описаны. По изменению теплоемкости можно судить о возникновении частично кристаллических структур или возникновении межмолекулярных ассоциатов – это малозаметные свойства, но важные для некоторых видов электроники и техники.
С целью объяснения термических свойств изучаемого полиэфира интересно создать модель его структуры при помощи квантово-химических расчетов.
Предсказание свойств полиэфиров до их синтеза является актуальной технологической задачей. Если для кристаллических соединений существуют уже предсказательные теории и компьютерные программы на их основе (например, эволюционный алгоритм USPEX или программа CRYSTAL14 [9]), для углеводородных молекул в соответствии с теорией химического строения, например, программа CHETAH [10], в работе [11] была показана высокая сходимость полученных расчётных значений методом квантово-химического расчёта с литературными данными для углеводородных молекул, и даже для предсказания их биологической активности [12], то подобные предсказательные теории практически отсутствуют для фторорганических молекул.
Для сравнения имеющихся и расчетных физико-химических свойств ранее синтезированного ПЭФ-216 были проведены исследования и квантово-химические расчеты с выявлением однозначного соответствия между квантово-химической расчетной моделью и свойствами реальных молекул, с целью создания расчетной модели обладающей предсказательной способностью.
В настоящее время в опубликованных источниках ощущается недостаток данных по соотнесению результатов квантово-химических расчётов фторированных органических соединений, основанных на выбранным нами методе квантово-химического расчёта, с известными характеристиками существующих соединений. Получение таких величин и сравнение их с реальными и литературными данными источников является ценной информацией.
Квантово-химические расчёты оптимизации геометрического строения, а также расчёт энергии и дипольного момента молекулы осуществлены с применением теории функционала плотности (DFT-density functional theory) и методом гибридного функционала плотности B3LYP, базисным набором 6-311G++(d, p), с установленным значением допуска сходимости градиента по Хартри/Бору (OPTOL) равным 8,0×10-6.
Квантово-химические расчёты оптимизации структур перфторированных полиэфиров ПЭФ-216-1 и ПЭФ-216-2, а также их углеводородных аналогов ПЭ-1 (5,8,9,12-тетраметил-4,7,10,13-тетраоксагексадекан) и ПЭ-2 (5,8,13-триметил-4,7,11,14-тетраоксагептадекан), проводили используя программное обеспечение Firefly на базе QCpackage [13] и GAMESS (US) [14].
В таблице 1 представлены расчётные значения энергий молекул и дипольного момента для указанных структур.
Пересчёт энергии Хартри в кДж/моль, происходил по соотношению [15] и [16]:
Ем = 2625.5 Eмх,
где 2625500 – коэффициент пересчета энергии из Хартри (а.е.- атомные единицы) в Дж/моль;
Ем – значение энергии молекулы в Дж/моль;
Eмх – значение энергии молекулы в Хартри.
Таблица 1. Полученные квантово-химическим методом расчётные значения энергетических характеристик молекулярных структур ПЭФ-216-1 и ПЭФ-216-2, а также их углеводородных аналогов с идентичным строением углеводородного скелета ПЭ-1 и ПЭ-2
|
Наименование |
Дипольный момент, Дебай |
Энергия молекулы, Хартри |
Энергия молекулы 10-6, Дж/моль |
|
ПЭФ-216-1, вероятность структуры 99% |
0.436223 |
-4 306.483 |
-11 306.670 |
|
ПЭФ-216-2, вероятность структуры 1% |
0.961393 |
-4 306.487 |
-11 306.680 |
|
ПЭ-1, углеводородный аналог ПЭФ-216-1 |
0.306377 |
-931.325 |
-2 445.195 |
|
ПЭ-2, углеводородный аналог ПЭФ-216-2 |
1.556392 |
-931.324 |
-2 445.191 |
Расчетные величины для описанных в таблице 1 изомеров даны с точностью до отличающихся цифр, в данном случае это тысячные Хартри и тысячные доли Дж/моль. Анализ величин дипольных моментов (таблица 1) показывает близкое к двукратному изменение значения дипольного момента при сравнении ПЭФ-216-1 и ПЭФ-216-2, что можно объяснить более симметричным строением молекулы ПЭФ-216-1 в сравнении с ПЭФ-216-2. Более ассиметричная молекула ПЭФ-216-2 имеет большую величину дипольного момента или более значительное расстояние между геометрическими центрами отрицательно и положительно заряженных атомов в молекуле. Величина дипольного момента, несомненно, зависит от структурной изменчивости молекулы, но в данном случае речь идет о молекуле в состоянии идеального газа и полностью оптимизированной – с наименьшей возможной энергией по данным квантового расчета, однако выводы по результатам расчётов могут быть использованы для построения системы знаний «состав-свойство» этих молекул как индивидуально, так и в смесях с другими соединениями.
Расчёт значений энергий молекул ПЭФ-216-1 и ПЭФ-216-2 даёт идентичные результаты, что говорит нам о том, что обе структуры энергетически выгодны и обе структуры присутствуют в качестве конечного продукта при синтезе фторированного полиэфира.
Аналогичная тенденция наблюдается и для углеводородных аналогов: дипольные моменты отличаются в разы, при этом энергии молекул практически идентичны.
Меньший дипольный момент преобладающего в смеси изомера может быть следствием каких-то кинетических ограничений для образования изомера с большим дипольным моментом, поскольку энергии обеих молекул изомеров или их термодинамические характеристики одинаковы.
Таким образом, преобладающее строение простого перфторированного полиэфира ПЭФ-216-1 (рисунок 1) и преобладающее строение углеводородного полиэфира ПЭ-1 отличаются структурно, но энергетически не отличаются. Это соответствует традиции при рассмотрении замены атомов водорода на атомы фтора почти такой же атомной величины, учитывать в основном взаимовлияние атомов фтора при предсказании, проявляемых в физических взаимодействиях или химических реакциях свойств молекулы.
Судя по энергетическим характеристикам молекул, приведённым в таблице 1 можно заключить, что более отрицательные величины энергии молекул ПЭФ-216-1 и ПЭФ-216-2 указывают на их большую инертность, но в тоже время меньшую конформационную изменчивость молекул в сравнении с углеводородными аналогами ПЭ-1 и ПЭ-2.
На рисунке 6 представлены структуры молекул и направление их дипольных моментов для ПЭФ-216-1 и ПЭФ-216-2, а также их углеводородных аналогов ПЭ-1 и ПЭ-2 с указанием направления дипольного момента молекулы, полученные в результате квантово-химических расчетов указанных молекул. Направление дипольных моментов у фторзамещённых полиэфиров ПЭФ-216 проходит в основном вдоль оси скелета изогнутой в форме полумесяца молекулы, в то время как у углеводородных аналогов ПЭ-1 и ПЭ-2 направление дипольных моментов перпендикулярно к оси скелета молекулы. Такие отличия связаны в большей степени с локализацией электроотрицательных атомов: в случае углеводородного полиэфира это атомы кислорода, которые относительно симметрично расположены с обеих сторон от геометрического центра молекулы, оттого и дипольный момент занимает положение практически оси симметрии молекулы. В случае же перфторированного полиэфира более электроотрицательны, чем атомы кислорода атомы фтора, которых значительно больше в молекуле и их расположение и влияние более разнообразно, – соответственно, и «центр отрицательных зарядов» структуры находится далеко от центра симметрии молекулы, создавая более сложнонаправленное собственное магнитное поле.
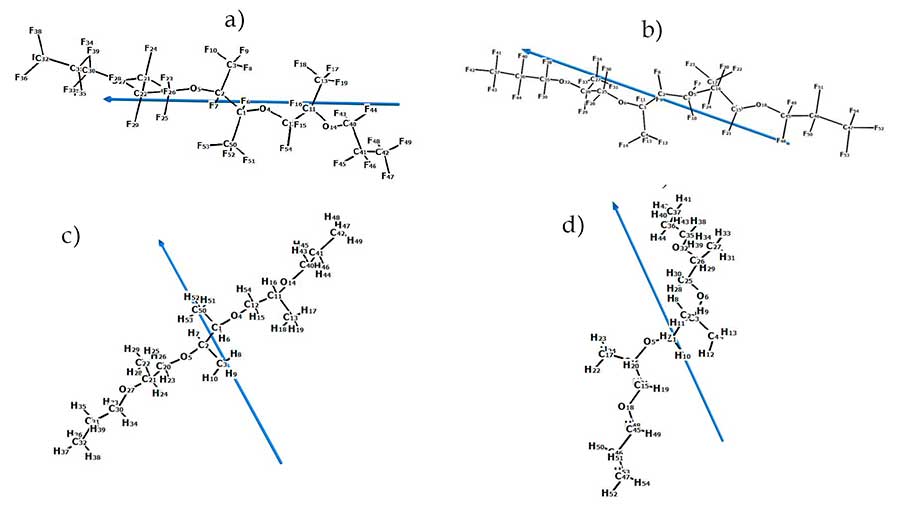
Рисунок 6. Расчетные дипольные моменты полиэфиров:
а) оптимизированная структура ПЭФ-216-1, 99% согласно спектрам ЯМР 19F;
б) оптимизированная структура ПЭФ-216-2,в 1% согласно спектрам ЯМР 19F;
в) ПЭ-1; г) ПЭ-2.
Проведен квантово-химический расчёт длин связей, углов расположения атомов и значений заряда каждого атома для ПЭФ-216-1 и ПЭФ-216-2, а также их углеводородных аналогов ПЭ-1 и ПЭ-2.
Таблица 2. Значение длин связей, углов расположения атомов относительно друг друга и значения заряда каждого атома молекулы ПЭФ-216-1.
|
ПЭФ-216-1 вероятность структуры 99% |
|||||
|---|---|---|---|---|---|
|
Тип и номер атома |
Заряд атома, Mulleken |
Обозначение атомов связи |
Значение длины связи, Å |
Обозначение атомов угла |
Значение угла связи, градусы |
|
C1 |
-1.309749 |
R(1-2) |
1.586 |
A(2-1-4) |
104.4 |
|
C2 |
-0.813605 |
R(1-4) |
1.397 |
A(2-1-6) |
108.3 |
|
C3 |
0.799327 |
R(1-6) |
1.359 |
A(2-1-50) |
113.1 |
|
O4 |
0.33864 |
R(1-50) |
1.578 |
A(1-2-3) |
113.4 |
|
O5 |
0.431444 |
R(2-3) |
1.579 |
A(1-2-5) |
106.9 |
|
F6 |
0.068969 |
R(2-5) |
1.402 |
A(1-2-7) |
108.7 |
|
F7 |
0.057866 |
R(2-7) |
1.356 |
A(4-1-6) |
111.0 |
|
F8 |
-0.024253 |
R(3-8) |
1.333 |
A(4-1-50) |
113.9 |
|
F9 |
0.000545 |
R(3-9) |
1.336 |
A(1-4-12) |
125.6 |
|
F10 |
-0.056933 |
R(3-10) |
1.336 |
A(6-1-50) |
106.0 |
|
C11 |
-1.643975 |
R(4-12) |
1.382 |
A(1-50-51) |
109.4 |
|
C12 |
0.252222 |
R(5-20) |
1.378 |
A(1-50-52) |
111.3 |
|
C13 |
0.954032 |
R(11-12) |
1.579 |
A(1-50-53) |
110.5 |
|
O14 |
0.086152 |
R(11-13) |
1.572 |
A(3-2-5) |
108.0 |
|
F15 |
-0.009412 |
R(11-14) |
1.394 |
A(3-2-7) |
107.3 |
|
F16 |
0.039637 |
R(11-16) |
1.357 |
A(2-3-8) |
111.2 |
|
F17 |
-0.018644 |
R(12-15) |
1.344 |
A(2-3-9) |
110.4 |
|
F18 |
-0.068201 |
R(12-54) |
1.344 |
A(2-3-10) |
109.3 |
|
F19 |
-0.005167 |
R(13-17) |
1.338 |
A(5-2-7) |
112.5 |
|
C20 |
-0.15421 |
R(13-18) |
1.336 |
A(2-5-20) |
123.7 |
|
C21 |
-1.148324 |
R(13-19) |
1.335 |
A(8-3-9) |
109.5 |
|
C22 |
0.882427 |
R(14-40) |
1.379 |
A(8-3-10) |
108.0 |
|
F23 |
-0.00332 |
R(20-21) |
1.576 |
A(9-3-10) |
108.3 |
|
F24 |
0.036055 |
R(20-23) |
1.344 |
A(4-12-11) |
107.7 |
|
F25 |
0.001865 |
R(20-25) |
1.347 |
A(4-12-15) |
112.5 |
|
F26 |
-0.035878 |
R(21-22) |
1.570 |
A(4-12-54) |
110.6 |
|
O27 |
0.10858 |
R(21-24) |
1.360 |
A(5-20-21) |
107.4 |
|
F28 |
-0.040098 |
R(21-27) |
1.394 |
A(5-20-23) |
112.5 |
|
F29 |
-0.016583 |
R(22-26) |
1.334 |
A(5-20-25) |
111.7 |
|
C30 |
0.208552 |
R(22-28) |
1.339 |
A(12-11-13) |
113.7 |
|
C31 |
-0.265798 |
R(22-29) |
1.336 |
A(12-11-14) |
103.3 |
|
C32 |
0.632992 |
R(27-30) |
1.379 |
A(12-11-16) |
107.8 |
|
F33 |
-0.034372 |
R(30-31) |
1.566 |
A(11-12-15) |
109.7 |
|
F34 |
-0.038449 |
R(30-33) |
1.349 |
A(11-12-54) |
108.3 |
|
F35 |
-0.039028 |
R(30-34) |
1.343 |
A(13-11-14) |
113.0 |
|
F36 |
-0.076908 |
R(31-32) |
1.563 |
A(13-11-16) |
107.5 |
|
F37 |
-0.087581 |
R(31-35) |
1.348 |
A(11-13-17) |
109.4 |
|
F38 |
-0.079782 |
R(31-39) |
1.349 |
A(11-13-18) |
110.7 |
|
F39 |
-0.043116 |
R(32-36) |
1.336 |
A(11-13-19) |
110.8 |
|
C40 |
0.245408 |
R(32-37) |
1.337 |
A(14-11-16) |
111.6 |
|
C41 |
-0.226797 |
R(32-38) |
1.337 |
A(11-14-40) |
125.7 |
|
C42 |
0.59073 |
R(40-41) |
1.565 |
A(15-12-54) |
108.0 |
|
F43 |
-0.038198 |
R(40-43) |
1.343 |
A(17-13-18) |
108.3 |
|
F44 |
-0.030768 |
R(40-44) |
1.349 |
A(17-13-19) |
108.9 |
|
F45 |
-0.04374 |
R(41-42) |
1.563 |
A(18-13-19) |
108.7 |
|
F46 |
-0.037226 |
R(41-45) |
1.349 |
A(14-40-41) |
105.7 |
|
F47 |
-0.088184 |
R(41-46) |
1.348 |
A(14-40-43) |
112.5 |
|
F48 |
-0.080065 |
R(42-47) |
1.336 |
A(14-40-44) |
111.4 |
|
F49 |
-0.075932 |
R(42-48) |
1.337 |
A(21-20-23) |
108.1 |
|
C50 |
0.98814 |
R(42-49) |
1.336 |
A(21-20-25) |
110.0 |
|
F51 |
-0.027068 |
R(50-51) |
1.338 |
A(20-21-22) |
114.7 |
|
F52 |
0.010519 |
R(50-52) |
1.334 |
A(20-21-24) |
107.3 |
|
F53 |
-0.039886 |
R(50-53) |
1.336 |
A(20-21-27) |
102.5 |
|
F54 |
-0.032851 |
- |
- |
A(23-20-25) |
107.2 |
|
- |
- |
- |
- |
A(22-21-24) |
107.0 |
|
- |
- |
- |
- |
A(22-21-27) |
113.4 |
|
- |
- |
- |
- |
A(21-22-26) |
111.0 |
|
- |
- |
- |
- |
A(21-22-28) |
109.4 |
|
- |
- |
- |
- |
A(21-22-29) |
110.5 |
|
- |
- |
- |
- |
A(24-21-27) |
111.7 |
|
- |
- |
- |
- |
A(21-27-30) |
126.4 |
|
- |
- |
- |
- |
A(26-22-28) |
108.0 |
|
- |
- |
- |
- |
A(26-22-29) |
109.0 |
|
- |
- |
- |
- |
A(28-22-29) |
108.8 |
|
- |
- |
- |
- |
A(27-30-31) |
105.8 |
|
- |
- |
- |
- |
A(27-30-33) |
111.0 |
|
- |
- |
- |
- |
A(27-30-34) |
112.7 |
|
- |
- |
- |
- |
A(31-30-33) |
109.4 |
|
- |
- |
- |
- |
A(31-30-34) |
109.8 |
|
- |
- |
- |
- |
A(30-31-32) |
115.5 |
|
- |
- |
- |
- |
A(30-31-35) |
108.5 |
|
- |
- |
- |
- |
A(30-31-39) |
108.1 |
|
- |
- |
- |
- |
A(33-30-34) |
108.0 |
|
- |
- |
- |
- |
A(32-31-35) |
107.7 |
|
- |
- |
- |
- |
A(32-31-39) |
107.8 |
|
- |
- |
- |
- |
A(31-32-36) |
110.9 |
|
- |
- |
- |
- |
A(31-32-37) |
108.6 |
|
- |
- |
- |
- |
A(31-32-38) |
110.9 |
|
- |
- |
- |
- |
A(35-31-39) |
109.1 |
|
- |
- |
- |
- |
A(36-32-37) |
108.7 |
|
- |
- |
- |
- |
A(36-32-38) |
109.0 |
|
- |
- |
- |
- |
A(37-32-38) |
108.7 |
|
- |
- |
- |
- |
A(41-40-43) |
109.9 |
|
- |
- |
- |
- |
A(41-40-44) |
109.5 |
|
- |
- |
- |
- |
A(40-41-42) |
115.5 |
|
- |
- |
- |
- |
A(40-41-45) |
108.1 |
|
- |
- |
- |
- |
A(40-41-46) |
108.5 |
|
- |
- |
- |
- |
A(43-40-44) |
107.8 |
|
- |
- |
- |
- |
A(42-41-45) |
107.8 |
|
- |
- |
- |
- |
A(42-41-46) |
107.7 |
|
- |
- |
- |
- |
A(41-42-47) |
108.6 |
|
- |
- |
- |
- |
A(41-42-48) |
110.9 |
|
- |
- |
- |
- |
A(41-42-49) |
110.9 |
|
- |
- |
- |
- |
A(45-41-46) |
109.1 |
|
- |
- |
- |
- |
A(47-42-48) |
108.7 |
|
- |
- |
- |
- |
A(47-42-49) |
108.7 |
|
- |
- |
- |
- |
A(48-42-49) |
109.0 |
|
- |
- |
- |
- |
A(51-50-52) |
109.0 |
|
- |
- |
- |
- |
A(51-50-53) |
107.7 |
|
- |
- |
- |
- |
A(52-50-53) |
108.9 |
Рассчитано, что в структуре ПЭФ-216-1 все атомы кислорода имеют положительный заряд, т. к. атомы фтора более электроотрицательны, но несколько неожиданным оказалось, что часть атомов фтора (F6, F7, F9, F16, F24, F25, F52) имеют также положительный заряд. Общая структурная формула ПЭФ-216 имеет вид C16O4F34. Всего в электронейтральной структуре ПЭФ-216 имеется 34 атома фтора, соответственно процент положительно заряженных атомов фтора от общего числа атомов фтора в структуре составляет около 21 %.
При рассмотрении структуры молекулы видно, что атомы фтора с пониженной электронной плотностью связаны со «скелетным» углеродным атомом молекулы, который, в свою очередь, связан с эфирным кислородным мостиком и группой CF3 которая является основным приобретателем электронной плотности. Длина связи углерода с этими атомами фтора (1.358 ± 0.002) Å, что находится в соответствии со справочными данными для длин связей с атомами фтора в ионных тетраэдрических структурах [17], в то время как длины связей C–F в фрагменте CF3 (1.336 ± 0.003) Å типичны для этих групп [18], как в перфторированных молекулах, так и в качестве заместителя в органических молекулах. Длины связей углерод-углерод в структурах перфторированных эфиров составляют (1.570 ± 0.014) Å, что несколько больше длин связей в органических молекулах и приближается по величине к длине связей между атомами углерода в напряженных циклах с углеродными заместителями [17], в то время как в углеводородных аналогах ПЭ длины связей между атомами углерода (1.528 ± 0.011) Å (таблицы 4, 5) меньше. А вот длины связей углерод-кислород (1.388 ± 0.014) Å лишь немногим меньше, чем в простых органических эфирах (1.426 ± 0.005) Å (таблицы 4, 5), что несколько неожиданно, учитывая полностью другое распределение зарядов по молекуле, и должно приводить, по-видимому, к «сжатию» структуры молекулы.
Если посчитать долю всех положительно заряженных атомов в ПЭФ-216-2: углерода, кислорода и фтора от общего количества атомов молекулы, то получим содержание положительно заряженных центров в молекуле около 37 %, что почти в два раза больше, чем в рассмотренной выше молекуле изомера ПЭФ-216-1. Разнозаряженные центры свидетельствуют о наличии дипольного момента, характерного скорее для фторированных полимеров частично кристаллического строения [19], хотя структура полиэфира на первый взгляд не указывает на подобное свойство. Разница в процентном содержании положительно заряженных атомов между ПЭФ-216-1 и ПЭФ-216-2 связана с количеством групп СF3 в молекуле: больше групп – больше теряющих свое электронное облако атомов фтора напротив этих заместителей в основной цепи молекулы фторполиэфира. Трифторметильные СF3-группы вносят сильный поляризующий эффект, но одна такая группа в молекуле вносит больший вклад в ассиметрию зарядов и создает больший дипольный момент, чем две группы СF3, которые, по-видимому, отчасти компенсируют поляризующее влияние друг друга.
Таблица 3. Значение длин связей, углов расположения атомов относительно друг друга и значения заряда каждого атома молекулы ПЭФ-216-2.
|
ПЭФ-216-2 вероятность структуры 1% |
|||||
|---|---|---|---|---|---|
|
Тип и номер атома |
Заряд атома, Mulleken |
Обозначение атомов связи |
Значение длины связи, Å |
Обозначение атомов угла |
Значение угла связи, градусы |
|
C1 |
-0.054924 |
R(1-2) |
1.568 |
A(2-1-5) |
107.7 |
|
C2 |
0.375702 |
R(1-5) |
1.377 |
A(2-1-7) |
107.8 |
|
C3 |
-1.743212 |
R(1-7) |
1.343 |
A(2-1-10) |
109.3 |
|
C4 |
1.082164 |
R(1-10) |
1.348 |
A(1-2-3) |
119.2 |
|
O5 |
0.405634 |
R(2-3) |
1.579 |
A(1-2-8) |
107.2 |
|
O6 |
0.33351 |
R(2-8) |
1.351 |
A(1-2-9) |
106.8 |
|
F7 |
-0.016021 |
R(2-9) |
1.348 |
A(5-1-7) |
112.6 |
|
F8 |
0.009384 |
R(3-4) |
1.566 |
A(5-1-10) |
111.9 |
|
F9 |
0.014333 |
R(3-6) |
1.407 |
A(1-5-16) |
126.1 |
|
F10 |
0.004965 |
R(3-11) |
1.354 |
A(7-1-10) |
107.4 |
|
F11 |
0.039476 |
R(4-12) |
1.338 |
A(3-2-8) |
106.1 |
|
F12 |
-0.02287 |
R(4-13) |
1.335 |
A(3-2-9) |
108.7 |
|
F13 |
-0.001654 |
R(4-14) |
1.335 |
A(2-3-4) |
116.7 |
|
F14 |
-0.046151 |
R(5-16) |
1.396 |
A(2-3-6) |
105.1 |
|
C15 |
0.271916 |
R(6-25) |
1.374 |
A(2-3-11) |
108.5 |
|
C16 |
-1.585437 |
R(15-16) |
1.573 |
A(8-2-9) |
108.6 |
|
C17 |
0.888419 |
R(15-18) |
1.379 |
A(4-3-6) |
106.9 |
|
O18 |
0.040516 |
R(15-19) |
1.348 |
A(4-3-11) |
107.3 |
|
F19 |
-0.038344 |
R(15-21) |
1.344 |
A(3-4-12) |
110.2 |
|
F20 |
0.063785 |
R(16-17) |
1.573 |
A(3-4-13) |
110.9 |
|
F21 |
0.012383 |
R(16-20) |
1.358 |
A(3-4-14) |
109.2 |
|
F22 |
-0.03529 |
R(17-22) |
1.333 |
A(6-3-11) |
112.5 |
|
F23 |
-0.057756 |
R(17-23) |
1.335 |
A(3-6-25) |
123.0 |
|
F24 |
-0.005835 |
R(17-24) |
1.337 |
A(12-4-13) |
109.2 |
|
C25 |
0.019802 |
R(18-45) |
1.385 |
A(12-4-14) |
108.4 |
|
C26 |
-1.263178 |
R(25-26) |
1.576 |
A(13-4-14) |
108.9 |
|
C27 |
0.954253 |
R(25-28) |
1.346 |
A(5-16-15) |
112.9 |
|
F28 |
-0.029069 |
R(25-30) |
1.347 |
A(5-16-17) |
103.5 |
|
F29 |
0.034601 |
R(26-27) |
1.571 |
A(5-16-20) |
111.6 |
|
F30 |
-0.0019 |
R(26-29) |
1.359 |
A(6-25-26) |
107.4 |
|
F31 |
-0.040466 |
R(26-32) |
1.394 |
A(6-25-28) |
111.7 |
|
O32 |
0.104271 |
R(27-31) |
1.334 |
A(6-25-30) |
112.1 |
|
F33 |
-0.041718 |
R(27-33) |
1.339 |
A(16-15-18) |
107.8 |
|
F34 |
-0.02015 |
R(27-34) |
1.336 |
A(16-15-19) |
108.9 |
|
C35 |
0.18297 |
R(32-35) |
1.378 |
A(16-15-21) |
109.8 |
|
C36 |
-0.236858 |
R(35-36) |
1.566 |
A(15-16-17) |
114.2 |
|
C37 |
0.622581 |
R(35-38) |
1.349 |
A(15-16-20) |
107.3 |
|
F38 |
-0.035027 |
R(35-39) |
1.343 |
A(18-15-19) |
111.5 |
|
F39 |
-0.038839 |
R(36-37) |
1.563 |
A(18-15-21) |
111.1 |
|
F40 |
-0.038774 |
R(36-40) |
1.348 |
A(15-18-45) |
121.5 |
|
F41 |
-0.077175 |
R(36-44) |
1.349 |
A(19-15-21) |
107.8 |
|
F42 |
-0.088057 |
R(37-41) |
1.336 |
A(17-16-20) |
107.2 |
|
F43 |
-0.079762 |
R(37-42) |
1.337 |
A(16-17-22) |
110.6 |
|
F44 |
-0.044023 |
R(37-43) |
1.337 |
A(16-17-23) |
109.2 |
|
C45 |
0.195155 |
R(45-46) |
1.564 |
A(16-17-24) |
110.7 |
|
C46 |
-0.1607 |
R(45-48) |
1.345 |
A(22-17-23) |
108.3 |
|
C47 |
0.58055 |
R(45-49) |
1.345 |
A(22-17-24) |
109.1 |
|
F48 |
-0.06278 |
R(46-47) |
1.563 |
A(23-17-24) |
108.9 |
|
F49 |
-0.042783 |
R(46-50) |
1.349 |
A(18-45-46) |
106.2 |
|
F50 |
-0.047666 |
R(46-51) |
1.348 |
A(18-45-48) |
112.0 |
|
F51 |
-0.034781 |
R(47-52) |
1.336 |
A(18-45-49) |
110.7 |
|
F52 |
-0.087055 |
R(47-53) |
1.337 |
A(26-25-28) |
108.2 |
|
F53 |
-0.081829 |
R(47-54) |
1.336 |
A(26-25-30) |
109.8 |
|
F54 |
-0.07629 |
- |
- |
A(25-26-27) |
114.5 |
|
- |
- |
- |
- |
A(25-26-29) |
107.5 |
|
- |
- |
- |
- |
A(25-26-32) |
102.7 |
|
- |
- |
- |
- |
A(28-25-30) |
107.6 |
|
- |
- |
- |
- |
A(27-26-29) |
107.1 |
|
- |
- |
- |
- |
A(27-26-32) |
113.4 |
|
- |
- |
- |
- |
A(26-27-31) |
111.0 |
|
- |
- |
- |
- |
A(26-27-33) |
109.4 |
|
- |
- |
- |
- |
A(26-27-34) |
110.6 |
|
- |
- |
- |
- |
A(29-26-32) |
111.7 |
|
- |
- |
- |
- |
A(26-32-35) |
126.2 |
|
- |
- |
- |
- |
A(31-27-33) |
108.0 |
|
- |
- |
- |
- |
A(31-27-34) |
108.9 |
|
- |
- |
- |
- |
A(33-27-34) |
108.8 |
|
- |
- |
- |
- |
A(32-35-36) |
105.7 |
|
- |
- |
- |
- |
A(32-35-38) |
111.2 |
|
- |
- |
- |
- |
A(32-35-39) |
112.7 |
|
- |
- |
- |
- |
A(36-35-38) |
109.4 |
|
- |
- |
- |
- |
A(36-35-39) |
109.8 |
|
- |
- |
- |
- |
A(35-36-37) |
115.6 |
|
- |
- |
- |
- |
A(35-36-40) |
108.5 |
|
- |
- |
- |
- |
A(35-36-44) |
108.1 |
|
- |
- |
- |
- |
A(38-35-39) |
107.9 |
|
- |
- |
- |
- |
A(37-36-40) |
107.7 |
|
- |
- |
- |
- |
A(37-36-44) |
107.8 |
|
- |
- |
- |
- |
A(36-37-41) |
111.0 |
|
- |
- |
- |
- |
A(36-37-42) |
108.6 |
|
- |
- |
- |
- |
A(36-37-43) |
110.9 |
|
- |
- |
- |
- |
A(40-36-44) |
109.1 |
|
- |
- |
- |
- |
A(41-37-42) |
108.7 |
|
- |
- |
- |
- |
A(41-37-43) |
108.9 |
|
- |
- |
- |
- |
A(42-37-43) |
108.7 |
|
- |
- |
- |
- |
A(46-45-48) |
110.1 |
|
- |
- |
- |
- |
A(46-45-49) |
110.0 |
|
- |
- |
- |
- |
A(45-46-47) |
115.5 |
|
- |
- |
- |
- |
A(45-46-50) |
108.0 |
|
- |
- |
- |
- |
A(45-46-51) |
108.4 |
|
- |
- |
- |
- |
A(48-45-49) |
107.9 |
|
- |
- |
- |
- |
A(47-46-50) |
107.9 |
|
- |
- |
- |
- |
A(47-46-51) |
107.8 |
|
- |
- |
- |
- |
A(46-47-52) |
108.6 |
|
- |
- |
- |
- |
A(46-47-53) |
110.8 |
|
- |
- |
- |
- |
A(46-47-54) |
110.9 |
|
- |
- |
- |
- |
A(50-46-51) |
109.1 |
|
- |
- |
- |
- |
A(52-47-53) |
108.8 |
|
- |
- |
- |
- |
A(52-47-54) |
108.7 |
|
- |
- |
- |
- |
A(53-47-54) |
109.0 |
Обнаружено, что и в структуре ПЭФ-216-2 все атомы кислорода, ожидаемо, имеют положительный заряд, как и в случае с ПЭФ-216-1, а также часть атомов фтора (F8, F10, F11, F20, F21, F29) положительно заряжены. Процент положительно заряженных атомов фтора от общего числа атомов фтора в структуре около 18 %. При расчёте всех положительно заряженных атомов, таких как углероды, кислороды и фторы, от общего количества атомов молекулы, получается содержание положительно заряженных центров в молекуле около 39 %.
При рассмотрении молекулы ПЭФ-216-2 обнаружено, что, как и в случае с ПЭФ-216-1, положительно заряженные атомы фтора связаны с центральным атомом углеродного скелета молекулы. К этому же атому углерода присоединяется эфирный кислородный мостик и группа CF3, в сторону которой сдвинута электронная плотность.
Наличие указанных положительных и отрицательных центров в структуре ПЭФ-216-1 и ПЭФ-216-2, позволяет предполагать возможность электростатических взаимодействий с малыми молекулами и стабильность удержания во времени ПЭФ-216 газов [20] и небольших органических молекул, позволяя использовать его в качестве газопереносящей среды, устойчивой к примесям и колебаниям внешних условий, а также жидких диэлектриков.
Таблица 4. Значение длин связей, углов расположения атомов относительно друг друга и значения заряда каждого атома молекулы ПЭ-1 углеводородного аналога ПЭФ-216-1
|
ПЭ-1 УВ аналог ПЭФ-216-1 |
|||||
|---|---|---|---|---|---|
|
Тип и номер атома |
Заряд атома, Mulleken |
Обозначение атомов связи |
Значение длины связи, Å |
Обозначение атомов угла |
Значение угла связи, градусы |
|
C1 |
-0.153408 |
R(1-2) |
1.539 |
A(2-1-4) |
106.3 |
|
C2 |
-0.190649 |
R(1-4) |
1.429 |
A(2-1-6) |
107.5 |
|
C3 |
-0.441739 |
R(1-6) |
1.101 |
A(2-1-50) |
112.3 |
|
O4 |
0.013733 |
R(1-50) |
1.528 |
A(1-2-3) |
112.9 |
|
O5 |
0.038501 |
R(2-3) |
1.527 |
A(1-2-5) |
106.0 |
|
H6 |
0.179052 |
R(2-5) |
1.432 |
A(1-2-7) |
107.9 |
|
H7 |
0.161348 |
R(2-7) |
1.100 |
A(4-1-6) |
108.9 |
|
H8 |
0.166522 |
R(3-8) |
1.090 |
A(4-1-50) |
112.1 |
|
H9 |
0.158036 |
R(3-9) |
1.094 |
A(1-4-12) |
115.3 |
|
H10 |
0.115296 |
R(3-10) |
1.093 |
A(6-1-50) |
109.6 |
|
C11 |
-0.202572 |
R(4-12) |
1.419 |
A(1-50-51) |
111.5 |
|
C12 |
-0.252886 |
R(5-20) |
1.419 |
A(1-50-52) |
110.2 |
|
C13 |
-0.364687 |
R(11-12) |
1.528 |
A(1-50-53) |
110.0 |
|
O14 |
-0.03675 |
R(11-13) |
1.527 |
A(3-2-5) |
111.1 |
|
H15 |
0.159003 |
R(11-14) |
1.428 |
A(3-2-7) |
109.7 |
|
H16 |
0.140242 |
R(11-16) |
1.100 |
A(2-3-8) |
110.5 |
|
H17 |
0.132807 |
R(12-15) |
1.100 |
A(2-3-9) |
110.2 |
|
H18 |
0.138064 |
R(12-54) |
1.096 |
A(2-3-10) |
110.8 |
|
H19 |
0.164044 |
R(13-17) |
1.092 |
A(5-2-7) |
109.1 |
|
C20 |
-0.38789 |
R(13-18) |
1.091 |
A(2-5-20) |
114.9 |
|
C21 |
-0.127816 |
R(13-19) |
1.094 |
A(8-3-9) |
108.7 |
|
C22 |
-0.372806 |
R(14-40) |
1.421 |
A(8-3-10) |
108.2 |
|
H23 |
0.176773 |
R(20-21) |
1.528 |
A(9-3-10) |
108.3 |
|
H24 |
0.135478 |
R(20-23) |
1.096 |
A(4-12-11) |
108.6 |
|
H25 |
0.172347 |
R(20-25) |
1.100 |
A(4-12-15) |
110.5 |
|
H26 |
0.160108 |
R(21-22) |
1.527 |
A(4-12-54) |
111.6 |
|
O27 |
-0.035204 |
R(21-24) |
1.100 |
A(5-20-21) |
108.8 |
|
H28 |
0.128973 |
R(21-27) |
1.429 |
A(5-20-23) |
111.6 |
|
H29 |
0.162358 |
R(22-26) |
1.092 |
A(5-20-25) |
110.5 |
|
C30 |
-0.312009 |
R(22-28) |
1.092 |
A(12-11-13) |
112.7 |
|
C31 |
-0.111039 |
R(22-29) |
1.094 |
A(12-11-14) |
104.9 |
|
C32 |
-0.57889 |
R(27-30) |
1.421 |
A(12-11-16) |
107.8 |
|
H33 |
0.112629 |
R(30-31) |
1.522 |
A(11-12-15) |
109.6 |
|
H34 |
0.129289 |
R(30-33) |
1.099 |
A(11-12-54) |
108.4 |
|
H35 |
0.14641 |
R(30-34) |
1.102 |
A(13-11-14) |
112.4 |
|
H36 |
0.135474 |
R(31-32) |
1.531 |
A(13-11-16) |
109.6 |
|
H37 |
0.150932 |
R(31-35) |
1.095 |
A(11-13-17) |
111.7 |
|
H38 |
0.132753 |
R(31-39) |
1.095 |
A(11-13-18) |
109.9 |
|
H39 |
0.138488 |
R(32-36) |
1.095 |
A(11-13-19) |
110.1 |
|
C40 |
-0.321191 |
R(32-37) |
1.093 |
A(14-11-16) |
109.2 |
|
C41 |
-0.10461 |
R(32-38) |
1.095 |
A(11-14-40) |
115.4 |
|
C42 |
-0.581808 |
R(40-41) |
1.522 |
A(15-12-54) |
108.1 |
|
H43 |
0.128801 |
R(40-43) |
1.102 |
A(17-13-18) |
108.0 |
|
H44 |
0.113384 |
R(40-44) |
1.099 |
A(17-13-19) |
108.4 |
|
H45 |
0.139842 |
R(41-42) |
1.531 |
A(18-13-19) |
108.7 |
|
H46 |
0.145346 |
R(41-45) |
1.095 |
A(14-40-41) |
108.8 |
|
H47 |
0.151184 |
R(41-46) |
1.095 |
A(14-40-43) |
109.7 |
|
H48 |
0.133088 |
R(42-47) |
1.093 |
A(14-40-44) |
110.8 |
|
H49 |
0.135519 |
R(42-48) |
1.095 |
A(21-20-23) |
108.4 |
|
C50 |
-0.447427 |
R(42-49) |
1.095 |
A(21-20-25) |
109.5 |
|
H51 |
0.141363 |
R(50-51) |
1.092 |
A(20-21-22) |
112.8 |
|
H52 |
0.163876 |
R(50-52) |
1.094 |
A(20-21-24) |
108.0 |
|
H53 |
0.142867 |
R(50-53) |
1.091 |
A(20-21-27) |
104.8 |
|
H54 |
0.179452 |
- |
- |
A(23-20-25) |
108.0 |
|
- |
- |
- |
- |
A(22-21-24) |
109.5 |
|
- |
- |
- |
- |
A(22-21-27) |
112.4 |
|
- |
- |
- |
- |
A(21-22-26) |
109.9 |
|
- |
- |
- |
- |
A(21-22-28) |
111.5 |
|
- |
- |
- |
- |
A(21-22-29) |
110.2 |
|
- |
- |
- |
- |
A(24-21-27) |
109.2 |
|
- |
- |
- |
- |
A(21-27-30) |
115.4 |
|
- |
- |
- |
- |
A(26-22-28) |
108.0 |
|
- |
- |
- |
- |
A(26-22-29) |
108.8 |
|
- |
- |
- |
- |
A(28-22-29) |
108.4 |
|
- |
- |
- |
- |
A(27-30-31) |
108.7 |
|
- |
- |
- |
- |
A(27-30-33) |
110.8 |
|
- |
- |
- |
- |
A(27-30-34) |
109.7 |
|
- |
- |
- |
- |
A(31-30-33) |
109.9 |
|
- |
- |
- |
- |
A(31-30-34) |
110.4 |
|
- |
- |
- |
- |
A(30-31-32) |
112.4 |
|
- |
- |
- |
- |
A(30-31-35) |
108.5 |
|
- |
- |
- |
- |
A(30-31-39) |
108.6 |
|
- |
- |
- |
- |
A(33-30-34) |
107.4 |
|
- |
- |
- |
- |
A(32-31-35) |
110.2 |
|
- |
- |
- |
- |
A(32-31-39) |
110.3 |
|
- |
- |
- |
- |
A(31-32-36) |
111.5 |
|
- |
- |
- |
- |
A(31-32-37) |
111.0 |
|
- |
- |
- |
- |
A(31-32-38) |
111.5 |
|
- |
- |
- |
- |
A(35-31-39) |
106.7 |
|
- |
- |
- |
- |
A(36-32-37) |
107.5 |
|
- |
- |
- |
- |
A(36-32-38) |
107.7 |
|
- |
- |
- |
- |
A(37-32-38) |
107.5 |
|
- |
- |
- |
- |
A(41-40-43) |
110.3 |
|
- |
- |
- |
- |
A(41-40-44) |
109.9 |
|
- |
- |
- |
- |
A(40-41-42) |
112.4 |
|
- |
- |
- |
- |
A(40-41-45) |
108.6 |
|
- |
- |
- |
- |
A(40-41-46) |
108.5 |
|
- |
- |
- |
- |
A(43-40-44) |
107.4 |
|
- |
- |
- |
- |
A(42-41-45) |
110.3 |
|
- |
- |
- |
- |
A(42-41-46) |
110.2 |
|
- |
- |
- |
- |
A(41-42-47) |
111.0 |
|
- |
- |
- |
- |
A(41-42-48) |
111.5 |
|
- |
- |
- |
- |
A(41-42-49) |
111.4 |
|
- |
- |
- |
- |
A(45-41-46) |
106.7 |
|
- |
- |
- |
- |
A(47-42-48) |
107.5 |
|
- |
- |
- |
- |
A(47-42-49) |
107.6 |
|
- |
- |
- |
- |
A(48-42-49) |
107.7 |
|
- |
- |
- |
- |
A(51-50-52) |
108.3 |
|
- |
- |
- |
- |
A(51-50-53) |
108.0 |
|
- |
- |
- |
- |
A(52-50-53) |
108.8 |
Таблица 5. Значение длин связей, углов расположения атомов относительно друг друга и значения заряда каждого атома молекулы ПЭ-2 углеводородного аналога ПЭФ-216-2
|
ПЭ-2 УВ аналог ПЭФ-216-2 |
|||||
|---|---|---|---|---|---|
|
Тип и номер атома |
Заряд атома, Mulleken |
Обозначение атомов связи |
Значение длины связи, Å |
Обозначение атомов угла |
Значение угла связи, градусы |
|
C1 |
-0.493093 |
R(1-2) |
1.524 |
A(2-1-5) |
108.8 |
|
C2 |
-0.061703 |
R(1-5) |
1.424 |
A(2-1-7) |
109.5 |
|
C3 |
-0.127388 |
R(1-7) |
1.100 |
A(2-1-10) |
110.9 |
|
C4 |
-0.6522 |
R(1-10) |
1.099 |
A(1-2-3) |
115.1 |
|
O5 |
0.098723 |
R(2-3) |
1.537 |
A(1-2-8) |
107.9 |
|
O6 |
0.024396 |
R(2-8) |
1.094 |
A(1-2-9) |
108.6 |
|
H7 |
0.137678 |
R(2-9) |
1.096 |
A(5-1-7) |
109.6 |
|
H8 |
0.16629 |
R(3-4) |
1.524 |
A(5-1-10) |
110.8 |
|
H9 |
0.157403 |
R(3-6) |
1.435 |
A(1-5-16) |
115.4 |
|
H10 |
0.124733 |
R(3-11) |
1.097 |
A(7-1-10) |
107.2 |
|
H11 |
0.151271 |
R(4-12) |
1.093 |
A(3-2-8) |
109.1 |
|
H12 |
0.138254 |
R(4-13) |
1.094 |
A(3-2-9) |
108.6 |
|
H13 |
0.160143 |
R(4-14) |
1.092 |
A(2-3-4) |
113.3 |
|
H14 |
0.14899 |
R(5-16) |
1.431 |
A(2-3-6) |
110.2 |
|
C15 |
-0.107713 |
R(6-25) |
1.419 |
A(2-3-11) |
108.8 |
|
C16 |
-0.364537 |
R(15-16) |
1.532 |
A(8-2-9) |
107.1 |
|
C17 |
-0.430553 |
R(15-18) |
1.417 |
A(4-3-6) |
106.3 |
|
O18 |
-0.066372 |
R(15-19) |
1.100 |
A(4-3-11) |
109.4 |
|
H19 |
0.122218 |
R(15-21) |
1.101 |
A(3-4-12) |
111.3 |
|
H20 |
0.151721 |
R(16-17) |
1.521 |
A(3-4-13) |
110.4 |
|
H21 |
0.150215 |
R(16-20) |
1.099 |
A(3-4-14) |
110.1 |
|
H22 |
0.153202 |
R(17-22) |
1.092 |
A(6-3-11) |
108.7 |
|
H23 |
0.141749 |
R(17-23) |
1.092 |
A(3-6-25) |
115.3 |
|
H24 |
0.152055 |
R(17-24) |
1.094 |
A(12-4-13) |
108.5 |
|
C25 |
-0.328332 |
R(18-45) |
1.420 |
A(12-4-14) |
108.2 |
|
C26 |
-0.019417 |
R(25-26) |
1.528 |
A(13-4-14) |
108.2 |
|
C27 |
-0.437254 |
R(25-28) |
1.098 |
A(5-16-15) |
109.6 |
|
H28 |
0.167414 |
R(25-30) |
1.099 |
A(5-16-17) |
107.8 |
|
H29 |
0.145543 |
R(26-27) |
1.527 |
A(5-16-20) |
109.4 |
|
H30 |
0.173251 |
R(26-29) |
1.100 |
A(6-25-26) |
108.5 |
|
H31 |
0.158869 |
R(26-32) |
1.429 |
A(6-25-28) |
110.6 |
|
O32 |
-0.034559 |
R(27-31) |
1.092 |
A(6-25-30) |
111.8 |
|
H33 |
0.126925 |
R(27-33) |
1.093 |
A(16-15-18) |
108.7 |
|
H34 |
0.164999 |
R(27-34) |
1.094 |
A(16-15-19) |
110.1 |
|
C35 |
-0.281761 |
R(32-35) |
1.420 |
A(16-15-21) |
109.4 |
|
C36 |
-0.12604 |
R(35-36) |
1.522 |
A(15-16-17) |
112.4 |
|
C37 |
-0.579369 |
R(35-38) |
1.100 |
A(15-16-20) |
108.1 |
|
H38 |
0.117508 |
R(35-39) |
1.102 |
A(18-15-19) |
110.1 |
|
H39 |
0.125129 |
R(36-37) |
1.531 |
A(18-15-21) |
110.8 |
|
H40 |
0.143585 |
R(36-40) |
1.095 |
A(15-18-45) |
113.6 |
|
H41 |
0.135303 |
R(36-44) |
1.095 |
A(19-15-21) |
107.8 |
|
H42 |
0.15027 |
R(37-41) |
1.095 |
A(17-16-20) |
109.6 |
|
H43 |
0.132739 |
R(37-42) |
1.093 |
A(16-17-22) |
110.1 |
|
H44 |
0.140069 |
R(37-43) |
1.095 |
A(16-17-23) |
110.5 |
|
C45 |
-0.18965 |
R(45-46) |
1.521 |
A(16-17-24) |
110.1 |
|
C46 |
-0.147664 |
R(45-48) |
1.101 |
A(22-17-23) |
109.1 |
|
C47 |
-0.567507 |
R(45-49) |
1.102 |
A(22-17-24) |
108.7 |
|
H48 |
0.1313 |
R(46-47) |
1.531 |
A(23-17-24) |
108.3 |
|
H49 |
0.118716 |
R(46-50) |
1.095 |
A(18-45-46) |
109.1 |
|
H50 |
0.142905 |
R(46-51) |
1.095 |
A(18-45-48) |
109.8 |
|
H51 |
0.142953 |
R(47-52) |
1.093 |
A(18-45-49) |
109.8 |
|
H52 |
0.151806 |
R(47-53) |
1.094 |
A(26-25-28) |
109.0 |
|
H53 |
0.133133 |
R(47-54) |
1.094 |
A(26-25-30) |
109.0 |
|
H54 |
0.133655 |
- |
- |
A(25-26-27) |
112.5 |
|
- |
- |
- |
- |
A(25-26-29) |
108.0 |
|
- |
- |
- |
- |
A(25-26-32) |
104.9 |
|
- |
- |
- |
- |
A(28-25-30) |
107.9 |
|
- |
- |
- |
- |
A(27-26-29) |
109.5 |
|
- |
- |
- |
- |
A(27-26-32) |
112.5 |
|
- |
- |
- |
- |
A(26-27-31) |
109.8 |
|
- |
- |
- |
- |
A(26-27-33) |
111.6 |
|
- |
- |
- |
- |
A(26-27-34) |
110.1 |
|
- |
- |
- |
- |
A(29-26-32) |
109.2 |
|
- |
- |
- |
- |
A(26-32-35) |
115.4 |
|
- |
- |
- |
- |
A(31-27-33) |
108.2 |
|
- |
- |
- |
- |
A(31-27-34) |
108.7 |
|
- |
- |
- |
- |
A(33-27-34) |
108.4 |
|
- |
- |
- |
- |
A(32-35-36) |
108.7 |
|
- |
- |
- |
- |
A(32-35-38) |
110.8 |
|
- |
- |
- |
- |
A(32-35-39) |
109.7 |
|
- |
- |
- |
- |
A(36-35-38) |
109.9 |
|
- |
- |
- |
- |
A(36-35-39) |
110.3 |
|
- |
- |
- |
- |
A(35-36-37) |
112.5 |
|
- |
- |
- |
- |
A(35-36-40) |
108.5 |
|
- |
- |
- |
- |
A(35-36-44) |
108.6 |
|
- |
- |
- |
- |
A(38-35-39) |
107.4 |
|
- |
- |
- |
- |
A(37-36-40) |
110.2 |
|
- |
- |
- |
- |
A(37-36-44) |
110.3 |
|
- |
- |
- |
- |
A(36-37-41) |
111.5 |
|
- |
- |
- |
- |
A(36-37-42) |
111.0 |
|
- |
- |
- |
- |
A(36-37-43) |
111.5 |
|
- |
- |
- |
- |
A(40-36-44) |
106.7 |
|
- |
- |
- |
- |
A(41-37-42) |
107.5 |
|
- |
- |
- |
- |
A(41-37-43) |
107.6 |
|
- |
- |
- |
- |
A(42-37-43) |
107.5 |
|
- |
- |
- |
- |
A(46-45-48) |
110.4 |
|
- |
- |
- |
- |
A(46-45-49) |
110.4 |
|
- |
- |
- |
- |
A(45-46-47) |
112.4 |
|
- |
- |
- |
- |
A(45-46-50) |
108.6 |
|
- |
- |
- |
- |
A(45-46-51) |
108.5 |
|
- |
- |
- |
- |
A(48-45-49) |
107.3 |
|
- |
- |
- |
- |
A(47-46-50) |
110.2 |
|
- |
- |
- |
- |
A(47-46-51) |
110.2 |
|
- |
- |
- |
- |
A(46-47-52) |
110.9 |
|
- |
- |
- |
- |
A(46-47-53) |
111.5 |
|
- |
- |
- |
- |
A(46-47-54) |
111.5 |
|
- |
- |
- |
- |
A(50-46-51) |
106.7 |
|
- |
- |
- |
- |
A(52-47-53) |
107.5 |
|
- |
- |
- |
- |
A(52-47-54) |
107.5 |
|
- |
- |
- |
- |
A(53-47-54) |
107.7 |
Самая простая и повторяющаяся группа атомов в ПЭФ-216-1 – это CF3 с длиной связи С-F равной (1,336 ± 0,003) Å, что согласуется с литературными данными [18] и в пределах точности расчетов может считаться одинаковой. Энергетически связь между углеродом и фтором приблизительно 443 кДж/моль [21], а между водородом и углеродом 414 кДж/моль [21], – довольно близкие значения (около 7 % разницы), особенно в сравнении с отличием в расстоянии между атомами С-F и С-Н. Аналогичная группа CH3 в аналоге ПЭ-1 с длиной связи С-H равной (1,093 ± 0,003) Å, имеет длину связи почти на 20 % меньше. Это наблюдение логично, поскольку атом фтора имеет полностью заполненные электронами атомные оболочки, но более длинная связь предположительно менее прочна. Экспериментальные данные по реакционноспособности перфторированных эфиров ПЭФ-216 противоречат этому заключению – реакции замещения отдельных атомов фтора в молекуле не отмечалось, а разрушение молекулы происходит, как правило, по кислородным эфирным связям.
Рассмотрим другие группы атомов в ПЭФ-216-1 и ПЭ-1, числовые характеристики которых приведены в табл. 2 и табл. 4.
По результатам квантово-химических расчетов установлено, что отличие значений длин связей между кислородом и углеродом, например, длина связи C1−O4 для ПЭФ-216 равна 1.397 Å, а для ПЭ – 1.429 Å, она больше примерно на 2 %. Это свидетельствует о том, что углеводородные полиэфиры более «рыхлые» по этим группам атомов, в то время как более длинные связи между атомами углерода в молекуле приводят к практически одинаковым внешним размерам молекулы. Для процессов образования донорно-акцепторных связей при комплексообразовании с помощью кислорода, данный аспект является важным.
В то же время, если сравнить углы связей между соответствующими атомами С2‑С1‑О4 104.4 °для ПЭФ-216 и 106.3 ° для ПЭ, то отличие в углах составляет 1,8 %, – близкие величины, но уменьшение углов связей вблизи гетероатомов будет затруднять комплексообразование по кислороду в ПЭФ-216 как стерически, так и по причине смещения электронной плотности к атомам фтора молекулы.
В случае углеводородных полиэфиров ПЭ-1 и ПЭ-2 преимущественно отрицательные заряды сконцентрированы на связующих атомах кислорода, дополнительно перетягивая электронную плотность ближайших атомов водорода и углерода. У ПЭФ-216 на атомах кислорода заряд положительный и дополнительной электронной плотности получить от атомов фтора невозможно, именно поэтому с кислородными мостиковыми частями молекулы более нестабильны и ПЭФ-216 более склонны к деструкции, чем перфторпарафины без включения в структуру функциональных групп. Квантово-химические расчёты подтверждают, что соотношение длины связи С–О ПЭ и ПЭФ-216, перераспределение электронной плотности в пользу трифторметильных групп в ПЭФ-216 приводит к уменьшению эффективной прочности связи с окса-атомами в структуре перфорированных соединений и снижает химическую и термическую стабильность молекул с такими группами, увеличивая возможности деградации их в естественных условиях. Таким образом, результат квантово-химического расчета программой, которую доказательно использовали для углеводородов, для фторполиэфиров также демонстрирует хорошую сходимость экспериментальных и литературных данных.
Выводы
- По данным ЯМР спектроскопии преобладающей структурой является молекула ПЭФ-216-1.
- Установлена температура стеклования ПЭФ-216 = -108 °C. Температура начала испарения по ДСК и СТА составила 45 °C. Температура разложения в запаянном тигле составила 254 °C.
- Расчётные значения энергий ПЭФ-216-1 и ПЭФ-216-2 практически идентичны между собой, как и расчётные значения ПЭ практически совпадают, тогда как отличия в энергии молекул между ПЭФ-216 и ПЭ в несколько раз, что подтверждается значительно большей химической стабильностью молекул ПЭФ на опыте.
- Расчётные дипольные моменты ПЭФ и ПЭ различаются сильнее, чем можно было бы ожидать.
- Обсуждение величин зарядов на конкретных атомах может служить основой предсказания взаимодействия с крупными органическими молекулами и их функциональными группами, а значит о растворяющей способности ПЭФ-216 и возможности координации его молекул.
- Сравнение данных квантово-химических расчетов перфторированных и углеводородных эфиров доказало корректность этого вида расчета свойств фторированных молекул: сравнение длин связей и углов в структурах молекул соответствует литературным данным для подобных соединений.
Предлагаемый метод квантово-химических расчётов показал высокую сходимость с литературными данными по длинам и углам связей, а также по распределению зарядов атомов молекулы, что говорит о целесообразности использования и надежности этого метода квантовых расчетов для фторорганических молекул.
Исследования выполнены при финансовой поддержке Пермского научно-образовательного центра «Рациональное недропользование», 2024 г.
Список литературы
- Барабанов В.Г., Максимов Б.Н. Работы РНЦ «Прикладная химия» в области химии и технологии промышленных фторсодержащих соединений. Химическая промышленность. 2019. Т. 96. № 6. С. 275–283.
- Пеганова Н.В., Маталин В.А., Людикайнен А.А., Пузанова Н.В., Михайлова Т.В., Лесневская Н.Б., Каурова Г.И., Быков В.И., Петрова И.В., Лебедева В.И., Волков В.В., Терещенко Г.Ф. Электрохимический синтез перфторполиэфиров методом Кольбе.Журнал прикладной химии. 2009. Т. 82. № 12. С. 1976–1984.
- Литвиненко Е.В., Маталин В.А., Пеганова Н.В., Людикайнен А.А. Получение перфторполиэфира с использованием электрохимического инициирования полимеризации.В книге: Инновационные направления развития науки о полимерных волокнистых и композиционных материалах. тезисы докладов Международной научной конференции. Санкт-Петербург, 2020. С. 84–85.
- Лесневская Н.Б., Литвиненко Е.В., Людикайнен А.А., Маталин В.А., Михайлова Т.В., Пеганова Н.В. Сравнение химического инициирования полимеризации и электродимеризации в синтезе перфтор-5,8,11,12,15,18-гексаметил-4,7,10,13,16,19-гексаоксадекозана.Химическая промышленность. 2019. Т. 96. № 6. С. 306–312.
- Поспелова Н.Б., Мокрушин И.Г. Особенности ЯМР-анализа перфторированных соединений.Вестник Пермского университета. Серия: Химия. 2016. № 3 (23). С. 85–91.
- http://engineering.technolog.edu.ru/pages/equipment_desc.php?itercount=%201, Дата обращения 05.10.2023.
- Краткий справочник физико-химических величин. / под ред. А. А. Равделя и А. М. Пономарёвой. Изд. 8-е. – Ленинград: Химия, 1983. – 496 с.
- Eskandari K., Lesani M. Does fluorine participate in halogen bonding? //Chemistry–A European Journal. – 2015. –Т. 21. – №. 12. –С. 4739-4746.
- Dovesi, R., et al., CRYSTAL14: A Program for the Ab Initio Investigation of Crystalline Solids. International Journal of Quantum Chemistry, 2014. 114(19): p. 1287–1317.
- http://www.chetah.usouthal.edu/Chetah.htm, Дата обращения 27.12.2023.
- Сашина, Е. С. Особенности молекулярной структуры солей пиридиния и их растворяющая способность по отношению к целлюлозе / Е. С. Сашина, Д. А. Каширский, Е. В. Мартынова // Журнал общей химии. – 2012 – Т. 82, вып. 4 – С. 643–649.
- Филимонов Д. А., Поройков В. В.PASS: Прогноз спектра биологической активности органических соединений. Рос. хим. ж., 2006, Т.L, № 2.
- AlexA.Granovsky,Fireflyversion 8.0.0, Режим доступа http://classic.chem.msu.su/gran/firefly/index.html, Дата обращения 20.12.2023
- M. W. Schmidt, K. K. Baldridge, J. A. Boatz, S. T. Elbert, M. S. Gordon, J. H. Jensen, S. Koseki, N. Matsunaga, K. A. Nguyen, S.Su, T. L. Windus, M.Dupuis, J.A.Montgomery J. Comput. Chem. 14,P.1347-1363 (1993).
- Каширский, Д. А. Влияние строения ионных жидкостей на основе 1-алкил-3-метилпиридиния на их растворяющую способность по отношению к целлюлозе: специальность 02.00.04 «Физическая химия»: диссертация на соискание ученой степени кандидата химических наук / Каширский Дмитрий Александрович. – Санкт-Петербург, 2016. – 155c.
- Степанов, В.Н. Применение неэмпирических методов квантовой химии для определения внутримолекулярных эффектов взаимодействия заместителей/ В.Н. Степанов, И.А. Нестеров // Известия Самарского научного центра Российской академии наук. –2006 – Т. 8, вып. №3 – С. 645–51.
- Бацанов С.С. Структурная химия. Факты и зависимости. М. Диалог-МГУ 2000г. 292 с.: ил. Твердый переплет, Обычный формат. (ISBN: 5-89209-597-5 / 5892095975).
- Вишневский Ю. В., Шишков И. Ф., Христенко Л.В., Рыков А. Н., Вилков Л. В., Оберхаммер Х. Молекулярная структура о- и м-фтор (три-фторметокси)бензолов по данным газовой электронографии и квантовой химии. Сравнение структур трифторметоксибензола и его фторпроизводных.Журнал физической химии. 2005. Т. 79. № 10. С. 1735–1745.
- Что такое поливинилиденфторид (PVDF, ПВДФ, фторопласт). ПластИнфо. 12 апреля 2018. Интернет ресурс. Доступ по ссылке https://plastinfo.ru/information/articles/645/. Дата обращения 27.10.2023.
- Георгиефф М. Лекарственный препарат, содержащий липофильный инертный газ. Патент RU2204397 C2. 20.07.2001. 14 с.
- Саймонс Дж. «Фтор и его соединения» в 2х томах. 1953, Изд.: ИЛ, МоскваISBN: 978-5-458-45030-0. Энциклопедический формат, с илл. – 510 с.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2024, 152, 1-2


