Поступило в редакцию: Май 2023
УДК 547.472+547.539.11+547.269.1+547.29.053+547.279.1
Fluorine Notes, 2023, 148, 3-4
СИНТЕЗ ТИОЛОВЫХ ЭФИРОВ ФТОРСОДЕРЖАЩИХ 2-МЕТОКСИПРОПАНОВОЙ И БЕНЗОЙНОЙ КИСЛОТ
Т. П. Васильева*, Д. В. Воробьева
Институт элементоорганических соединений им. А.Н. Несмеянова РАН, Российская Федерация, 119334 Москва, ул. Вавилова, 28, стр. 1
Факс: (499) 135 5085. E-mail: d-20@mail.ru
Аннотация: Изучены реакции хлорангидридов 2,3,3,3-тетрафтор-2-метоксипропановой и 2-, а также 4-фторбензойной кислот с различными тиолами в инертных растворителях. Показано, что лучшие выходы целевых тиоловых эфиров достигаются в присутствии триэтиламина в качестве основания с использованием избытка тиола.
Ключевые слова: тиолы, N-(2-меркаптоэтил)ацетамид, 2,3,3,3-тетрафтор-2-метоксипропаноилхлорид, 2-фтор- и 4-фторбензоилхлорид, S-циклогексил- и S-(2-ацетамидоэтил)-2,3,3,3 - тетрафтор-2-метоксипропантиоаты, 2- и 4-фторзамещенные S-алкил- и S-(2-ацетамидоэтил)бензотиоаты.
В предыдущих работах нами был разработан метод получения фторсодержащих 2-метоксипропанамидов [1] и фторзамещенных бензамидов [2]. Целью настоящей работы явился синтез других производных фторсодержащих карбоновых кислот – тиоловых эфиров. Органические производные серы, особенно тиоловые эфиры, играют важную роль в различных биологических процессах, а также очень востребованы для получения биологически активных и медицинских соединений [3]. Некоторые S-содержащие производные 2-метилпропановой кислоты применяют для лечения гипертонии, например препарат каптоприл (капотен) [4].
Для синтеза целевых соединений в качестве фторсодержащих кислот были выбраны 2-метокситетрафторпропановая кислота, а также 2- и 4-фторбензойные кислоты. Получение тиоловых эфиров этих кислот проводили с помощью циклогексилмеркаптана (C6H11SH), N-ацетилцистеамина (NAC) и н-амилмеркаптана. Из всех тиоловых эфиров наибольший интерес представляют NAC-производные карбоновых кислот, так как они являются эффективными предшественниками в синтезе аналогов неприродных поликетидов. Известно, что поликетиды широко применяются в качестве антибиотиков, противораковых средств, лекарств для снижения уровня холестерина и т.д. [5, 6]. О получении тиоловых эфиров фторбензойной кислоты известно немного. Так, описан синтез S-циклогексил-4-фторбензотиоата с низким выходом (18%) взаимодействием 4-фторбензоилхлорида с C6H11SH в присутствии 1,4-диазабицикло[2.2.0]октана [7]. Позже этот тиоэфир удалось получить с выходом 62% реакцией 4-фторбензальдегида с C6H11SH в присутствии диизопропилазодикарбоксилата и Cs2CO3 в среде ДМФА [8]. В то же время о синтезе тиоэфиров фторсодержащих 2-метоксипропановых кислот в литературе нет сведений.
Нефторированные аналоги NAC-тиоэфиров – S-(2-ацетиламиноэтил)-2-гидрокси- или 2-метоксиалкантиоаты ранее получали взаимодействием соответствующих кислот с NAC в присутствии карбодиимидов. Эти тиоэфиры использовали для получения противоопухолевых средств (аналогов криптофицина) [9-11]. В последние годы много работ посвящено синтезу NAС-тиоэфира бензойной кислоты. Так, описано его получение реакцией PhCOCl и NAC в присутствии Et3N [12,13] или i-Pr2NEt (DIPEA) [14]. Для синтеза тиоэфира из бензойной кислоты и NAC использовали разнообразные реагенты: азид Ph2P(O)N3 и Et3N [15], дициклогексилкарбодиимид (DCC) и N-гидроксисукцинимид [16], пентафторпиридин и DIPEA [17], 4-диметиламинопиридин (DMAP) и DCC [18], хлоргидрат 1-этил-3(3-диметиламинопропил)карбодиимида (EDCI), Et3N и 1-гидроксибензотриазол [19,20], а также DMAP и EDCI [5]. На основе NAC-бензотиоата были получены аналоги «симвастатина» (гиполипидемическое средство) [12], антибиотиков («антимицин» [15], «миксопиронин» [18], «пактамицин» [20]) и поликетидов [5,14,16,19].
Предложено несколько способов получения и для другого тиоэфира – S-циклогексилбензотиоата. Описан его синтез из бензоилхлорида и C6H11SH в присутствии катализаторов: (CF3)2CHOH [21] или ZnO [22]. Тиоэтерификацию бензойной кислоты этим меркаптаном проводили в присутствии CF3COOH [23], ангидрида (MeSO2)2O [24] или смеси состава 4,4’-азопиридин – Ph3P [25]. Окислительная тиоэтерификация бензальдегида тиолом происходила в присутствии феназина, органического основания и NHC-катализатора [26,27] или при действии дибромизоциануровой кислоты [28]. Кросс-сочетание бензальдегида с циклогексилдисульфидом в присутствии ди-трет-бутилпероксида дает тиоэфир с меньшим выходом (44%) [29]. В реакции тиокарбонилирования йодбензола в присутствии гексакарбонилов M(CO)6 (M = Cr, Mo) и каталитических количеств галогенида никеля выход тиоэфира с тиолом также выше в 2 раза [30], чем при использовании дисульфида и цинка [31].
S-Пентилбензотиоат ранее получали ацилированием н-пентантиола бензоилхлоридом (в присутствии ZnO) [22] или бензоилбромидом на поверхности силикагеля [32]. Хорошие выходы этого тиоэфира также дает конденсация бензойной кислоты с тиолом под действием 4,4’-азопиридина и Ph3P [25] или системы реагентов Ph2PCl/I2 и имидазол [33]. Описан синтез тиоэфира реакцией бензальдегида с тиолом, используя окислитель (феназин) и каталитические количества основания (DBU) и йодида поли(3,4-диметил-5-винилтиазол-3-иния) [26]. Тиокарбонилирование йодбензола тиолом с образованием тиоэфира гладко происходит при действии гексакарбонила хрома в присутствии катализатора (NiCl2) [30]. Следует отметить, что описанные выше методы получения тиоловых эфиров чаще всего являются многокомпонентными реакциями, поэтому во всех случаях для выделения продуктов требовалась колоночная хроматография, что усложняет процесс.
Известны многочисленные примеры повышенной активности фторсодержащих лекарств по сравнению с гидрированными аналогами [34,35], поэтому синтез новых фторзамещенных ацил-тиоэфиров является актуальной задачей. Для получения тиоловых эфиров фторированной 2-метоксипропановой кислоты в качестве исходного соединения был выбран 2,3,3,3-тетрафтор-2-метоксипропаноилхлорид 1, полученный омылением легкодоступного метилового эфира и последующей реакции кислоты с фталоилдихлоридом [1]. Реакции хлорангидрида 1 с тиолами (C6H11SH или NAC) в присутствии триэтиламина в инертном растворителе давали соответствующие тиоэфиры (2, 3) с выходами 59 и 60% (после очистки перегонкой в вакууме) (схема 1).
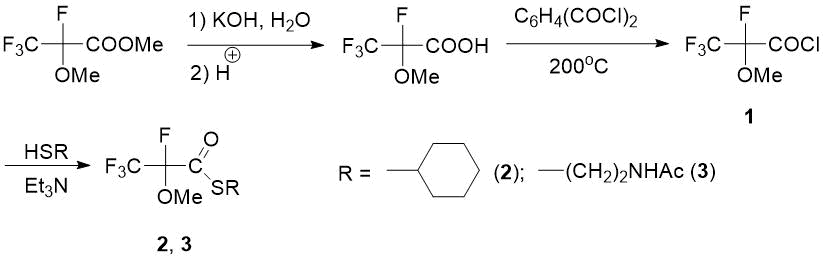
Схема 1. Синтез тиоловых эфиров 2-метокситетрафторпропановой кислоты 2, 3.
Следует отметить, что если для синтеза тиоэфира 3 необходимо эквимолярное количество NAC, то в случае легко окисляемого C6H11SH потребовался его избыток (1,7 экв.)
Тиоловые эфиры фторированных бензойных кислот были получены нами с хорошими выходами аналогично взаимодействием фторзамещенных бензоилхлоридов с тиолами (C6H11SH, н-амилмеркаптаном и NAC) в среде бензола (схема 2). Реакции проводили в присутствии триэтиламина; если вместо Et3N использовали пиридин, то выходы и чистота целевых продуктов снижались.
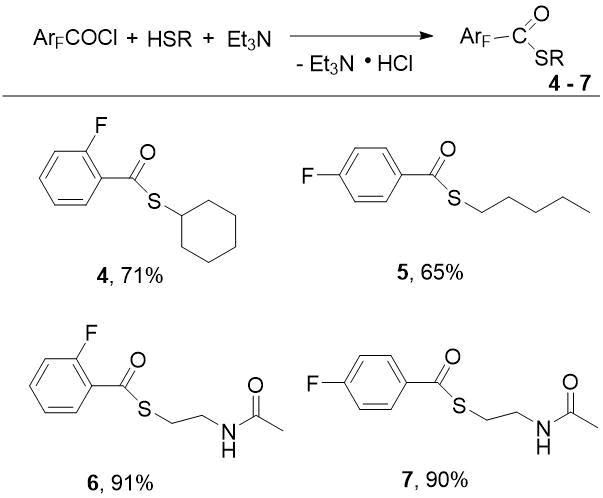
Схема 2. Синтез тиоловых эфиров фторзамещенных бензойных кислот 4-7.
При этом лучшие выходы целевых бензотиоатов 4-7 достигаются при молярном соотношении ArFCOCl/HSR, равном 1/1,4-1,7 для R = циклогексил или н-пентил, тогда как в случае R = -(CH2)2NHAc это соотношение составляло 1/1,2.
Синтезированные S-алкиловые эфиры 2-5 – светло-желтые или
бесцветные масла, легко очищаемые перегонкой в вакууме; NAC-бензотиоаты 6 и 7 – твердые кристаллические вещества, состав и строение которых доказаны данными элементного анализа
и спектроскопии ЯМР 1H и 19F. В спектрах 19F ЯМР алкантиоатов 2 и 3 сигнал CF-группы проявляется в области -133,35÷-134,66 м.д., а сигнал CF3-группы
– при -79,38÷
-80,73 м.д. В спектрах 19F ЯМР 2-фторбензотиоатов 4 и 6 сигнал фтора наблюдается в области -110,33÷-111,26 м.д., а для 4-фторзамещенных
соединений 5 и 7 характерным является синглет при -106,24÷-106,90
м.д.
Таким образом, в данной работе на основе реакции тиолирования ацилхлоридов меркаптанами в присутствии Et3N получены различные тиоловые эфиры F-содержащих карбоновых кислот с хорошими выходами (59-91%). Разработанные нами синтезы являются препаративными, легко могут быть масштабированы и не требуют применения хроматографических методов очистки. Это делает полученные новые соединения доступными в количествах, достаточных для синтеза биологически активных веществ. Известно, что тиоэфиры активно используются для получения пептидов и фармацевтических средств [3, 8, 31, 36].
Экспериментальная часть
Cпектры ЯМР регистрировали на приборах «Bruker Avance-200», «Bruker Avance-300» и «Bruker Avance-400» с рабочими частотами 200 МГц, 300 МГц и 400 МГц (внутренний стандарт SiMe4) для 1Н ЯМР и 188 МГц, 282 МГц и 376 МГц для 19F ЯМР (CFCl3) соответственно. Элементный анализ выполнен в лаборатории микроанализа ИНЭОС РАН. Контроль протекания реакций методом ТСХ осуществляли на пластинах фирмы «Merck» (силикагель 60 F254, 0.25 мм). Значения RF полученных соединений определены в системах ацетон-СCl4 = 1:3; 3:1 или петролейный эфир –этилацетат = 3:1. Исходный 2,3,3,3-тетрафтор-2-метоксипропаноил хлорид 1 получали из соответствующей кислоты и фталоил дихлорида [1]. 2-Фтор- и 4-фторбензоилхлориды являются коммерчески доступными реагентами. Все используемые растворители очищали по стандартным методикам.
S-Циклогексил-2,3,3,3-тетрафтор-2-метоксипропантиоат (2).
К раствору 2,0 г (10,0 ммоль) хлорангидрида 1 в 25 мл гексана прибавляли раствор Et3N (1,14 г, 11,0 ммоль) и C6H11SH (1,94 г, 16,7 ммоль) в гексане (20 мл) порциями, до появления положительной реакции на SH-группу. На следующий день выпавший осадок хлоргидрата отфильтровывали, маточный раствор упаривали в вакууме, остаток перегоняли. Получали 1,69 г соединения 2 (выход 60%) в виде светло-желтого масла с т.кип. 96-98°С при 10 мм рт.ст., nD = 1,4340 (20°С), RF = 0,73 (в системе петролейный эфир – этилацетат = 3:1).
Спектр 1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 1,24-1,37 (м, 1Н, СН2); 1,43-1,55 (м, 4Н, 2 СН2); 1,63-1,66 (м, 1Н, СН2); 1,74-1,78 (м, 2Н, СН2); 1,97-2,00 (м, 2Н, СН2); 3,60 (с, 3Н, ОСН3); 3,64‑3,69 (м, 1Н, СН).
Спектр 19F ЯМР (376 МГц, CDCl3, δ, м.д.): -80,73 (с, 3F, CF3); -134,66 (с, 1F, СF).
Найдено (%): С, 43,63; Н, 4,91; S, 11,42. C10H14F4O2S. Вычислено (%): С, 43,80; Н, 5,11; S, 11,68.
S-(2-Ацетамидоэтил)-2,3,3,3-тетрафтор-2-метоксипропантиоат (3).
Синтез проводили аналогично получению 2, но используя эквимолярные количества реагентов 1, Et3N и NAC в среде бензола. Получали продукт 3 (выход 59%) в виде светло-желтого масла с т.кип. 150-152°С при 0,2 мм рт.ст.
Спектр 1Н ЯМР (200 МГц, CDCl3, δ, м.д.): 2,00 (с, 3Н, СН3); 3,12-3,27 (м, 2Н, СН2S); 3,38‑3,55 (м, 2Н, СН2N); 3,60 (с, 3Н, ОСН3); 6,13 (уш. с, 1Н, NН).
Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -79,38 (с, 3F, CF3); -133,35 (с, 1F, СF).
Найдено (%): С, 34,86; Н, 4,12; N, 5,29. C8H11F4NO3S. Вычислено (%): С, 34,66; Н, 3,97; N, 5,05.
S-Циклогексил-2-фторбензотиоат (4).
К раствору 0,95 г (6,0 ммоль) 2-фторбензоилхлорида в 10 мл бензола прибавляли раствор Et3N (0,61 г, 6,0 ммоль) и C6H11SH (1,18 г, 10,0 ммоль) в бензоле (13 мл) порциями, до появления положительной реакции на SH-группу. На следующий день выпавший осадок хлоргидрата отфильтровывали, маточный раствор дважды промывали холодной водой и сушили над MgSO4. После удаления MgSO4 фильтрат упаривали в вакууме, остаток перегоняли. Получали 1,01 г продукта 4 (выход 71%) в виде бесцветного масла с т.кип. 96-98°С при 0,05 мм рт.ст., nD = 1,5592 (16°С), RF = 0,68 (в системе петролейный эфир – этилацетат = 3:1).
Спектр 1Н ЯМР (300 МГц, CDCl3, δ, м.д.): 1,27-1,37 (м, 1Н, СН2); 1,42-1,55 (м, 4Н, 2 СН2); 1,59-1,66 (м, 1Н, СН2); 1,73-1,79 (м, 2Н, СН2); 2,03-2,07 (м, 2Н, СН2); 3,72-3,79 (м, 1Н, СН);7,11-7,24 (м, 2Н, Ar); 7,46-7,54 (м, 1Н, Ar); 7,81-7,87 (м, 1Н, Ar).
Спектр 19F ЯМР (282 МГц, CDCl3, δ, м.д.): -111,26 (с, 1F, F-Ar).
Найдено (%): С, 65,34; Н, 6,15; S, 13,32. C13H15FOS. Вычислено (%): С, 65,55; Н, 6,30; S, 13,45.
S-Пентил-4-фторбензотиоат (5).
Синтез проводили аналогично получению 4 из 0,95 г (6,0 ммоль) 4-фторбензоилхлорида, 0,61 г (6,0 ммоль) Et3N и 0,87 г (8,4 ммоль) н-амилмеркаптана. Получали 0,88 г продукта 5 (выход 65%) в виде бесцветного масла с т.кип. 55-57°С при 0,03 мм рт.ст., nD = 1,5334 (16°С).
Спектр 1Н ЯМР (200 МГц, CD3OD, δ, м.д., J/Гц): 0,86 (т, 3Н, СН3, J = 7,7); 1,21-1,67 (м, 6Н, 3 СН2); 2,99 (т, 2Н, SСН2, J = 7,7); 7,15 (т, 2Н, Ar, J = 9,2); 7,85-8,05 (м, 2Н, Ar).
Спектр 19F ЯМР (282 МГц, CD3OD, δ, м.д.): -106,24 (с, 1F, F-Ar).
Найдено (%): С, 63,58; Н, 6,47; S, 13,98. C12H15FOS. Вычислено (%): С, 63,72; Н, 6,64; S, 14,16.
S-(2-Ацетамидоэтил)-2-фторбензотиоат (6).
Синтез проводили аналогично получению 4 из 1,42 г (9,0 ммоль) 2-фторбензоил-хлорида, 1,0 г (9,9 ммоль) Et3N и 1,33 г (11,2 ммоль) NAC в бензоле (25 мл), но без перегонки. Получали 1,97 г продукта 6 (выход 91%) в виде белого кристаллического вещества с т.пл. 71-73°С, RF = 0,68 (раствор в бензоле, в системе ацетон – CCl4 = 3:1).
Спектр 1Н ЯМР (200 МГц, C6D6, δ, м.д.): 1,57 (с, 3Н, СН3); 2,82-3,00 (м, 2Н, СН2S); 3,14-3,37 (м, 2Н, СН2N); 5,69 (с, 1Н, NH); 6,43-6,59 (м, 2Н, Ar); 6,63-6,78 (м, 1Н, Ar); 7,55-7,73 (м, 1Н, Ar).
Спектр 19F ЯМР (282 МГц, C6D6, δ, м.д.): -110,33 (с, 1F, F-Ar).
Найдено (%): С, 54,94; Н, 4,86; N, 5,68. C11H12FNO2S. Вычислено (%): С, 54,77; Н, 4,98; S, 5,81.
S-(2-Ацетамидоэтил)-4-фторбензотиоат (7).
Синтез проводили аналогично получению 6 из 1,31 г (8,3 ммоль) 4-фторбензоил-хлорида, 0,84 г (8,3 ммоль) Et3N и 1,21 г (10,1 ммоль) NAC в бензоле (35 мл). Получали 1,8 г продукта 7 (выход 90%) в виде белого кристаллического вещества с т.пл. 98-100°С, RF = 0,20 (раствор в бензоле, в системе ацетон – CCl4 = 1:3).
Спектр 1Н ЯМР (300 МГц, CD3OD, δ, м.д., J/Гц): 1,95 (с, 3Н, СН3); 3,22 (т, 2Н, СН2S, J = 6,6); 3,44 (т, 2Н, СН2N, J = 6,6); 4,93 (с, 1Н, NH); 7,26 (т, 2Н, Ar, J = 8,7); 8,03-8,07 (м, 2Н, Ar).
Спектр 19F ЯМР (282 МГц, CD3OD, δ, м.д.): -106,90 (с, 1F, F-Ar).
Найдено (%): С, 54,98; Н, 4,83; N, 5,62. C11H12FNO2S. Вычислено (%): С, 54,77; Н, 4,98; S, 5,81.
Благодарности
Работа выполнена в рамках Государственного задания № 075-03-2023-642 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Vasilyeva T. P., Dyachenko V. I., Vorobyeva D. V., Fluorine notes, 2022, 145(6), 5-6.
- Vasilyeva T. P., Dyachenko V. I., Vorobyeva D. V., Fluorine notes, 2022, 143(4), 3-4.
- Feng J., Lu G.-P., Cai C., RSC Advances, 2014, 4(97), 54409.
- Регистр лекарственных средств России РЛС Энциклопедия лекарств, под ред. Вышковского Г. Л., М.: Веданта, 2020, 275, 279.
- Kim M., Kwon S., Dordick J., Org. Lett., 2009, 11, 3806.
- Hunziker D., Wu N., Kenoshita K., Cane D., Khosla C., Tetrahedron Lett., 1999, 40, 635.
- Spratt M., Dorn H., Anal. Chem., 1984, 56(12), 2038.
- Maruani A., Lee M., Watkins G., Akhbar A., Baggs H., Shamsabadi A., Richards D., Chudasama V., RSC Advances, 2016, 6(4), 3372.
- Beck Z., Aldrich C., Magarvey N., Georg G., Sherman D., Biochemistry, 2005, 44(41), 13457.
- Ding Y., Seufert W., Beck Z., Sherman D., J. Am. Chem. Soc., 2008, 130, 5492.
- Taft F., Brünjes M., Knobloch T., Floss H., Kirschning A., J. Am. Chem. Soc., 2009, 131, 3812.
- Xie X., Watanabe K., Wojcicki W., Wang C., Tang Y., Chem. and Biology, 2006, 13(11), 1161.
- Wang M., Zhou H., Wirz M., Tang Y., Boddy C., Biochemistry, 2009, 48(27), 6288.
- Huitt-Roehl C., Hill E., Adams M., Vagstad A., Li J., Townsend C., ACS Chem. Biol., 2015, 10(6), 1443.
- Sandy M., Zhu X., Rui Z., Zhang W., Org. Lett., 2013, 15, 3396.
- Kwon S., Kim H., Ku B., Coulombel L., Kim J.-H., Shawky J., Linhardt R., Dordick J., ChemBioChem., 2010, 11, 573.
- Beardmore L., Cobb S., Brittain W., Org. and Biomol. Chem., 2022, 20, 8059.
- Sahner J., Sucipto H., Wenzel S., Groh M., Hartman R., ChemBioChem., 2015, 16, 946.
- Prasad G., Borketey L., Lin T., Schnarr N., Org. and Biomol. Chem., 2012, 10, 6717.
- Abugrain M., Brumsted C., Osborn A., Philmus B., Mahmud T., ACS Chem. Biol., 2017, 12, 362.
- Singh P., Peddinti R., Tetrahedron Lett., 2017, 58, 1875.
- Feng Y., Yang S., Zhao S., Zhang D., Li X., Liu H., Dong Y., Sun F., Org. Lett., 2020, 22, 6734.
- El-Azab A., Abdel-Aziz A., Phosphorus, Sulfur and Silicon, 2012, 187(9), 1046.
- Singh P., Peddinti R., J. Chem. Sciences, 2021, 133, 20.
- Iranpoor N., Firouzabadi H., Khalili D., Motevalli S., J. Org. Chem., 2008, 73, 4882.
- Chung J., Seo U., Chun S., Chung Y, Chem. Catal. Chem., 2016, 8, 318.
- Uno T., Inokuma T., Takemoto Y., J. Chem. Soc., Chem. Commun., 2012, 48, 1901.
- Kwon Y.-D., La M., Kim H.-K., New J. Chem., 2018, 42, 10833.
- Zeng J.-W., Liu Y.-C., Hsieh P.-A., Huang Y.-T., Yi C.-L., Badsara S., Lee C.-F., Green Chem., 2014, 16, 2644.
- Iranpoor N., Etemady-Davan E., Nematollani A., Firouzi H., New J. Chem., 2015, 39, 6445.
- Xiao Y.-M., Lv W.-W., Yuan J.-W., Yang L.-R., Mao P., Mai W.-P., Chemistry Select, 2022, 7(26), e202200914.
- Basu B., Paul S., Nanda A., Green Chem., 2010, 12, 767.
- Nowrouzi N., Mehranpour A., Rad J., Tetrahedron, 2010, 66, 9596.
- Ricci G., Ruzziconi R., J. Org. Chem., 2005, 70, 611.
- Zhu Y., Han J., Wang J., Shibata N., Sodeoka M., Soloshonok V.A., Coelho J., Toste F., Chem. Rev., 2018, 118, 3887.
- Tao J., Yu W., Luo J., Wang T., Ge W., Zhang Z., Yang B., Xiong F., J. Chem. Res., 2019, 43, 486.
Статья рекомендована к публикации д.х.н. С.М. Игумновым
Fluorine Notes, 2023, 148, 3-4


