Поступило в редакцию: Март 2023
УДК 541.64 :543.544
Fluorine Notes, 2023, 148, 1-2
ТРИФТОРМЕТИЛСОДЕРЖАЩИЕ N-МЕТИЛОЛАКРИЛАМИДЫ И ПОЛИМЕРЫ НА ИХ ОСНОВЕ
О. А. Мельник, А. А. Корлюков, В. И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова РАН, Российская Федерация, 119334, г. Москва, ул. Вавилова, д.28, стр.1
e-mail: omel@ineos.ac.ru
Аннотация: Взаимодействием акриламида 1 с полифторкарбонильными соединениями синтезированы стабильные CF3-содержащие N-гидроксиметилакриламиды формулы 3a-c в качестве мономеров для создания полимерных материалов различного назначения. Изучены их физико-химические свойства. Свободно-радикальной (со)полимеризацией 3a-c в растворе получены гомо- и сополимеры, а также определены их растворимость, молекулярно-массовые характеристики и температуры стеклования.
Ключевые слова: акриламид, полифторкетоны, эфиры трифторпировиноградной кислоты, фторсодержащие N-гидроксиметилакриламиды, свободно-радикальная (со)полимеризация
Фторсодержащие полимеры обладают ценными свойствами, такими как химическая, окислительная и термическая стойкость, низкий показатель преломления, коэффициент рассеивания, диэлектрическая проницаемость и гидрофобность.Для них характерна высокая устойчивость к атмосферным воздействиям и длительный срок эксплуатации. В настоящее время они находят широкое применение в качестве покрытий, мембран топливных элементов, компонентов для литий-ионных аккумуляторов, оптических устройств, составных частей композитов и эластомеров [1-5].
Фторсодержащие амиды акриловой кислоты, а также их гомо- и сополимеры характеризуются рядом свойств, которыми не обладают их нефторированные аналоги. Перспективы использования этих соединений для самосборки различных полимерных архитектур с уникальными свойствами изложены в обзоре [6]. В работах [7, 8] описан N-(2,2,2-трифторэтил)aкриламид, обладающий сильной фотолюминесценцией, смещенной в красную область. Показано, что его использование в качестве сомономера с N,N-диметиламиноэтилметакрилатом приводит к образованию термочувствительных статистических сополимеров, способных переключаться как на О2, так и СО2 [9, 10].
На основе N-(2,2-дифторэтил)aкриламида синтезированы новые биосовместимые термочувствительные сополимеры и наногели, содержащие достаточную концентрацию магнитно-эквивалентных атомов фтора для МРТ 19F[11].
Из нефторированных производных акриламида особо следует отметить N‑гидроксиметилакриламид (N-метилолакриламид) (Рис. 1), который на протяжении многих десятков лет используется в полимерной химии для получения полимеров и сополимеров различного состава и назначения [12, 13].
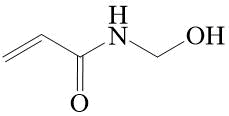
Рисунок 1. N-Метилолакриламид.
Его сополимеры нашли применение в электронике, фармацевтической и текстильной промышленности, строительстве и сельском хозяйстве [14-16]. Мировое производство этого соединения в настоящее время составляет сотни тысяч тонн в год. К сожалению, N‑гидроксиметилакриламид нестабилен и при 20°С начинает разлагаться на акриламид и формальдегид, а также трансформироваться в N,N'-метиленбисакриламид) [17]. Поэтому для полимеризации, а также транспортировки, его, как правило, используют в виде 60%-ного водного раствора.
Следует отметить, что из всех негалогенированных карбонильных соединений лишь формальдегид образует с акриламидом достаточно стабильное для дальнейшего использования метилольное производное (Рис. 1). В то же время констатировалось, что полифторкарбонильные соединения, такие, как полифтор(хлор)ацетон и алкильные эфиры трифторпировиноградной кислоты, реагируют с амидами насыщенных, ароматических и гетероароматических карбоновых кислот, образуя стабильные альфа-полифторалкил- замещенные метилольные производные [18-20]. В настоящее время в литературе описан всего один пример реакции акриламида с гексафторацетоном, приводящей к образованию соединения данного строения [21].
Целью данной работы является изучение взаимодействия акриламида (1) с метиловым (2a) и этиловым (2b) эфирамитрифторпировиноградной кислоты, приводящего к образованию альфа-трифторметилзамещенныхN-метилолакриламидов формулы (3), а такжеисследованиеих физико-химических свойств и особенностей полимеризации.
Установлено, что реакция акриламида 1 с метиловым 2а или этиловым 2b эфиром трифторпировиноградной кислоты осуществляется в безводном бензоле при кратковременном нагревании реагентов с 10%-ным избытком карбонильного соединения на протяжении 15 минут (см. Cхему 1).
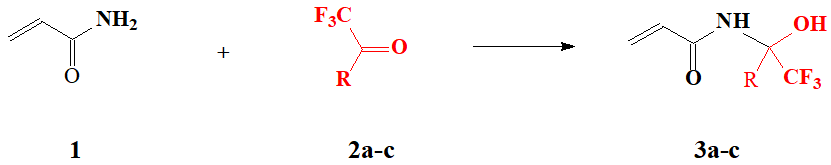
где R = CO2CH3 (2a, 3a), CO2C2H5 (2b, 3b), СF3(2c, 3c)
Схема 1
При этом выход продуктов реакции составляет 91-96%. Полученные соединения 3a и 3b представляют собой белые кристаллические вещества, хорошо растворимые в полярных растворителях, таких как диметилформамид, этилацетат, ацетон и тетрагидрофуран (ТГФ). Следует отметить, что соединения 3a и 3b зарегистрированы в базе данных REGISTRY [онлайн] информационно-поисковой системы STN как RN 355155-90-7 и RN 328270-27-5 соответственно. Однако в ней не приводятся ни метод синтеза, ни экспериментальные ЯМР‑спектры, ни физико-химические свойства этих соединений.
Для сравнения реакционной способности гексафторацетона 2с и эфиров трифторпировиноградной кислоты 2а-b в реакции с 1, а также склонности получаемых в результате этих превращений мономеров вступать в полимеризацию, был синтезирован N‑метилолакриламид 3с. Взаимодействие 1 с 2с также осуществляли в безводном бензоле в запаянной стеклянной ампуле при комнатной температуре на протяжении суток. После вскрытия ампулы и удаления растворителя получали спектрально чистый белый кристаллический продукт 3с с выходом 94%. Помимо сильнополярных растворителей, мономер 3с также растворим при нагревании в толуоле и дихлорэтане.
Строение соединений 3a-c доказано данными элементного анализа, ИК-, масс- и ЯМР-спектроскопии. В отличие от N-гидроксиметилакриламида, cоединения 3a-c на воздухе при комнатной температуре на протяжении года не изменяют своих физико-химических свойств и, по данным 1Н и 19F ЯМР-спектров, остаются спектрально чистыми.
Структура молекулы 3с изучена с помощью рентгенодифракционного исследования (Рис. 2). Акриламидный фрагмент плоский, длины связей C1-N1, C1-O1, N1-C4, C4-C5, C4-O2 и C5-C6 (1.4558(13), 1.3800(11), 1.3557(12), 1.4732(15), 1.2460(12), 1.3165(16) Å) позволяют заключить об отсутствии значимой электронной делокализации между карбонильной и винильной группами. В молекуле 3с наблюдается сильная внутри молекулярная водородная связь. Расстояния O1...O2 и O2...H1 равны 2.6040(11) и 1.84 Å соответственно; угол O1-H1...O2 составляет 149.5°.
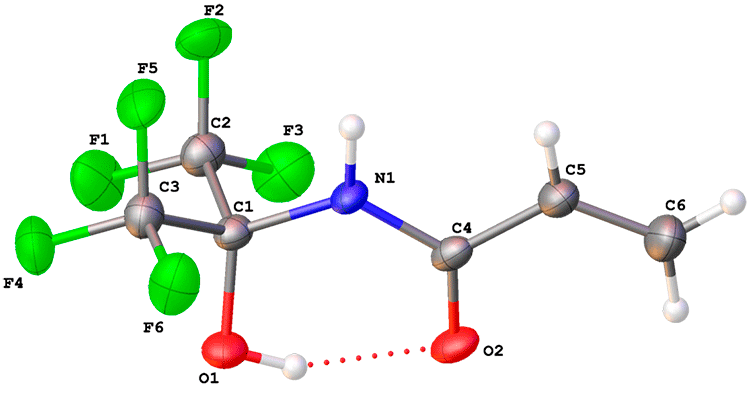
Рисунок 2. Общий вид соединения 3c. Неводородные атомы показаны в виде эллипсоидов анизотропных атомных смещений с вероятностью 50%.
В кристалле молекулы 3с объединены в цепи параллельные ребру с элементарной ячейки за счет слабых водородных связей N-H...O (Рис. 3).
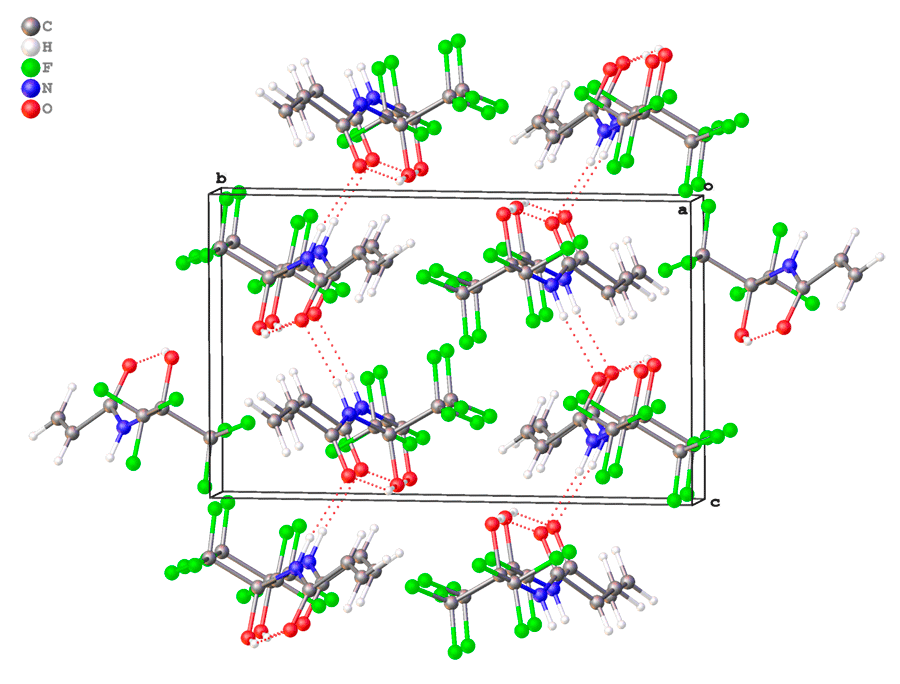
Рисунок 3. Кристаллическая упаковка 3c.
Свободно-радикальную полимеризацию N-гидроксиметилакриламидов 3a-c и сополимеризацию соединения 3с с метилметакрилатом (ММА) проводили в запаянных стеклянных ампулах в атмосфере аргона в присутствии инициатора – динитрилаазобисизомасляной кислоты (ДАК) в толуоле или ТГФ при 60°С в течение 4-8 ч. Полученные (со)полимеры очищали переосаждением гексаном из растворов в органическом растворителе.
Полимеры представляют собой порошки белого цвета, растворимые в спиртах, диметилсульфоксиде, N-метил-2-пирролидоне и нерастворимые в диметилформамиде, хлороформе, бензоле. Сополимеры соединения 3с с ММА растворимы в хлорированных органических растворителях, бензоле, толуоле. Строение (со)полимеров подтверждено методами элементного анализа, ИК- и ЯМР-спектроскопии.
В ИК-спектрах полимеров присутствуют полосы поглощения, соответствующие валентным колебаниям связей С-F (1230-1245,1110-1112, 1056 см-1), N-H (3300-3200 см-1), O‑H (3500-3400 cм-1), C=O амида (1680-1670 см-1), C=O и С-О-С сложноэфирной группы полимеров 3а и 3b (1760-1750, 1261, 1200 см-1). При этом в спектрах отсутствуют полосы поглощения валентных колебаний связи С=С при 1645-1655 см-1 и деформационных колебаний С=С (975-965 см-1), имевшиеся в ИК-спектрах исходных мономеров. В ИК‑спектрах сополимеров содержатся полосы поглощения, характерные для звеньев как ММА, так и соединения 3с: 1725 и 1144 см-1 (С=О и С–О ММА), 1230 и 1110 см-1 (СF3 соединения 3с).
Спектры 1Н ЯМР полимеров в D6-ДМСО в области 1,47-1,75 и 1,95-2,23 м.д. содержат две группы уширенных сигналов, относящихся к CH2- и CH-фрагментам с интегральной интенсивностью 2:1 соответственно. В ПМР спектрах полимеров соединений 3a и 3b также имеются сигналы сложноэфирных групп с характерными химическими сдвигами и интенсивностью. Сигналы протоновфрагментов CH2= соединений 3a‑c в спектрах полимеров отсутствуют. В области 7,52-9,51 м.д. находятся уширенные сигналы, относящиеся к протонам групп O-H и N-H. Спектры 19F ЯМР содержат уширенные сигналы в области -78,20 – -81,75 м.д.
Результаты синтеза (со)полимеров в растворе представлены в Таблице 1.
Таблица 1. Выход, молекулярно-массовые характеристики и температуры стеклования Tс (со)полимеров соединений 3a‑c, ([ДАК] = 0,5 мас.%, [М] = 20 мас.%, время реакции 8 ч, T = 60°C)
|
Мономер |
Растворитель |
Выход (со)полимера, % |
Mw, кДа |
Mw / Mn |
Tс, oC |
|
3а |
ТГФ |
64 |
153 |
2,17 |
114 |
|
3b |
ТГФ |
69 |
149 |
1,75 |
113 |
|
3с |
толуол |
67 |
145 |
1,54 |
112 |
|
3с + MMA* (20:80 мол. %) |
- |
72 |
320 |
1,20 |
100 |
*[ДАК] = 0,2 масс. %, время реакции 4 ч
Выход (со)полимеров соединений 3a-c составляет 64‑72%. Методом гель-проникающей хроматографии (ГПХ) были оценены их молекулярно-массовые характеристики. Молекулярные массы Mw гомополимеров 145‑153 кДа, а Mw сополимера 3с с ММА равна 320 кДа. Значение коэффициента полидисперсности (со)полимеров Mw / Mn лежит в интервале 1,20‑2,17, что характерно для радикальной полимеризации. По данным термомеханического анализа, температура стеклования Tс полимеров соединений 3a‑с практически не зависит от природы заместителя R и составляет 112-114°С. Сополимер 3с и ММА имеет ту же Tс, что и ПММА (100°С).
Ранее было показано [22], что аналогичные 3а-с метилольные производные, полученные реакцией гексафторацетона с ацетамидом или формамидом, легко образуют с ионами щелочноземельных металлов и лантаноидами стабильные кристаллические комплексы.
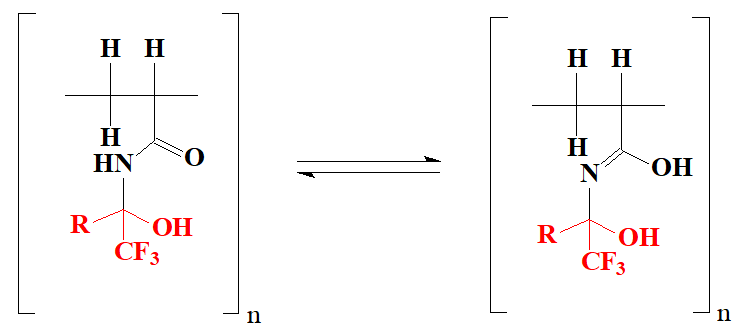
Где R = CO2CH3 (3a), CO2C2H5 (3b), CF3(3c)
Рисунок 4. Лактим-лактамная таутомерия в полимерной матрице.
По-видимому, полученные нами полимеры, являясь по своей природе бидентатными лигандами (см. Рис. 2), также способны обладать этим свойством.
Таким образом, синтезированные (со)полимеры на основе мономеров 3а-с могут служить матрицей для создания целого ряда композиционных, ион- и электропроводящих материалов.
Экспериментальная часть
Использованы промышленно-доступные исходные реагенты - акриламид [CAS 79-06-1], гексафторацетон 98% [CAS 684-16-2], метиловый эфир трифторпировиноградной кислоты 98% [CAS 13089-11-7], этиловый эфир трифторпировиноградной кислоты 98% [CAS 13089-18-0]. ММА (Aldrich, 99%) перегоняли при пониженном давлении.
Спектры ЯМР 1Н и 19F записаны в D6-DMSO (сополимеров с ММА - в CDCl3) на приборе Bruker Avance 300 (300 и 282 МГц соответственно). Химические сдвиги в ЯМР‑спектрах приведены в шкале δ (м.д.) относительно ТМС в качестве внутреннего стандарта (спектры ЯМР 1Н) и CCl3F в качестве внешнего стандарта (спектры ЯМР 19F). Константы спин-спинового взаимодействия приведены в герцах. ИК-спектры сняты на Фурье-спектрометре Bruker Vertex 70 v (разрешение 4 см-1 в режиме нарушенного полного внутреннего отражения) с использованием приставки PIKE Glady ATR c алмазным рабочим элементом. ЖХ‑МС-анализ полученных соединений проведен на высокоэффективном жидкостном хроматографемасс-спектрометре Shimadzu LCMS-2020 с использованием метода ионизации DUIS и ацетонитрила (градиент ВЭЖХ 99,9+%, Chem-Lab) в качестве подвижной фазы и растворителя.
Рентгенодифракционное исследование
Кристаллы 3c моноклинные (пространственная группа P2₁/n), брутто-формула C6H5F6NO2, a = 8.5937(7), b = 12.9117(11), c = 9.1073(8) Å, β = 115.812(3), V = 909.72(14) ų, Z = 4, dcalc= 1.731 г·см-3, F(000) = 472, M = 237.11. Для измерений был использован монокристалл (бесцветная призма 0.21 × 0.24 × 0.38 мм), интенсивности 14254 рефлексов были измерены на дифрактометре Bruker D8 QUEST при 100К, (ϕ и ω-сканирование, микрофокусный рентгеновский источник, λ[MoKα] = 0.71073 Å, μ = 0.205 мм-1, 2θmax = 66.442°). После усреднения эквивалетных отражений и введения поправки на поглощение 3452 независимых отражения (Rint = 0.0343) были использованы для решения и уточнения структуры. Структура была решена с помощью метода двойного пространства и уточнена по F2 в анизотропном приближении для неводородных атомов. Атомы водорода были рассчитаны исходя из геометрических соображений и уточнены с наложением ограничений. Окончательные параметры расходимости: R1 = 0.0382, (2068 отражений с I>σ(I)), wR2 = 0.0909 (по всем отражениям), GOF = 0.981. Структура решена и уточнена с помощью программ ShelXT [23] и ShelXL [24]. Рисунки общего вида молекулы и кристаллической упаковки выполнены с помощью программы OLEX2 [25].
Полная информация о структуре 3с (включая измеренные величины структурных факторов) депонирована в Кембриджскую базу данных (номер депонирования 2266028) и может быть получена по веб-адресу https://www.ccdc.cam.ac.uk/structures.
Молекулярные массы (со)полимеров определены методом ГПХ в N-метил-2-пирролидоне со скоростью потока 1 мл/мин при 25°С на приборе Knauer Smartline, оборудованном колонкой Phenomenex Phenogel (300х7.8 мм, 5 мкм) 10E4А. Калибровка колонки проведена по стандартам полистиролов. Детектор – рефрактометр. Температуры стеклования определены методом термомеханического анализа на приборе ТМА Q400 фирмы TA Instruments (зонд диаметром 2,54 мм, нагрузка 100 г) при скорости нагревания образца 5 град/мин в интервале температур 20–250°С.
Метиловый эфир 2-акрилоиламино-2-гидрокси-3,3,3-трифторпропионовой кислоты (3a)
В стеклянную трехгорлую коническую колбу объемом 50 мл, снабженную магнитной мешалкой с нагревом, термометром, капельной воронкой и обратным холодильником, помещали 0,71 мг (10ммоль) акриламида и 12 мл безводного бензола. Включали нагрев и перемешивание. По достижении раствором акриламида температуры 80°С в него в один прием прибавляли 1,74 г (11 ммоль) метилового эфира трифторпировиноградной кислоты и кипятили реакционную смесь на протяжении 10 минут. Затем нагрев и перемешивание отключали. При самопроизвольном снижении температуры выпадал обильный осадок. Для полноты кристаллизации продукта реакционную массу оставляли на ночь при 20°С. Выпавший осадок отфильтровывали, промывали бензолом и сушили на стеклянном фильтре воздухом до постоянного веса. Получали 2,2 г белого кристаллического вещества 3a. Выход 97%, т. пл. 125-126°С (бензол).
Найдено, %: С 36,94; Η 3,57; F 25,02. С7Н8F3NO4. Вычислено, %: С 37,02; Η 3,55; F 25,09.
Масс-спектр, m/z: 227 [M+].
Спектр ЯМР 1Н (300 МГц, D6-DMSO, δ, м.д., J/Гц): 9,53 (с, 1Н, NH), 7,99 (c, 1H, OH), 6,39 (дд, 1Н, СН, 3JH-H(цис)=12, 3JH-H(транс)=9), 6,17 (дд, 1H, Н2С=, 3JH-H=12, 2JH-H =3), 5,73 (дд, 1H, Н2С=, 3JH-H=9, 2JH-H =3), 3,70 (с, 3 Н, ОСН3).
Спектр ЯМР 19F (282 МГц, D6-DMSO, δ, м.д., J/Гц): -78,83 (с, 3F, CF3).
Этиловый эфир 2-акрилоиламино-2-гидрокси-3,3,3-трифторпропионовой кислоты (3b)
В стеклянную грушевидную колбу, снабженную магнитной мешалкой с нагревом, термометром, капельной воронкой и обратным холодильником, помещали 0,35 г (5 ммоль) акриламида и 6 мл безводного бензола. Включали нагрев и перемешивание. По достижении 80°С в колбу в один прием прибавляли 1,0 г (5,9 ммоль) этилового эфира трифторпировиноградной кислоты. Реакционную смесь кипятили в течение 15 мин, затем нагрев и перемешивание отключали и давали смеси самопроизвольно охладиться до 20°С. При этом наблюдали образование белого осадка. Реакционную массу оставляли на ночь при комнатной температуре, на следующий день выпавший осадок отфильтровывали, промывали бензолом и сушили на стеклянном фильтре до постоянного веса. Получали 1,1 г белого кристаллического вещества 3b. Выход 91%, т. пл. 9697оС (бензол).
Найдено, %: С 39,94; Η 4,29; F 23,43; N 5,82. С8Н10F3NO4. Вычислено, %: С 39,84; Η 4,18; F 23,63; N 5,81.
Масс-спектр, m/z: 241 [M+].
Спектр ЯМР 1Н (300 МГц, D6-DMSO, δ, м.д., J/Гц): 9,50 (с, 1Н, NH), 7,88 (c, 1H, OH), 6,39 (дд, 1Н, СН, 3JH-H(цис) = 15, 3JH-H(транс) = 9), 6,16 (дд, 1H, Н2С=, 3JH-H= 15, 2JH-H = 3), 5,72 (дд, 1H, Н2С=, 3JH-H= 9, 3JH-H = 3), 4,17 (м, 2Н, ОСН2, 3JH-H= 60), 1,17 (т, 3Н, СН3, 3JH-H= 60). Спектр ЯМР 19F (282 МГц, D6-DMSO, δ, м.д.): 78,73 (с, 3F, CF3).
N-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)акриламид (3c)
В стеклянную ампулу на 50 мл помещали 2,13 г (30 ммоль) акриламида и 30 мл безводного бензола, приготовленного азеотропной отгонкой воды и последующей перегонкой. Ампулу охлаждали смесью ацетона и сухого льда до -78°С и конденсировали в нее 7,5 г (45 ммоль) гексафторацетона (т. кип. -28°С). Затем ее запаивали, давали самопроизвольно нагреться до 20°С и выдерживали на протяжении 1 суток в этих условиях. Ампулу снова охлаждали до -78оС, вскрывали, нагревали до комнатной температуры, конденсируя при этом избыток гексафторацетона в ловушку. Реакционную массу переносили из ампулы в коническую колбу и упаривали на роторном испарителе. Остаток в виде белого кристаллического вещества извлекали из колбы на фильтровальную воронку и промывали холодным петролейным эфиром. Получали 6,7 г белого кристаллического спектрально чистого соединения 3c. Выход 94%, т. пл. 48-49°С.
Найдено, %: С 30,17; Η 2,28; F 47,96. С6Н5F6NO2. Вычислено, %: С 30,39; Η 2,13; F 48,08.
Масс-спектр, m/z: 237 [M+].
Спектр ЯМР 1Н (300 МГц, D6-DMSO, δ, м.д., J/Гц): 9,58 (уш.с, 1Н, NH), 9,47 (c, 1H, OH), 6,51 (дд, 1Н, СН, 2JH-H=18, 3JH-H =12), 6,27 (дд, 1H, Н2С=, 2JH-H=18, 2JH-H =3), 5,82 (дд, 1H, Н2С=, 2JH-H=12, 2JH-H =3).
Спектр ЯМР 19F (282 МГц, D6-DMSO, δ, м.д., J/Гц): - 78,20 (с, 6F, 2CF3).
Получение полиметилового эфира 2-акрилоиламино-2-гидрокси-3,3,3-трифторпропионовой кислоты
К раствору 2,30 г соединения 3a в 11 мл ТГФ прибавляли 0,012 г (0,5 масс. %) ДАК в качестве инициатора полимеризации. Приготовленную реакционную массу фильтровали в стеклянную ампулу, которую затем заполняли аргоном, запаивали и помещали в термостат. Температура полимеризации 60°С. Через 8 ч ампулу вынимали, охлаждали и вскрывали. Полученный полимер очищали переосаждением из раствора в ТГФ в гексан, многократно промывали гексаном и сушили в вакууме при 40°С в течение 72 ч. Выход полимера (белый порошок) 1,47 г (64%).
Найдено, %: С 37,24; Η 3,38; F 24,89; N 6,22. Вычислено, %: С 37,02; Η 3,55; F 25,09; N 6,17.
Спектр ЯМР 19F (D6-DMSO, δ, м.д., J/Гц): -78,28 – -79,78 (уш.с, 3F, CF3).
Получение полиэтилового эфира 2-акрилоиламино-2-гидрокси-3,3,3-трифторпропионовой кислоты
Синтезировали аналогично вышеописанному способу из 2,55 г соединения 3b, 12 мл ТГФ и 0,013 г (0,5 масс. %) ДАК. Выход полимера 1,76 г (69%).
Найдено, %: С 40,05; Η 4,03; F 23,31; N 5,96. Вычислено, %: С 39,84; Η 4,18; F 23,63; N 5,81.
Спектр ЯМР 19F (D6-DMSO, δ, м.д., J/Гц): -78,76 – -80,09 (уш.с, 3F, CF3).
Получение поли[(N-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)акриламида]
Синтезировали аналогично вышеописанному способу из 2,79 г соединения 3с, 13 мл толуола и 0,014 г (0,5 масс. %) ДАК. Выход полимера 1,87 г (67%).
Найдено, %: С 30,68; Η 2,06; F 47,73; N 6,08. Вычислено, %: С 30,39; Η 2,13; F 48,08; N 5,90.
Спектр ЯМР 19F (D6-DMSO, δ, м.д., J/Гц): -78,20 – -80,25 (уш.с, 6F, 2CF3).
Получение cополимера метилметакрилата и N-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)акриламида при исходном соотношении мономеров 80:20 мол. %
Аналогично из 1,32 г ММА, 0,92 г соединения 3c и 0,0045 г (0,2 масс. %) ДАК после нагревания при 60°С в течение 4 ч получали прозрачный твердый бесцветный сополимер. Его очищали переосаждением из раствора в ТГФ в гексан, многократно промывали гексаном и сушили в вакууме при 40°С в течение 72 ч. Выход 1,61 г (72%). Соотношение звеньев в сополимере 83:17 мол. % (определено по содержанию фтора).
Найдено, %: С 47,87; Н 6,03; F 14,60; N 1,88. Вычислено, %: С 45,95; Н 5,45; F 16,79; N 2,06.
Спектр ЯМР 19F (CDCI3, δ, м.д., J/Гц): -81,00 – -81,75(уш.с, 6F, 2CF3).
Выводы
Синтезированы фторсодержащие N-гидроксиметилакриламиды, которые могут быть эффективно использованы в качестве мономеров для получения полимерных композиционных и ионогенных материалов различной архитектуры с газоразделительными, электропроводящими и иными функциональными свойствами. Наличие в составе соединений 3a-c помимо двойной связи N-гидроксиметиламидной группы также позволяет рассматривать их применение в качестве сшивателей. Методом свободно-радикальной (со)полимеризации получены (со)полимеры этих соединений и определены их молекулярно-массовые и термические характеристики.
Благодарности
Работа выполнена в рамках Государственного задания №075-03-2023-642 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН. Авторы благодарят М. М. Ильина за определение молекулярно-массовых характеристик полимеров, Е. С. Афанасьева за термомеханический анализ.
Список литературы
- Фторполимеры, под ред. И.Л. Кнунянца, В.А. Пономаренко. М.: Мир, 1975, 448 c.
- G. Hougham, P. E. Cassidy, K. Jones, T. Davidson. Fluoropolymers: Synthesis and Applications. New York: Plenum Publishers, 1999, V. 1-2.
- Фторполимерные материалы, под ред. В. М. Бузника. Изд-во НТЛ, г. Томск, 2017, 600 c.
- B. Améduri, B. Boutevin. Well Architectured Fluoropolymers: Synthesis, Properties and Applications. Amsterdam, Elsevier, 2004, 231-348.
- B. Améduri, The promising future of fluoropolymers. Macromol. Chem. Phys, 2020, 221(8), 1900573.
- M. Guerre, G. Lopez, В. Améduri, М. Semsarilar, V. Ladmiral, Polym. Chemistry, 2021, 12(27), 3852-3877.
- Halpern et al., U.S. Atomic Energy Comm., WADC-TR 54-264, 1954, 74.
- J. Longetal., Chemistry - AnAsianJournal,2021, 16(17), 2426-2430.
- L. Lei, Qi Zhang, S. Shuxian, Z. Shiping, Polym. Chemistry, 2016, 7(34), 5456-5462.
- W. Steglich et al., Chemische Berichte, 1974, 107, 1488-1498.
- K. Kolouchova, O. Sedlacek, D. Jiraket al., Biomacromolecules, 2018, 19(8), 3515-3524.
- H. Feuer, U. E. Lynch, J. Am. Chem. Soc., 1953, 75(20), 5027-5029.
- Патент КНР 112939799А, 2021.
- L. Мa, Y. Zhang, X. Wang et al., J. Applied Electrochemistry, 2021, 51(2), 131-141.
- M. Arslan et al., Polym. Bulletin, 2021, 78(3), 1535-1550.
- F. K. Baysak, N. Isiklan, J. Applied Polym. Sci., 2022, 139(16), 51976.
- Л. Л. Гурьева, А. И. Ткачук, Я. И. Эстринидр., Высокомолекулярные соединения, Серия А, 2008, 50(3), 446-455.
- Патент США 3324178, 1967.
- S. N. Osipov, A. F. Kolomiets, A. V. Fokin, Bulletin of the Academy of Sciences of the USSR, Division of Сhemical Sciences, 1988, 3, 122-126.
- A. Yu. Aksinenko, A. N. Pushin, V. А. Sokolov, Russian Chemical Bulletin, 2002, 51(11), 2136‑2138.
- Патент США 3549705, 1970.
- С. MacDonald, C. J. Willis, Can. J. Chem., 1973, 51, 732-740.
- Sheldrick G. M., Acta Cryst. A 71,2015, 3-8.
- Sheldrick G. M., Acta Cryst. C 71, 2015, 3-8.
- Dolomanov O. V., Bourhis L. J., Gildea R. J, Howard J. A. K., Puschmann H., J. Appl. Cryst., 2009, 42, 339-341.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2023, 148, 1-2


