Поступило в редакцию: Декабрь 2022
УДК 547.472+547.221+547.298.1+547.333+547.333.4
Fluorine Notes, 2022, 145, 5-6
РЕАКЦИИ ПРОИЗВОДНЫХ 2-МЕТОКСИТЕТРАФТОРПРОПАНОВОЙ КИСЛОТЫ С АМИНАМИ
Т. П. Васильева*, В.И. Дяченко, Д. В. Воробьева
Институт элементоорганических соединений им. А.Н. Несмеянова РАН, Российская Федерация, 119334 Москва, ул. Вавилова, 28, стр. 1
Факс: (499) 135 5085. E-mail: d-20@mail.ru
Аннотация: Изучены реакции метилового эфира и хлорангидрида 2‑метокситетрафторпропановой кислоты с гетероциклическими аминами и 2‑фенилэтиламином. Показано, что лучшие выходы продуктов аминолиза достигаются при использовании 2,3,3,3-тетрафтор-2-метоксипропаноилхлорида. Взаимодействие метилового эфира той же кислоты с гетероциклическими аминами осложняется конкурирующей реакцией N-метилирования аминов. В результате образуется смесь целевых амидов и N‑метиламмониевых солей 2-метокситетрафторпропановой кислоты, соотношение которых зависит от структуры используемого амина.
Ключевые слова: амины, метил-2,3,3,3-тетрафтор-2-метоксипропионат, 2,3,3,3-тетрафтор-2-метоксипропаноилхлорид, аминолиз, фторсодержащие 2-метоксипропанамиды, N‑метиламмониевые соединения.
Повышенный интерес к химии фторсодержащих О- или N-гетероциклов в последние годы связан с их высокой физиологической активностью [1]. В то же время известно, что производные α-гидрокси-α-трифторметилкарбоновых кислот также обладают уникальными фармацевтическими свойствами; в работах по синтезу лекарств описано более 2800 соединений, содержащих эту структурную единицу [2]. Поэтому синтез гетероциклических производных α-гидрокси-α-CF3-кислот, объединяющих преимущества обоих классов соединений, является актуальной задачей. В предыдущих работах нами был разработан метод получения производных α-гидрокси-α-CF3-карбоновых кислот, содержащих α-арильный заместитель [3], а также фурановый или 1,2,3-триазольный гетероцикл в α- или β-положении [4]. В продолжение этих исследований в настоящей работе изучена реакционная способность производных 2-метокситетрафторпропановой кислоты по отношению к гетероциклическим аминам и 2-фенилэтиламину. Сообщалось, что арилэтиламиды алифатических кислот обладают радиозащитной активностью; отмечалось также, что введение атомов фтора в противолучевые средства повышает их радиозащитный эффект и терапевтический индекс [5,6].
Известно, что одним из часто используемых методов получения амидов карбоновых кислот является взаимодействие аминов со сложными эфирами путем присоединения амина по двойной С=О связи с последующим элиминированием спирта [7]. Таким путем действием гидроокиси аммония на эфиры 2-алкокситетрафторпропионовой кислоты были получены соответствующие амиды с хорошими выходами [8,9] (Схема 1).
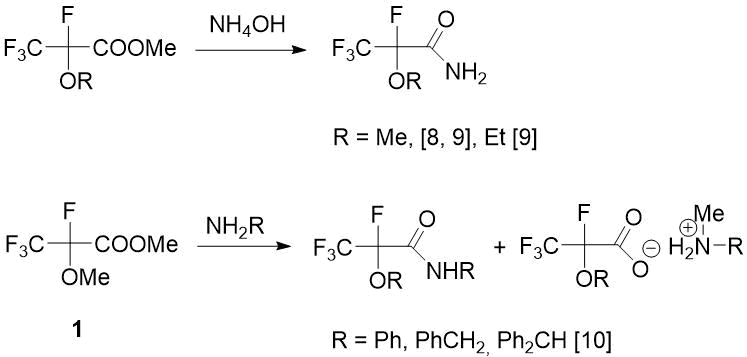
Схема 1. Результаты аммонолиза и аминолиза эфиров 2-алкокситетрафторпропановой кислоты [8-10].
Поэтому для синтеза целевых амидов 2-метокситетрафторпропановой кислоты в качестве исходного соединения был выбран легкодоступный метиловый эфир 1. Однако позже O. Paleta впервые обнаружил, что в отличие от нефторированных аналогов в результате реакций эфира 1 с первичными аминами наряду с амидами образуются продукты метилирования аминов, соотношение которых зависит от температуры реакции и растворителя [10] (Схема 1). По другим данным, действие такого первичного амина, как (3‑аминопропил)триметоксисилан на эфир 1 дает единственный продукт – соответствующий амид, который используют для получения гидрофобных аэрогелей, применяемых как изоляторы, носители для катализаторов и оптические материалы [11] (Схема 2).
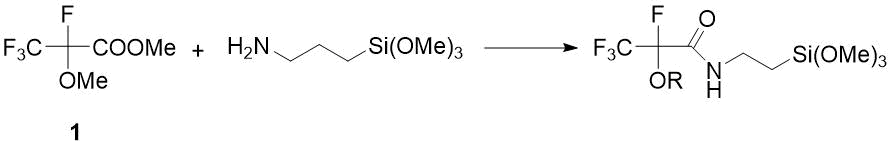
Схема 2. Реакция эфира 1 с аминоалкилсиланом [11].
Традиционным способом - аминолизом соответствующего хлорангидрида (RFCOCl) был получен только (S)-(-)-1-фенэтиламид--метокситетрафторпропановой кислоты [12,13], который является интермедиатом в синтезе летучих ингаляционных анестетиков общей формулы CF3CF(OR)H, где R=Me, CF2H и C(Cl)(F)H [12-14].
Вследствие противоречивости литературных данных относительно аминолиза эфира 1 представлялось интересным выяснить результаты новых реакций 1 с гетероциклическими аминами. В качестве аминов нами были выбраны 2-фурфуриламин, пиперидин, морфолин и гексаметиленимин. Оказалось, что эти реакции наряду с ожидаемыми амидами дают также и N-метиламмониевые соли 2-метокситетрафторпропановой кислоты в результате конкурирующей атаки амином карбонильного атома углерода и метильной группы. При этом относительные количества продуктов зависят от структуры взятого субстрата. С первичным амином – 2-фурфуриламином – образуется смесь (2:1) соответствующего амида 2 и продукта метилирования 6 в виде аммониевой соли. Действие на эфир 1 гетероциклических вторичных аминов (пиперидина или морфолина) дает примерно равные количества амидов 3 или 4 и N-метиламмониевых солей 7 или 8. Реакция стерически затрудненного гексаметиленимина с 1 приводит к преимущественному образованию продукта N метилирования 9 – соотношение амида 5 и соли 9 составляет 1:3,2 (Схема 3).
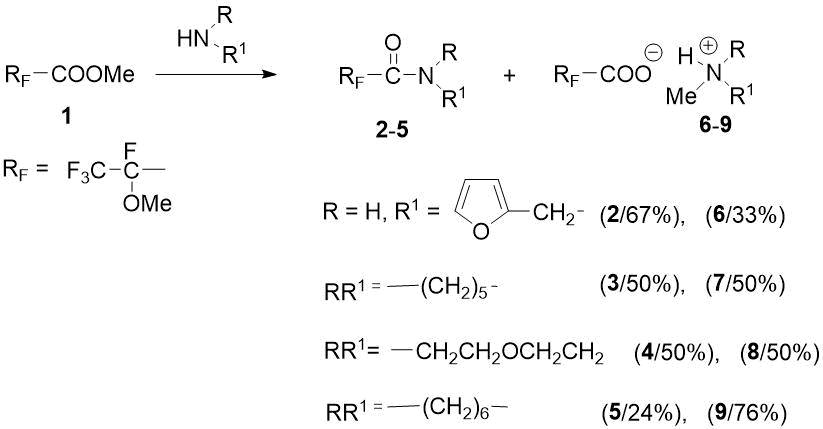
Схема 3. Соотношение продуктов реакций метилового эфира 1 с гетероциклическими аминами.
Полученные амиды 2-5 очищены перегонкой в вакууме. Соли 6-9 не удается очистить (об этом также сообщалось и в работе [10] для аналогичных солей), и они охарактеризованы спектрами ЯМР 1H и 19F. Значения RF у амидов 2-5 в ТСХ (в системе ацетон-CCl4 = 1:3) находятся в интервале 0,58-0,73, а соли 6-9 остаются у старта (RF = 0-0,18).
Поскольку аминолиз эфира 1 давал невысокие выходы фторсодержащих амидов после выделения (21-62%), нами получено другое производное 2-метокситетрафторпропановой кислоты – хлорангидрид 10 путем омыления эфира 1 до кислоты [8] и последующей реакции с фталоил дихлоридом [12] (Cхема 4). Реакции хлорангидрида 10 с морфолином, гексаметиленимином и фенилэтиламином давали соответствующие амиды 4, 5, 11 с высокими выходами (71-91%), причем в качестве акцептора HCl мы использовали дополнительно еще 1 экв. амина или триэтиламин (Cхема 4).
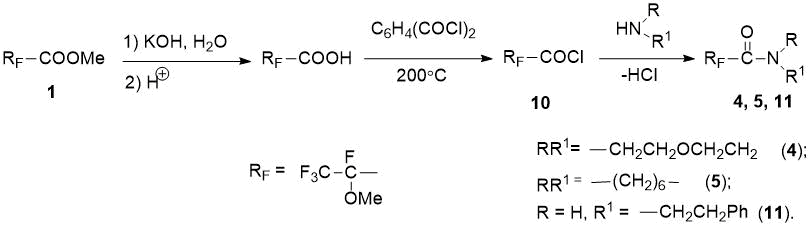
Схема 4. Синтез фторсодержащих амидов 4, 5, 11 из хлорангидрида 10.
Согласно спектру ЯМР 19F гексаметиленимид 5, полученный из RFCOCl 10, существует в виде смеси двух стереоизомеров в соотношении 6:1. Синтезированные нами фторзамещенные алкиламиды 2-5 и 11 являются новыми соединениями, состав и строение которых доказаны данными ЯМР 1H и 19F и элементного анализа. В спектрах ЯМР 19F амидов сигнал CF-группы проявляется в области -49,93÷-58,07 м.д., а сигнал CF3-группы – при -2,15÷-4,90 м.д.
Таким образом, нами показано, что результаты аминолиза эфира 1 зависят от структуры амина. Согласно нашим и литературным данным [10, 11] получение амидов с препаративными выходами удается только при использовании пространственно незатрудненных первичных метиленаминов общей формулы R-CH2NH2. По отношению к стерически затрудненным вторичным гетероциклическим аминам метиловый эфир 1 проявляет двойственную реакционную способность, и в результате образуется смесь соответствующих амидов и N-метиламмониевых солей 2-метокситетрафторпропановой кислоты. В этих случаях для получения амидов вместо эфира 1 следует использовать хлорангидрид RFCOCl 10. Поскольку многие лекарства содержат амидную функцию [15, 16], синтез фторсодержащих амидов является актуальной задачей.
Экспериментальная часть
Cпектры ЯМР регистрировали на приборах «Bruker Avance-200» и «Bruker Avance-300» с рабочими частотами 200 МГц и 300 МГц (внутренний стандарт SiMe4) для 1Н ЯМР и 188 МГц и 282 МГц для 19F ЯМР (CF3COOH) соответственно. Элементный анализ выполнен в лаборатории микроанализа ИНЭОС РАН. Контроль протекания реакций методом ТСХ осуществляли на пластинах фирмы «Merck» (силикагель 60 F254, 0.25 мм). Значения RF полученных соединений определены в системе ацетон-СCl4 = 1:3. Исходный метиловый эфир 1 синтезировали взаимодействием эпоксида гексафторпропена с метанолом [8]. 2,3,3,3-Тетрафтор-2-метоксипропаноил хлорид 10 получали из соответствующей кислоты [8] и фталоил дихлорида, как описано в работах [12, 13]. Все используемые растворители очищали по стандартным методикам.
Аминолиз метил- 2,3,3,3-тетрафтор-2-метоксипропионата (1).
Реакция 1 с 2-фурфуриламином.
Смесь 3,5 г (18,4 ммоль) эфира 1 и 1,0 г (10,3 ммоль) 2-фурфуриламина нагревали при перемешивании при 50-60°С до завершения реакции (9 ч.). Температуру доводили до комнатной, реакционную смесь упарили в вакууме и получали 3,05 г масла, содержащего согласно ТСХ-анализу и спектрам ЯМР (1H, 19F) смесь (2:1) целевого амида 2 и N-(фуран-2-илметил)-N-метил-О-(2,3,3,3-тетрафтор-2-метоксипропаноил)гидроксил-аммония 6. Для удаления соли 6 полученное масло растворяли в диэтиловом эфире, промывали водой, разбавленной соляной кислотой и еще раз водой. Эфирный слой отделяли, упаривали в вакууме, к остатку добавляли CCl4, и раствор фильтровали через небольшой слой силикагеля (5 мм). Удаление растворителя в вакууме давало 1,64 г (62%) оранжевого масла (после обработки холодным петролейным эфиром - светло-желтый порошок). Получен 2,3,3,3-тетрафтор-N-(фуран-2-илметил)-2-метоксипропанамид 2, т.пл. 30С, RF = 0,66 (раствор в CCl4). Спектр 1Н ЯМР (200 МГц, CD3OD,δ, м.д.): 3,51 (с, 3Н, ОСН3); 4,43 (с, 2Н, СН2N); 4,84 (с, 1Н, NН); 6,19-6,25 (м, 1Н, фуран); 6,30-6,36 (м, 1Н, фуран); 7.41 (с,1Н, фуран). Спектр 19F ЯМР (188 МГц, CD3OD, δ, м.д.): -4,90 (уш. с, 3F, CF3); -53,26 (уш. с, 1F, СF). Найдено (%): С, 42,21; Н, 3,62; N, 5,33. C9H9F4NO3. Вычислено (%): С, 42,35; Н, 3,53; N, 5,49.
Реакция 1 с пиперидином.
Синтез проводили из 1,71 г (9,0 ммоль) эфира 1 и 0,81 г (9,5 ммоль) пиперидина аналогично, но при 72°С в течение 5,5 ч. Получили 2,1 г масла, содержащего согласно ТСХ анализу и спектрам ЯМР (1H, 19F) смесь (1:1) целевого 2,3,3,3-тетрафтор-2-метокси-1-(пиперидин-1-ил)пропан-1-она 3 (RF = 0,58) и 1-метил-1-((2,3,3,3-тетрафтор-2-метокси-пропаноил)окси)пиперидин-1-ия 7 (RF = 0,18). Амид 3 выделяли из смеси перегонкой с выходом 0,77 г (35%) в виде бесцветного масла с т. кип. 72С/3 мм.рт.ст. Спектр 1Н ЯМР (200 МГц, C6D6, δ, м.д.): 1,07-1,27 (м, 6Н, 3СН2); 3,28 (с, 3Н, ОСН3); 3,22-3,54 (м, 4Н, СН2NCH2). Спектр 19F ЯМР (188 МГц, C6D6, δ, м.д.): -2,15 (с, 3F, CF3); -49,93 (с, 1F, СF). Найдено (%): С, 44,29; Н, 5,44; N, 5,68. C9H13F4NO2. Вычислено (%): С, 44,44; Н, 5,35; N, 5,76.
Реакция 1 с морфолином.
Смесь 0,51 г (2,7 ммоль) эфира 1 и 0,23 г (2,7 ммоль) морфолина перемешивали при 20°С до завершения реакции (7 дней). После вакуумирования реакционной смеси получили 0,5 г низкоплавкого продукта, содержащего согласно ТСХ-анализу и спектру ЯМР (19F) смесь (1:1) целевого амида 4 и 4-метил-4-((2,3,3,3-тетрафтор-2-метокси-пропаноил)окси)морфолин-4-ия 8. Спектр 19F ЯМР (188 МГц, ацетон-d6,δ, м.д.): -1,50 (с, 3F, CF3 для 8); -3,00 (с, 3F, CF3 для 4); -48,42 (с, 1F, СF для 8); -51,25 (с, 1F, СF для 4).
2,3,3,3-Тетрафтор-2-метокси-1-морфолино-пропан-1-он (4).
К раствору 1,52 г (7,8 ммоль) RFCOCl 10 в 10 мл диэтилового эфира при охлаждении холодной водой прибавляли 1,39 г (16 ммоль) морфолина в 14 мл диэтилового эфира. На следующий день выпавший осадок хлоргидрата отфильтровывали, маточник упаривали в вакууме, остаток перегоняли. Получили 1,6 г (84%) амида 4 в виде бесцветного масла с т. кип. 61С/0.045 мм.рт.ст., nD = 1,4209 (20,5С). Спектр 1Н ЯМР (200 МГц, C6D6, δ, м.д.): 3,02 (с, 3Н, ОСН3); 3,04-3,28 (м, 8Н, 4СН2). Спектр 19F ЯМР (188 МГц, C6D6, δ, м.д., J/Гц): -2,18 (д, 3F, CF3, J = 4,0); -50,32 (с, 1F, СF). Найдено (%): С, 39,05; Н, 4,57; N, 5,65. C8H11F4NO3. Вычислено (%): С, 39,18; Н, 4,49; N, 5,71.
Реакция 1 с гексаметиленимином.
Синтез проводили из 1,06 г (5,6 ммоль) эфира 1 и 0,59 г (6,0 ммоль) гексаметиленимина аналогично реакции 1 с морфолином. Получили 1,55 г масла, содержащего согласно ТСХ-анализу и спектрам ЯМР (1H, 19F) смесь (1:3,2) целевого амида 5 и 1-метил-1-((2,3,3,3-тетрафтор-2-метокси-пропаноил)окси)азепан-1-ия 9. Спектр 19F ЯМР (188 МГц, CD3OD, δ, м.д.): -2,00 и -4,70 (оба с, 3F, CF3 для 5); -4,10 (с, 3F, CF3 для 9); -50,10 и -59,40 (оба с, 1F, СF для 5); -53,60 (с, 1F, СF для 9). Амид 5 выделяли из смеси перегонкой с выходом 0,30 г (21%) в виде светло-желтого масла с т. кип. 81-83°С/3 мм.рт.ст.
1-(Азепан-1-ил)-2,3,3,3-тетрафтор-2-метоксипропан-1-он (5).
К раствору 1,6 г (8,2 ммоль) RFCOCl 10 в 8 мл диэтилового эфира при охлаждении ледяной водой прибавляли раствор 1,0 г (10,1 ммоль) гексаметиленимина и 0,83 г (8,2 ммоль) триэтиламина в 12 мл диэтилового эфира при перемешивании. На следующий день выпавший осадок хлоргидрата отфильтровывали, маточник упаривали в вакууме, остаток перегоняли. Получили 1,49 г (71%) амида 5 в виде бесцветного масла с т. кип. 58-60°С/0.05 мм.рт.ст., nD = 1,4271 (20,5С) и RF = 0,73 (раствор в бензоле). Спектр 1Н ЯМР (200 МГц, C6D6, , м.д.): 1,00-1,46 (м, 8Н, 4СН2); 3,10 (с, 3Н, ОСН3); 2,86-3,36 (м, 4Н, 2СН2). Спектр 19F ЯМР (188 МГц, C6D6, δ, м.д.): -2,17 и -4,87 (с, 3F, CF3); -50,52 и -58,00 (с, 1F, СF). Найдено (%): С, 46,54; Н, 5,98; N, 5,31. C10H15F4NO2. Вычислено (%): С, 46,69; Н, 5,84; N, 5,45.
2,3,3,3-Тетрафтор-2-метокси-N-фенэтилпропанамид (11).
К раствору 1,33 г (11,0 ммоль) 2-фенилэтиламина в 13 мл бензола при охлаждении холодной водой прибавляли 1,07 г (5,5 ммоль) RFCOCl 10 в 5 мл бензола. На следующий день выпавший осадок хлоргидрата отфильтровывали, маточник упаривали в вакууме, в остатке – желтое кристаллизующееся масло. Получили 1,4 г (91%) амида 11 в виде светло-желтых кристаллов с т. пл. 62-64°С, RF = 0,71 (раствор в бензоле). Спектр 1Н ЯМР (300 МГц, C6D6, δ, м.д., J/Гц): 2,34-2,51 (м, 2Н, СН2Ph); 3,09 (с, 3Н, ОСН3); 3,13-3,28 (м, 2Н, СН2N); 5,95 (уш. с, 1H, NH); 6,98 (д, 2Н, Ph, J = 7,0); 7,09-7,21 (м, 3Н, Ph). Спектр 19F ЯМР (282 МГц, C6D6, δ, м.д.): -4,7 (с, 3F, CF3); -58,07 (с, 1F, СF). Найдено (%): С, 51,48; Н, 4,74; N, 4,95. C12H13F4NO2. Вычислено (%): С, 51,61; Н, 4,66; N, 5,02.
Благодарности
Работа выполнена в рамках Государственного задания №075-00697-22-03 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Салоутин В.И., Салоутина Л.В., Запевалов А.Я., Чупахин О.Н., Изв. АН. Сер. хим., 2016, 2163.
- Wang P., Feng L.-W., Wang L., Li J.-F., Liao S., Tang Y., J. Am. Chem. Soc., 2015, 137, 4626.
- Васильева Т.П., Воробьева Д.В., Изв. АН. Сер. хим., 2018, 1426.
- Васильева Т.П., Воробьева Д.В., Изв. АН. Сер. хим., 2020, 300.
- Васильева Т.П., Знаменский В.В., Хим.-фарм. Журн., 1994, 28, 33.
- Васильева Т.П., Лисина Н.И., Знаменский В.В., Хим.-фарм. журн., 1997, 31, 40.
- Титце Л., Айхер Т. Препаративная органическая химия: Пер. с нем./Под ред. Алексеева Ю.Е. М.:Мир, 2009, с.162.
- Sianesi D., Pasetti A., Tarli F., J. Org. Chem., 1966, 31, 2312.
- Pasetti A., Tarli F., Sianesi D., Gazz.Chim. Ital., 1968, 98, 277.
- Dolensky B., Kvičala J., Paleta O., J. Fluorine Chem., 2016, 185, 31.
- Lermontov S., Sipyagina N., Malkova A., Yarkov A., Vasil’ev S., Simonenko N., Baranchikov A., Ivanov V., RSC Advances, 2016, 6(84), 80766.
- Rozov L., Rafalko P., Evans S., Brockunier L., Ramig K., J. Org. Chem., 1995, 60, 1319.
- Rozov L., Ramig K., Tetrahedron Lett., 1994, 35, 4501.
- Ramig K., Brockunier L., Rafalko P., Rozov L., Angew. Chem., Int., Ed., 1995, 34, 222.
- Nicholson W., Barreteau F., Leitch J., Payne R., Priestley I., Godineau E., Battilocchio C., Browne D., Angew. Chem. Int. Ed., 2021, 60, 21868.
- Ning X., Lou S., Mao Y., Xu Z., Xu D., Org. Lett. 2018, 20, 2445.
Статья рекомендована к публикации к.х.н. О. В. Брызгаловой
Fluorine Notes, 2022, 145, 5-6


