Поступило в редакцию: Декабрь 2022
УДК 543.51+547
Fluorine Notes, 2022, 145, 3-4
ИССЛЕДОВАНИЕ ПОЛИФТОРАЛКИЛСОДЕРЖАЩИХ ФЕНОЛОВ И ПРОДУКТОВ ИХ СИЛИЛИРОВАНИЯ МЕТОДОМ ГАЗОВОЙ ХРОМАТО-МАСС-СПЕКТРОМЕТРИИ
Е.А. Хакина, В.И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова РАН, Российская Федерация, 119991, Москва, ул. Вавилова, д. 28
Fax: (499) 135 5085 Е-mail: khakina90@ineos.ac.ru
Aннотация: Настоящее сообщение посвящено анализу полифторалкилсодержащих фенолов 1a-e и продуктов их дериватизации (силилирования) 2a-e методом газовой хромато-масс-спектрометрии. Показано, что интенсивности молекулярных ионов соединений 1a-e зависят от положения заместителей в ароматическом ядре. Установлено, что механизм фрагментации молекулярных ионов продуктов силилирования исследованных фенолов 2a-e зависит от их строения.
Ключевые слова: газовая хромато-масс-спектрометрия, дериватизация, полифторалкилсодержащие фенолы
В последнее время полифторированные соединения находят всё большее применение в производстве различных полимерных материалов, гидрофобных покрытий, а также исследуются в качестве лекарственных препаратов различного спектра действия [1-3]. Наряду с развитием методов синтеза таких соединений разрабатываются аналитические методы их определения и обнаружения в различных субстанциях [4]. Газовая хромато-масс-спектрометрия с ионизацией электронным ударом является одним из наиболее эффективных методов анализа летучих термически стабильных соединений [5-7]. Библиотеки NIST, в которых суммированы спектральные данные для большого числа соединений различных классов, позволяют эффективно идентифицировать компоненты смесей. Кроме того, активное развитие методов дериватизации расширяет границы применимости газовой хромато-масс-спектрометрии. Функционализация гидрокси-, амино-, карбокси- и других групп с помощью коммерчески доступных дериватизирующих реагентов приводит к превращению малолетучих соединений (полиспиртов, кислот и т.д.) в хорошо летучие, что позволяет значительно улучшить качество и соотношение сигнал-шум в спектрах[8].
Однако проанализировав базу NIST17 MS можно сделать вывод об ограниченном количестве данных для полифторированных соединений.
В настоящей работе мы исследовали ряд полифторалкил содержащих фенолов методом газовой хромато-масс-спектрометрии с применением дериватизации (и без) для выявления зависимости паттернов фрагментации от состава и строения. В качестве объектов исследования были выбраны орто- и пара- замещенные 2-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)-фенолы 1а-е, отличающиеся составом и положением заместителей в ароматическом ядре (Рис. 1).
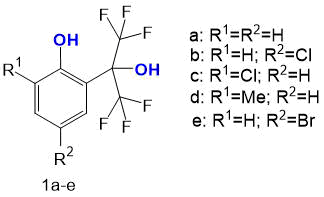
Рисунок 1. орто- и пара-Замещенные 2-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)-фенолы.
Данные соединения были нами синтезированы реакцией С-оксиалкилирования фенолов гексафторацетоном по ранее описанным методикам [9-11]. Однако масс-спектров этих соединений, полученных при ионизации электронным ударом, с объяснением фрагментации в литературе найти не удалось.
Анализ проводили с использованием газового хромато-масс-спектрометра ShimadzuGCMS-QP2020 с использованием колонки SH-RTx-5MS (30 м × 0,25 мм × 0,25 мкм), метода ионизации электронным ударом и одноквадрупольного детектора в режиме регистрации полного ионного тока положительных ионов. В качестве газа-носителя использовался гелий (99,9999%). Параметры анализа приведены в Таблице 1. Регистрацию осуществляли в режиме сканирования положительных ионов в диапазоне 35-650 m/z.Для приготовления проб навеску образца массой 0,1 мг растворяли в 1 мл хлористого метилена. Анализ полученных результатов осуществляли с помощью программы GCMSolution.
Таблица 1. Параметры ГХ/МС анализа.
|
начальная температура и выдержка |
50°C, 1 мин |
|
скорость нагрева |
30°C/мин до 290°C |
|
выдержка при конечной температуре |
3 мин |
|
полное время анализа |
15 мин |
|
температура инжектора |
250°C |
|
режим инжектора |
Split (1:10) |
|
объем пробы |
0,1 мкл |
|
скорость потока гелия через колонку |
1 мл/мин |
|
температура источника ионов |
200°C |
|
температура интерфейса |
250°C |
|
энергия электронов |
70 эВ |
Было показано, что в спектрах всех исходных фенолов 1a-e в указанных условиях ионизации наблюдаются достаточно интенсивные сигналы молекулярных ионов (Рис.2).Интенсивность сигнала молекулярного иона заметно увеличивается при наличии какого-либо заместителя из ряда CH3, Cl, Br в ароматическом ядре. Причем, наличие заместителя в пара-положении к фенольной группе приводит к большему возрастанию интенсивности сигнала молекулярного иона в сравнении с наличием его в орто-положении. Основной путь фрагментации молекулярных ионов исследованных полифторированных фенолов заключается в первоначальном отщеплении атома фтора с последующим выбросом дифторкарбена, что является распространённым механизмом фрагментации фторированных соединений [12]. Последующая фрагментация сопровождается отщеплением протона наряду с атомом фтора и дифторкарбеном, что приводит к образованию пика с максимальной интенсивностью. Молекулярные ионы всех исследованных соединений фрагментируют по одному механизму независимо от их строения.
Интенсивность молекулярных ионов в масс-спектрах соединений 1а-e зависит от строения молекулы и электронных свойств заместителей. Она рассчитана отношением интенсивности соответствующего молекулярного иона к интенсивности молекулярного иона в спектре соединения 1а. Стоит отметить, что интенсивность сигнала растёт в ряду о-Сl<о-CH3<п-Cl<п-Br (Рис.3).
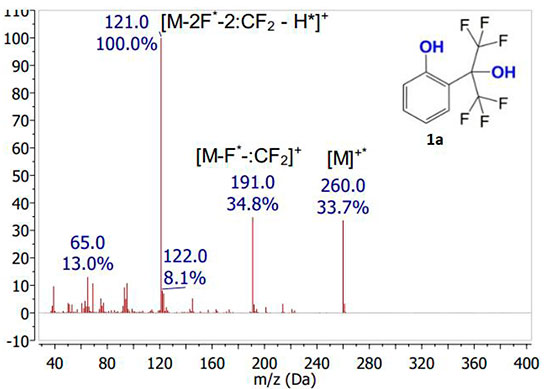
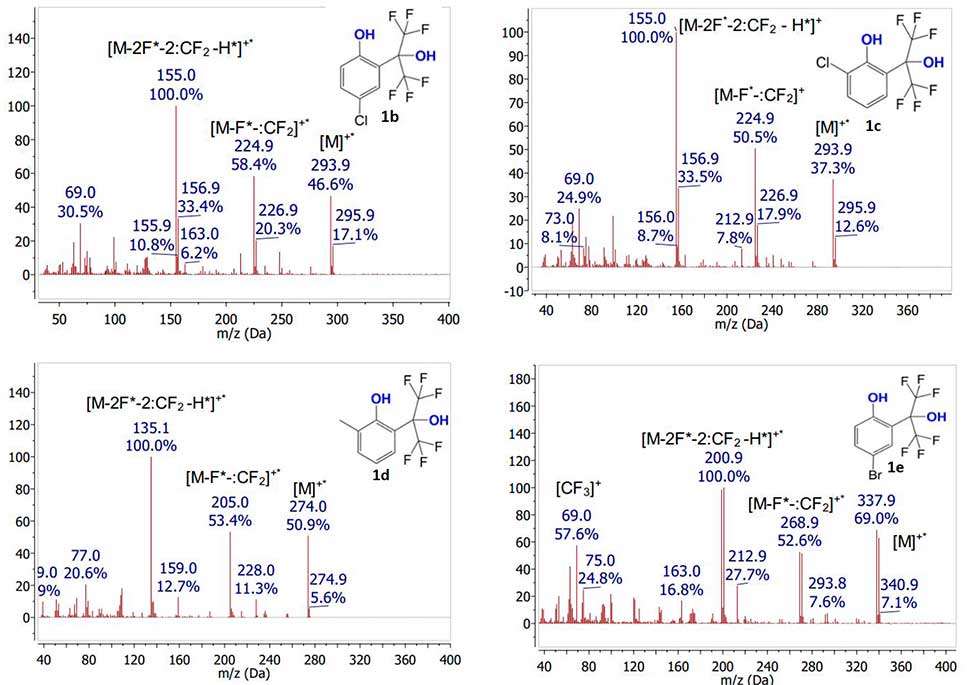
Рисунок 2. Масс-спектры соединений1а-e, полученные при ионизации электронным ударом.
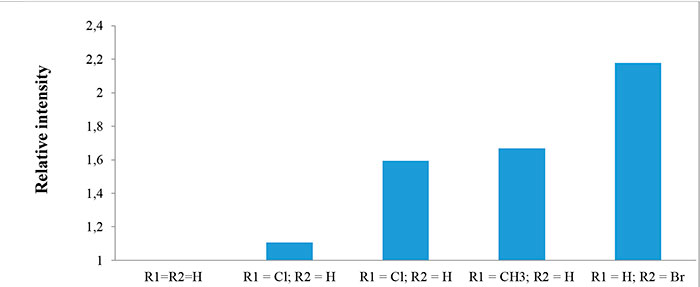
Рисунок 3. Относительная интенсивность молекулярных ионов в масс-спектрах соединений 1а-e.
Для проведения дериватизации применяли 1-(триметилсилил)имидазол (Схема 1). В качестве растворителя при проведении дериватизации использовали этилацетат. К раствору 0,1 мг соединения 1а-е в 1 мл сухого этилацетата в виале для хроматографического анализа добавляли 3 мкл дериватизирующего агента. Полученную смесь кипятили в течение 30 сек, затем охлаждали до комнатной температуры и анализировали в тех же условиях, что и исходные спирты (Табл.2).
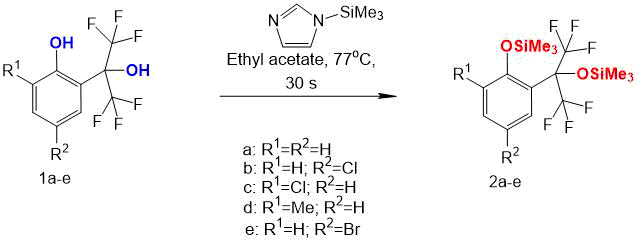
Схема 1.
Взаимодействие исследованных фенолов с дериватизирующим агентом в указанных условиях привело к превращению обеих спиртовых групп в силиловые эфиры несмотря на стерические затруднения, что было подтверждено с помощью ГХ-МС (Рис.4). При этом, в связи с увеличением молекулярной массы силильных эфиров по сравнению с массой исходных фенолов увеличилось и их время удерживания в данных условиях разделения. В Таблице 2 просуммированы времена удерживания исходных фенолов и их силиловых эфиров.
Таблица 2. Времена удерживания (tR) фенолов 1а-e и их силиловых эфиров в условиях ГХ-МС анализа
|
tR, мин |
Соединения |
|||||||||
|
1а |
2a |
1b |
2b |
1c |
2c |
1d |
2d |
1e |
2e |
|
|
5,39 |
6,45 |
6,05 |
6,99 |
5,79 |
7,06 |
5,39 |
6,90 |
6,39 |
7,31 |
|
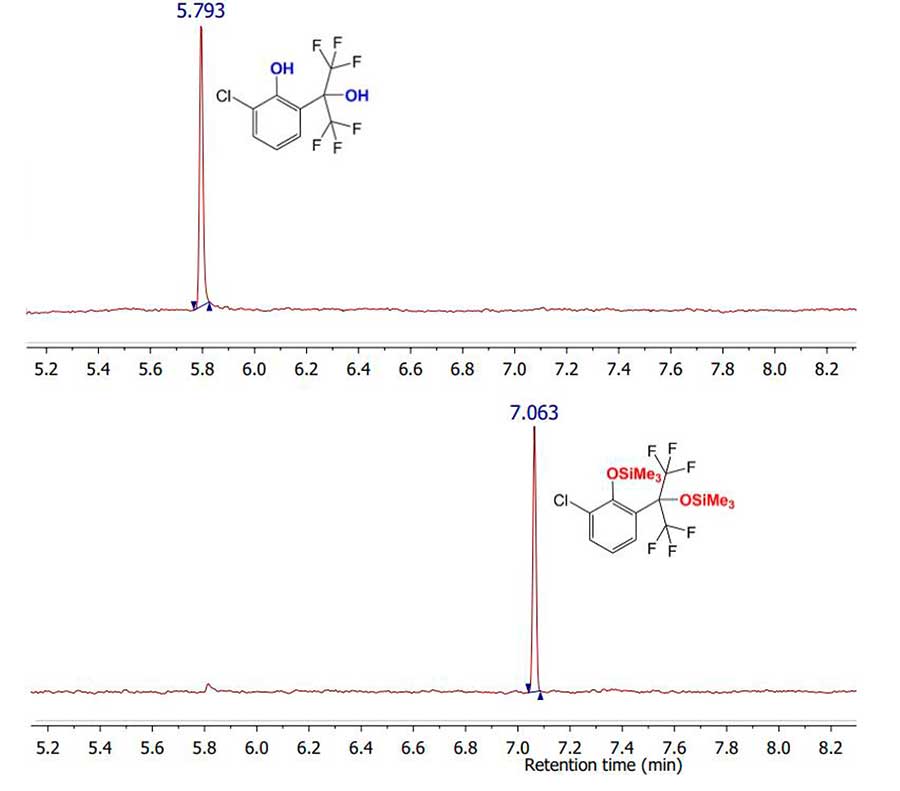
Рисунок 4. Сравнение хроматограмм полного ионного тока для соединений1c (сверху) и 2c(снизу).
В отличие от спектров исходных фенолов 1а-е, в спектре их силиловых эфиров 2а-е интенсивность сигналов молекулярных ионов достаточно мала. Необходимо отметить, что механизм фрагментации силиловых эфиров, в отличие от фрагментации фенолов, зависит от расположения заместителя в ароматическом ядре. При наличии какого-либо заместителя в пара-положении к Me3SiO-группе первой стадией фрагментации молекулярного иона является отщепление атома фтора с последующим выбросом дифторкарбена по аналогии с исходными фенолами. (Рис. 5).
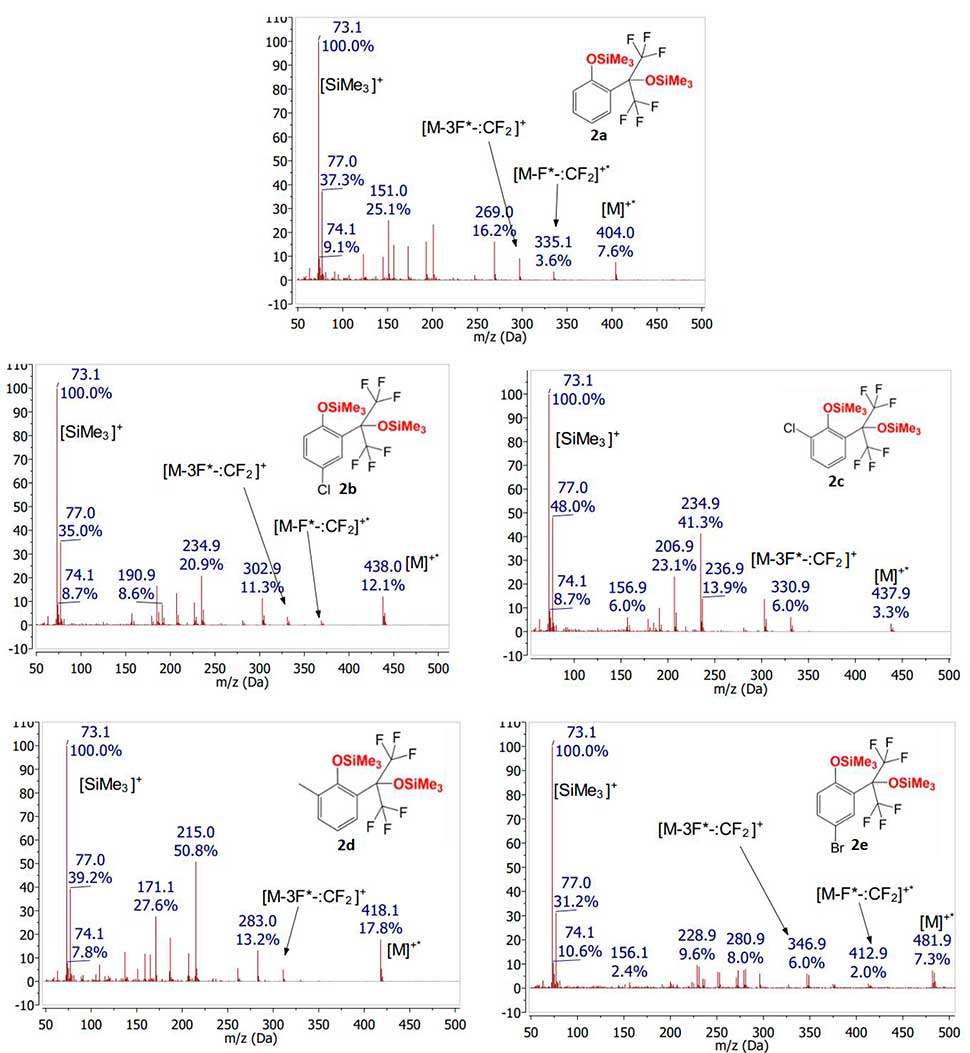
Рисунок 5. Масс-спектры соединений2а-e, полученные при ионизации электронным ударом.
Наличие заместителя в орто-положении к триметилсилоксильной группе силиловых эфиров 2а-е, триметилсилокси сигнала с соотношением m/z, соответствующим [M-F*-:CF2]+ не набюдается. В данном случае наблюдается сигнал иона, вероятно соответствующего составу [M-3F*-:CF2]+.
По-видимому, найденные закономерности масс-спектральной фрагментации фторалкилсодержащих фенолов 1а-е и их триметилсилиловых эфиров 2а-е могут быть характерны и для других аналогов, содержащих в ароматическом ядре иные алкильные и алкоксильные группы, арильные заместители, атомы галогена и т.п.
Выводы
Методом газовой хромато-масс-спектрометрии исследованы 2-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)-фенолы 1а-е и их ди-(триметилсиловые) эфиры 2а-е. Показано, что дериватизация приводит к присоединению двух силильных групп несмотря на потенциальные стерические затруднения, вызванные СF3-группами.
Продемонстрирована зависимость интенсивности молекулярного иона для фенолов 1а-е от их строения. Установлено, что фрагментация молекулярных ионов фенолов 1а-е и продуктов их дериватизации 2а-е протекает по разным механизмам и зависит от расположения заместителя в ароматическом ядре.
Это может являться весомым аргументом при идентификации данных изомеров по их масс-спектральным характеристикам.
Благодарности
Работа выполнена в рамках Государственного задания №075-00697-22-03 Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- H. Amii, Perfluoroalkyl Substances: Synthesis, Applications, Challenges and Regulations, ed. by Bruno Ameduri, Royal Society of Chemistry, 2022, 66-112.
- Robertson JF. R, Come SE, Jones SE, Beex F, Kaufmann M, Makris A, Nortier JW. R, Possinger K, Rutqvist L.-E., Eur. J. Cancer, 2005, 41, 346.
- Tong C.-L, Xu X.-H, Qing F.-L., Angew. Chem. Int. Ed., 2021, 60, 22915.
- Gao K, Chen Yu., Xue Q., FuJ., Fu K., Fu J., Zhang A., CaiZ., Jiang G., Trends in Analytical Chemistry, 2020, 133, 116114.
- Krüsemann E. J. Z., PenningsJ. L. A., Cremers J. W. J. M., Bakker F., Boesveldt S., Talhout R., Journal of Pharmaceutical and Biomedical Analysis, 2020, 188, 113364.
- Bisceglia K.J., Kroening G., Bikram S., ACS Symposium Series, 2019, 1319, 51.
- Mojiri A., Zhou J. L.,Ohashi A., Ozaki N., Kindaichi T., Science of the Total Environment, 2019, 696, 133971.
- Harvey D. J., Vouros P., Mass Spectrometry Reviews, 2020, 39, 105.
- Dyachenko V.I., Galakhov M.V., Kolomiets A.F., Fokin A.V., Chemistry of Heterocyclic Compounds, 1989, 25, 1200.
- Dyachenko V.I., Kolomets A.F., Fokin A.V., Russ. Chem. Bull., 1988, 36, 2646.
- Dyachenko V.I., Galakhov M.V., Kolomiets A.F., Fokin A.V., Russ. Chem. Bull., 1989, 38, 831.
- Kagramanov N.D., Fluorine notes, 2020, 1(128), 3-4.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2022, 145, 3-4


