Поступило в редакцию: Февраль 2022
УДК 547.1`1
Fluorine Notes, 2022, 140, 3-4
С2-Алкилирование в трёхкомпонентной реакции фторкарбонильных соединений, производных пиррола и малононитрила в условиях конкуренции с С2-оксиалкилированием
О. Ю. Федоровский, Н. Д. Чкаников
Институт элементоорганических соединений им. А. Н. Несмеянова Российской академии наук,
Российская
Федерация, 119991 Москва, ул. Вавилова, 28 (offskii@rambler.ru)
Аннотация: Осуществлено С2-алкилирование производных пиррола 2-(2,2,2-трифторэтилиден)малононитрилом 1, образующимся in situ из трифтор-ацетальдегида этил полуацеталя 2 и малононитрила в присутствии основания. В результате этой трехкомпонентной реакции получены нитрилы – производные 4,5,6,7-тетрагидроиндола и пиррола 4a – с. Конкурирующей реакцией является С2-оксиалкилирование пиррольного ядра полуацеталем 2. Показано, что побочная реакция может быть полностью подавлена снижением температуры реакции до -30°С. При взаимодействии этилового эфира трифторпировиноградной кислоты 3 с производными пиррола в присутствии малононитрила основной является реакция С2-оксиалкилирования пиррольного ядра, а не его С2-алкилирование, образующимся in situ алкеном 10. Нитрилы 6 – 9 с высокими выходами получены из производных пиррола и алкена 10. Строение полученных соединений подтверждено методами 1Н, 13C, 19F ЯМР спектроскопии, масс-спектрометрии и масс-спектрометрии высокого разрешения.
Ключевые слова: 2-(2,2,2-трифторэтилиден)малононитрил, этил 3,3-дициано-2-(трифтор-метил)акрилат, замещённые 2-(2,2,2-трифтор-1-(1H-пиррол-2-ил)этил)малононитрила и этил 2-(дицианометил)-3,3,3-трифтор-2-(4,5,6,7-тетрагидро-1H-индол-2-ил)пропаната, трёхкомпонентный одностадийный синтез, С2-алкилирование, С2-оксиалкилирование, трифторацетальдегид этил полуацеталь, этил трифторпируват, производные пиррола и индола, малононитрил.
Введение
Синтез гетероциклических фторорганических соединений привлекает к себе большое внимание на протяжении многих лет. Их перспективность особенно заметна в фармацевтической химии, около 20% всех лекарственных препаратов содержат, по крайней мере, один атом фтора. Однако, синтез этих соединений часто вызывает неожиданные трудности [1-4]. Трифтор-ацетальдегида этил полуацеталь 2 и этиловый эфир трифторпировиноградной кислоты 3 являются одними из наиболее важных синтонов, с помощью которых могут быть получены гетероциклические соединения, содержащие трифторметильную группу.
Ранее мы сообщали о трёхкомпонентной реакции производных индола, 2 и малононитрила в присутствии основания, приводящей к нитрилам 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты с хорошими выходами [4]. Циано производные пиррола и ТГИ являются потенциально биологически активными веществами, а так же могут служить полупродуктами в дальнейшем направленном синтезе для поиска новых биологически активных соединений или регуляторов роста растений [5]. В настоящее время мультикомпонентные реакции достигли уровня продвинутых синтетических инструментов, поиск и развитие которых стимулируется принципами безотходности химического производства, то есть «зеленой» химии. Применение процедуры трёхкомпонентного синтеза позволяет избежать стадии получения, очистки и применения фторсодержащих цианоэтиленов, известных своей токсичностью [6, 7].
В данной работе мы применили трёхкомпонентный одностадийный синтез для получения фторсодержащих циан производных пиррола и индола, замещённых по положению 2 на основе фторкарбонильных соединений 2 и 3.
Обсуждение результатов
Развивая систематические исследования синтеза фторсодержащих гетероциклических соединений, исходя из фторсодержащих цианоэтиленов мы показали, что C2-алкилирование индолов таким реакционно-способным алкеном как 2-(2,2,2-трифтоэтилиден)малононитрил 1 может быть осуществлено в результате трехкомпонентной реакции индолов, трифтор-ацетальдегида этил полуацеталя 2 и малононитрила в присутствии основания, т.е. без выделения алкена, образующегося in situ [4] (схема 1).
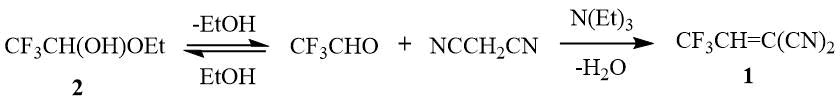
Схема 1. Синтез 2-(2,2,2-трифторэтилиден)малононитрила 1.
Такой подход создает перспективу широкого использования фторсодержащих цианоэтиленов без их предварительного выделения из реакционной массы. В настоящей работе мы попытались расширить ряд использованных гетероциклических субстратов на 4,5,6,7-тетрагидроиндол (ТГИ), пиррол и их N-метильные производные. Кроме того, в качестве полифторкарбонильного предшественника цианоэтиленов мы использовали также этиловый эфир трифторпировиноградной кислоты 3. Использование ТГИ вместо индола в реакциях с полифторкарбонильными соединениями позволяет получить в конечном счете не 3-, а 2-замещенные индолы [8]. В отличие от индола, ТГИ и пиррол в мягких условиях подвергаются С2-оксиалкилированию под действием полуацеталя 2, что создает конкуренцию трёхкомпонентному процессу образования алкена 1 и С2-алкилированию ТГИ этим алкеном.
Взаимодействие ТГИ или N-Me-ТГИ с альдегидом 2 и малононитрилом проводили в ДХМ. В случае N-Me-ТГИ при 5°С после экспозиции в течение 16 ч и последующего хроматографического разделения получены нитрил 4а и спирт 5а с выходами 57% и 17% соответственно. Снижение температуры реакции до -30°С приводило к образованию нитрила 4а с выходом 69% и снижению выхода спирта 5а до следовых количеств - 4% (схема 2).
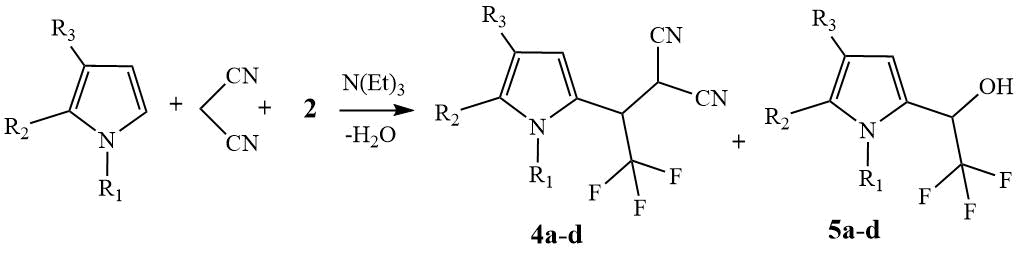
Схема 2. Трёхкомпонентный синтез нитрилов 4 и спиртов 5,
a) R1=Me, R2+R3= (CH2)4; b) R1=H, R2+R3= (CH2)4;
c) R1=Me, R2 = R3 = H; d) R1=H, R2 = R3 = H.
При комнатной температуре соотношение образующихся продуктов 4а и 5а по данным 19F ЯМР спектроскопии составляло 43:57, т.е. преобладало образование спирта 5а. Из этих данных следует, что снижение температуры реакции приводит к возрастанию относительного количества нитрила 4а по отношению к спирту 5а. Такая же закономерность наблюдаются при взаимодействии незамещенного ТГИ с полуацеталем 2 и малононитрилом при 5°С. Относительное количество выделенных продуктов 4b и 5b составляло 39 и 23%, в то время как при -30°С получен исключительно нитрил 4b с выходом 75%, причем по данным 19F ЯМР спектроскопии и ТСХ (проявление ТСХ реактивом Эрлиха) в реакционной массе следов спирта 5b не обнаружено.
В случае N-Me-пиррола, 2 и малононитрила в ДХМ при 5°С трёхкомпонентная реакция приводит к продуктам С2-алкилирования 4с и С2-оксиалкилирования 5с, выделенным с выходами 54 и 13%, соответственно. Снижением температуры реакции до -30°С побочную реакцию С2-оксиалкилирования так же удалось подавить полностью, выход нитрила составил 71%. В случае незамещенного пиррола устойчивого нитрила 4d выделить не удалось.
В том случае, когда в трехкомпонентной реакции с ТГИ, пирролом и их N-Me-производными, вместо полуацеталя 2 использовали более реакционно-способный этиловый эфир трифторпировиноградной кислоты 3 продукты трехкомпонентной реакции, как правило, образовывались в незначительных количествах (6 – 9%). Относительного успеха удалось достичь только в случаях незамещенного ТГИ и пиррола при -30°С. Нитрилы 7 и 9 получены этим методом с выходами 32 и 24%, соответственно.
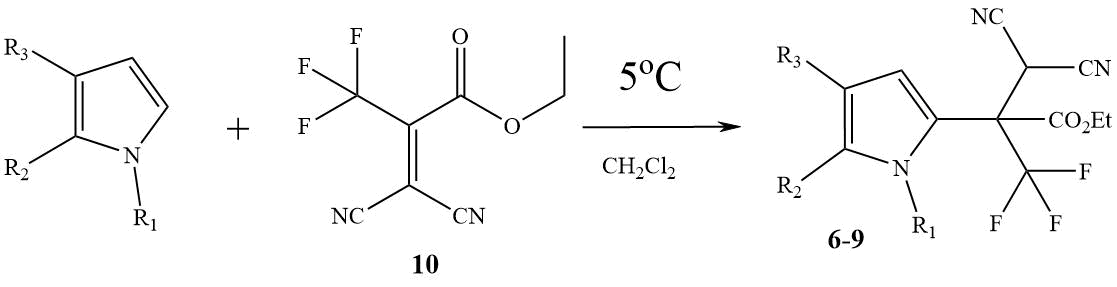
Схема 3. Получение нитрилов 6 – 9 с использованием алкена 10,
6) R1=Me, R2+R3= (CH2)4; 7) R1=H, R2+R3= (CH2)4;
8) R1=Me, R2 = R3 = H; 9) R1=H, R2 = R3 = H.
В отличие от синтона 1, алкен 10 доступен и ранее широко изучен на других примерах [9]. Оказалось, что взаимодействие ТГИ, пиррола и их N-Me-производных с алкеном 10 приводит к продуктам региоселективного С2-алкилирования, нитрилам 6 – 9 с выходами 77-85% (схема 3).
Выводы
Таким образом, разработанная нами стратегия синтеза нитрилов гетарил-2-циано-4,4,4-трифторбутановой кислоты, основанная на использовании 2-(2,2,2-трифторэтилиден)малононитрила, образующегося in situ из коммерчески доступных предшественников [4], успешно распространена на синтез нитрилов 2-замещённых пирролов и индолов 4a – с. Показано, что присутствие в реакционной массе полуацеталя 2 приводит к конкурирующей реакции C2-оксиалкилирования пиррольного ядра, которая может быть полностью подавлена снижением температуры реакции до -30°С. В случае кетоэфира 3 при взаимодействии с пирролом, его производными и малононитрилом основной является реакция С2-оксиалкилирования пиррольного ядра, а не его С2-алкилирование, образующимся in situ алкеном 10. Нитрилы 6 – 9 с высокими выходами получены из производных пиррола, ТГИ и алкена 10, предварительно синтезированного из кетоэфира 3 и малононитрила с выходом 61%.
Экспериментальная часть
Все исходные соединения закупались у компаний Merck, Sigma-Aldrich и использовались без очистки. Все элюенты и растворители: петролейный эфир Ткип = 40-70 °C (ПЭ), EtOAc (ЭА), ДХМ и триэтиламин были очищены перегонкой перед использованием. Для контроля реакции и обнаружения веществ использовались пластинки ТСХ Merck Kieselgel 60 F254. Очистку продуктов проводили колоночной хроматографией с использованием силикагеля Merck Kieselgel 60 (0,06-0,20 мм).
Спектры 1Н, 13С JMODECHO и 19F ЯМР записаны на спектрометре Bruker AvanceTM400 с рабочей частотой 400, 100 и 376 МГц, соответственно. Химические сдвиги протонов определены относительно остаточных сигналов CDCl3 (7.26 м.д.) и пересчитаны к сигналу SiMe4. Спектры 19F записаны с подавлением спин-спинового взаимодействия H-F. Химические сдвиги ядер 19F определены относительно CFCl3 как внешнего стандарта.
Масс-спектры записаны на приборе Finnigan Polaris Q (ионная ловушка, ЭУ, энергия ионизирующих электронов 70 эВ) методом прямого ввода образца. Масс-спектры высокого разрешения были зарегистрированы на приборе Bruker micrOTOF II (ионизация методом электрораспыления (ESI)). Измерения выполнены на положительных (напряжение на капилляре 4500 В) или на отрицательных (напряжение на капилляре 3200 В) ионах. Диапазон сканирования масс m/z 50-3000 Да, калибровка внешняя или внутренняя (Electrospray Calibrant Solution, Fluka). Использовали шприцевой ввод вещества для растворов в ацетонитриле, метаноле или воде, скорость потока 3 мкл∙мин–1. Газ-распылитель азот (4 л∙мин–1), температура интерфейса 180 οC [10].
Общая методика получения нитрилов 4a – d и 6 – 9 трёхкомпонентным одностадийным синтезом.
В круглодонную одногорлую колбу, снабжённую магнитной мешалкой, загружают свежеперегнанный ДХМ (2 мл), малононитрил (0.1 г, 1.5 ммоль), трифторацетальдегид этил полуацеталь 2 или этил трифторпируват 3 (0.216 г или 0.255 г, соответственно, 1.5 ммоль), триэтиламин (0.1 г) и 5-7 гранул просушенных молекулярных сит с размером пор 4А. Колбу закрывают септой, вакуумируют и заполняют аргоном, охлаждают до запланированной температуры (+5 °С или -30 °С) и с помощью шприца вводят производное пиррола или ТГИ (1.5 ммоль), растворённое в 1 мл ДХМ. Реакционную массу выдерживают при запланированной температуре (+5 °С или -30 °С) в течение ночи. Затем содержимое колбы разбавляют смесью ДХМ и ПЭ (10 мл, 1/1) и переносят на хроматографическую колонку, содержащую 100 мл силикагеля. Реакционную массу элюируют смесью ДХМ с ПЭ (1/1), постепенно повышая градиент растворителя добавлением ЭА до 3-5 %. Первыми с колонки выходят спирты 5, их Rf составляет 0.6-0.9, затем нитрилы 4 с Rf равным 0.3-0.6 (ПЭ/ЭА = 8/2). Растворы очищенных продуктов 4 и 5 упаривают при пониженном давлении и переупаривают с 20 мл ДХМ.
Общая методика синтеза нитрилов 6 – 9 с использованием алкена 10.
В круглодонную одногорлую колбу, снабжённую магнитной мешалкой, загружают свежеперегнанный ДХМ (2 мл) и производное пиррола или ТГИ (1.5 ммоль). Колбу закрывают септой, трижды последовательно вакуумируют и заполняют аргоном, охлаждают до +5°С и с помощью шприца вводят алкен 10 (0.327г, 1.5 ммоль), растворённый в 1 мл ДХМ. Реакционную массу выдерживают при +5°С в течение 2-3 часов. Затем содержимое колбы разбавляют смесью ДХМ и ПЭ (10 мл, 1/1) и переносят на стеклянный фильтр, содержащий 10 мл силикагеля. Нитрилы 6 – 9 элюируют смесью ДХМ с ПЭ (1/1), собирают раствор нитрила и упаривают при пониженном давлении, затем переупаривают с ДХМ (20 мл).
(4a) 2-(2,2,2-Трифтор-1-(1-метил-4,5,6,7-тетрагидро-1Н-индол-2-ил)этил)малононитрил
Получено 3КР при 5°С: 0.24г, выход 57%; при -30°С получено: 0.29 г, выход 69%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.77-1.89 (4H, m, 2CH2); 2.53-2.59 (4H, m, 2CH2); 3.48 (3H, s, Me); 4.21-4.28 (1H, m, CHCF3); 4.38 (1H, d, 6.2 Гц, CH(CN)2); 6.35 (1H, s, 3(С)H ТГИ). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 22.02 (СH2); 22.75 (СH2); 22.95 (СH2); 23.28 (СH2); 25.07 (СH(CN)2); 29.58 (NMe); 41.86 (q, 30.3 Гц, СНCF3); 108.66 (3(С) ТГИ); 110.50 (CN); 110.71 (CN); 116.19; 118.04; 123.69 (q, 281.1 Гц, CF3); 131.20. Спектр 19F ЯМР (CDCl3, δ, ppm.): -68.31 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 281 [М]+ (2.45); 216 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C14H14F3N3, найдено m/z: 280.1076 [M - H]-. Вычислено: 280.1067.
(4b) 2-(2,2,2-Трифтор-1-(4,5,6,7-тетрагидро-1H-индол-2-ил)этил)малононитрил
Получено 3КР при 5°С: 0.155г, выход 39%, при -30°С: 0.3г, выход 75%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.74-1.84 (4H, m, 2CH2); 2.48-2.58 (4H, m, 2CH2); 4.00-4.07 (1H, m, CHCF3); 4.34 (1H, d, 4.8 Гц, CH(CN)2); 6.20 (1H, d, 2.4 Гц, 3(C)H ТГИ); 8.08 (1H, br. s., NH). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 22.56 (СH2); 22.60 (СH2); 23.05 (СH2); 23.44 (СH2); 25.22 (СH(CN)2); 44.79 (q, 30.3 Гц, CF3СН); 110.46 (CN); 110.60 (CN); 111.17 (3(C) ТГИ); 114.15; 118.38; 123.77 (q, 281.4 Гц, CF3); 130.64. Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.88 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 267 [М]+ (2.1); 202 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C13H12F3N3, найдено m/z: 266.0921 [M - H]-. Вычислено: 266.0911.
(4c) 2-(2,2,2-Трифтор-1-(1-метил-1H-пиррол-2-ил)этил)малононитрил
Получено 3КР при 5°С: 0.185г, выход 54%, при -30 оС: 0.24г, выход 71%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.2 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 3.65 (3H, s, NMe); 4.12-4.19 (1H, m, CHCF3); 4.33 (1H, d, 6.6 Гц, CH(CN)2); 6.23 (1H, m, Ar); 6.54 (1H, m, Ar); 6.74 (1H, m, Ar). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 25.12 (СH(CN)2); 33.99 (NMe); 41.91 (q, 30.6 Гц, CF3СН); 108.58; 110.16 (CN); 110.46 (CN); 110.75; 118.33; 123.52 (q, 280.7 Гц, CF3); 125.41. Спектр 19F ЯМР (CDCl3, δ, ppm.): -68.39 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 227 [М]+ (4.9); 162 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C10H8F3N3, найдено m/z: 226.0591 [M - H]-. Вычислено: 226.0598.
(6) Этил 2-(дицианометил)-3,3,3-трифтор-2-(1-метил-4,5,6,7-тетрагидро-1H-индол-2-ил)пропанат
Получено 3КР при 5°С: 0.03г, выход 6%; при -30°С: 0.05г, выход 9%; получено через алкен 10: 0.43г, выход 81%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.3 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.40 (3H, t, 7.1 Гц, Me); 1.70-1.83 (4H, м, 2CH2); 2.45-2.49 (4H, m, 2CH2); 3.34 (3H, s, NMe); 4.42-4.52 (2H, m, CH2); 4.57 (1H, s, CH(CN)2); 6.17 (1H, s, 3(C)Н ТГИ). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 13.78 (CH3); 22.33 (CH2); 22.72 (CH2); 22.95 (CH2); 23.13 (CH2); 29.39 (СH(CN)2); 31.23 (NMe); 64.54 (q, 30.1 Гц, CF3С); 64.94 (CH2); 109.84 (CN); 110.03 (CN); 111.52 (3(C) ТГИ); 115.94; 117.94; 123.20 (q, 280.2 Гц, CF3); 133.26; 164.67. Спектр 19F ЯМР (CDCl3, δ, ppm.): -65.30 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 353 [М]+ (3.7); 288 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C17H18F3N3O2, найдено m/z: 352.1270 [M - H]-. Вычислено: 352.1278.
(7) Этил 2-(дицианометил)-3,3,3-трифтор-2-(4,5,6,7-тетрпгидро-1H-индол-2-ил)пропанат
Получено 3КР при 5°С: 0.035г, выход 7%; при -30°С: 0.165г, выход 32%; получено через алкен 10: 0.39г, выход 77%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.5 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.43 (3H, t, 7.1 Гц, Me); 1.73-1.81 (4H, m, 2CH2); 2.45-2.56 (4H, m, 2CH2); 4.46-4.56 (2H, m, CH2); 4.76 (1H, s, CH(CN)2); 6.11 (1H, s, 3(C)H ТГИ); 8.45 (1H, br. s., NH). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 13.59 (СH3); 22.44 (СH2); 22.50 (СH2); 22.91 (СH2); 23.30 (СH2); 27.46 (СH(CN)2); 58.71 (q, 27.4 Гц, CF3С); 65.15; 109.93; 110.06 (CN); 110.15 (CN); 113.63; 118.38; 122.71 (q, 286.8 Гц, CF3); 131.19; 163.46. Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.37 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 339 [М]+ (3.3); 274 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C16H16F3N3O2, найдено m/z: 338.1121 [M - H]-. Вычислено: 338.1122.
(8) Этил 2-(дицианометил)-3,3,3-трифтор-2-(1-метил-1H-пиррол-2-ил)пропанат
Получено 3КР при 5°С: 0.0г, выход 0.0%; при -30°С: 0.0г, выход 0.0%; получено через алкен 10: 0.38г, выход 85%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.38 (3H, t, 7.1 Гц, Me); 3.62 (3H, s, NMe); 4.41-4.50 (2H, m, CH2); 4.70 (1H, s, CH(CN)2); 6.13 (1H, m, Ar); 6.65 (1H, m, Ar); 6.75 (1H, m, Ar). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 13.42 (Ме); 29.10 (NMe); 36.23 (СH(CN)2); 58.82 (q, 27.3 Гц, CF3С); 64.17; 106.99; 110.39; 110.40 (CN); 110.61 (CN); 121.93; 123.27; 123.35 (q, 285.2 Гц, CF3); 164.37. Спектр 19F ЯМР (CDCl3, δ, ppm.): -66.70 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 299 [М]+ (5.8); 234 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C13H12F3N3O2, найдено m/z: 298.0801 [M - H]-. Вычислено: 298.0809.
(9) Этил 2-(дицианометил)-3,3,3-трифтор-2-(1H-пиррол-2-ил)пропанат
Получено 3КР при 5°С: 0.025г, выход 6%; при -30°С: 0.103г, выход 24%; получено через алкен 10: 0.337г, выход 79%. Прозрачное светло-жёлтое медленно застывающее масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2). Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 1.41 (3H, t, 7.1 Гц, Me); 4.49-4.51 (2H, m, CH2); 4.83 (1H, s, CH(CN)2); 6.27 (1H, m, Ar); 6.41 (1H, m, Ar); 6.90 (1H, m, Ar); 9.07 (1H, br. s., NH). Спектр 13С ЯМР JMODECHO (CDCl3, δ, ppm., J/Гц): 13.49 (Ме); 27.49 (СH(CN)2); 58.56 (q, 27.6 Гц, CF3С); 65.40; 109.61; 109.95 (CN); 110.03 (CN); 110.81; 116.07; 121.70; 122.59 (q, 286.5 Гц, CF3); 163.26. Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.47 (CF3). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 285 [М]+ (5.4); 220 [M - СН(СN)2]+ (100). Масс-спектр высокого разрешения (ESI, отрицательные ионы), C12H10F3N3O2, найдено m/z: 284.0657 [M - H]-. Вычислено: 284.0652.
Благодарность
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации. Строение полученных соединений изучено с использованием оборудования «Центра исследования строения молекул» ИНЭОС РАН (Москва, РФ). Измерения масс-спектров высокого разрешения выполнены в Отделе структурных исследований ИОХ РАН (Москва, РФ). Для проведения данного исследования трифтор-ацетальдегида этил полуацеталь был предоставлен компанией P&M Invest.
Литература
- J. Wang, M. Sánchez-Roselló, J. L. Aceña, C. del Pozo, A. E. Sorochinsky, S. Fustero, V. A. Soloshonok, H. Liu, The importance of fluorine in the life science industry, Chem. Rev., <2013, 114, 2432–2506. DOI: 10.1021/cr4002879.
- E. P. Gillis, K. J. Eastman, M. D. Hill, D. J. Donnely, N. A. Meanwell, Fluorine in Pharmaceuticals: Looking Beyond Intuition, J. Med. Chem., 2015, 58, 8315–8359. DOI: 10.1021/acs.jmedchem.5b00258.
- J.-P. Bégué, D. Bonnet-Delpon, Recent advances (1995–2005) in fluorinated pharmaceuticals based on natural products, J. Fluorine Chem., 2006, 127, 992–1012. DOI: doi.org/10.1016/j.jfluchem.2006.05.006.
- O. Yu. Fedorovskii, N. D. Chkanikov, Three-component one-step synthesis of new nitriles – 3-(1H-indole-3-yl)-2-cyano-4,4,4-trifluorobutanoic acid, Fluorine Notes, 2021, 134, 3-4. DOI: 10.17677/fn20714807.2021.01.02.
- O. Yu. Fedorovskii, A. Yu. Volkonskii, A. S. Golubev, Yu. Ya. Spiridonov, N. D. Chkanikov, Synthesis of ethyl α-nitro-β-trifluoromethyl acrylate and β-trifluoromethyl-substituted tryptophan analogs and their plant growth regulating activity, Russian Chemical Bulletin, 2017, 66, 6, 1116-1121. DOI: doi.org/10.1007/s11172-017-1863-z.
- W. J. Middleton, 1,1-Dicyano-2,2-bis(trifluoromethyl)ethylene, J. Org. Chem., 1965, 30, 1402 – 1407.DOI: doi.org/10.1021/jo01016a013.
- N. D. Chkanikov and A. S. Golubev, C-Oxyalkylation of Arylamines, Enamines, and Nitrogen-Containing Heterocycles with Polyfluorinated Carbonyl Compounds as a Synthetic Route to Biologically Active Compounds, INEOS OPEN, 2021, 4 (1), 1–19. DOI: 10.32931/io2105r.
- Sigan Andrei L., Gusev Dmitrii V., Chkanikov Nikolai D., Shmidt Elena Yu, Ivanov Andrei V., Mihaleva Al’bina I., Hydroxyalkylation of 4,5,6,7-tetrahydroindole with polyfluorocarbonyl compounds as a route to 2-substituted indoles, Tetrahedron Letters, Elsevier BV (Netherlands), 2011, 52, 39, 5025-5028. DOI: doi.org/10.1016/j.tetlet.2011.07.071.
- V. Yu. Tyutin, N. D. Chkanikov, A. F. Kolomietz, A. V. Fokin, Synthessis of esters of 3,3-dicyano-2-(trifluoromethyl)acrylic acid and their reactions with arylamines, J. Fluorine Chem., 1991, 51, 323-334. DOI: doi.org/10.1016/S0022-1139(00)80188-8.
- Tsedilin A. M., Fakhrutdinov A. N., Eremin D. B., Zalesskiy S. S., Chizhov A. O., Kolotyrkina N. G., Ananikov V. P., How sensitive and accurate are routine NMR and MS measurements?, Mendeleev Comm., 2015, 25, 454. DOI: doi.org/10.1016/j.mencom.2015.11.019.
Статья рекомендована к публикации к.х.н. В.Л. Дон
Fluorine Notes, 2022, 140, 3-4


