Поступило в редакцию: Октябрь 2021
УДК 547.022
Fluorine Notes, 2021, 139, 1-2
СИНТЕЗ (ПЕРФТОРАЛКИЛ)ТРИГИДРОАЛЮМИНАТОВ ЛИТИЯ Li[RFAlH3]
A.A. Тютюновa, А.С. Перегудовa, С.М. Игумновa,b
aФедеральное государственное бюджетное учреждение науки Институт
элементоорганических соединений им. А.Н. Несмеянова Российской академии наук,
119991, ГСП-1,
Москва, В-334, ул. Вавилова, д. 28
bООО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
e-mail: tuytuynov@rambler.ru
Аннотация: Показано, что (перфторалкил)триметилсиланы взаимодействуют с LiAlH4 в эфирных растворителях с образованием (перфторалкил)тригидроалюминатов лития Li[RFAlH3], которые, в случае RF = C2F5 и н-C3F7, могут быть выделены в виде стабильных комплексов сольватированных эфирными растворителями, например Li[C2F5AlH3]2DME, Li[nC3F7AlH3]2DME.
Ключевые слова: литийалюминий гидрид, (перфторалкил)триметилсиланы, (перфторалкил)тригидроалюминаты лития.
Ранее нами было показано, что взаимодействие NaBH4 с CF3SiMe3 в растворе диглима не приводит к образованию Na[CF3BH3], а основным продуктом реакции является HCF2SiMe3 [1]. Действием NaBH4 или BH3 (полученный in situ реакцией NaBH4 + ClSiMe3) в растворе диглима на CF3B(OMe)2 или K[CF3B(OMe)3] получить (трифторметил)боргидриды нам также не удалось. Образующиеся в этих реакциях продукты оказались не устойчивыми и при выделении разлагались, причем в ряде случаев с сильными взрывами. Опубликованная недавно работа по синтезу (перфторалкил)боргидридов косвенно подтверждает наши результаты, причем в ней показано, что более стабильные (пентафторэтил)боргидриды калия и цезия, полученные в чистом виде, взрываются при трении [2].
Естественный вопрос, возникший в ходе изучения реакции RFSiMe3 с NaBH4, как аналогичная реакция будет осуществляться с LiAlH4? Мы показали, что реакция RFSiMe3 с LiAlH4 в эфирных растворителях приводит к образованию Li[RFAlH3] и HSiMe3 [3]. В настоящей работе представлены результаты этих исследований.
Оказалось, что после добавления CF3SiMe3 (1,1 экв.) к раствору LiAlH4 (1 экв.) в диглиме при комнатной температуре через несколько минут наблюдается сильная экзотермическая реакция. В случае проведения данной реакции и контролировании температуры реакционной смеси около 20°C в течение 5,5 часов анализ смеси методом ЯМР 1H показал, что в ходе реакции образуется HSiMe3 (ЯМР 1H, δ: 0,56 (д, 9H, 3JHH = 5 Гц, SiMe3), 4,44 (dec, 1H, HSi); ЯМР 29Si{1H} δ: -16 c) при этом конверсия CF3SiMe3 составляет 58% (через 24 ч конверсия CF3SiMe3 79%). В спектре ЯМР19F реакционной смеси наблюдается уширенный сигнал с максимумом при -175 м.д., указывающий на образование алюминийфторидных комплексов [4] (например, в [nBu4N][Me2AlF2] и Li[(Me3Si)3CAlF3]THF химические сдвиги атомов фтора -154 [5] и -169 м.д. [6] соответственно), а также остаточный синглетный сигнал непрореагировавшего CF3SiMe3 с δ=-67 м.д. Это согласуется со спектром ЯМР29Si{1H}, в котором присутствует соответствующий CF3SiMe3 сигнал с δ=5 (кв, 2JSiF = 37 Гц, CF3Si). Учитывая, что в спектре ЯМР1H реакционной смеси присутствуют несколько уширенных сильнопольных сигналов (δ: -0,7 и -0,75 м.д.) можно предположить, что в реакции, помимо HSiMe3, образуются литий алюминийгидрофторидные комплексы. В спектрах ЯМР7Li и 27Al характеристических сигналов ненаблюдается. Проведение данной реакции в растворе THF дает похожий результат. Конверсия CF3SiMe3 в HSiMe3 составляет: 8 часов – 36%; 32 часа – 55% и 56 часов – 63% и также образуются литий алюминийгидрофторидные комплексы с аналогичными спектральными характеристиками. После удаления в вакууме ТГФ вместе с летучими компонентами смеси (HSiMe3 и непрореагировавшего CF3SiMe3) остается твердый белый порошок, который активно реагирует с водой и метанолом. Масса остатка, а также низкое содержание фтора (5%), установленное с помощью элементного анализа, позволяет сделать предположение, что этот продукт Li[AlFH3], который содержит непрореагировавший LiAlH4 и сольватный ТГФ, вероятно, получившийся в результате разложения первоначально образующегося Li[CF3AlH3]. Очистка и идентификация, образующихся в ходе данной реакции литий алюминийгидрофторидных комплексов, не осуществлялась.
В противоположность этому C2F5SiMe3 взаимодействует c LiAlH4 в растворе диглима практически без разогрева. По данным ЯМР1H и 29Si{1H} в результате реакции образуется HSiMe3, а в спектре ЯМР19F помимо сигналов исходного C2F5SiMe3 (δ: -132 (c, 2F, CF2), -82 (c, 3F, CF3); ЯМР29Si{1H} δ: 7,8 (т, 2JSiF = 27 Гц, CF2Si)) наблюдаются сигналы продукта реакции, содержащего C2F5-группу (δ: -126 (уш.c, 2F, CF2Al), -84 (c, 3F, CF3)), являющегося, как мы предположили, ate комплексом Li[C2F5AlH3], что согласуется с данными ЯМР27Al, в спектре которого присутствует сигнал с δ=116 (уш.д, CF2Al). Однако, судя по спектрам ЯМР1H, 19F, 27Al и 29Si оказалось, что C2F5SiMe3 (1,1 экв.) реагирует c LiAlH4 (1 экв.) в диглиме при температуре ~20°C в течение нескольких суток с неполной конверсией равной ~70%. Указанное обстоятельство существенно затрудняет выделение комплекса Li[C2F5AlH3] в чистом виде, из-за присутствия в растворе непрореагировавшего LiAlH4. Это подтверждает спектр ЯМР27Al с δ = 102 м.д., уш.c (мультиплетность сигнала, который должен представлять собой квинтет, не наблюдается, вероятно, вследствие влияния растворителя [7-8]). Поэтому нами было исследовано влияние природы растворителя, соотношения реагентов и времени проведения реакции на степень конверсии исходных соединений (см. Таблицу).
|
№ опыта |
Растворитель |
Конверсия C2F5SiMe3*, % (Время, ч) |
||
|
1 |
Diglyme |
34 (6) |
69 (28) |
74 (72) |
|
2 |
DME |
36 (8) |
56 (32) |
61 (72) |
|
3 |
DME C2F5SiMe3 (3 eq.) |
65 (7) |
81 (31) |
91 (100) |
|
4 |
DME C2F5SiMe3 (5 eq.) |
- |
- |
94 (90) |
|
5 |
THF |
47 (7,5) |
- |
66 (79) |
|
6 |
Et2O |
17 (7) |
- |
24 (79) |
|
7 |
1,4-Dioxane |
0 (6) |
0 (30) |
- |
|
8 |
HMDSO |
- |
0 (24) |
- |
|
9 |
NEt3 |
- |
0 (24) |
- |
|
10 |
TMEDA |
- |
0 (24) |
- |
|
*Степень конверсии C2F5SiMe3 определялась по совокупности данных спектров ЯМР 1H (соотношение сигналов с δ= 0,80 (C2F5SiMe3) и 0,57 (HSiMe3)) и ЯМР 19F (соотношение сигналов с δ= -126 (LiC2F5AlH3) и -132 (C2F5SiMe3)), а также по спектру ЯМР 27Al фиксировалось количество непрореагировавшего LiAlH4 (соотношение сигналов с δ= 116 (LiC2F5AlH3) и 102 (LiAlH4)). |
||||
Из приведенных данных видно, что реакция одинаково хорошо осуществляется в сильно сольватирующих донорных эфирных растворителях диглиме, моноглиме и THF (опыты 1-5). Между тем в диэтиловом эфире наблюдается существенно меньшая конверсия (пентафторэтил)триметилсилана за аналогичное время (опыт 6). В свою очередь в 1,4-диоксане C2F5SiMe3 c LiAlH4 не реагирует, вероятно, в следствии очень низкой растворимости LiAlH4 (растворимость LiAlH4 в 1,4-диоксане при 25°C 0,1 г в 100 г [9]). Реакции не наблюдается и при использовании в качестве растворителей гексаметидисилоксана, триэтиламина и TMEDA должно быть по аналогичной причине (Таблица 1, опыты 8-10). С точки зрения удобства выделения комплекса Li[C2F5AlH3] наиболее подходят сравнительно низко кипящие растворители: THF и моноглим. Так, мы показали, что при проведении реакции в моноглиме, для того чтобы достичь практически полной конверсии LiAlH4, необходим большой (3-5 экв.) избыток C2F5SiMe3 и увеличение продолжительности времени реакции до 5 суток (опыты 3-4). Дальнейшее увеличение времени реакции до 9 суток приводит к накоплению побочно образующихся фторсодержащих примесей, содержание которых в выделенном продукте повышается с ~2% (если реакцию проводить 5 суток) до 12% (за время реакции 9 суток). В результате осуществления реакции в оптимальных условиях, последующего удаления летучих компонентов смеси в вакууме и толуольной очистки продукта, был получен сольватированный комплекс Li[C2F5AlH3]2DME, а также аналогично получен комплекс Li[C2F5AlH3]2ТHF.
Следует отметить, что провести данную реакцию с небольшим избытком (пентафторэтил)триметилсилана до полной конверсии LiAlH4, сдвигая равновесие в сторону образования продуктов путем отгонки легкокипящего HSiMe3 (Т.кип. 7°C), нам не удалось. Реакция практически останавливается на 70-80% конверсии и только при использовании большого избытка C2F5SiMe3 (>3 экв.) удается добиться высокой степени конверсии LiAlH4.
Эфирные растворители (Et2O, THF) можно практически полностью удалить из их комплексов с LiAlH4 нагреванием в динамическом вакууме ~0,5 Торр при температуре 60-70°C [9-10]. Однако попытка удаления растворителя из Li[C2F5AlH3]2DME, нагреванием его в динамическом вакууме <0,5 Торр при температуре 55-60°C, приводит к разложению этого комплексного гидрида с сильным взрывом (температура разложения LiAlH4 >100-150°C [9-10]).
Синтезированный таким образом Li[C2F5AlH3]2DME представляет собой бесцветную жидкость, имеющую следующие спектральные характеристики. Cигнал гидридных протонов в спектре ЯМР 1H проявляется в виде широкого синглета с δ = 3,5 м.д. (в комплексе с THF сигнал более острый c δ = 3,2 м.д.), что достаточно близко значению химического сдвига протонов в LiAlH4 (δ = 2,9 м.д., раствор в DME) [11]. В спектре ЯМР 19F наблюдаются две пары сигналов соответствующих C2F5-группе (δ: -126 (уш.c, 2F, CF2Al), δ 83,8 (c, 3F, CF3) и δ: -128 (уш.c, 2F, CF2Al), -84 (c, 3F, CF3), с соотношением 2,5:1. Соответственно, в спектре ЯМР 13С присутствуют два сигнала CF3-групп, проявляющихся в виде квартетов триплетов на ~123 м.д. (1JCF = 283 Гц, 2JCF = 30 Гц) и сильно уширенный триплет на 132 м.д., соответствующий CF2-группе, связанной с атомом алюминия. В спектрах ЯМР 7Li и 27Al присутствуют синглет -0,7 м.д. и сильно уширенный синглет 117 м.д. соответственно. В случае регистрации спекторов ЯМР 19F и 27Al в разбавленном растворе в моноглиме вид спектров становится похожим на спектры реакционной смеси. А именно, во фторном спектре наблюдается практически только одна C2F5-группа с химическими сдвигами (δ: -126 (уш.c, 2F, CF2Al), -84,3 (c, 3F, CF3)) (содержание второй пары сигналов от C2F5-группы уменьшается с 25% до 6%), а в спектре ЯМР27 Al – сильно уширенный квартет на 117 м.д. (1JAlH = ~170 Гц) (для сравнения КССВ 27Al-1H в анионе AlH4- 170-175 Гц [10]).
При хранении в запаянной ампуле в течение нескольких недель жидкий комплекс Li[C2F5AlH3]2DME превращается в кристаллически подобный продукт, однако на самом деле он становится гелеобразным. КР спектры жидкого комплекса и образовавшегося спустя 2 недели гелеобразного вещества идентичны, что говорит о том, что изменение агрегатного состояния происходит не в результате разложения комплекса. При замораживании жидкого комплекса в холодильнике (~ -25°C) он превращается в белое на вид кристаллическое вещество, которое может хранится длительное время без видимого разложения.
В присутствии хелатирующих аминов, таких как TMEDA или DABCO, в эфирных растворителях Li[C2F5AlH3] разлагается, поэтому нам не удалось получить комплексов типа LiAlH4-TMEN [11] (TMEN = TMEDA), хотя триэтиламин в этих условиях с Li[C2F5AlH3] не реагирует.
(н-Гептафторпропил)триметилсилан взаимодействует с LiAlH4 аналогичным образом. В тоже время, при осуществлении реакции nC3F7SiMe3 c LiAlH4, в оптимальных условиях (DME, 5 экв. силана, 5 сут.), наблюдается заметное снижение выхода Li[nC3F7AlH3]2DME до 77% и увеличение количества побочных фторсодержащих продуктов до 7-12%. Полученный н-гептафторпропильный комплекс – Li[nC3F7AlH3]2DME является также жидким со спектральными характеристиками аналогичными комплексу с C2F5-группой.
При дальнейшем увеличении длины перфторалкильного радикала начинают доминировать реакции, приводящие к побочным фторсодержащим продуктам. Так, при взаимодействии nC6F13SiMe3 с LiAlH4 в ТГФ в течение 2 сут. наблюдается, судя по спектрам ЯМР 1H, 19F и 27Al, образование соответствующего (н-перфторгексил)тригидроалюминатного комплекса с выходом ~30%. Однако в ходе дальнейшего проведения реакции в реакционной смеси начинают появляться значительные количества побочных продуктов, что делает невозможным выделение комплекса Li[nC6F13AlH3]2THF в чистом виде.
Подобные изменения в реакционной способности (перфторалкил)триметилсиланов, связанные с длиной перфторалкильного радикала, наблюдались и ранее. Так, известно, что CF3SiMe3 и C2F5SiMe3 практически количественно перфторалкилируют B(OMe)3 в присутствии KF в растворе ТГФ или диглима с образованием соответствующих боратных солей. В тоже время nC3F7SiMe3 взаимодействует c B(OMe)3 в аналогичных условиях с образованием K[nC3F7B(OMe)3] с очень низким выходом [12].
Из литературы известно, что Na[EtAlH3] в растворе не стабилен и находится в равновесной смеси с продуктами диспропорционирования – NaAlH4 и Na[Et2AlH2], что установлено по спектру ЯМР27Al, в котором присутствуют три сигнала, соответствующие этим соединениям [13]. В отличие от этильного аналога Na[iBuAlH3] стабилен и может быть получен реакцией NaAlH4 с NaAliBu4 или AliBu3 [13]. Описаны и другие примеры алкил- и арилтригидроалюминатов лития, стабильность которых определяется стерическим объемом алифатического или ароматического заместителя при атоме алюминия, например Li[(Me3Si)3CAlH3] и Li[(Me2PhSi)3CAlH3] [14], а также Li[(2,4,6-iPr3C6H2)AlH3] и Li[(2,4,6-tBuC6H2)AlH3] [15].
В ходе данной работы нами установлено, что Li[C2F5AlH3] и Li[nC3F7AlH3], сольватированные DME или ТГФ, являются достаточно стабильными соединениями и могут быть получены в чистом виде из соответствующих (перфторалкил)триметилсиланов и LiAlH4 с хорошими выходами. В этой реакции RFSiMe3 реагируют с LiAlH4 подобно алифатическим производным щелочных, щелочноземельных металлов, Zn, Cd, B и Al [9]. Однако выделить в чистом виде (перфторалкил)тригидроалюминаты лития с CF3- и nC6F13-группами нам не удалось, вероятно, вследствие их нестабильности в условиях синтеза. Интересно отметить, что недавно одновременно было опубликовано две работы, посвященные синтезу тетракис(пентафторэтил)алюминатного аниона – [Al(C2F5)4]- [16, 17], который, по мнению авторов, является первым охарактеризованным перфторалкильным производным алюминия со связью RF-Al. Причем один из методов синтеза Li[(C2F5)4Al] – нестабильной в эфирном растворе или в твердом виде, сольватированной Et2O соли – заключался в реакции (C2F5)3SiMe или (C2F5)3SiH с LiAlH4, которая приводила исключительно к тетракис-замещенному продукту и соответствующим гидросиланам [16]. В случае обнаруженной нами реакции C2F5SiMe3 c LiAlH4 образования поли-C2F5-замещенных алюминатов не наблюдается.
Таким образом, впервые продемонстрирована принципиальная возможность синтеза стабильных перфторалкильных производных алюминия путем замены заместителя в координационной сфере тетраэдрического аниона алюминия на перфторалкильную группу, что открывает перспективу дальнейшего изучения свойств этого, пока еще экзотического, класса соединений. Несмотря на то что, первая, наиболее естественная мысль использовать Li[C2F5AlH3]2DME для синтеза (пентафторэтил)алкоксиалюминатов лития в полной мере нами не реализована, поскольку реакции со спиртами приводят к частичному замещению C2F5-группы с образованием трудноразделимой смеси продуктов. Однако, возможно, при замене Li-катиона на стерически объемные органические катионы, например PNP или EtP4H (как в работе [16]), удастся синтезировать анионы вида [C2F5Al(OR)3]-.
Экспериментальная часть
Спектры ЯМР на ядрах 1H; 13C; 19F; 27Al; 29Si и 7Li записаны на спектрометрах «Bruker AM-300», «Bruker AVANCE-400», «Bruker AVANCE-500» и «Bruker AVANCE-600» с рабочими частотами по 1H 300,13, 400,13, 500,13 и 600,22 МГц, соответственно. Частоты других ядер, в зависимости от используемого прибора, приведены в экспериментальной части ниже при описании спектров ЯМР соответствующих соединений. Химические сдвиги в спектрах ЯМР 1H измерены относительно остаточного сигнала хлороформа в CDCl3 (7,26 м.д.) и приведены в м.д. относительно ТМС. Химические сдвиги в спектрах ЯМР 13C измерены относительно сигнала ядра 13С CDCl3 (77,0 м.д.) и приведены в м.д. относительно ТМС. Химические сдвиги в спектрах ЯМР 19F определены в м.д. относительно внешнего CFCl3. Химические сдвиги в спектрах ЯМР 27Al определены в м.д. относительно внешнего Al(NO3)3. Химические сдвиги в спектрах ЯМР 29Si определены в м.д. относительно ТМС. Химические сдвиги в спектрах ЯМР 7Li определены в м.д. относительно LiCl. Положительные значения ХС соответствуют сдвигу сигнала индикаторного ядра в слабое поле. Спектры комбинационного рассеяния записаны на спектрометре Jobin Yvon LabRam. Элементный анализ выполнен в Лаборатории микроанализа ИНЭОС РАН.
Все опыты проводили в инертной атмосфере, применяя абсолютные растворители и стандартные приемы работы. Перед использованием коммерчески доступный LiAlH4 очищали стандартным способом [9]: растворяли в Et2O, не растворившийся серый остаток отстаивали, прозрачный раствор отделяли, упаривали в вакууме досуха или до концентрированного раствора, из которого гидрид высаживали добавлением толуола и отделяли фильтрованием, полученный белый порошок LiAlH4 сушили при 60-65С (<0,5 Торр). (Перфторалкил)триметилсиланы: CF3SiMe3, C2F5SiMe3, nC3F7SiMe3 и nC6F13SiMe3 получены нами разработанным ранее способом [18-19].
Для анализа реакционных смесей около 0,3 мл реакционного раствора запаивали в стеклянную ампулу (диаметром ~3 мм и длиной 110-130 мм). Затем ампулу помещали в стандартную 5 мм ЯМР ампулу, добавляли в качестве внешнего стандарта CDCl3 и реакционную смесь анализировали методом ЯМР.
Li[C2F5AlH3]2DME.
К 1 г (0,026 моль) LiAlH4 в 50 мл DME прибавляют 25 г (0,13 моль) C2F5SiMe3 и смесь перемешивают в течение нескольких часов до гомогенного раствора, после чего оставляют стоять при комнатной температуре в течение 5 суток, периодически перемешивая раствор. Далее летучие компоненты смеси отгоняют в вакууме <0,5 Торр в ловушку, получая белый твердый остаток, который при продолжительном высушивании в вакууме <0,5 Торр начинает превращаться в жидкость.
К остатку добавляют 20 мл толуола и смесь перемешивают до растворения и образования жидкой двухфазной смеси, из которой в вакууме <0,5 Торр отгоняют растворитель и жидкий остаток сушат несколько часов в вакууме <0,5 Торр. Получают в результате 7,8 г бесцветной жидкости (выход 90%).
Найдено %: C, 35,52; H, 6,73. C10H23AlF5LiO4. Вычислено (%): C, 35,73; H, 6,90.
ЯМР 1H (500,13 МГц) δ: 3,45-3,65 (уш.с, 3H, AlH3), 3,95 (c, 12H, OCH3), 4,14 (c, 8H, CH2CH2); ЯМР 19F (470,59 МГц) δ: две пары сигналов -128 (с, 2F, CF2), -84 (c, 3F, CF3) и -126 (уш.c, 2F, CF2), -83,8 (c, 3F, CF3) с соотношением 1:2,5;
ЯМР 13С{1H} (125,75 МГц) δ: 59 (с, CH3O), 70 (c, CH2O), 123 (кв.т., 1JCF = 283 Гц, 2JCF = 30 Гц, CF3), 132 (уш.т., CF2Al);
ЯМР 27Al (104,26 МГц) δ: 117 (уш.с);
ЯМР 7Li (155,5 МГц) δ: -0,66 (c).

Спектр комбинационного рассеяния Li[C2F5AlH3]2DME.
Li[nC3F7AlH3]2DME.
Получен аналогично Li[C2F5AlH3]2DME. Бесцветная вязкая жидкость, при -25°C частично затвердевает.
Найдено %: C, 34,21; H, 6,26. C11H23AlF7LiO4. Вычислено (%): C, 34,21; H, 6,00.
ЯМР 1H (500,13 МГц) δ: 3,45-3,65 (уш.с, 3H, AlH3), 3,9 (c, 12H, OCH3), 4,1 (c, 8H, CH2CH2); ЯМР 19F (282,4 МГц) δ: в области CF2-групп две пары сигналов -128 (с, 2F, CF2CF2Al), -126,3 (с, 2F, CF2CF2Al) и -126,6 (с, 2F, CF2CF2Al), -126,1 (с, 2F, CF2CF2Al) с соотношением 1:4, -81,3 (с, 3F, CF3);
ЯМР 13С{1H} (125,75 МГц) δ: 59 (с, CH3O), 70 (c, CH2O), 112 (т.кв., 1JCF = 251 Гц, 2JCF = 28 Гц, CF2), 119 (кв.т., 1JCF = 288 Гц, 2JCF = 38 Гц, CF3), 135 (уш.т., CF2Al);
ЯМР 27Al (104,26 МГц) δ: -117 (уш.с);
ЯМР 7Li (155,5 МГц) δ: -0,64 (c).
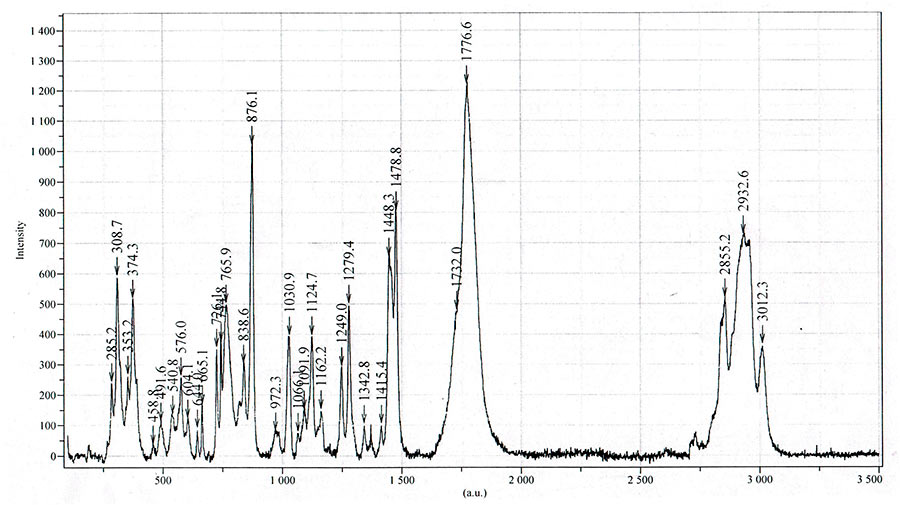
Спектр комбинационного рассеяния Li[nC3F7AlH3]2DME
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Литература
- A.A. Tyutyunov, V.E. Boyko, S.M. Igoumnov, Fluorine Notes, 2011, 1(74).
- P.T. Hennig, J.A.P. Sprenger, L.N. Schneider, N.V. Ignat’ev, M. Finze, Chem. Commun., 2019, 55, 6110-6113.
- Результаты исследований представлены на 57-м традиционном конкурсе научно-исследовательских работ ИНЭОС РАН, 2012.
- J. Pinkas, H.W. Roesky, J. Fluor. Chem., 2003, 122, 125-150.
- H.W. Roesky, A. Stasch, H. Hatop, C. Rennekamp, D.H. Hamilton, M. Noltemeyer, H.-G. Schmidt, Angew. Chem. In. Ed., 2000, 39, 171-173.
- A.G. Avent, W.-Y. Chen, C. Eaborn, I.B. Gorrell, P.B. Hitchcock, J.D. Smith, Organometallics, 1996, 15, 4343-4345.
- H. Noth, R. Rurlander, P. Wolfgardt, Zeitschrift fur Naturforschung B, 1980, 35, 31-41.
- H. Noth, Zeitschrift fur Naturforschung B, 1980, 35, 119-124.
- E.C. Ashby, Adv. Inorg. Chem. Radiochem., 1966, 8, 283-335.
- V.P. Tarasov, G.A. Kirakosyan, Russ. J. Inorg. Chem., 2008, 53, 2048-2081.
- M.M. Andrianarison, A.G. Avent, M.C. Ellerby, I.B. Gorrell, P.B. Hitchcock, J.D. Smith, D.R. Stanley, J. Chem. Soc., Dalton Trans., 1998, 249-254.
- N.Yu. Adonin, V.V. Bardin, H.-J. Frohn, Z. Anorg. Allg. Chem., 2007, 633, 647-652.
- V.V. Gavrilenko, M.I. Vinnikova, V.A. Antonovich, L.I. Zakharkin, Bull. Acad. Sci. USSR, Div. Chem. Sci., 1982, 31, 2084-2087.
- C. Eaborn, I.B. Gorrell, P.B. Hitchcock, J.D. Smith, K. Tavakkoli, Organometallics, 1994, 13, 4143-4144.
- R.J. Wehmschulte, J.J. Ellison, K. Ruhlandt-Senge, P.P. Power, Inorg. Chem., 1994, 33, 6300‑6306.
- N. Tiessen, B. Neumann, H.-G. Stammler, B. Hoge, Chem. Eur. J., 2020, 26, 13611-13614.
- L.A. Bischoff, J. Riefer, R. Wirthensohn, T. Bischof, R. Bertermann, N.V. Ignat’ev, M. Finze, Chem. Eur. J., 2020, 26, 13615-13620.
- S.M. Igoumnov, V.K. Men’shikov, V.E. Boyko, A.A. Tyutyunov, S.R. Sterlin, Fluorine Notes, 2012, 6(85).
- V.E. Boyko, A.A. Tyutyunov, V.L. Don, S.M. Igoumnov, Fluorine Notes, 2013, 6(91).
Статья рекомендована к публикации членом редколлегии к.х.н. М. А. Манаенковой
Fluorine Notes, 2021, 139, 1-2


