Получение взаимодействием фторированных спиртов с диазометаном, присоединением полифторалкилиодидов к алкенам..."
Поступило в редакцию: Октябрь 2021
УДК 547.221
Fluorine Notes, 2021, 138, 7-8
ФТОРСОДЕРЖАЩИЕ ПРОСТЫЕ ЭФИРЫ.
СООБЩЕНИЕ 2. ПОЛУЧЕНИЕ ВЗАИМОДЕЙСТВИЕМ ФТОРИРОВАННЫХ СПИРТОВ С ДИАЗОМЕТАНОМ, ПРИСОЕДИНЕНИЕМ ПОЛИФТОРАЛКИЛИОДИДОВ К АЛКЕНАМ, МЕЖМОЛЕКУЛЯРНОЙ ДЕГИДРАТАЦИЕЙ, ПРИСОЕДИНЕНИЕМ ПЕРФТОРАЛКИЛГИПОГАЛОГЕНИТОВ К АЛКЕНАМ И ПИРОЛИЗОМ ПРОИЗВОДНЫХ ПЕРФТОР-2-АЛКОКСИПРОПИОНОВЫХ КИСЛОТ
С.В. Вершилова, В.В. Корнилов, А.С.Цырульниковаа,в, Л.М.Поповаа,в, Н.В.Лебедева
а ФГУП «Научно-исследовательский институт синтетического каучука им. Академика С.В.Лебедева», ул. Гапсальская 1, Санкт-Петербург, 198035, Россия
в Санкт-Петербургский политехнический университет Петра Великого, ул. Новороссийская 48, Санкт-Петербург, 194021 Россия
Аннотация: Во второй части обзора рассмотрено получение фторсодержащих простых эфиров взаимодействием фторированных спиртов с диазометаном, присоединением полифторалкилиодидов к алкенам, межмолекулярной дегидратацией, присоединением перфторалкилгипогалогенитов к алкенам и пиролизом производных перфтор-2-алкоксипропионовых кислот. Приведены условия синтезов и возможные механизмы реакций для отдельных методов.
Ключевые слова: диазометан, перфторалкилиодиды, фторсодержащие спирты, межмолекулярная дегидратация, перфторалкилгалогениты, перфтор-2-алкоксипропионовые кислоты, перфторалкилвиниловые эфиры.
Введение
В первой части обзора [1] были описаны два общих метода получения фторсодержащих простых эфиров – алкилирование спиртов (алкил- и алкенилгалогенидами, алкилсульфатами и алкилсульфонатами) и присоединение спиртов к алкенам и алкинам.
В настоящей статье рассмотрены ряд других методов получения фторсодержащих простых эфиров, а именно:
- взаимодействие фторированных спиртов с диазометаном,
- присоединение полифторалкилиодидов к алкенам
- реакции межмолекулярной дегидратации,
- присоединение перфторалкилгипогалогенитов к алкенам
- пиролиз производных перфтор-2-алкоксипропионовых кислот
Часть этих методов имеют преимущественно лабораторное применение. Другие, как например пиролиз производных перфтор-2-алкоксипропионовых кислот, имеют широкое применение в промышленности.
1. Получение метилфторалкиловых простых эфиров реакцией фторсодержаших спиртов с диазометаном
Одно их первых упоминаний о реакции фторсодержащих спиртов с диазометаном встречается работе А. Хенне и М. Смука в 1950 г. [2]. Авторы осуществили взаимодействие 2,2,2-трифторэтилового эфира с диазометаном, который был растворен в петролейном эфире. Реакцию проводили при температуре минус 10°С до полного исчезновения желтого цвета раствора. В результате реакции был получен соответствующий метил-2,2,2-трифторэтиловый эфир с выходом 27%.
CF3CH2OH + CH2N2 → CF3CH2OCH3.
Добавление в процесс Al(O-i-Pr)3 (Aluminium isopropoxide) в качестве “кислого” катализатора позволяло повысить выход до 75%, однако полученный продукт содержал трудно отделяемую примесь углеводорода. Применение других растворителей, в частности бициклогексила, позволяло только незначительно увеличить выход эфира (30%).
Х. Адольф и М. Камлет [3] описали взаимодействие раствора диазометана в эфире с 2,2-динитро-2-фторэтанолом. Продуктом реакции являлся ожидаемый 2,2-динитро-2-фторэтил метиловый эфир. Авторы отметили, что 2,2-динитро-2-фторэтанол активно реагировал с диазометаном в эфире только присутствии эфирата трифторида бора как катализатора, при этом конверсия спирта и выход целевого метилового эфира (т.кип. 45°С, 3 мм рт ст) были низкими.
В работе А.Ф. Елеева и В.Ф. Черсткова с соавторами [4] рассмотрены реакции перфторпинакона с растворенным в диэтиловом эфире диазометаном при комнатной температуре. Авторами были получены как монометиловый (т.кип. 135°C, выход 85%), так и диметиловый (т.пл. 50-51°С, выход 60%) эфиры перфторпинакона.
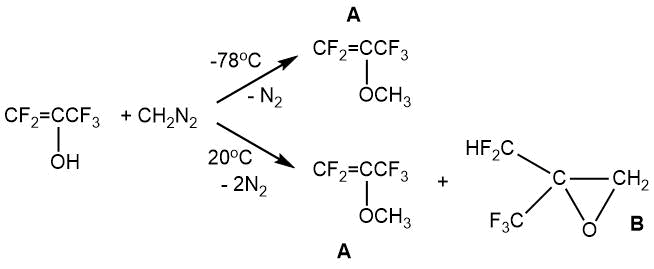
Взаимодействие пентафторпропен-2-ола (в енольной форме) с диазометаном в дибутиловом эфире по сообщению И.Л. Кнунянца с соавт. [5] приводило к различным продуктам в зависимости от условий проведения синтеза. Так при температуре минус 78°С с выходом 45% получали пентафтор-изо-пропенилметиловый эфир «A» (т.кип. 32), а при 20°С – смесь пентафтор-изо-пропенилметилового эфира «A» и оксирана «B» (60 и 40%, по данным ГЖХ).
2. Присоединение полифторалкилиодидов к алкенам
Использование перфторалкилиодидов в реакциях с алифатическими ненасыщенными эфирами позволяет вводить перфторалкильный фрагмент в субстрат, уже имеющий простую эфирную связь.
Так в статье 1992 г. К. Дапремонт и К. Аматора [6] исследована реакция присоединения н-перфторбутил иодида (C4F9I) к нефторированному виниловому эфиру при электрохимической активации с получением соответствующего эфира с выходом 89%.
n-C4F9I + CH2=CHOC4H9 → n- C4F7CH2CHIOC4H9
В патенте М. Кнелла и Н. Брейса [7] описано присоединение 1-иодоперфторгептана к аллил-н-пропиловому эфиру с получением н-пропил 2-иодо-1,1,2,3,3-пентагидроперфтордецилового эфира в присутствии азобисизобутиронитрила (АИБН) в качестве инициатора. Обработка реакционной смеси в течение 12 часов при температуре 70°С приводила к целевому продукту с выходом 71%.
n-C7F15I + CH2=CHCH2OC3H7 → n-C7F15CH2CHICH2OC3H7
Подобным образом, Н. Брейсом [8] был получен продукт присоединения 1-иодоперфторбутана к аллил-перфтор-изо-пропиловому эфиру (инициатор АИБН) с выходом 75%.
n-C4F9I + CH2=CHCH2OCF(CF3)2 → n- C4F9CH2CHICH2OCF(CF3)2.
Присоединение перфторалкилиодида по аллильному фрагменту полиэтиленгликолей при более высокой температуре (170°С) было осуществлено Х. Мейнертом с соавт. [9].
C6F13I + CH2=CHCH2OR → C6F13CH2CHICH2OR
R = CH3(OC2H4)m, где m=7,12,17
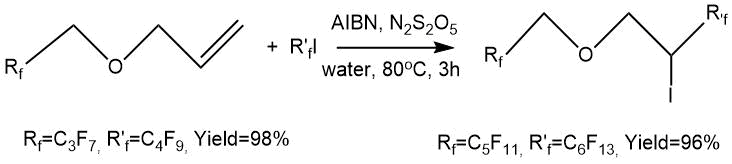
Д. Лаззари с сотр. [10] провели синтез ряда фторсодержащих эфиров «блочного» строения, в частности 2,2,3,3,4,4,4—гептафторбутил 4,4,5,5,6,6,7,7,7-нонафторгептилового и 4,4,5,5,6,6,7,7,8,8,9,9,9-тридекафторнонил 2,2,3,3,4,4,5,5,6,6,6-ундекафторгексилового эфиров.
Указанные эфиры получали по реакции аллил полифторалкиловых эфиров с перфторалкилиодидами (С4F9I,
C6F13I) с последующим деиодированием. Реакции проводили в водной среде
в присутствии инициирующей системы (Na2S2O5, АИБН) при умеренной
температуре (80°C). Продолжительность синтезов составляла 3 часа. Выход аддуктов был высоким
(95–98%).
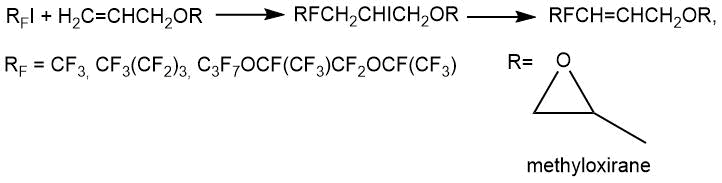
В.И.Салоутин с соавт. [11] проводили перфторалкилирование глицидилового эфира перфторалкилиодидами
в водном ацетонитриле в присутствии Na2S2O4 (атмосфера аргона,
0-5°C, 1 ч, выход 68-75%).
3. Получение фторсодержащих простых эфиров методом межмолекулярной дегидратации спиртов
Фторсодержащие спирты менее склонны к образованию простых эфиров под действием дегидратирующих агентов, чем их не содержащие фтор аналоги. А. Хенне и М. Смук в своей работе [2] сообщали о неудачной попытке получения фторсодержащих простых эфиров межмолекулярной дегидратацией спиртов на примерах 2,2,2-трифторэтанола и 3,3,3-трифторпропанола.
В статье В.А. Комарова с соавт. [12] также было отмечено, что действие серной кислоты или фосфорного ангидрида на 2,2-дифтор-2-нитроэтанол не приводило к образованию соответствующего эфира.
Однако, в ряде случаев фторсодержащие спирты могут реагировать с другими спиртами в присутствии дегидратирующих средств, таких как концентрированная серная кислота (H2SO4), метансульфоновая кислота (CH3SO3H), п-толуолсульфоновая кислота или ледяная уксусная кислота.
Так Х. Мураматсу с сотр. [13] получили этиловые эфиры моно- (т.кип. 75-76°С), ди- (т.кип. 66-67°С) и трифторэтанола (т.кип. 50-51°С,) с умеренными выходами при нагревании этанола и соответствующего фторсодержащего спирта в присутствии серной кислоты.
RFCH2OH + C2H5OH → RFCH2OC2H5,
RF = H2FC- (Выход 30%), HCF2- (Выход 55%), CF3- (Выход 18%).
В работе [14] описано взаимодействие 2,2-динитро-2-фторэтанола с 1-бром-1,1,4-тринитро-4-азапентанолом-5 в присутствие концентрированной серной кислоты (94%) при 0-10°С в течение 2 ч. Реакция приводила к получению несимметричного простого эфира (т.пл. 50-53°С) с выходом 70%.
FC(NO2)2CH2OH + R-N(NO2)CH2OH → FC(NO2)2CH2OCH2N(NO2)-R,
R- = BrC(NO2)2CH2CH2-.
Как было отмечено авторами цитируемой работы, преимущественное образование несимметричного эфира происходило при использовании избытка 2,2-динитро-2-фторэтанола и концентрации серной кислоты 80–90%. В случае эквимолярных количеств реагентов образовывалась смесь симметричных и несимметричного эфиров.
В работе В.В. Коршака с сотр. [15] было отмечено, что третичные винилэтинилкарбинолы в присутствии минеральных кислот образовывали со спиртами простые эфиры легче, чем первичные спирты. Было показано, что при взаимодействии диметилвинилэтинилкарбинола с рядом полифторированных спиртов (H2SO4, 20-40°С, 20 ч) получались соответствующие полифторалкиловые эфиры с умеренным выходом (40-60%).
CH2=CH-C≡C-C(CH3)2OH + HOCH2(CF2)nH → CH2=CH-C≡C-C(CH3)2OCH2(CF2)nH.
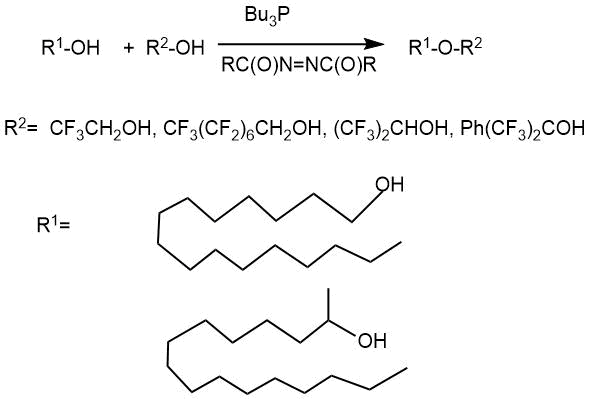
Модифицированный Дж. Фальком с сотр. [16] вариант конденсации Митсунобу, открыл возможность получения несимметричных полифторсодержащих простых эфиров конденсацией спиртов с полифторированными первичными, вторичными и третичными спиртами в относительно мягких условиях. Конденсация нефторированного и полифторированного спиртов в безводном бензоле в присутствии 1,1’-(азодикарбонил)дипиперидина (ADDP) и три-трет-бутилфосфина (Bu3P) приводила к целевым эфирам с выходом от среднего (33-55%) до высокого (83- 96%) в зависимости от строения нефторированного спирта.
4. Присоединение перфторалкилгипогалогенитов к алкенам
Одним из первых сообщений о взаимодействии перфторалкилгипогалогенитов с алкенами является статья Р. Портера и Д. Кэди, опубликованная в 1957 г. [17]. Попытки получения трифторметил пентафторэтилового эфира реакцией трифторметилгипофторита с тетрафторэтиленом были неудачными. В результате реакции получался либо твердый полимер, либо смесь оксида углерода и тетрафторметана.
В то же время использование менее реакционноспособного перфторциклопентена привело к получению целевого перфтор(метоксициклопентана) с почти количественным выходом.

В 1959 г. в статье Д. Алисона и Д. Кэди [18] было описано взаимодействие трифторметилгипофторита с этиленом с получением трифторметил 2-фторэтилового эфира. Для успешного проведения реакции с выходом близким к количественному требовалось четырехкратное разбавление этилена азотом и облучение УФ в течение 12 часов.
CF3OF + CH2=CH2 → CF3-O-CH2CH2F
При отсутствии разбавления смешение исходных реагентов приводило к взрыву после небольшого индукционного периода.
В статье Л. Андерсона с соавторами [19] описаны реакции полифторалкилгипохлоритов с различными
алкенами, которые приводили к соответствующим простым эфирам с высоким выходом (>90%).
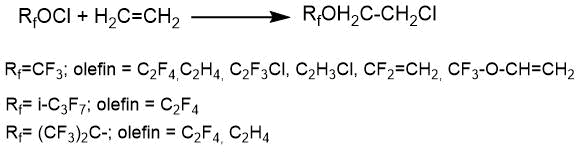
По мнению авторов цитируемой работы, атом хлора молекулы гипофторита преимущественно присоединяется к атому углерода при двойной связи, который обладает наибольшей электронной плотностью. Поэтому взаимодействие трифторметилгипохлорита с 1,1-дифторэтиленом и винилхлоридом протекает практически селективно.
CF3OCl + CF2=CH2 → CF3OCF2CH2Cl (изомер CF3OCF2CH2Cl - 96%)
CF3OCl + CClH=CH2 → CF3OCHClCH2Cl
В случаях, когда разница между плотностью электронов на атомах углерода при двойной связи была невелика (например, в молекуле хлортрифторэтилена) наблюдается образование двух изомеров.
CF3OCl + CClF=CF2 → CF3OCFClCF2Cl + CF3OCF2CFCl2
Это предположение также подтверждено в работе [20], где приведены результаты исследования взаимодействия гексафторпропилена с трифторметилгипохлоритом при 0°С с получением двух аддуктов.
CF3OCl + CF2=CFCF3 → CF3OCF2CFClCF3 (70%) + CF3OCF(CF3)CF2Cl (30%).
Использование реакции перфторалкилгипофторитов с перфторалкенами позволяет в ряде случаев синтезировать полностью фторированные простые эфиров. Так, С. Той и Р. Стрингхем [21] получили перфтор-н-пропил-трет-бутиловый эфир реакцией перфтор-трет-бутилгипофторита с гексафторпропеном. При этом содержание изомера, имеющего перфтор-н–пропиловый фрагмент, превышало 95%.
CF3CF=CF2 + (CF3)3COF → CF3CF2CF2OC(CF3)3.
Авторы указанной работы предположили, что реакция могла протекать через электрофильную атаку группы O-F с последующим присоединением флорониум иона.
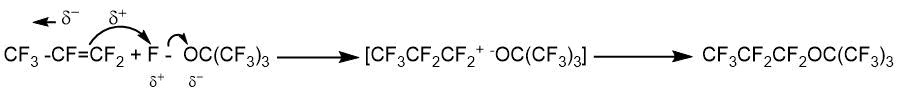
В патенте Италии [22] показано, что взаимодействие трифторметилгипофторита с 1,2-дихлордифторэтиленом при -70°С привело к получению трифторметил 1,2-дихлортрифторэтилового эфира с выходом 60%.
CF3OF + CClF=CClF → CF3-O-CClF-CClF2
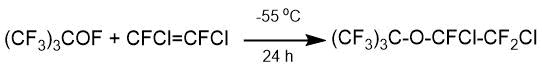
В статье Ч. Лю с соавт. [23] приведено описание реакции получения перфтор-трет-бутил 1,2-дихлортрифторэтилового эфира при -55°С с выходом 91%.
5. Пиролиз производных перфтор-2-алкокси-пропионовой кислоты
Большинство известных методов синтеза фторсодержащих эфиров не подходят для получения перфторалкилвиниловых эфиров (Rf-O-CF=CF2), которые являются ключевыми мономерами в производстве высокофторированных сополимеров с уникальными свойствами.
Для получения ряда соединений, например, перфторметилвинилового эфира возможно применение дегалогенирования перфторалкиловых эфиров 1,2-дихлортрифторэтана, которые можно получить присоединением перфторгипогалогенитов к алкенам (см. гл. 4).
Кроме того, Ч. Фрицем и С Селманом [24, 25] упоминалась возможная реакция алкоголятов перфторированных спиртов с тетрафторэтиленом.
RfOMe + CF2=CF2 →Rf-O-CF=CF2 + MeF
В 1965 г. М. Рэдвуд и С. Виллис [26] сообщили о получении трифторметилатов ряда щелочных металлов взаимодействием карбонилфторида с фторидами металлов в ацетонитриле:
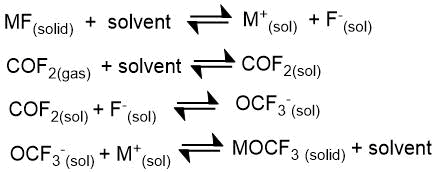
Где M=K, Rb, Cs.
Трифторметилаты калия, рубидия и цезия были выделены и описаны как устойчивые твердые кристаллические соединения. Попытки получить при этих условиях алкоголяты лития или натрия были безуспешными.
В 1967 г. М. Рэдвудом и С. Виллисом были получены также алкоголяты щелочных металлов (K, Rb, Cs) пентафторэтанола, н-гептафторпропанола, гептафторизопропанола и нанофторбутанола [27].
Однако, работ, описывающих возможный синтез перфторалкилвиниловых эфиров реакцией алкоголятов перфторированных спиртов с тетрафторэтиленом или хлорфторэтиленами, авторам настоящего обзора найти не удалось.
На сегодняшний день единственным практическим методом получения широкого спектра перфторалкилвиниловых эфиров является пиролиз фторангидридов или солей перфтор-2-алкокси-пропионовых кислот. Краткое описание метода приведено в книге Ш. Ебнесаджада на примере синтеза перфторпропилвинилового эфира [28].
На первой стадии процесса оксид гексафторпропилена (ОГФП, HFPO, Hexafluoropropylene oxide) взаимодействует с перфторированными ацилфторидами в присутствии фтор-аниона (например, фториды щелочных металлов) с образованием перфтор-2-алкокси-пропионил фторида.
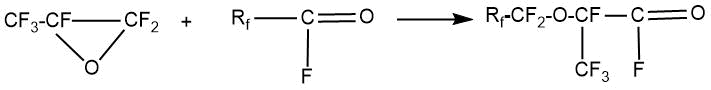
На второй стадии перфтор-2-алкокси-пропионил фторид взаимодействует с кислородсодержащей
солью (карбонаты, сульфаты) щелочного или щелочноземельного металла при повышенной
температуре. Интервал применяемых температур зависит от природы соли. В ряде случаев
перфтор-2-алкокси-пропионил фторид переводят в соль щелочного или щелочноземельного
металла, которую затем подвергают декарбоксилированию. Часто эту стадию процесса
обозначают как стадию пиролиза.
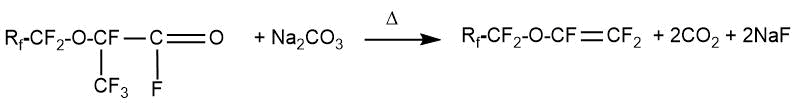
Возможный механизм реакции ОГФП с перфторацилфторидами представлен в работе Г.Миллауэра с соавт. [29] на примере получения фторангидрида 2-перфторпропоксипропионовой кислоты.
На начальной стадии перфторпропионил фторид может переходить в равновесную форму иона
перфторпропоксида 2, который взаимодействует с одной молекулой ОГФП
с образованием алкоксида 3. Далее алкоксид 3 в
зависимости от условий процесса может или взаимодействовать со следующей молекулой
ОГФП или после отщепления одного фторид-иона превратиться в фторангидрид 2-перфторпропоксипропионовой
кислоты 4.
Одним из первых примеров получения перфторвиниловых эфиров методом пиролиза является патент Ч. Фрица, Э. Мура и С. Селмана в [24]. В этом патенте описано получение перфторметилвинилового, перфторэтилвинилового, перфтор-н-пропилвинилового (PPVE) и некоторых других эфиров.
Взаимодействие перфторацилфторида с ОГФП проводили в присутствии катализатора в инертном полярном растворителе. В качестве катализатора применяли активированный уголь, фториды щелочных металлов, фторид серебра или четвертичную соль аммония.
Вторую стадию пиролиза проводили при температурах от 100 до 600°С. В примерах описано применение сульфата натрия, сульфата калия, карбоната цезия и ряда других солей.
Возможный двухстадийный механизм образования натриевых солей карбоновых кислот был предложен Ч. Фрицем и С. Селманом на примере сульфата и карбоната натрия [25].
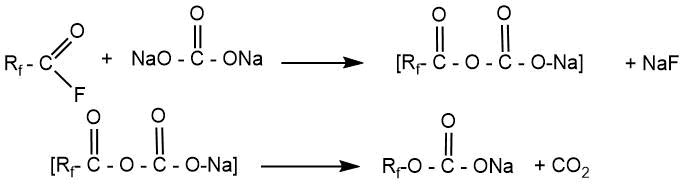
Авторами этого патента было отмечено, что применяемые для пиролиза кислородсодержащие соли, должно быть тщательно высушены, поскольку остаточная влага приводит к образованию водородсодержащих соединений.
В работе [30] на примере пиролиза перфтор-2-(2-пропоксипропокси)пропионил фторида показано,
что в зависимости от количества взятого в реакцию карбоната натрия по отношению к
перфторацилфториду, направление пиролитического процесса может приводить к преимущественному
образованию перфторалкилвиниловых эфиров, либо соответствующих диперфтор-1-метил-2-оксаалкилкетонов.
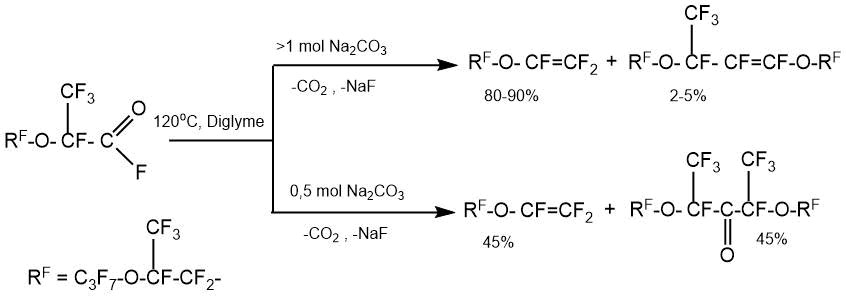
В 1961 г. Д. Андерсон и С. Селман опубликовали работу[31], в которой распространили метод
пиролитического декарбоксилирования для получения дивиниловых эфиров. На первой стадии
процесса из перфтормалонил фторида и ОГФП был получен фторангидрид перфтор-2-метил-3-окса-адипиновой
кислоты.
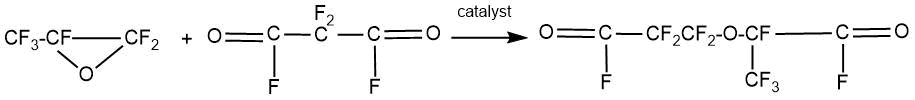
Процесс проводили в среде полярного растворителя (диметиловый эфир этиленгликоля, ацетонитрил, а также диметилсульфоксид или N-метилпирролидон) с добавлением каталитических количеств фторидов щелочных металлов или четвертичного аммония.
Cинтез перфторалкилвинилового эфира из полученного ацилфторида проводили двумя методами:
1) При контакте сухой кислородсодержащей соли щелочного металла или оксида цинка с фторангидридом перфтор-2-метил-3-окса-адипиновой кислоты при температуре 250÷350°C.
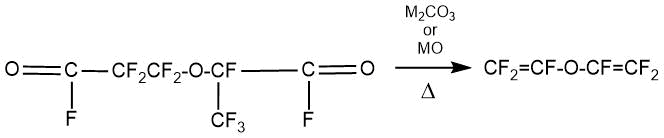
M=щелочной металл или цинк.
2) Фторангидрид перфтор-2-метил-3-окса-адипиновой кислоты обрабатывали водным раствором гидроксида щелочного металла с получением соответствующей соли. Полученную соль подвергали пиролизу при 250÷270°C.
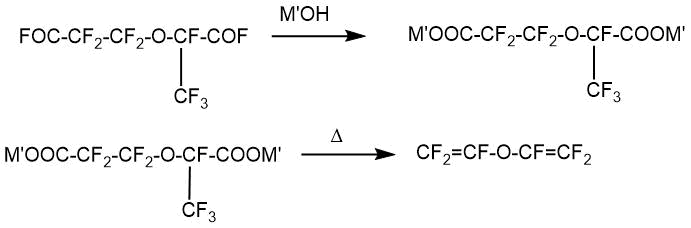
M’-щелочной металл.
Р. Салливаном была показана возможность монодекарбоксилирования солей дикарбоновых кислот с образованием перфторалкилвиниловых эфиров, содержащих карбоксильную группу [32].
Несимметричные диацилфториды были получены в результате присоединения ОГФП к фторангидридам перфторглутаровой и перфторянтарной кислот с получением несимметричных аддуктов.
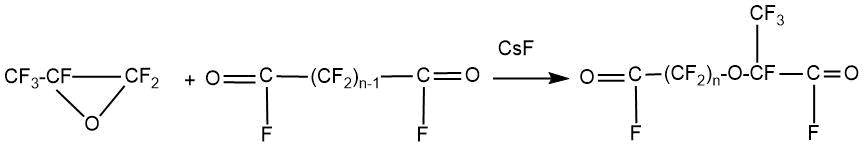
n=3,4; выход ~70%
При исследовании процесса пиролиза полученных солей было установлено, что при пониженной
температуре 185-200°C происходит монодекарбоксилирование с преимущественным декарбоксилированием
карбонильной группы, имеющей трифторметильную группу в α-положении. Автор объяснял
это стабилизирующей ролью α-CF3 группы в образовании промежуточного карбаниона.
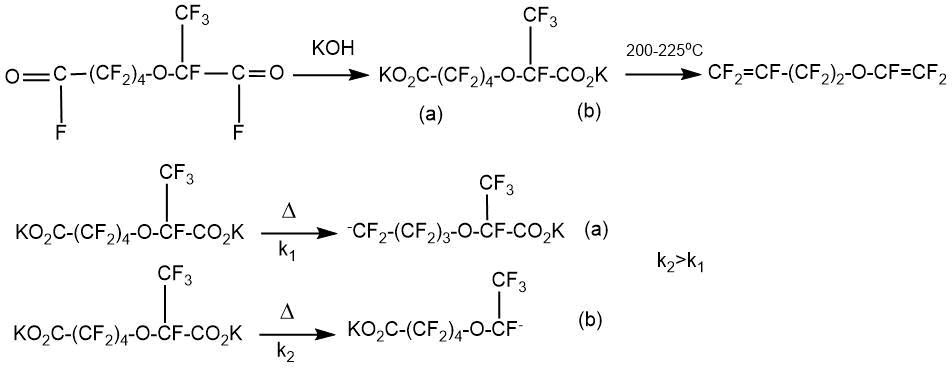
Следует отметить, что выход полученной таким образом калиевой соли перфтор-6-окса-окт-7-еновой кислоты был невысок (~25%).
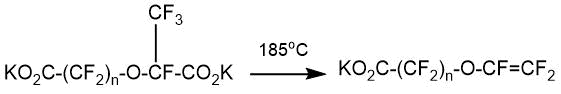
В случае перфтор-окса-алкандикарбоновых кислот, имеющих 6-7 атомов в цепи, пиролиз их солей протекает преимущественно с образованием циклических соединений [33] . Так, при пиролизе диацилфторидов, полученных в результате присоединения ОГФП к фторангидридам перфтормалоновой и перфторянтарной кислот, наблюдалось образование перфтор-2-метилоксалан-3-она и перфтор-2-метилпиран-3-она, соответственно.
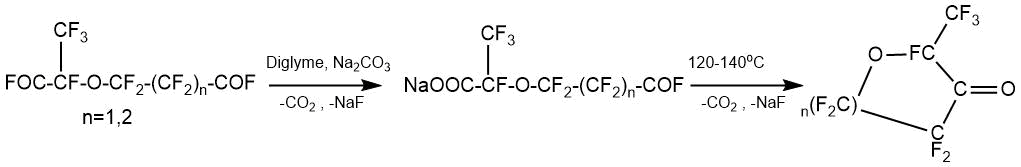
Процесс монодекарбоксилирования, позволяющий избежать циклизации при получении виниловых эфиров пиролитическим методом, описан в статье М. Ямабе [34].
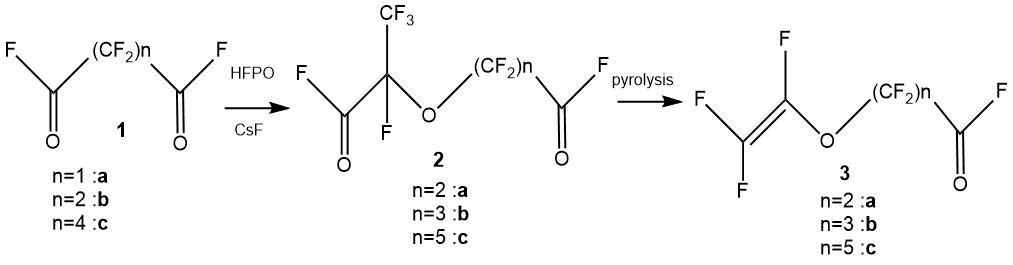
Ацилфториды 1(a-c) были обработаны ОГФП в присутствии обезвоженного фторида цезия с получением промежуточных дифторангидридов 2-(перфторалкокси)-2,3,3,3-тетрафторпропионовой кислоты (2-(perfluoroalkoxy)-2,3,3,3-tetrafluoropropinonyl fluoride) 2(a-c).
Стадию пиролиза проводили в газовой фазе путем пропускания разбавленных паров асимметричных диацилфторидов 2(a-c) через зону пиролиза. Температуры, состав разбавителя и другие параметры реакций приведены в таблице.
|
No |
Исходное соединение 2 |
Температура (°C) |
Разбавитель |
Объемное соотношение газов |
Объемная скорость (min. -1) |
Конверсия (%) |
Селективность 3a-c (%) |
|
|
1 |
2a |
295 |
N2 |
1/6 |
2.2 |
18.5 |
3a |
79 |
|
2 |
2a |
300 |
N2/SO2 (4:1) |
1/6 |
2.2 |
14.3 |
3a |
83 |
|
3 |
2a |
300 |
Воздух/H2O (1000:5) |
1/20 |
6.5 |
22.5 |
3a |
92 |
|
4 |
2b |
295 |
N2 |
1/6 |
2.2 |
19.5 |
3b |
85 |
|
5 |
2b |
300 |
N2/SO2 (4:1) |
1/6 |
2.2 |
15.0 |
3b |
85 |
|
6 |
2b |
300 |
Воздух/H2O (1000:5) |
1/6 |
6.5 |
20.0 |
3b |
85 |
|
7 |
2b |
370 |
N2 |
1/6 |
2.2 |
80.0 |
3b |
85 |
|
8 |
2c |
290 |
N2 |
1/6 |
2.2 |
20.3 |
3c |
83 |
|
9 |
2c |
300 |
N2/SO2 (4:1) |
1/6 |
2.2 |
14.5 |
3c |
81 |
|
10 |
2c |
300 |
Воздух/H2O (1000:5) |
1/6 |
6.5 |
25.0 |
3c |
89 |
|
11 |
2c |
370 |
N2 |
1/6 |
2.2 |
78.5 |
3c |
32 |
В статье В. Бардина и Х. Фрона [35] приведена типовая методика получения перфторалкилвиниловых эфиров на примере перфторпропилвинилового эфира (C3F7OCF=CF2) пиролизом при 300-350°С натриевой соли соответствующей кислоты, которая была предварительно высушена в течение 4-х часов при 150°С.
C3F7OCF(CF3)CO2Na → C3F7OCF=CF2 (т.кип. 35°С, выход 46%).
В патенте Дж. Харриса [36] описан синтез перфтор-2-метоксипропионилфторида, а также различных перфторалкилвиниловых эфиров из соответствующих перфтор-2-алкоксипропионил фторидов пиролизом при пропускании через слой сульфата калия. Другой метод получения эфиров заключался в нагревании предварительно полученных из перфтор-2-алкоксипропионил фторидов калиевых солей перфтор-2-алкокси-пропионовых кислот.
В качестве примера в данном патенте приведен синтез перфтор-2-метоксипропионил фторида (т.кип. 10-12°С) взаимодействием карбонилфторида с ОГФП (CsF, диглим, автоклав, - 80°С, 75°С, 4 ч) с выходом около 70%.
На следующей стадии при пропускании перфтор-2-метоксипропионил фторида через слой сухого K2SO4 (300°С, время контакта 10 мин) был получен перфторметилвиниловый эфир (т. кип. -22°С, 60%).
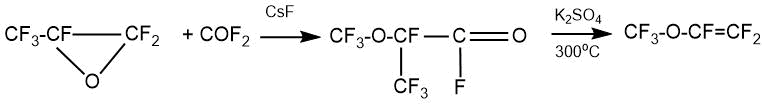
В другом примере этого патента показано, что при использовании сухой калиевой соли перфторметоксипропионовой кислоты выход винилового эфира составил 80% при более низкой температуре пиролиза (185-215°С, 24 ч). Подобным же образом пиролизом калиевой соли был получен перфторпропилвиниловый эфир с выходом 79%.
В ряде случаев фторангидрид 2-перфторпропоксипропионовой кислоты синтезировали непосредственно из ОГФП. В этих процессах перфторпропионил фторид образовывался in situ изомеризацией молекулы ОГФП в присутствии фтористого цезия или других источников фторид иона [29].

Для изомеризации ОГФП в перфторпропионил фторид, помимо фторидов щелочных металлов, могут быть использованы алкиламины. Пример такого синтеза приведен в статье Н. Ишикава с сотр. [37]. В смесь тетраметилмочевины ((Me2N)2CO) и диглима при -70°С добавляли ОГФП. Затем температуру смеси доводили до комнатной и перемешивали в течение 3-х часов. Выход перфтор-2-пропоксипропионил фторида составлял около 70%.
В патенте Е. Мура [38], фторангидрид 2-перфторпропоксипропионовой кислоты был получен при обработке ОГФП фторидом серебра или иодидом тетраэтиламмония в ацетонитриле при 0°С.
Как было неоднократно отмечено выше, отсутствие следов воды при проведении пиролиза является важным фактором для получения перфторированных виниловых эфиров. Образующиеся в присутствии следов воды перфтормоногидроалканы являются побочными продуктами в процессах получения виниловых эфиров, и снижают выход [32]. В то же время, некоторые исследователи рассматривают пиролиз солей или фторангидридов перфторированных эфирокислот в присутствии влаги (либо другого источника ионов водорода) как способ получения гидропроизводных [39, 40]. Обработка натриевых или калиевых солей, перфторированных моно- и дикарбоновых кислот, чаще всего в этиленгликоле при 120-170°С, приводит к продуктам декарбоксилирования и образованию терминальных моно- и дигидросоединений.
Список литературы
- S.Vershilov, V.Kornilov, A.Tsyrulnikova, L.Popova, N.Lebedev, Fluorinated ethers. Communication 1. Preparation of ethers by Williamson reaction and the addition of alcohols to alkenes and alkynes. // Fluorine notes, 2021, Vol. 3(136), DOI: 10.17677/fn20714807.2021.03.01.
- A.L. Henne, M.A. Smook, Fluorinated Ethers. // J. Am. Chem. Soc.,1950, V. 72, 4378-4379.
- H.G. Adolph, M.J. Kamlet, Fluoronitroalkanes. IV. Some reactions of 2-fluoro-2,2-dinitroethanol. // J. Org. Chem., 1969, V. 34, Iss., 45-50.
- А.Ф.Елеев, Г.А.Сокольский, В.Ф.Черстков, И.Л.Кнунянц, Эфиры перфторпинакона. // Изв. АН СССР, сер. хим., 1980, № 2, 451-453.
- Р.А.Беккер, Г.Г.Меликян, Б.Л.Дяткин, И.Л.Кнунянц, Полифторированные енолы и их производные. V. Реакции перфторпропен-2-ола с арилдиазониевыми солями и алифатическими диазосоединениями. // Ж. орг. хим., 1976, Т. 12, Вып. 7, 1377-1379.
- C.Dapremont, P.Calas, A.Commeyras, C.Amatore, Radical chain addition of iodo-perfluoroalkanes to ethylenic or acetylenic substrates. Comparison of rates of iodine atom transfer from C4F9I to σ-vinyl and σ- alkyl α-F radicals. // Journal of Fluorine Chemistry, 1992, v. 56, 249-258.
- M. Knell, N.O. Brace, US. Patent 3 843 735, 1974
- N.O. Brace, Syntheses with perfluoroalkyl radicals from perfluoroalkyl iodides. A rapid survey of synthetic possibilities with emphasis on practical applications. Part one: alkenes, alkynes and allylic compounds. / Journal of Fluorine Chemistry, 1999, V. 93, 1-25.
- H.Meinert, P.Reuter, J.Mader, L.Haidmann, N.Northoff, Synthesis, interfacial active properties and toxity of new perfluoroalkylated surfactants. // Biomater., Artificial Cell & Immob. Biotech., 1992, V. 20, Iss. 1, 115-124.
- D.Lazzari, M.C.Cassani, G.Solinas, M.Pretto, Fluoroalkyl allyl ethers: Useful building blocks for the synthesis of environmentally safer fluorinated multiblock molecules. // Journal of Fluorine Chemistry, 2013, V. 156, 34-37.
- D.N.Bazin, T.I.Gorbunova, A.Ya.Zapevelov, V.I.Saloutin, One-step Synthesis of Epoxy(perfluoroalkyl)alkenes. // Russ. J. Org. Chem., 2009, V. 45, Iss. 4, 491-495.
- В.А.Комаров, А.В.Фокин, К.В.Фросина, Х.А.Абдулганиева, Реакционная способность некоторых дифторнитросодержащих спиртов. // ЖОХ, 1967, Т. 37, Вып. 3, 684-686.
- H.Muramatsu. H.Kimoto, K.Inukai. The addition reactions of fluoroalkyl ethyl ethers to perfluoropropene. // Bull. Chem. Soc. Japan, 1969, V. 42, Iss. 4, 1155-1158.
- А.Г.Корепин, Р.Г.Гафуров, Л.Т.Еременко, Реакции N-метилолнитраминов в кислых средах. // Изв. АН СССР, сер. xим., 1974, № 2. 474-477.
- А.М.Полякова, М.Д.Сучкова, К.А.Магер, В.В.Коршак, Синтез фторсодержащих простых эфиров диметилвинилэтинил-карбинола. // Изв. АН СССР, cер. хим., 1983, № 3, 625-626.
- J.R. Falck, J. Yu, H.-S. Cho, A Convenient Synthesis of Unsymmetric Polyfluoroethers. // Tetrahedron. Lett., 1994, V. 35, Iss 33, 5997-6000.
- R.S. Porter, G.H. Cady. Some Chemical Reactions of Trifluoromethyl Hypofluorite // JACS, 1957, Vol. 79, Iss. 21, 5625-5627.
- J. Allison, G. Cady, Reactions of trifluoromethyl hypofluorite with organic compounds. // JACS, 1959, Vol. 8, Iss. 5, 1089-1091.
- L.R.Anderson, D.E.Young, D.E.Gould, R.Juurik-Hogan, D.Nuechterlein, W.B.Fox, Perhaloalkyl Hypochlorites and Pentafluorosulfur Hypochlorites. IV. Reactions with Olefins. // J. Org. Chem., 1970, V. 35, 3730-3733.
- Д.Д. Молдавский, В.Г.Темченко, В.И.Слесарева, Г.Л. Антипенко, Присоединение некоторых фторсодержащих веществ к гексафторпропену. // Ж. Орг. хим., 1973, т. 9, 673-676.
- S. Toy, R.S. Stringham, Electrophilic additions involving Fluoronium ions. I. Fluoroxy additions to perfluoro-olefinic bonds // Journal of Fluorine Chemistry, 1975, V. 5, 25-30.
- G. Guastalla, G. Guglielmo, G. Fortunato, G. Gregorio, Pat. Italy IT1196519B, 1988.
- C. Lu, J.-H. Kim, D. D. DesMarteau, Synthesis of perfluoro-t-butyl trifluorovinyl ether and its copolymerization with TFE.// Journal of Fluorine Chemistry, 2010, 131, 17-20.
- Ch.Fritz, E.Moore, S.Selman, US Patent 3114778, Fluorinated vinyl ethers and their preparation, 1963.
- Ch.Fritz, S.Selman, US Patent 3291843, Fluorinated vinyl ethers and their preparation, 1966.
- M. E. Redwood, C. J. Willis, Fully fluorinated alkoxides: part I. Trifluoromethoxides of alkali metals. // Can. J. Chem., 1965, Vol. 43, 1893, DOI: 10.1139/v65-251.
- M. E. Redwood, C. J. Willis, Fully fluorinated alkoxides. Part II. Ethoxides, propoxides, and butoxides. // Can. J. Chem., 1967, Vol. 45, 389, DOI: 10.1139/v67-069.
- Sina Ebnesajjad, FLUOROPLASTICS, Volume 2: Melt Processible Fluoropolymers - The Definitive User’s Guide and Data Book, 2nd edition, William Andrew, 2015, p.72, ISBN: 978-1-4557-3197-8.
- H.Millauer, W.Schwertfeger, G.Siegemund, Hexafluoropropene Oxide – a key compound in Organofluorine Chemistry. // Angew. Chem., Int. Ed. Eng., 1985, V. 24, 161-179.
- N. V. Lebedev, V. V. Berenblit, Yu. K. Starobin, V. A. Gubanov, Pyrolytic Decarboxylation of Some Derivatives of Perfluorinated Mono- and Dicarboxylic Acids. // Russian Journal of Applied Chemistry, 2005, V 78, Iss. 10, 1640-1645.
- D.G.Anderson, S.Selman, Perfluorodivinyl ether, US pat. 3326984, 1967.
- R. Sullivan, Synthesis of Perfluoroalkyl Vinyl Ether Acids and Derivatives. // J. Org. Chem., 1969, V. 34, 1841-1844.
- N. V. Lebedev, V. V. Berenblit, Yu. K. Starobin, Cyclization processes in pyrolysis of perfluorooxaalkanedicarboxylic acid derivatives. // Russian Journal of Applied Chemistry, 2008, V. 81, Iss. 1, 95-99
- M.Yamabe, S.Munekata, I.Kaneko, H.Ukihashi, Synthesis of fluorinated vinyl ethers, having esters group. // Journal of Fluorine Chemistry, 1999. V. 94, 65-68.
- H.-J.Frohn, V.V.Bardin, The unusual reactivity of C3F7OCF=CF2 with PBu3 and the complex hydrides M[EH4] (M: Li, Na; E: B, Al); preparation of potassium perfluoro-2-propoxyeth-1-enyltrifluoroborate K[C3F7OCF=CFBF3]. // Journal of Fluorine Chemistry, 2003, V. 123, 43-49.
- J.F.Harris. Fluorocarbon ethers. Pat. USA. 3180895, 1965.
- H. Kawa, F. Yamaguchi and N. Ishikawa, Optically active perfluoro-2-propoxypropionic acid: A new chiral reagent for 19F NMR study. // Journal of Fluorine Chemistry, 1982, V. 20, 415-485, DOI: 10.1016/s0022-1139(00)82273-3).
- E.Ph. Moore, Polymerization of hexafluoropropylene epoxide, Pat. US 3322826, 1967.
- S.Selman, W.S.Smith Jr., Hydrogen capped fluorocarbon polyethers, Pat. US 3342875, 1967.
- G.Moore, R.Flynn, M.Guerra, J.Owens. Omega-hydrofuoroalkyl Ethers, Precursor Carboxylic acids and derivatives thereof, and their preparations and applications, Pat. US 6204299, 2001.
Статья рекомендована к публикации д.х.н. С.М. Игумновым
Fluorine Notes, 2021, 138, 7-8


