Поступило в редакцию: Сентябрь 2021
УДК 543.51+547
Fluorine Notes, 2021, 138, 5-6
ИОННЫЕ СЕРИИ В МАСС-СПЕКТРАХ ТРИФТОРМЕТИЛ-ЗАМЕЩЕННЫХ ГЕТЕРОЦИКЛОВ И ЦИКЛОПРОПАНОВ, НЕ СОДЕРЖАЩИХ РЕГУЛЯРНЫХ ФРАГМЕНТНЫХ ГРУПП
Н.Д. Каграманов*, А.Л. Сиган, А.С. Голубев
Институт элементоорганических соединений им. А. Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
e-mail: ndkagram@gmail.com
Аннотация: В масс-спектрах н-алканов, н-перфторалканов, н-карбоновых кислот, их метиловых эфиров, циклоалканов и перфторполициклоалканов, содержащих регулярные фрагментные группы (C2H4)n или (CF2)n, все параллельно образующиеся серии ионов достаточно просто определяются по реперным отрывам.
В настоящем сообщении представлены серии ионов масс-спектров трифторметил-замещенных соединений, не содержащих регулярных фрагментных групп. Отсутствие регулярных фрагментных групп затрудняет установление цепочек ионных серий, поскольку характерные отрывы (-C2H4 и -CF2) не происходят.
В качестве примеров, представлены ионные серии масс-спектров трех этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов, двух 3-(трифторметил)-2,1-бензизоксазолов, а также одиннадцати транс-2-арил-2-трифторметил-1-нитроцикло-пропанов. При фрагментации производных этил-5-арил-5-трифторметил-4,5-дигидро-изоксазол-3-карбоксилатов образуются две серии, приводящие к двум стабильным фрагментным ионам PhC+=O и PhC+=CH2. В масс-спектрах производных 3-(трифторметил)-2,1-бензизоксазолов, в зависимости от положения заместителя по отношению к CF3 группе, регистрируется либо выброс .CF3, либо перегруппировочный отрыв CF2. В спектрах транс-2-арил-2-трифторметил-1-нитроциклопропанов, при синхронном отрыве HNO, .CF3 и С2H2, возникает интенсивный пик перегруппировочного иона Ar-C+=O. Другим путем фрагментации производных 2-трифторметил-1-нитроциклопропанов является образование катион-радикала трифторнитрометана [CF3NO2]+. c m/z 115, в результате выброса нейтральных молекул Aryl-C3H3, в которых сохраняется циклопропен, но без электроноакцепторных заместителей. В масс-спектрах транс-2-арил-2-трифторметил-1-нитроциклопропанов, содержащих заместители в пара- или мета- положении фенильной группы, интенсивности пиков конкурирующих ионных серий меняются в зависимости от пара- или мета- положения заместителя.
Ключевые слова: ионные серии в масс-спектрах, серии ионов без регулярных фрагментных групп, этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилаты, 3-(трифтор-метил)-1-бензизоксазолы, транс-2-арил-2-трифторметил-1-нитроциклопропаны.
Введение
В масс-спектрах соединений, не содержащих регулярных фрагментных групп (C2H4)n или (CF2)n, установление фрагментационных цепочек ионных серий осложняется отсутствием характерных реперных отрывов [1]. При многовариантности состава отрываемого радикала, он может быть надежно установлен при съемке спектра высокого разрешения. Тем не менее, наличие массива данных по спектрам низкого разрешения для производных с различными изотопными заместителями обычно позволяет сделать обоснованный вывод о составе отрываемых радикалов. Рассмотрение всех вариантов отрыва первичных радикалов, установление ионных серий спектра и согласование их между собой более продуктивно, чем описание интерпретируемого спектра, как единого целого. При ионизации электронами несимметричных молекул, имеющих заместители, процесс фрагментации, как правило, начинается с периферийных функциональных групп заместителей, нарушающих симметрию более стабильного центрального фрагмента.
Экспериментальная часть
Масс-спектры производных этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов, 3-(трифторметил)-2,1-бензизоксазолов и транс-2-арил-2-трифторметил-1-нитроциклопропанов получены на спектрометре «Finnigan Polaris Q» (ионная ловушка, диапазон 30-700 Да, энергия 70 эВ, метод прямого ввода DIP, температура ионного источника 250C). С целью оценки возможности термораспада производных транс-2-арил-2-трифторметил-1-нитроциклопропанов температуру ионного источника понижали от 250 до 50C.
Ионные серии этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов
Этил-5-арил-трифторметил-4,5-дигидроизоксазол-3-карбоксилаты обладают свойствами регуляторов роста растений. Сравнение их активности с существующими гербицидами подтверждает перспективность применения их в агрохимии. Новый, удобный метод их синтеза и разделения, элементный анализ, а также ЯМР-спектры и масс-спектры представлены в работе [2]. На Рис. 1-3 представлены две серии ионов, присутствующих в масс-спектрах трех этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов. Одна из серий, начинающаяся с отрыва радикала .CF3, приводит к базовым пикам R-C6H4+C=O. Другая серия, начинающаяся с отрыва этоксильного радикала концевой этоксикарбонильной группы и завершающаяся отрывом радикала .CF3, приводит к пикам средней интенсивности R-C6H4+C=CH2.
Так, в спектре этил-5-фенил-5-(трифторметил)-4,5-дигидроизооксазол-3-карбоксилата после выброса .CF3 происходит последовательный отрыв молекулы этилена, CO2 и ацетонитрила CH3CN m/z 41 с образованием базового иона оксифенилметилиума Ph-+C=O.
В случае отрыва концевой этоксикарбонильной группы происходит выброс радикала .CNO c m/z 42 и отрыв .CF3 с образованием фенилэтенильного иона Ph-+C=CH2 m/z 103 (50%).
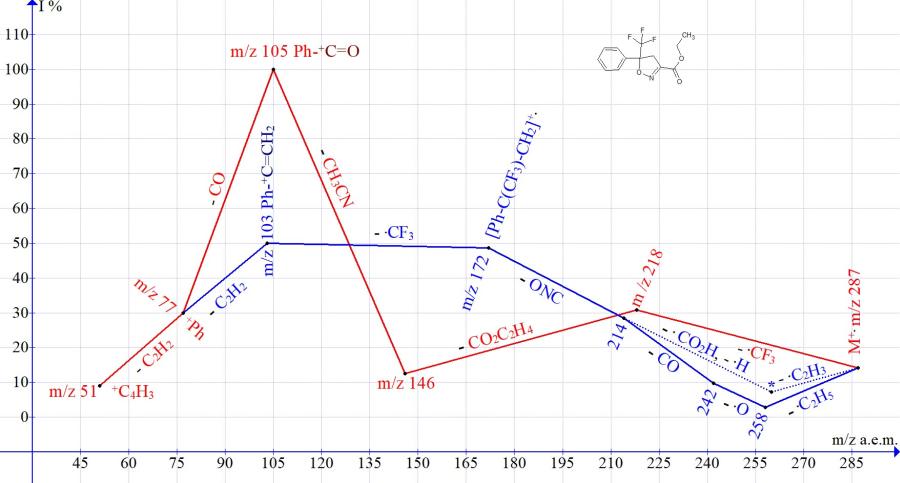
Рисунок 1. Серии ионов масс-спектра этил-5-трифторметил-5-фенил-4,5-дигидроизоксазол-3-карбоксилата C13H12F3NO3 MW:287.
Сходные ионные серии присутствуют в масс-спектрах этил-5-трифторметил-5-пара-толил-4,5-дигидроизоксазол-3-карбоксилата (Рис. 2) и этил-5-(4-бромфенил)-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилата (Рис. 3).
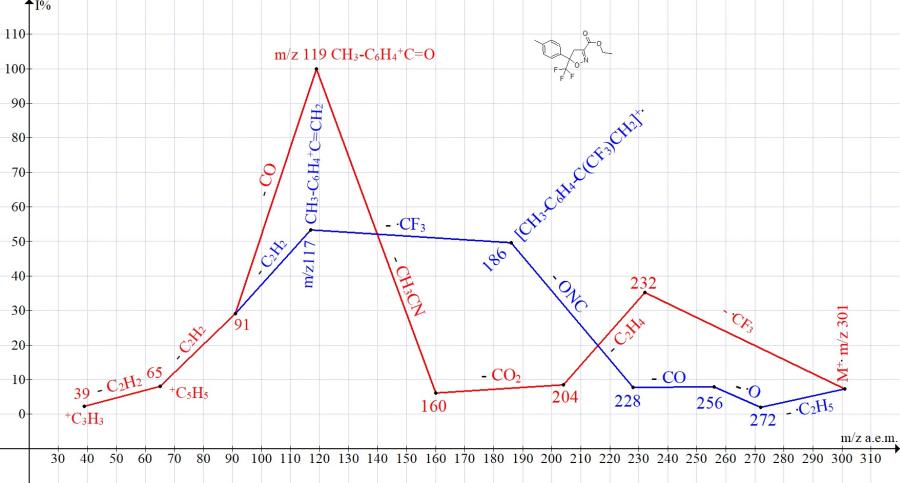
Рисунок 2. Серии ионов масс-спектра этил-5-трифторметил-5-пара-толил-4,5- дигидроизоксазол-3-карбоксилата C14H14F3NO3 MW:301.
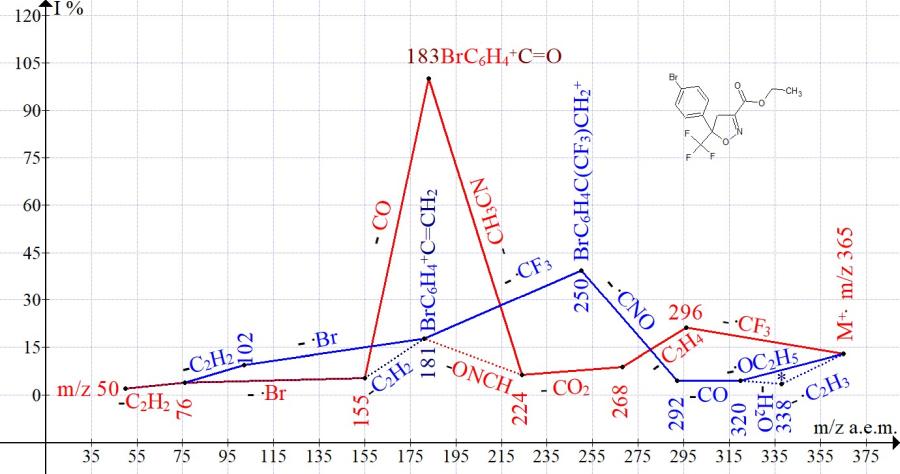
Рисунок 3. Серии ионов масс-спектра этил-5-(4-бромфенил)-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилата C13H11BrF3NO3 MW:365.
Одна из серий (Рис. 1-3), начинающаяся с отрывов радикала .CF3, приводит к базовым пикам R-C6H4-+C=O. Другая серия, начинающаяся с отрыва этоксильного радикала и завершающаяся отрывом радикала .CF3, приводит к пикам R-C6H4-+C=CH2 средней (Рис. 1-2) и малой интенсивности (Рис. 3).
Ионные серии 3-(трифторметил)-2,1-бензизоксазолов
2,1-Бензизоксазолы (антранилы) - важный класс гетероциклических соединений, применяемых в качестве синтонов в органическом синтезе.
Они представляют интерес также для биохимических исследований и фармакологии. В работе [3] предложен новый метод синтеза и впервые получены ранее не известные 3-(трифторметил)- и 3-(дифторметил)-2,1-бензизоксазолы.
В отличие от спектров этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов [2] в спектрах менее разветвленных и более ненасыщенных структур 3‑(трифторметил)-2,1-бензизоксазолов, в зависимости от взаимного положения заместителей и CF3 группы, наблюдается либо отрыв трифторметильной группы либо перегруппировка с миграцией атома фтора и выбросом CF2. В масс-спектре 3-(трифторметил)-2,1-бензизоксазола, а также в спектрах его производных: 4-фтор, 5-хлор, 5-бром и 7-нитро привлекает внимание высокая интенсивность пиков (+.M-CF2) от 66% до 100%, соответствующих отрыву дифторкарбена от трифторметильных групп [3]. Отрывы .F или HF происходят только как вторичные процессы, после выброса CF2.
Электроноакцепторная CF3 группа при двойной связи ослабляет ее. При ионизации молекулы удаляется один из электронов ослабленной двойной связи 3а-3. Координация одного из атомов фтора трифторметильной группы с новым радикальным центром-3а приводит к перегруппировке c образованием новой C-F связи и отрыву CF2.
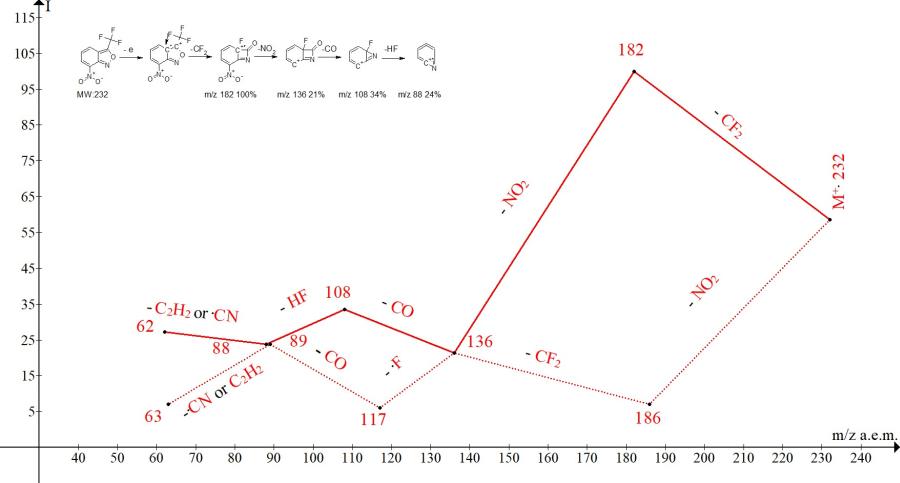
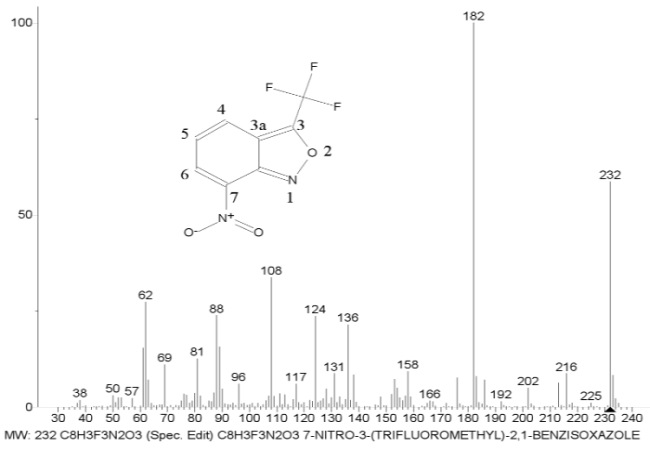
Рисунок 4. Масс-спектр 7-нитро-3-(трифторметил)-2,1-бензизоксазола C8H3F3N2O3 MW: 232 и две серии его ионов.
Представленные на Рис. 4 две ионных серии масс-спектра различаются только очередностью отрыва радикалов и интенсивностью пиков. В сущности, менее интенсивная серия ионов, отмеченная на Рис. 4 пунктиром, - это зеркальное отражение более интенсивной главной серии.
Напротив, фрагментация 4-замещенных производных: 4-азидо, 4-нитро, и в меньшей мере 4-фтор-3-(трифторметил)-2,1-бензизоксазола начинается с отрыва трифторметильных радикалов. Соотношение интенсивностей пиков, соответствующих отрывам .CF3 / CF2 , в спектрах бензизоксазолов с заместителями 4-азидо 100/0, 4-нитро 100/56, и 4-фтор 40/66 % соответственно.
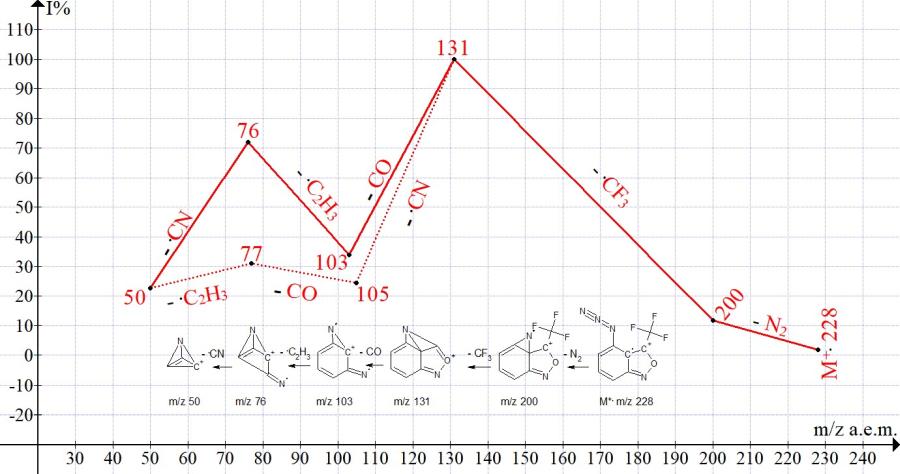
Рисунок 5. Серии ионов масс-спектра 4-азидо-3-(трифторметил)-2,1-бензизоксазола C8H3F3N4O MW: 228.
Азидо-группа в четвертом положении - ближайшем к двойной связи 3-3а - полностью блокирует перегруппировочный отрыв атома фтора от трифторметильной группы. Заместители 4-нитро, а также 4-фтор, частично блокируют электроноакцепторные свойства трифторметильной группы, затрудняя отрыв атома фтора. В отличие от 4-азидо-3-(трифторметил)бензизоксазола, ионная серия которого со 100% отрывом .CF3 представлена на Рис. 5, в спектрах 4-нитро- и 4-фтор производных 3-(трифторметил)бензизоксазола идут конкурирующие фрагментационные отрывы .CF3 и CF2. Следует отметить, что в спектре трифторметилбензола (NIST#: 118781 ID#: 134414 DB: mainlib) отрыва .CF3 нет, а происходят только последовательные выбросы CF2 и .F или .F и CF2 50/50%.
Ионные серии транс-2-арил-2-трифторметил-1-нитроциклопропанов
Транс-2-арил-2-трифторметил-1-нитроциклопропаны впервые получены и описаны в работе [4]. Строение их подтверждено методами ЯМР, ИК-спектроскопии, масс-спектрометрии, рентгеноструктурным и элементным анализом [4].
Поскольку циклопропановое кольцо обладает высокой напряженностью и низкой энергией разрыва связей C-C (54,4 ккал/моль) [5], спектры транс-2-арил-2-трифторметил-1-нитроциклопропанов представляют собой примеры многовариантности распада. Особенности диссоциативной ионизации арилциклопропанов определяются сопряжением трехчленного цикла с ароматической системой [6,7], а также заместителями циклопропана и арильной группы. В случае циклопропанов с электроноакцепторными заместителями NO2 [8] и CF3 напряженность цикла возрастает. Съемкой спектров производных 2-арил-2-трифторметил-1-нитроциклопропанов, выполненной при температурах ионного источника 250С и 50С, подтверждено, что рассматриваемые фрагментационные процессы не связаны с термораспадом анализируемых веществ в ионном источнике.
Фрагментация 2-арил-2-трифторметил-1-нитроциклопропанов, как правило, начинается с отрывов HNO2 и CF3 c образованием циклопропенового иона Ar-+C3H2. Другой путь распада включает синхронный отрыв HNO, .CF3 и C2H2 с образованием перегруппировочного иона Ar-+C=O, возникающего в результате миграции атома кислорода NO2 при отрыве HNO. Еще одним общим процессом, характерным для фрагментации 2-арил-2-трифторметил-1-нитроциклопропанов, является образование пика иона c m/z 115 - катион-радикала трифторнитрометана [CF3NO2]+.. Основные пути распада 2-арил-2-трифторметил-1-нитроциклопропанов представлены на Схеме 1.
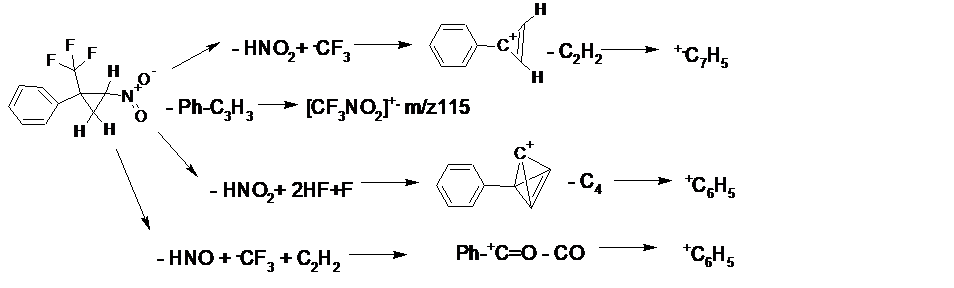
Схема 1. Пути фрагментации 2-арил-2-трифторметил-1-нитроциклопропанов.
Главные пути фрагментации [2-нитро-1-(трифторметил)циклопропил] бензола представлены на Рис. 6.
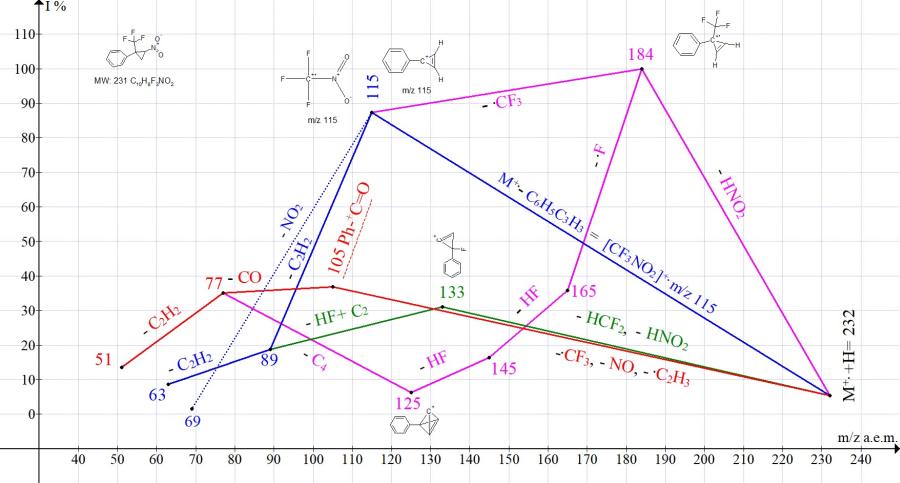
Рисунок 6. Серии ионов масс-спектра [2-нитро-1-(трифторметил)циклопропил]бензола C10H8F3NO2, MW:231.
При выбросе M+.- HNO2 (Рис. 6) образуется базовый пик иона c m/z 184. Вероятно, что цикл-С3 сохраняется и у иона с m/z 115 после отрыва .CF3. Пик иона с m/z 115 (87,4%) - суммарный пик двух ионов: Ph-+C3H2 и CF3+NO2. Этот факт подтверждает сохранение циклопропенового цикла как в образующимся ионе, так и в отрываемой нейтральной молекуле. Фрагментация иона с m/z 115 (отрыв C2H2) согласуется со структурой Ph-+C3H2. По сравнению со спектрами других производных 2-арил-2-трифторметил-1-нитроциклопропанов, в спектре [2-нитро-1-(трифторметил)циклопропил]бензола (рис.6) интенсивность пика с m/z 105 Ph-+C=O, образующегося при распаде циклопропана, минимальна (36,8%). По-видимому, незамещенная фенильная группа по сравнению с замещенными фенильными группами способна максимально стабилизировать циклопропан.
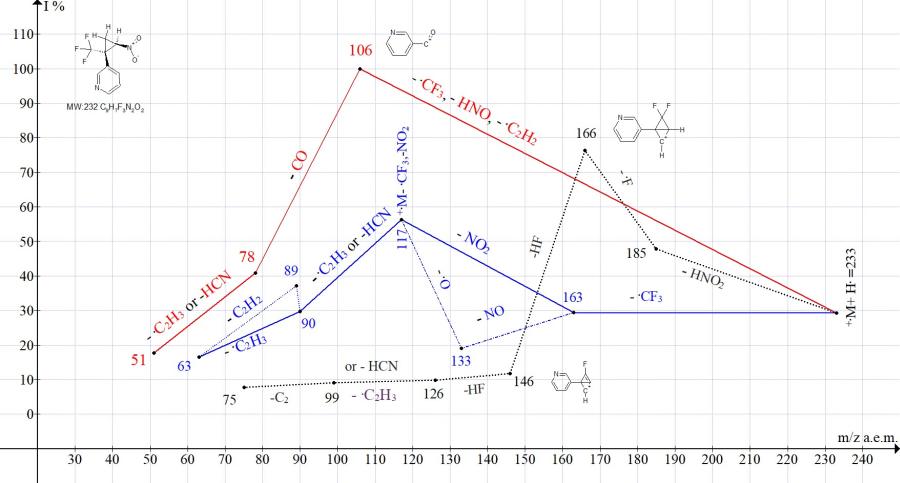
Рисунок 7. Серии ионов масс-спектра 3-[2-нитро-1-(трифторметил)циклопропил]пиридина C9H7F3N2O2, MW:232.
В спектре 3-[2-нитро-1-(трифторметил)циклопропил]пиридина (Рис. 7) отсутствует пик иона [CF3NO2]+. с m/z 115. Вместо него образуется пик циклопропена с m/z 117 (M+.- 115) средней интенсивности 56,3%. Базовый пик спектра C5NH4+C=O c m/z 106 - результат полного распада циклопропана.
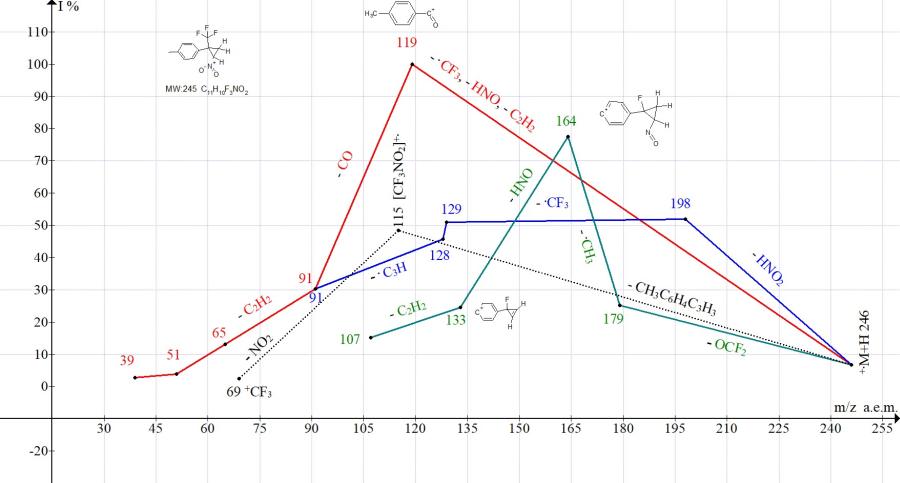
Рисунок 8. Серии ионов масс-спектра 1-метил-4-[2-нитро-1-(трифторметил)циклопропил]бензола C11H10F3NO2 MW:245.
В масс-спектре 1-метил-4-[2-нитро-1-(трифторметил)-циклопропил] бензола (Рис. 8) интенсивность пика иона циклопропена с m/z 129 не превышает (51%), тогда как распад цикла приводит к базовому пику с m/z 119 (100%). Интенсивность пика с m/z 115 всего 48%. То есть, по сравнению с [2-нитро-1-(трифторметил)циклопропил]бензолом, метильный заместитель снижает стабилизацию циклопропена и способствует распаду цикла (Рис. 8).
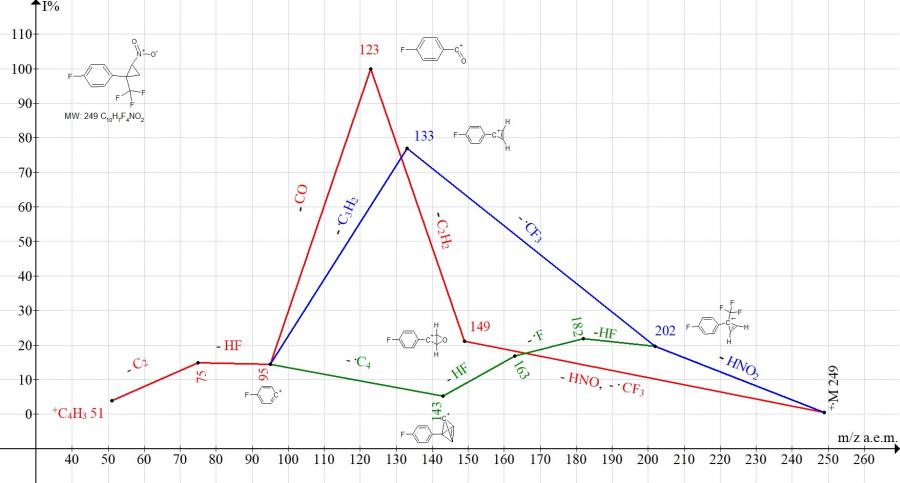
Риунок 9. Серии ионов масс-спектра 1-фтор-4-[2-нитро-1-(трифторметил)циклопропил]бензола C10H7F4NO2, MW:249.
В спектре 1-фтор-4-[2-нитро-1-(трифторметил)циклопропил]бензола ион с m/z 115 не образуется (Рис. 9). Двумя основными путями фрагментации являются: полный распад цикла с образованием базового иона с m/z 123, а также отрывы HNO2 и .CF3 (M-116), приводящие к пику циклопропена с m/z 133 (77%) (Рис. 9).
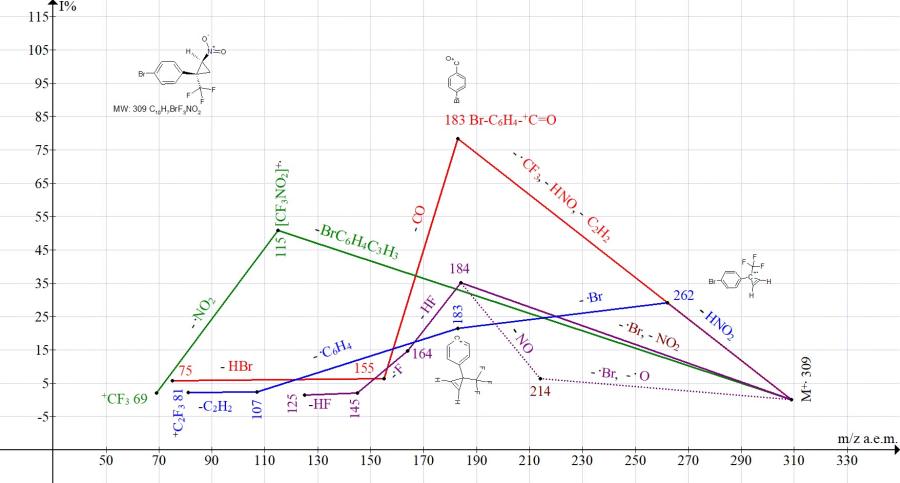
Рисунок 10. Серии ионов масс-спектра 1-бром-4-[2-нитро-1-(трифторметил)циклопропил]-бензола C10H7BrF3NO2, MW:309.
В масс-спектре 1-бром-4-[2-нитро-1-(трифторметил-циклопропил]бензола (Рис. 10) по сравнению со спектром [2-нитро-1-(трифторметил)циклопропил]бензола (Рис. 6) интенсивность пика [CF3NO2]+ с m/z 115, соответствующая сохранению циклопропана в отрываемой нейтральной молекуле, снижается с 87% до 51%, а отрыва M-116 (HNO2+ CF3)=193 не происходит. В соответствии с интенсивностями пиков изотопных ионов 79 и 81, пик с m/z 183 (рис.10.) принадлежит двум ионам: на 78,4% иону BrC6H4-+C=O и на 21,6% иону +C6H4-(CF3)C3H2. Интенсивность пика с m/z 262 +.M- HNO2 составляет только 29%.
По сравнению со спектром [2-нитро-1-(трифторметил) циклопропил] бензола (Рис. 6) замещение бромом фенильной группы не способствует стабилизации циклопропана. В масс-спектре (Рис. 10) появляются пики, подтверждающие отрывы атома брома.
Влияние пара- и мета-заместителей Cl, NO2 и CF3 фенильной группы на фрагментацию 2-арил-2-трифторметил-1-нитроциклопропанов
Сравнение ионных серий в масс-спектрах изомеров с пара- и мета-заместителями (Cl, NO2 и CF3) фенильной группы подтверждает влияние положения заместителя на пути фрагментации и интенсивности пиков, соответствующих распаду или промежуточному сохранению цикла. Так, в спектре циклопропана с пара-хлорфенильной группой главным путем фрагментации является его распад с образованием базового иона с m/z 139 Cl-C6H4-+C=O (Рис. 11). В спектре циклопропана с мета-хлорфенильной группой интенсивность пика с m/z 139 снижалась до 40%, а базовым пиком становился пик циклопропена с m/z 218 (Рис. 12). Выброс молекулы циклопропена с образованием иона трифторнитрометана m/z 115 в изомерах с пара-хлор (25%) и мета-хлорфенильной группой (31%) происходил с близкими интенсивностями.
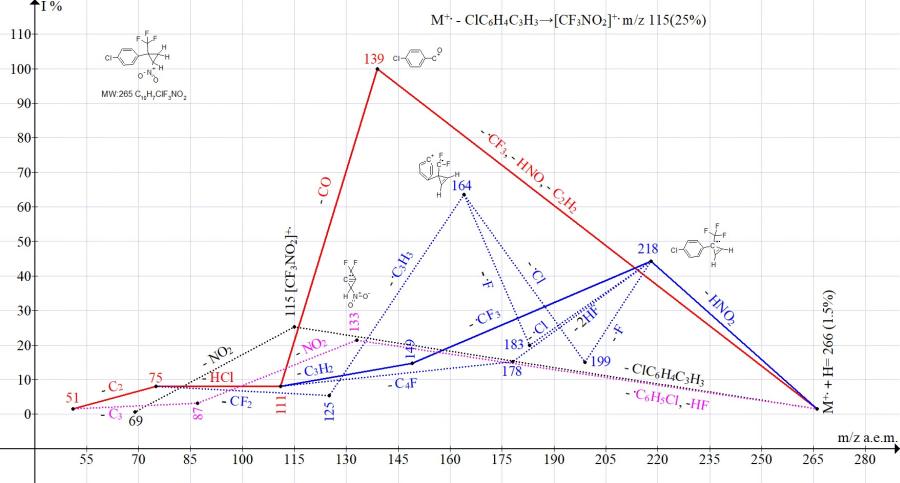
Рисунок 11. Серии ионов масс-спектра 1-хлор-4-[2-нитро-1-(трифторметил)циклопропил] бензола C10H7ClF3NO2, MW:265.
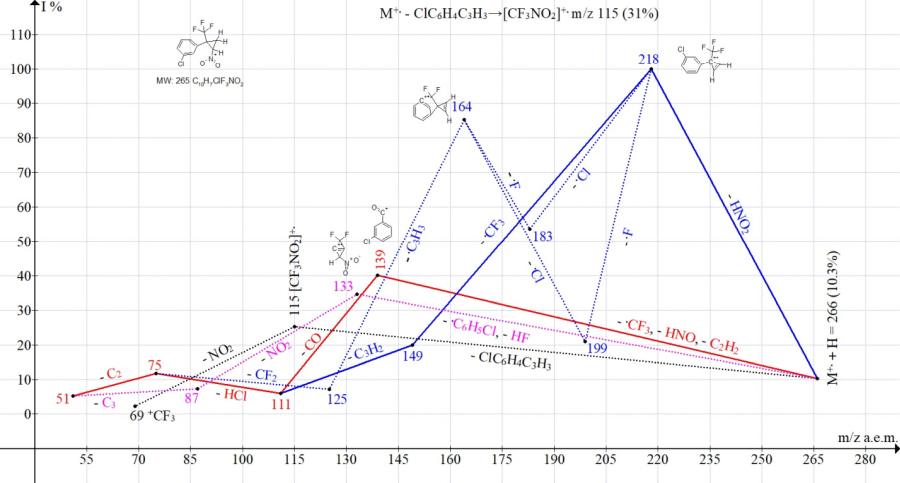
Рисунок 12. Серии ионов масс-спектра 1-хлор-3-[2-нитро-1-(трифторметил)циклопропил] бензола C12H7ClF3NO2, MW: 265.
В условиях фрагментации изомер с мета-хлорфенильной группой (Рис. 11) демонстрирует большую способность для сохранения цикла, чем изомер с пара-хлорфенильной группой (Рис. 12).
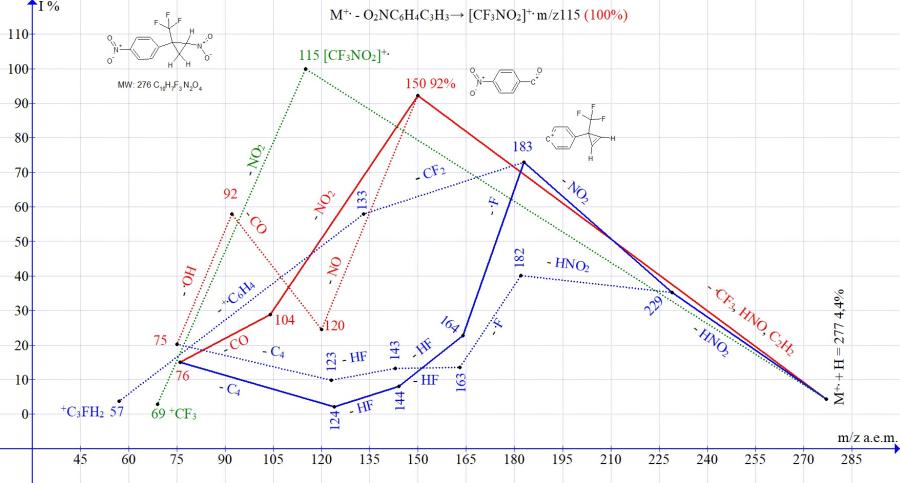
Рисунок 13. Серии ионов масс-спектра 1-нитро-4-[2-нитро-1-(трифторметил)циклопропил] бензола C10H7F3N2O4 MW: 276.
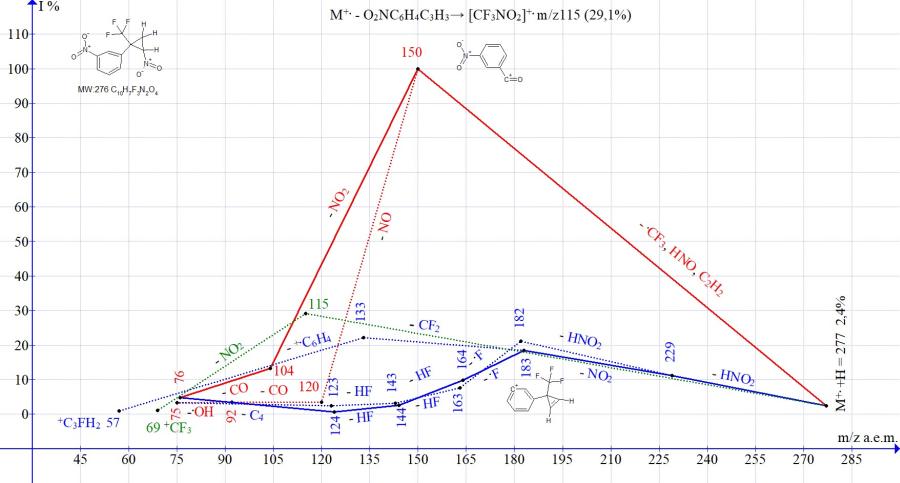
Рисунок 14. Серии ионов масс-спектра 1-нитро-3-[2-нитро-1-(трифторметил)циклопропил] бензола C10H7F3N2O4 MW: 276.
В масс-спектрах изомерных циклопропанов с пара- и мета-нитрозамещенными фенильными группами (Рис. 13-14) интенсивности пика иона с m/z 150, образующегося в результате полного распада циклопропана, близкие (92 и 100%). Интенсивность пика, соответствующего выбросу молекулы циклопропена с образованием иона трифторнитрометана m/z 115 составляет 100% для изомера с пара-нитрофенильной группой (Рис. 13) и 29% для изомера с мета-нитрофенильной группой (Рис. 14). Различие фрагментации изомеров проявляется также и в эффективности двойного отрыва HNO2. После отрыва HNO2 происходит не отрыв .CF3, как во всех спектрах нитроциклопропанов, не содержащих второй нитрогруппы, а повторный выброс HNO2 или NO2. Отрывы HNO2 и NO2 с сохранением циклопропенового цикла и образованием иона с m/z 183 происходят более эффективно (73%) в спектре с пара-нитрофенильной группой и менее эффективно (18%) в спектре с мета-нитрофенильной группой. В условия фрагментации изомер с пара-NO2 группой демонстрирует большую способность в сохранении цикла, чем изомер с мета-NO2 группой.
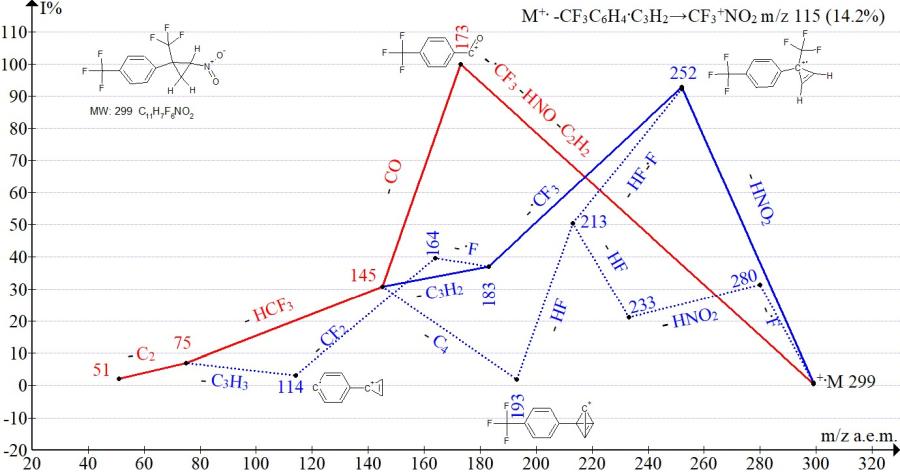
Рисунок 15. Cерии ионов масс-спектра 1-трифторметил-4-[2-нитро-1-(трифторметил) циклопропил]бензола C11H7F6NO2 MW:299.
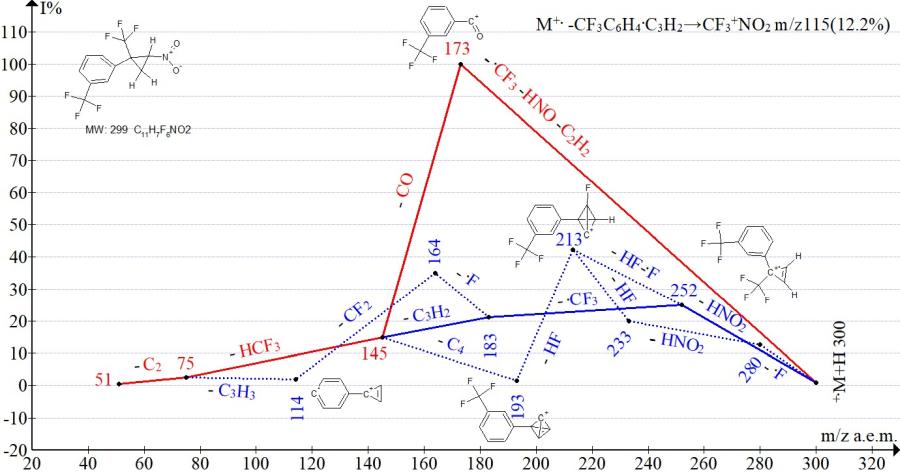
Рисунок 16. Серии ионов масс-спектра 1-трифторметил-3-[2-нитро-1-(трифторметил) циклопропил]бензола C11H7F6NO2 MW:299.
В спектрах изомеров с пара- и мета-трифторметилфенильными группами (Рис. 15‑16) интенсивности пика иона трифторнитрометана с m/z 115 равны (14% и 12%). Интенсивности пика иона с m/z 173, соответствующего полному распаду циклопропана, у изомеров одинаковые (100%). Различие фрагментации проявляется только в эффективности отрыва HNO2 группы. Отрыв HNO2 с промежуточным сохранением циклопропенового цикла и образованием иона с m/z 252 более эффективно (93%) происходит в спектре изомера с пара-CF3 группой и менее эффективно 25% в спектре с мета-CF3 группой.
Заключение
На примерах масс-спектров соединений, не содержащих регулярных фрагментных групп, показана возможность определения их ионных серий, соответствующих вариантам и последовательностям конкурирующих фрагментационных процессов. Определение серий спектров включало рассмотрение общих путей фрагментации, характерных для данного класса соединений, а также всех вариантов отрыва первичных радикалов и согласование их между собой. В спектрах содержащих изотопные атомы Cl и Br составы фрагментных и базовых ионов серий подтверждались соответствующими пиками изотопных ионов. Ионные серии в масс-спектрах позволяют определить основные и второстепенные конкурентные пути фрагментации, а также их зависимость от заместителей.
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Каграманов Н.Д., Серии фрагментных ионов циклоалканов, перфторциклогексана, перфторполициклоалканов, Fluorine notes, 2021, 3(136), 3-4.
- Сиган А.Л., Голубев А.С., Беляева Е.В., Горфинкель C.M., Каграманов Н.Д., Спиридонов Ю.Я., Чкаников Н.Д., Синтез этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3- карбоксилатов, обладающих свойствами регуляторов роста растений, Изв. АН, 2019, 1, 99-103.
- Golubev A.S., Shidlovskii A.F., Peregudov A.S., Kagramanov N.D., Synthesis of 3-fluoromethyl-2,1-benzisoxazoles, Russ. Chem. Bull., 2014, 63(10), 2264-2270.
- Патент России 2699654 (2019), Е-2-арил-2-трифторметил -1-нитроциклопропаны и способ их получения, Голубев А.С., Горфинкель С.М., Маркова А.А., Супоницкий К.Ю., Перегудов А. С., Стрелкова Т.В., Остапчук П. Н., Каграманов Н.Д., Чкаников Н.Д.
- Ferguson L.N., Ring strain and reactivity of alicycles, J. Chem. Educ., 1970, 47, 46-53.
- Чочуа К.А., Чижов О.С., Шабаров Ю.С., Казбулатова Н.А., Масс-спектрометрическое исследование производных циклопропана. I. Углеводороды ряда фенилциклопропана и родственные им соединения, ЖОрХ, 1971, 7, 2024-2028.
- Заикин В.Г., Микая А.И., Вдовин В.М., Масс-спектрометрия малых циклов. М., Наука, 1983.
- Аверина Е.Б., Яшин Н.B., Кузнецова Т.С., Зефиров Н.С., Успехи химии, 2009, 78(10), 963-979.
Статья рекомендована к публикации членом редколлегии к.х.н. М. А. Манаенковой
Fluorine Notes, 2021, 138, 5-6


