Поступило в редакцию: Июнь 2021
УДК 547.412.62+547.574.4+547.867.3+547.551
Fluorine Notes, 2021, 137, 3-4
РЕАКЦИИ ФТОРЗАМЕЩЕННЫХ 2-(2- ИЛИ 4-АМИНОАРИЛ)-ПРОПАН-2-ОЛОВ С БЕНЗАЛЬДЕГИДОМ
Т. П. Васильева*, Д. В. Воробьева
Институт элементоорганических соединений им. А.Н. Несмеянова РАН, Российская Федерация, 119991 Москва, ул. Вавилова, 28.
Факс: (499) 135 5085. E-mail: d-20@mail.ru
Аннотация: Реакцией бензальдегида с замещенным анилином, содержащим объемную гексафторизопропилгидрокси-группу в п-положении, в присутствии п-толуолсульфокислоты синтезированы новые бис-CF3-содержащие бензилиденимины с НО- или MeО-группой. Показано, что замещенный анилин с группой –С(CF3)2OH в о-положении при взаимодействии с PhCHO в тех же условиях претерпевает гетероциклизацию при участии свободных NH2- и HO-групп с образованием нового N-гетероцикла – фторзамещенного дигидробензоксазина. Последний проявляет двойственную реакционную способность по отношению к алкилиодидам в присутствии карбоната цезия. В результате образуются N-алкил-дигидробензоксазины и алкоксизамещенные бензилиденимины.
Ключевые слова: гексафторацетон, бензальдегид, С-оксиалкилирование 2,6- ксилидинов и 2,4-ксилидинов, бензилиденимины, гетероциклизация, фторсодержащие дигидробензоксазины.
Известно, что фторорганические соединения (особенно трифторметилсодержащие) в настоящее время широко используются во многих областях, включая медицину и производство новых материалов. В связи с этим в последние годы интенсивно развивается поиск эффективных синтетических методов для введения CF3-группы в органические соединения.
Ранее мы сообщали об использовании метилтрифторпирувата для введения фрагмента –С(CF3)(OH)- в алифатические [1,2], ароматические [1] и гетероциклические [2,3] соединения. Большое внимание в последнее время уделяется стерически затрудненным анилинам с двумя геминальными CF3-группами. Удобным доступным реагентом для введения фрагмента С(CF3)2OH в ариламины является гексафторацетон (ГФА)[4-8].
В настоящей работе с помощью ГФА синтезированы фторсодержащие метилзамещенные гидрокси-анилины типа (1) и (2) и изучены их реакции с бензальдегидом. Анилины 1, 2 представляют интерес не только как ценные прекурсоры NHC-лигандов; функционализация этих соединений актуальна также в плане поиска биоактивных веществ, поскольку структуры 1 и 2 включают в себя фармакофорную группу (CF3)2C(OH)C6H4N. Так, этот фрагмент содержится в некоторых противовоспалительных средствах (соединения 3 и 4) [9] (Рис.1).
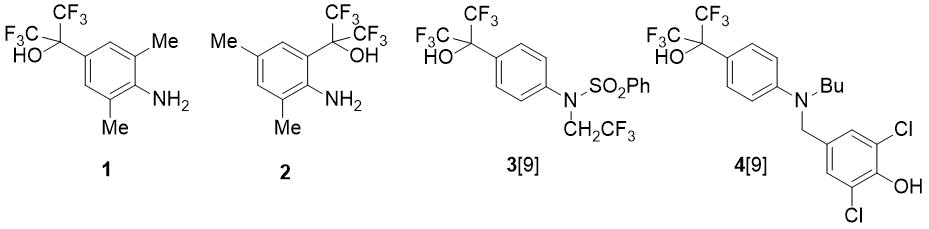
Рисунок 1. Гексафторизопропилгидроксизамещенные анилины.
Фторзамещенные анилины 1 и 2 ранее получали взаимодействием 2,6- или 2,4-ксилидинов с газообразным ГФА при 170-180С без растворителя [5] или (при синтезе 1) в закрытой системе во фреоне-113 (ClCF2CFCl2) [6], однако оба эти способа нетехнологичны. Для синтеза целевых анилинов 1 и 2 нами был выбран более удобный метод алкилирования ксилидинов коммерчески доступным гидратом ГФА•1,6H2O (т. кип. 104-106°С) в присутствии п-TolSO3H, опубликованный позже в работе [4]. Нами описаны усовершенствованные методики получения 1 и 2 (см. экспериментальную часть).
Известно, что для синтеза фторалкил(арил)замещенных N-гетероциклических карбенов, используемых для создания новых катализаторов метатезиса, необходимы анилины, содержащие во фторалкильном заместителе не гидрокси-, а алкокси-группу [4,7,8]. В связи с этим нами изучены реакции НО-содержащих анилинов 1 и 2 с бензальдегидом для защиты аминофункции и осуществления селективного О-алкилирования. Как оказалось, 2-(4-аминоарил)пропан-2-ол (1) реагирует с PhCHO уже при комнатной температуре, но при этом полная конверсия не достигается – согласно данным ЯМР 19F образуется смесь продукта конденсации (5, 62%) и исходного амина (1, 38%). Эту реакцию удалось довести до конца и выделить чистый альдимин 5 при добавлении гидрата п-толуолсульфокислоты (см. Схему 1).
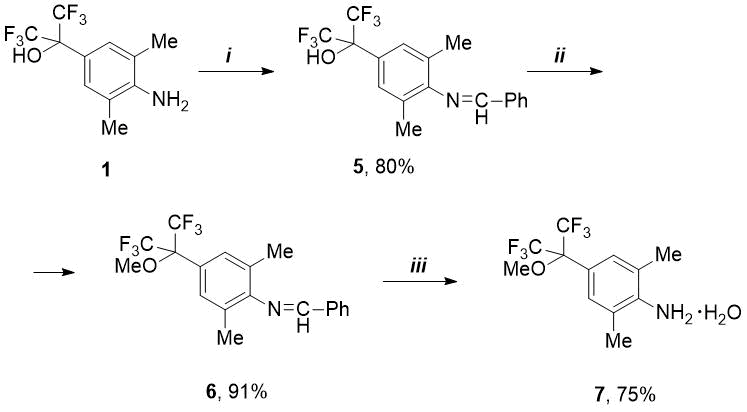
Схема 1. Реагенты и условия:
i) PhCHO, п-TolSO3H.H2O, 4,5 мол.%, толуол, кипячение в течение 5-7 ч;
ii) MeI, K2CO3, MeCN, 55-60C, 5ч; iii) 4M HCl/Et2O, затем Na2CO3/H2O.
Далее имин 5 был прометилирован в мягких условиях действием двойного избытка метилиодида в присутствии карбоната калия. Таким путем получено чистое метокси-производное 6 с отличным выходом без использования колоночной хроматографии. Соединение 6 оказалось довольно стабильным: попытки снятия бензилиденовой защиты в стандартных условиях – действием разбавленной HCl (1М или 2М) не увенчались успехом. Однако в более жестких условиях (4М HCl) удалось получить хлоргидрат метокси-амина, из которого свободный амин выделен в виде гидрата (соединение 7) после обработки водным раствором Na2CO3 (см. Схему 1). Аналогичный безводный амин ранее получали из 2,6-диметиланилина и ГФА в несколько стадий без выделения интермедиатов [4].
С целью синтеза o-алкилированного имина нами изучена реакция PhCHO с изомерным 2-(2-амино-арил)пропан-2-олом (2). Последний в отличие от амина 1 реагировал с бензальдегидом более энергично: если для синтеза 5 требовалось длительное кипячение (5-7 ч) в присутствии 4,5 мол.% катализатора, то в случае амина 2 время реакции составило всего лишь 1 ч 10 мин при использовании меньшего количества п-TolSO3H (1,6 мол.%). Однако в этом случае вместо ожидаемого имина был выделен новый бициклический фторсодержащий 1,3-бензоксазин (8) с количественным выходом (см. Схему 2). В литературе описано мало примеров получения CF3-замещенных бензоксазинов [10-13] (Рис. 2).
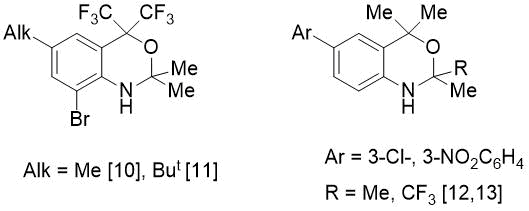
Рисунок 2. Замещенные бензоксазины, описанные в литературе.
Предложенный нами простой синтез NH-оксазина 8 пригоден для масштабирования ввиду доступности исходного аминоспирта 2 и легкости выделения 8 в чистом виде путем экстракции горячим гексаном, без использования колоночной хроматографии.
В отличие от гидрокси-имина 5 синтезированный нами оксазин 8 не реагировал с избытком метилиодида в присутствии К2CO3 в среде ацетонитрила даже при повышенных температурах. В других условиях – с большим избытком MeI (5,2 экв.) и карбоната цезия (3,5 экв.) в среде ДМФА при длительном нагревании (70С, 18 ч) конверсия исходного 8 составила 90%. При этом в результате конкурирующего N- и O-метилирования происходило образование двух продуктов – N-метилоксазина 9 и метокси-имина 10 в соотношении 2,5:1, которые были выделены с небольшими выходами с помощью колоночной хроматографии (см. Схему 2).
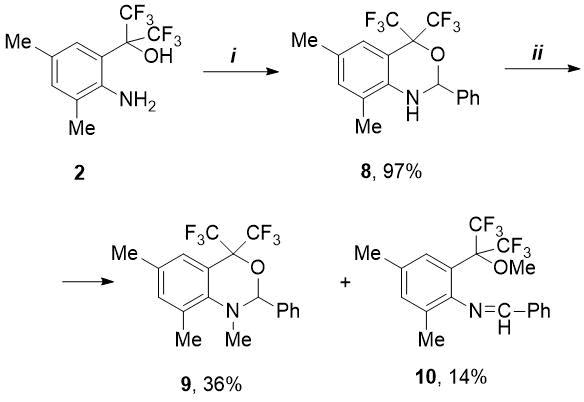
Схема 2. Реагенты и условия:
i) PhCHO, п-TolSO3H.H2O, 1,6 мол.%, толуол, кипячение в течение 1,2 ч;
ii) MeI, Cs2CO3, ДМФА, 70C, 18ч.
Далее в найденных условиях мы изучили реакции оксазина 8 с другими алкилгалогенидами. Нами показано, что взаимодействие 8 с 3 экв. этилиодида в присутствии 3 экв. Cs2CO3 в среде ДМФА при 75-80С в течение 20 ч приводит к 92%-ной конверсии исходного соединения. При этом в отличие от метилирования соотношение полученных этилзамещенных продуктов, - N-этилоксазина 11 и этокси-имина 12, равное 1:4,3 – оказалось в пользу последнего соединения (см. Схему 3). Предполагаемый механизм алкилирования оксазина 8 включает промежуточное образование гетероциклического аниона А, который далее реагирует по двум направлениям. Поскольку в SN2-реакциях метилгалогениды активнее, чем этилгалогениды [14], с MeI происходит преимущественное N-метилирование аниона А с образованием N-метилоксазина 9. В присутствии менее реакционноспособного EtI анион А претерпевает перегруппировку в алкоголят-анион Б, стабилизированный двумя CF3-группами, и в этом случае основным продуктом реакции оказывается этокси-имин 12 (см. Схему 3).
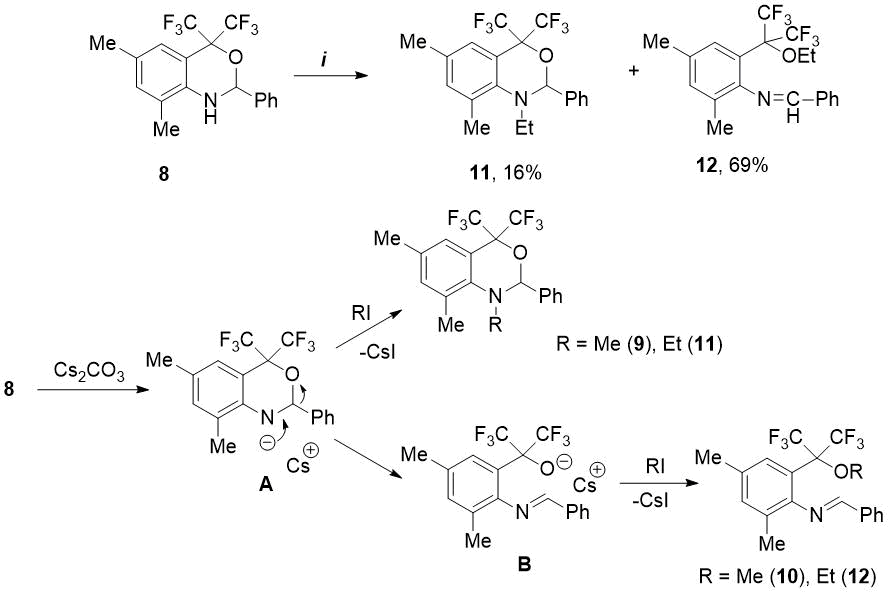
Схема 3. Реагенты и условия: i) EtI, Cs2CO3, ДМФА, 75-80C, 20ч.
Попытки алкилирования оксазина 8 изопропилбромидом при нагревании в различных условиях – в присутствии K2CO3 или Cs2CO3 в MeCN, а также NaH в ДМФА не увенчались успехом или приводили к низкой конверсии. Таким образом, алкилбромиды в отличие от иодидов не активны в подобных реакциях алкилирования.
Представляло интерес получение соответствующего амина из синтезированного этокси-имина 12. Последний оказался более устойчивым к гидролизу, чем п-метокси-имин 6 (см. Схему 1). В отличие от соединения 6 o-этокси-имин 12 не реагирует с 4М HCl в диэтиловом эфире. Соответствующий хлоргидрат этокси-амина 13 удалось получить действием более крепкой соляной кислоты (6М) в среде этанола. Свободный о-этокси-амин 14 получен из его хлоргидрата с количественным выходом действием избытка окиси пропилена при комнатной температуре (см. Схему 4).
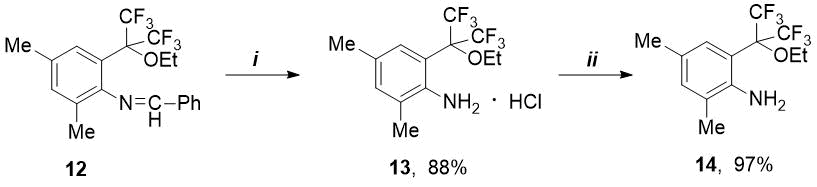
Схема 4. Реагенты и условия: i) 6М HCl/EtOH, 20C; ii) окись пропилена, 20С, 24 ч.
Синтезированные нами гидроксиимин 5, алкокси-имины 6, 10, 12, бензоксазины 8, 9, 11 и этокси-амин 14 являются новыми соединениями, состав и строение которых доказаны данными элементного анализа и спектроскопии ЯМР 1Н и 19F. В спектрах ЯМР 1Н иминов 5, 6, 10 и 12 характерными являются сигналы бензилиденового протона (CH=N) в области 7,6-8,2 м.д., тогда как сигнал NH оксазина 8 проявляется при 4 м.д.
Среди полученных соединений особый интерес представляют продукты гидролиза иминов 6 и 12 - стерически затрудненные ариламины 7 и 14 с объемными гексафторизопропилалкокси-группами, которые могут найти применение в качестве предшественников для синтеза фторсодержащих N-гетероциклических карбенов и металлокомплексов, являющихся, как показано недавно [4, 7, 8, 15,16], эффективными катализаторами.
Экспериментальная часть
Cпектры ЯМР регистрировали на приборах «Bruker Avance-300» и «Bruker Avance-400» с рабочими частотами 300 МГц и 400 МГц ( внутренний стандарт SiMe4) для 1Н ЯМР и 282 МГц и 376 МГц для 19F ЯМР (CF3COOH) соответственно. Элементный анализ выполнен в лаборатории элементного анализа ИНЭОС РАН. Контроль протекания реакций методом ТСХ осуществляли на пластинах фирмы «Merck» (силикагель 60 F254, 0.25 мм). Используемые 2,4- или 2,6-ксилидины и гидрат ГФА (ГФА.1,5H2O) являются коммерчески доступными реагентами. Растворители: петролейный эфир (ПЭ), этилацетат (ЭА) и N,N-диметилформамид (ДМФА).
2-(4-Амино-3,5-диметилфенил)-1,1,1,3,3,3-гексафторпропан-2-ол (1).
К смеси 5 г (41,3 ммоль) 2,6-ксилидина и 10,37 г (53,7 ммоль) ГФА•1,5H2O прибавляли 103,5 мг (0,545 ммоль) п-TolSO3H•H2O, и образующийся раствор нагревали при перемешивании при 99-103°С до завершения реакции (5,5 ч). Температуру доводили до комнатной, твердую реакционную смесь обрабатывали этилацетатом (45 мл) и 1 М NaOH (20 мл) до растворения. Органический слой отделяли, водный экстрагировали этилацетатом. Объединенные органические слои промыли насыщенным раствором NaCl и высушили над MgSO4. Растворитель удаляли в вакууме, остаток промывали гексаном и сушили в вакууме. Получили 10,56 г (89%) соединения 1 в виде порошка светло-сиреневого цвета. Т.пл. 179-180°С (в [5] 174-175С, в [6] 173-175°С), RF = 0,46 (раствор в Me2CO, в системе Me2CO – СCl4 = 1:3).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д.): 2,27 (с, 6Н, 2Ме); 2,93 (уш.с, 3Н, NH2, OH); 7,31 (с, 2H, Ar).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д.): 1,95 (с, 6F, 2CF3).
2-(2-Амино-3,5-диметилфенил)-1,1,1,3,3,3-гексафторпропан-2-ол (2).
Получен из 2,4-ксилидина по методике, описанной в литературе [4], но вместо 20 ч нагрев вели в течение 9 ч при 100-105С. Выход 81%, кристаллы бежевого цвета. Т.пл. 113-115°С (в [4] 110-112°С, в [5] 113-114°С), RF = 0,63 (раствор в CHCl3, в системе ЭА – ПЭ = 1:2).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д.): 2,36 (с, 3Н, Ме); 2,38 (с, 3Н, Me); 5,70 (уш.с, 3Н, NH2, OH); 7,18 (с, 1Н, Ar); 7,32 (с, 1H, Ar).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д.): 2,60 (с, 6F, 2CF3).
2-[4-(Бензилиденамино)-3,5-диметилфенил]-1,1,1,3,3,3-гексафторпропан-2-ол (5).
В колбу с насадкой Дина-Старка помещали 3,0 г (10,45 ммоль) аминоспирта 1, 2,22 г (20,9 ммоль) бензальдегида, 89 мг (0,47 ммоль) п-TolSO3H•H2O и 20 мл толуола. Смесь кипятили при перемешивании до прекращения выделения воды (5-7 ч, ТСХ-контроль в системе Me2CO – СCl4 = 1:10). После полной конверсии исходного соединения реакционную смесь упарили в вакууме досуха, остаток кристаллизовали из гексана и сушили на воздухе. Получили 3,14 г (80%) соединения 5 в виде белого порошка. Т.пл. 135-138°С, RF = 0,48 (раствор в CH2Cl2, в системе Me2CO – СCl4 = 1:10).
Спектр 1Н ЯМР (300 МГц, C6D6, , м.д.): 2,06 (с, 6Н, 2Ме); 3,73 (с, 1Н, ОН); 7,22-7,24 (м, 3Н, Ph); 7,61 (с, 1Н, -CH=N); 7,67 (с, 2H, Ar); 7,84-7,87 (м, 2Н, Ph).
Спектр 19F ЯМР (282 МГц, C6D6, , м.д.): 2,70 (с, 6F, 2CF3).
Найдено (%): С, 57,45; Н, 3,93; F, 30,56; N, 3,94. C8H15F6NO. Вычислено (%): С, 57,60; Н, 4,00; F, 30,40; N, 3,73.
N-Бензилиден-4-(1,1,1,3,3,3-гексафтор-2-метоксипропан-2-ил)-2,6 диметиланилин (6).
К раствору 2,95 г (7,9 ммоль) гидроксиимина 5 в ацетонитриле (20 мл) прибавили 2,18 г (15,8 ммоль) K2CO3, затем 2,24 г (15,8 ммоль) метилиодида в ацетонитриле (8 мл), и смесь нагревали при интенсивном перемешивании при 55-60С до завершения реакции (5 ч, ТСХ-контроль в системе Me2CO – СCl4 = 1:10). Температуру смеси доводили до 20°С, осадок удалили фильтрованием. Маточный раствор упаривали в вакууме, остаток обрабатывали смесью бензола и диэтилового эфира (20 мл, 1:1). Фильтрат после удаления твердых примесей упаривали досуха в вакууме 10 и 1 Торр при 45-70°С. Получили имин 6 в виде густого масла бурого цвета, затвердевающего при охлаждении в низкоплавкую массу светло-бежевого цвета. Выход 2,78 г (91%), RF = 0,82 (раствор в C6H6, в системе Me2CO – СCl4 = 1:10).
Спектр 1Н ЯМР (300 МГц, C6D6, , м.д.): 2,08 (с, 6Н, 2Ме); 3,32 (с, 3Н, ОМе); 7,24-7,26 (м, 3Н, Ph); 7,53 (с, 2H, Ar); 7,67 (с, 1Н, -CH=N); 7,85-7,88 (м, 2Н, Ph).
Спектр 19F ЯМР (282 МГц, C6D6, , м.д.): 7,18 (с, 6F, 2CF3).
Найдено (%): С, 58,39; Н, 4,35; N, 3,78. C19H17F6NO. Вычислено (%): С, 58,61; Н, 4,37; N, 3,60.
Моногидрат-4-(1,1,1,3,3,3-гексафтор-2-метоксипропан-2-ил)-2,6 диметиланилин (7).
К раствору 2,78 г (7,15 ммоль) метоксиимина 6 в диэтиловом эфире (30 мл) прибавляли 12 мл 4М HCl (48 ммоль), и смесь энергично перемешивали при комнатной температуре до завершения реакции (ТСХ-контроль). На следующий день выпавший осадок фильтровали и промывали гексаном. Получили 1,99 г (83%) хлоргидрата амина в виде белых кристаллов с т.пл. 173-178°С. Для выделения свободного амина к хлоргидрату добавляли 16 мл 15%-ного водного раствора Na2CO3 (22,6 ммоль), и смесь перемешивали при 20С в течение 0,5-1 ч. Образующийся осадок отфильтровали, промывали водой и гексаном, затем сушили на воздухе. Получили 1,41 г (75% в расчете на хлоргидрат) гидрата амина (соединение 7) в виде белых кристаллов с т.пл. 89-91°С (для безводного амина т.пл. 84-85°С [4]) и RF = 0,36 (раствор в CHCl3, в системе Me2CO – СCl4 = 1:15).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д.): 1,63 (с, 2Н, Н2О); 2,28 (с, 6Н, 2Ме); 3,52 (с, 3Н, ОМе); 3,85 (с, 2Н, NH2); 7,17 (с, 2H, Ar).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д.): 6,61 (с, 6F, 2CF3).
Найдено (%): С, 45,47; Н, 4,47; F, 35,70; N, 4,36. C12H13F6NOH2O (C12H15F6NO2). Вычислено (%): С, 45,14; Н, 4,70; F, 35,74; N, 4,39.
6,8-Диметил-2-фенил-4,4-бис(трифторметил)-2,4-дигидро-1Н-бензо[d][1,3]оксазин (8).
Смесь 3 г (10,45 ммоль) амина 2, 1,71 г (16,13 ммоль) бензальдегида, 32,3 мг (0,17 ммоль) п-TolSO3H•H2O и 15 мл толуола кипятили при перемешивании в колбе с насадкой Дина-Старка до прекращения выделения воды (1 ч 10 мин) и завершения реакции (ТСХ-контроль в системе Me2CO – СCl4 = 1:6). Реакционный раствор коричневого цвета упаривали досуха в вакууме 10 и 1 Торр при 60-80°С. Продукт экстрагировали из остатка несколько раз горячим гексаном. После удаления растворителя получили 3,81 г (97%) оксазина 8 виде светло-кремовых кристаллов с т.пл. 86-87°С и RF = 0,50-0,54 (раствор в CHCl3, в системе Me2CO – СCl4 = 1:10).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д.): 2,25 (с, 3Н, Ме); 2,39 (с, 3Н, Ме); 4,00 (уш.с, 1Н, NH); 5,78 (с, 1Н, СН); 7,15 (уш. с, 1Н, Ar); 7,33 (уш. с, 1Н, Ar); 7,52-7,55 (м, 3Н, Ph); 7,68-7,71 (м, 2Н, Ph).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д., J/Гц): 1,82 (кв, JF-F = 8,8, 3F, CF3); 5,69 (кв, JF‑F = 8,8, 3F, CF3).
Найдено (%): С, 57,68; Н, 3,91; N, 3,73. C18H15F6NO. Вычислено (%): С, 57,60; Н, 4,00; N, 3,73.
1,6,8-Триметил-2-фенил-4,4-бис(трифторметил)-2,4-дигидро-1Н-бензо[d][1,3]оксазин (9).
Смесь 0,5 г (1,33 ммоль) оксазина 8, 0,98 г (6,9 ммоль) метилиодида, 1,52 г (4,67 ммоль) карбоната цезия и 4,8 мл ДМФА нагревали при интенсивном перемешивании при 70°С до исчезновения основной массы исходного 8 (18 ч, ТСХ-контроль в системе ПЭ-ЭА = 15:1). Реакционную массу охладили до 20°С и добавили 12 мл смеси бензола и диэтилового эфира (1:1). Осадок удалили фильтрованием, маточный раствор упаривали в вакууме 10 и 1 Торр при 45-72°С. Сырой продукт – 0,6 г бурого масла, содержащего 10% исходного 8, очищали колоночной хроматографией с градиентным элюированием (ПЭ, затем ПЭ-ЭА = 30:1). Выделен преобладающий продукт с более высоким RF. Получили 0,19 г (36%) оксазина 9 в виде белых кристаллов с т.пл. 88-89°С и RF = 0,50 (раствор в CHCl3, в системе ПЭ – ЭА = 30:1).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д.): 2,40 (с, 3Н, NМе); 2,42 (с, 3Н, Ме); 2,43 (с, 3Н, Ме); 5,93 (с, 1Н, СН); 7,24 (уш. с, 1Н, Ar); 7,36 (уш. с, 1Н, Ar); 7,41-7,56 (м, 3Н, Ph); 7,66-7,72 (м, 2Н, Ph).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д., J/Гц): 2,87 (кв, JF-F = 9,6, 3F, CF3); 5,10 (кв, JF-F = 9,6, 3F, CF3).
Найдено (%): С, 58,69; Н, 4,43; N, 3,56. C19H17F6NO. Вычислено (%): С, 58,61; Н, 4,37; N, 3,60.
N-Бензилиден-2-(1,1,1,3,3,3-гексафтор-2-метоксипропан-2-ил)-4,6-диметиланилин (10).
При дальнейшем элюировании смеси (после выделения оксазина 9) получили 74 мг (14%) минорного продукта 10 в виде бесцветного масла, RF = 0,36 (в системе ПЭ – ЭА = 30:1).
Спектр 1Н ЯМР (300 МГц, CDCl3, , м.д., J/Гц): 2,44 (с, 6Н, 2Ме); 2,59 (с, 3Н, ОМе); 7,21 (уш. с, 1Н, Ar); 7,28 (уш. с, 1Н, Ar); 7,40-7,72 (м, 5Н, Ph); 8,23 (д, 1Н, -СН=N, J = 6,7).
Спектр 19F ЯМР (282 МГц, CDCl3, , м.д.): 1,68 (с, 6F, 2CF3).
Найдено (%): С, 58,41; Н, 4,52; N, 3,78. C19H17F6NO. Вычислено (%): С, 58,61; Н, 4,37; N, 3,60.
1-Этил-6,8-диметил-2-фенил-4,4-бис(трифторметил)-2,4-дигидро-1Н-бензо[d][1,3]оксазин (11).
Смесь 1,51 г (4,03 ммоль) оксазина 8, 1,99 г (12,76 ммоль) этилиодида, 3,94 г (12,08 ммоль) карбоната цезия и 12 мл ДМФА нагревали при интенсивном перемешивании при 75-80°С до исчезновения основной массы исходного 8 (20 ч, ТСХ-контроль в системе ПЭ-ЭА = 15:1). После охлаждения до 20°С к реакционной смеси добавили диэтиловый эфир (40 мл), осадок удалили фильтрованием. Маточный раствор промыли холодной водой и сушили над MgSO4. Фильтрат после удаления MgSO4 упарили в вакууме 10 Торр при 40-71°С. Сырой продукт – 1,64 г желтого масла, содержащего 8% исходного 8, очищали колоночной хроматографией с градиентным элюированием (ПЭ-ЭА = 30:1, 20:1). Выделен минорный продукт с более высоким RF – оксазин 11, выход 0.26 г (16%) в виде белых кристаллов с т.пл. 94-96С и RF = 0,68-0,73 (в системе ПЭ – ЭА = 20:1).
Спектр 1Н ЯМР (400 МГц, CDCl3, , м.д., J/Гц): 0,69 (т, 3Н, Ме, J = 9,6); 2,43 (с, 6Н, 2Ме); 2,63-2.76 (м, 1Н, СН2); 3,30-3.45 (м, 1Н, СН2); 6,00 (с, 1Н, СН); 7,24 (с, 1Н, Ar); 7,32 (уш. с, 1Н, Ar); 7,39-7,51 (м, 3Н, Ph); 7,61-7,70 (м, 2Н, Ph).
Спектр 19F ЯМР (376 МГц, CDCl3, , м.д., J/Гц): 2,38 (д, JF-F = 11,3, 3F, CF3); 3,57 (д, JF-F = 11,3, 3F, CF3).
Найдено (%): С, 59,54; Н, 4,68; N, 3,44. C20H19F6NO. Вычислено (%): С, 59,55; Н, 4,71; N, 3,47.
N-Бензилиден-2-(2-этокси-1,1,1,3,3,3-гексафторпропан-2-ил)-4,6-диметиланилин (12).
При дальнейшем элюировании смеси (после выделения оксазина 11) получили 1,12 г (69%) преобладающего продукта 12 в виде густого масла желтого цвета, RF = 0,48 (в системе ПЭ – ЭА = 20:1).
Спектр 1Н ЯМР (400 МГц, CDCl3, , м.д., J/Гц): 1,34 (т, 3Н, Ме, J = 8,0); 2,15 (с, 3Н, Ме); 2,41 (с, 3Н, Ме); 3,79 (кв, 2Н, ОСН2, J = 8,0); 7,24 (с, 1Н, Ar); 7,32 (с, 1Н, Ar); 7,50-7,65 (м, 3Н, Ph); 7,88-8,02 (м, 2Н, Ph); 8,14 (с, 1Н, -СН=N).
Спектр 19F ЯМР (376 МГц, CDCl3, , м.д.): 7,29 (с, 6F, 2CF3).
Найдено (%): С, 59,31; Н, 4,56; N, 3,68. C20H19F6NO. Вычислено (%): С, 59,55; Н, 4,71; N, 3,47.
2-(1,1,1,3,3,3-Гексафтор-2-этоксипропан-2-ил)-4,6-диметиланилин (14).
К раствору 1,19 г (2,95 ммоль) этоксиимина 12 в 10 мл этилового спирта прибавляли 4,9 мл 6М HCl, и смесь энергично перемешивали при 20°С до завершения реакции (24 ч, ТСХ-контроль в системе ПЭ-ЭА = 15:1). Реакционный раствор упарили досуха в вакууме 16 Торр при 50-70°С, остаток промывали диэтиловым эфиром. Получили 0,91 г (2,59 ммоль, 88%) хлоргидрата 13 в виде белого порошка. Для выделения свободного амина полученный хлоргидрат 13 растворяли в избытке (18 мл) окиси пропилена (14,94 г, 0,26 моль) и перемешивали при 20°С в течение 24 ч. Реакционную смесь упарили досуха в вакууме 10 Торр при 40-73С. Получили 0,79 г (97% в расчете на 13) амина 14 в виде белых кристаллов с т.пл. 53-54°С и RF = 0,44 (в системе ПЭ – ЭА = 10:1).
Спектр 1Н ЯМР (400 МГц, CDCl3, , м.д., J/Гц): 1,42 (т, 3Н, Ме, J = 8,8); 2,21 (с, 3Н, Ме); 2,29 (с, 3Н, Ме); 3,75 (кв, 2Н, ОСН2, J = 8,8); 4,53 (уш. с, 2Н, NН2); 7,06 (с, 2Н, Ar).
Спектр 19F ЯМР (376 МГц, CDCl3, , м.д.): 7,24 (c, 6F, 2CF3).
Найдено (%): С, 49,29; Н, 4,55; N, 4,66. C13H15F6NO. Вычислено (%): С, 49,52; Н, 4,76; N, 4,44.
Выводы
На основе реакций фторзамещенных 2-(2- или 4-аминоарил)пропан-2-олов 1 и 2 с бензальдегидом получены новые фторсодержащие гидрокси- и алкокси-замещенные бензилиденимины 5, 6, 10 и 12, которые могут быть востребованы в синтезе бис-(CF3)-содержащих N-гетероциклов и аминов.
Синтезированы новые CF3-содержащие гетероциклические соединения – NH-, N(Me)- и N(Et)-бензоксазины 8, 9 и 11 действием бензальдегида на фторзамещенный 2-(2-аминоарил)пропан-2-ол 2 с последующим алкилированием. Эти соединения представляют интерес для медицинской химии, поскольку фрагмент 1,3-оксазина встречается как в природных антибиотиках [17], так и в некоторых синтетических лекарственных средствах [12,13].
Показано, что NH-бензоксазин 8 проявляет двойственную реакционную способность по отношению к алкилиодидам, давая смесь продуктов N - (9, 11) и О-алкилирования (10, 12), соотношение которых зависит от природы алкильного радикала.
Благодарности
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Васильева Т.П., Воробьева Д.В., Изв. АН. Сер. хим., 2018, 67, 1426.
- Васильева Т.П., Воробьева Д.В., Изв. АН. Сер. хим., 2020, 69, 300.
- Воробьева Д.В., Васильева Т.П., Осипов С.Н., Изв. АН. Сер. хим., 2018, 1459.
- Masoud S.M., Mailyan A.K., Dorcet V., Roisnel T., Dixneuf P., Bruneau C., Osipov S.N., Organometallics, 2015, 34, 2305.
- Gilbert E., Jones E., Sibilia J., J. Org. Chem., 1965, 30, 1001.
- Чкаников Н.Д., Свиридов В.Д., Зеленин А.Е., Галахов М.В., Коломиец А.Ф., Фокин А.В., Изв. АН СССР. Сер. хим., 1990, 383.
- Topchiy M.A., Zotova M.A., Masoud S.M., Mailyan A.K., Ananyev I.V., Nefedov S.E., Asachenko A.F., Osipov S.N., Chem. Eur. J., 2017, 23, 6663.
- Akmalov T.R., Masoud S.M., Petropavlovskikh D.A., Zotova M.A., Nefedov S.E., Osipov S.N., Mendeleev Commun., 2018, 28, 609.
- Chao E., Caravella J., Watson M., Campobasso N., Ghisletti S., Billin A., Galardi C., Wang P., Laffitte B., Iannone M., Goodwin B., Nichols J., Parks D., Stewart E., Wiethe R., Williams S., Smallwood A., Pearce K., Glass C., Willson T., Zuercher W., Collins J., J. Med. Chem., 2008, 51, 5758.
- Nguyen T., Amey R., Martin J., J. Org. Chem, 1982, 47, 1024.
- Nguyen T., Wilson S., Martin J., J. Am. Chem. Soc., 1986, 108, 3803.
- Zhang P., Fensome A., Terefenko E.A., Wrobel J.E., Edwards J.P., Jones T.K., Tegley C.M., Zhi L., Patent US 6358948, 2002.
- Grubb G.S., Zhi L., Jones T.K., Zhang P., Edwards J.P., Fensome A., Terefenko E.A., Wrobel J.E., Tegley C.M., Patent US 6498154, 2002.
- Сондерс У., Ионные реакции в алифатическом ряду, Изд-во «Мир», Москва, 1967, 71c.
- Masoud S.M., Akmalov T.R., Palagin K.A., Dolgushin F.M., Nefedov S.E., Osipov S.N., Eur. J. Org. Chem., 2018, 5988.
- Masoud S.M., Vorobyeva D.V., Petropavlovskikh D.A., Bruneau C., Osipov S.N., Russ. Chem. Rev., 2021, 90(4), 419 [Успехи химии, 2021, 90(4), 419].
- Джилкрист Т., Химия гетероциклических соединений, Изд-во «Мир», Москва, 1996, 333.
Статья рекомендована к публикации членом редколлегии к.х.н. М. А. Манаенковой
Fluorine Notes, 2021, 137, 3-4


