Поступило в редакцию: Май 2021
УДК 547.221
Fluorine Notes, 2021, 136, 1-2
ФТОРСОДЕРЖАЩИЕ ПРОСТЫЕ ЭФИРЫ. СООБЩЕНИЕ 1.
ПОЛУЧЕНИЕ ПРОСТЫХ ЭФИРОВ РЕАКЦИЕЙ ВИЛЬЯМСОНА И ПРИСОЕДИНЕНИЕМ
СПИРТОВК АЛКЕНАМ И АЛКИНАМ
С.В. Вершилова, В.В. Корнилов, А.С. Цырульниковаа,б, Л.М. Поповаа,б, Н.В. Лебедевб
а ФГУП «Научно-исследовательский институт синтетического каучука им. Академика С.В.Лебедева», ул. Гапсальская 1, Санкт-Петербург, 198035, Россия
б Санкт-Петербургский политехнический университет Петра Великого, ул. Новороссийская 48, Санкт-Петербург, 194021 Россия
Аннотация: В обзоре рассмотрены основные методы синтеза фторсодержащих простых эфиров, а именно: различные вариации реакции Вильямсона и реакции присоединения алкенов и алкинов к спиртам. В обоих методах исходный фторсодержащий фрагмент может присутствовать как в исходном спирте (алкоголяте), так и в алкилгалогениде (или алкене), или в обоих исходных компонентах в зависимости от желаемой структуры целевого соединения.
Ключевые слова: алкилирование, алкилгалогениды, фторсодержащие спирты, реакция Вильямсона, фторированные алкены.
Введение
Фторсодержащие простые эфиры привлекают внимание исследователей с середины 20 века. Известно, что количество, а также положение как отдельных (единичных) атомов фтора, так и перфторированных фрагментов, оказывает существенное влияние на химические и физико-химические свойства органических молекул. В случае простых эфиров реализация такого подхода часто приводит к получению продуктов с требуемыми характеристиками, но также часто требует разработки новых методов синтеза. Комбинирование в структуре молекул высоко фторированных (перфторированных) и углеводородных фрагментов, а также варьирование длины углеродных цепей позволяют получать материалы, во многом обеспечивающие развитие новых химических технологий («фторный» бифазный катализ, «фторное» разделение), производства теплоносителей, полимерных материалов, самоорганизующихся систем, медико-биологических разработок и нанотехнологий микроэлектроники и др.
Введение единичного атома фтора в молекулу простого эфира осуществляется методами, которые применимы и для других классов соединений. К числу таких методов можно, например, отнести замещение другого галогена фтором при действии фторидов некоторых металлов (KF, HgF, HgF2) или фтористым водородом.
При этом в большинстве случаев эфирная связь устойчива к действию даже сильных фторирующих агентов [1].
Так этил-β-фторэтиловый эфир был получен с выходом 40% нагреванием (240-250°C) соответствующего хлорпроизводного с KF [1]:

В работах Свартса описано применение монофторида ртути для замещения атома брома, находящегося у вторичного
углерода в молекуле 2,3-дибромпропилэтилокого эфира (160-170°C, 1 сутки, 18,5%) [1]:
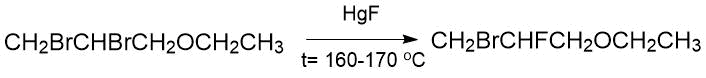
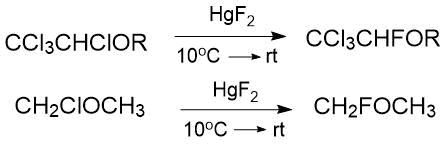
Использование фторида ртути (II) позволяет проводить замещение на фтор галогенов, находящихся в α-положении к эфирной связи, в более мягких условиях (10-20°C, 42%) [2].
Для получения полифторированных простых эфиров можно выделить два основных способа получения:
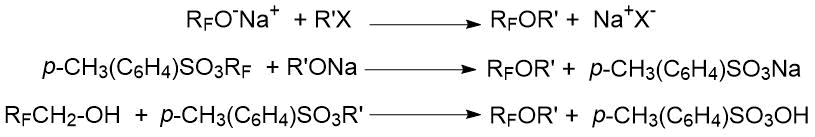
1) взаимодействие спиртов (алкоголятов) с алкилгалогенидами, а также тозилатами, сульфатами, сульфинатами и др.:
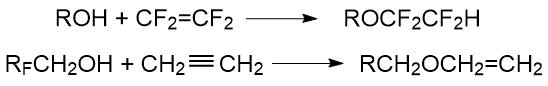
2) присоединение спиртов к алкенам и алкинам:
В обоих методах исходный фторсодержащий фрагмент может присутствовать как в исходном спирте (алкоголяте), так и в алкилгалогениде (или алкене), или в обоих исходных компонентах в зависимости от желаемой структуры целевого соединения.
Кроме основных методов, существуют несколько частных способов синтеза фторсодержащих простых эфиров определенной структуры, которые подробно будут рассмотрены во второй части обзора. В частности, метил фторалкиловые эфиры могут быть получены взаимодействием фторированных спиртов с диазометаном. В некоторых случаях применяют реакцию присоединения полифторалкилиодидов к алкенам (в том числе и фтосодержащим), которые уже имеют в своей структуре эфирную связь. Этот метод удобен для введения перфторалкильной группы в существующую структуру.
А. Хенне и М. Смук в своей работе [3] сообщали о неудачной попытке получения фторсодержащих простых эфиров одним из классических методов – межмолекулярной дегидратацией спиртов на примере трифторэтанола и 3,3,3-трифторпропанола. Поэтому, несмотря на то, что данная реакция теоретически возможна для синтеза каких-то конкретных эфиров, ее не следует рассматривать в качестве универсального способа получения.
1. Алкилирование спиртов
1.1. Алкилирование фторсодержащих спиртов алкилгалогенидами
Классическим способом получения простых эфиров является реакция Вильямсона, которая заключается во взаимодействии алкоголята щелочного металла с алкилгалогенидом [4].
Применительно к фторсодержащим простым эфирам известно несколько вариантов данного метода, отличающихся условиями проведения (катализатор, растворитель, температура, время синтеза) и способом генерирования алкоголятов.
Одним из первых примеров синтеза фторсодержащих простых эфиров взаимодействием алкоголятов полифторалканолов с алкилгалогенидами является патент МакБи с соавт. [5].
Трифторэтилат натрия, предварительно полученный при взаимодействии трифторэтанола с натрием в среде диоксана, нагревали в металлической ампуле с этилбромидом (130°С, 89 ч). После фракционной перегонки был получен 2,2,2-трифторэтил-этиловый эфир (CF3CH2OCH2СН3) с т. кип. 50,3°С, плотностью 1,065 г/см3 и nD25 1,3065.
В реакции с полифторалканолами алкилбромиды были предпочтительнее соответствующих хлоридов или иодидов поскольку обеспечивали более высокую конверсию спиртов и выход целевых эфиров [3].
Согласно стандартной процедуре, Хенне и Смук [3] обрабатывали фторсодержащие спирты металлическим натрием, помещали в автоклав, прибавляли алкилгалогенид, после чего выдерживали при 200°С и давлении 36 атм в течение 15 часов. Результаты представлены в Табл. 1.1.
Таблица 1.1
|
ROH |
RX |
Продукт *) |
Конверсия/выход, % |
Т.кип., °С / ρ, г/см3 |
|
CF3CH2OH |
CH3I |
CF3CH2OСН3 |
- |
31,2(746) / 1,1661(3°С) |
|
CF3CH2OH |
CH3Br |
43 / 61 |
||
|
CF3CH2OH |
C2H5Cl |
CF3CH2OС2Н5 |
Небольшие количества |
49,9(742) / 1,0910(20) |
|
CF3CH2OH |
C2H5Br |
-/ 60 |
||
|
CF3CH2OH |
CClF2CH3 |
CF3CH2OСF2CН5 |
28 / 24 |
37,8 /- (разлагается при хранении) |
|
CF3C2H4OH |
CH3Br |
CF3C2H4OСН3 |
-/43 |
54,9(753) / 1,1129(20) |
|
CF3C2H4OH |
C2H5Br |
CF3C2H4OС2Н5 |
-/30 |
72,3(746) / 1,0593(20) |
|
*) Na, 200°С, 36 атм, 15 ч. |
||||
Питтман и Уэсли [6] синтезировали ряд простых эфиров взаимодействием гептафторизопропилата калия (CF3)2FCOK и 1,2-дихлорпентафторизопропилата калия (CF2Cl)2FCOK с 1-бром-2-хлорэтаном или 1,2-дибромэтаном по следующей схеме:
(CF3)2FCOK + CH2BrCH2Х → (CF3)2FCOCH2CH2B(Х)
где X=Cl, Br.
Исходные алкоголяты были получены из полностью галогенированных производных ацетона (в частности гексафторацетона) обработкой фторидом калия в диглиме. Таким способом были получены, в частности, 2-(2-бромэтокси)гептафторпропан и 2-(2-хлорэтокси)гептафторпропан:
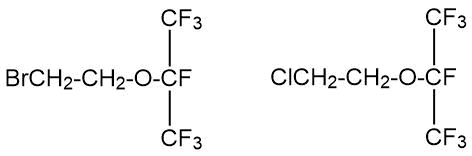
Благодаря относительно высокой кислотности полифторалканолов общей формулы RFCH2OH [1], алкоксид-ионы могут быть получены не только при обработке этих спиртов щелочными металлами, но также и при взаимодействии с гидроксидами щелочных металлов в подходящем растворителе или в бифазных водных системах.
Так в статье Д.Н. Бажина с сотр. [7] описано алкилирование спиртов-теломеров вида H(CF2CF2)nCH2OH
(n = 1-3) алкилгалогенидами с различной длинной углеводородной цепи в присутствии гидроксида калия
в среде ДМСО, а также в условиях бифазной системы дихлорметан/водный гидроксид калия:

где X=Cl, Br; R=C4H9 , C6H13, C10H21.
Авторами было показано, что в среде ДМСО выход целевых эфиров (n = 1) составлял 45-55%, а в смеси дихлорметан/водный гидроксид калия в присутствии катализатора мажфазного переноса (КМП) был существенно выше (87-94%) для продуктов с n =2 или 3. Примеры представлены в Табл. 1.2.
Таблица 1.2. Выходы и характеристики полифторированных простых эфиров [7]
|
№ |
Формула эфира |
Метод*) |
Выход, % |
Т.кип.,°С/мм.рт.ст |
|
I |
HCF2CF2CH2O(CH2)3СН3 |
1 |
45 |
140-141 |
|
II |
HCF2CF2CH2O(CH2)5CH3 |
1 |
49 |
170-171 |
|
III |
HCF2CF2CH2O(CH2)9CH3 |
1 |
55 |
105-107/6 |
|
IV |
H(CF2CF2)2CH2O(CH2)3CH3 |
2 |
87 |
179-180 |
|
V |
H(CF2CF2)2CH2O(CH2)5CH3 |
2 |
89 |
196-198 |
|
VI |
H(CF2CF2)2CH2O(CH2)9CH3 |
2 |
94 |
195-196/30 |
|
VII |
H(CF2CF2)3CH2O(CH2)3CH3 |
2 |
89 |
201-202 |
|
VIII |
H(CF2CF2)3CH2O(CH2)5CH3 |
2 |
88 |
160-161/30 |
|
IX |
H(CF2CF2)3CH2O(CH2)9CH3 |
2 |
96 |
217-220/30 |
*) Метод 1: RX, КОН, ДМСО, затем спирт-теломер при 100°С, 8 ч.
Метод 2: CH2Cl2, КОН (40%-й водн. р-р), H(CF2CF2)nCH2OH, ТЭБАХ, 40°С, затем RX, 40°С, 5 ч.
В статье Хуанга c соавт. [8] описан синтез ряда углеводород-фторуглеродных ПАВ, которые представляли из себя соединения с простой эфирной связью [8].
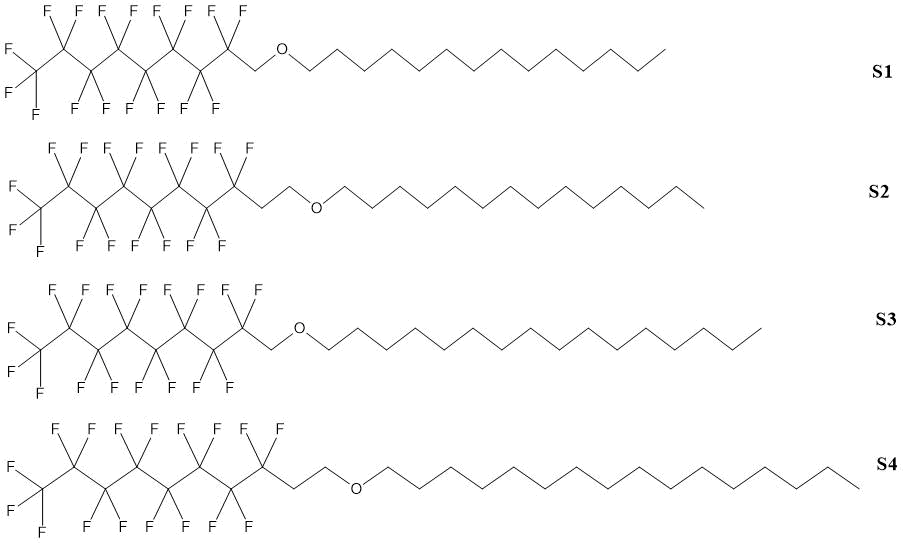
Алкиловые эфиры 1H,1H-перфторнонан-1-ола и 1H,1H,2H,2H-перфтордекан-1-ола получали в одну стадию тремя вариациями реакции Вильямсона (Табл. 1.3).
Таблица 1.3. Выходы и характеристики алкиловых эфиров 1H,1H-перфторнонан-1-ола и 1H,1H,2H,2H-перфтордекан-1-ола [8].
|
№ |
Эфир |
Метод*) |
Выход,% |
Т.пл.,°С |
|
1 |
S1 |
1 |
70 |
31 |
|
2 |
S2 |
2 |
70 |
35 |
|
3 |
S3 |
1 |
71 |
39 |
|
4 |
S4 |
3 |
52 |
42 |
*) Метод 1: RF(CH2)nOH, ТГФ, NaH, 40°С, 1 ч, затем RBr, кипячение 4 дня.
Метод 2: RF(CH2)nOH, С6Н6, ТГФ, Bu4N+HSO4-, NaOH (50%-й водн. р-р), 10°С, 1.5 ч, затем RBr, 20°С, 4 дня.
Метод 3: RF(CH2)nOH, КОН, ДМСО, RBr, 70°С, 2 дня. Метод очистки – колоночная флэш- хроматография
1.2. Алкилирование фторсодержащих спиртов алкенилгалогенидами
Простые эфиры полифторалканолов, содержащие ненасыщенный углеводородный фрагмент, представляют повышенный интерес, прежде всего как потенциальные мономеры.
Так, виниловые эфиры различной структуры можно получать дегалогенированием 2-галогенэтоксиполифторалканов гидроксидом калия в спирте [6]:

Реакцией фторсодержащих спиртов с алкилгалогенид виниловым эфиром можно получить диэфиры с перфторалкиловым фрагментом и терминальной винильной группой [9]:
Аллиловые эфиры полифторированных спиртов в большинстве случаев также получают реакцией Вильямсона через взаимодействие алкоголятов полифторалканолов с аллилгалогенидами (хлоридами, или бромидами) в различных условиях.
Так в работе [10] было описано получение таких соединений нагреванием алкоголятов полифторалканолов с аллилгалогенидами в среде безводного растворителя. Результаты представлены в Табл. 1.4.
Исходный алкоголят генерировали либо предварительно при обработке фторалканола натрием, либо in situ с применением безводного карбоната калия и ацетона.
Таблица 1.4. Аллилполифторалкиловые эфиры общей формулы ROCH2CH=CH2 [10].
|
ROH |
X-CH2CH=CH2 |
Параметры процесса |
Выход, % |
|
CF3CH2OH |
ClCH2CH=CH2 |
Na, диглим, 80°С, 20 ч |
66 |
|
CF3(CF2)2CH2OH |
BrCH2CH=CH2 |
Na, (CH3CH2)2O, t. кип., 16 ч |
67 |
|
K2CO3, (CH3)2CO, t. кип., 3 дня |
52 |
||
|
CF3(CF2)6CH2OH |
ClCH2CH=CH2 |
K2CO3, (CH3)2CO, t. кип., 3 дня |
37 |
|
H(CF2)2CH2OH |
ClCH2CH=CH2 |
Na, диглим, 80°С, 20 ч |
43 |
|
H(CF2)4CH2OH |
ClCH2CH=CH2 |
Na, диглим, 80°С, 20 ч |
21 |
|
H(CF2)6CH2OH |
BrCH2CH=CH2 |
Na, (CH3CH2)2O, t. кип., 16 ч |
24 |
|
H(CF2)10CH2OH |
BrCH2CH=CH2 |
K2CO3, (CH3)2CO, t. кип., 3 дня |
25 |
|
K2CO3, (CH3)C(O)C2H5, t. кип., 3 дня |
35 |
Получению аллиловых эфиров тригидроперфторированных спиртов общей формулы H(CF2CF2)nCH2OH (n=2,3) посвящена работа А.И. Рахимова с сотр. [11]. Эфиры были получены с 54÷85% выходом реакциями тригидроперфторированных спиртов с аллилиодидом (или аллилбромидом) при температурах до 80°С в диоксане, который cодержал до 1,1% воды:

где X=I, Br; n= 2,3.
В статье польских исследователей (Hieronim Maciejewski и др.) [12] было описано получение аллил-2,2,3,3,4,4,5,5-октафторпентилового и аллил-1,1,2,2-тетрафторпропилового эфиров. К исходному фторсодержащему спирту добавляли аллилхлорид, гидрокид натрия, бензол и небольшое количество диметиламинопиридина. Реакционную массу выдерживали в течении 8 часов при температуре 70-80°С и постоянном перемешивании. По окончании реакции продукты фильтровали и подвергали фракционной перегонке с выделением фракции с температурой кипения 140°С. Выход целевых эфиров был не ниже 78%.
Д. Лаззари с сотр. получали аллиловые эфиры 1Н,1Н-перфторбутан-1-ола, 1Н,1Н-перфторгексан-1-ола и 1Н,1Н,8Н,8Н-перфтороктан-1,8-диола при нагревании эквивалентных количеств соответствующих спиртов, аллилбромида и измельченного гидроксида натрия в автоклаве (80°С, 7 ч) с выходом 69, 67 и 62%, соответственно [13].
Синтез и характеристики перфтор-трет-бутоксиаллилового и пропаргилового эфиров представлены в патенте Хорвата c cотр. [14].
В статье французских исследователей [15] описано получение простых полифторалкил аллиловых эфиров из соответствующих фторированных спиртов и аллилхлорида (или аллилбромида) при использовании бисульфата тетрабутиламмония Bu4NHSO4 в качестве катализатора межфазного переноса:

где X=Cl, Br ; R-OH = CF3CH2-OH, CF2HCF2CH2-OH, ClCF2-CF2CH2-OH и др.
В работе [16] авторами было установлено, что в условиях гетерофазного процесса (водн. щелочь) высокая
конверсия низших полифторалканолов (С≤5) обеспечивалась применением солюбилизатора, например
1,4-диоксана. В случае фторированных алканолов с более длинными цепями (С>5) уже требовалось
применение тетрабутиламмония (TBAB) в качестве катализатора межфазного переноса (CTP):

где R= CF3CH2-; CF3(CF3)CH-; HCF2CF2CH2-; H(CF2CF2) 2CH2; H(CF2CF2)3 CH2-; H(CF2CF2)4CH2-.
1.3. Алкилирование спиртов полифторалкилгалогенидами
Бенингом с соавт. [17] описано взаимодействие CF3CH2Cl с СН3СH2ONa (130°С, ≈ 55 ч, стальная бомба, EtOH абс.), выход целевого эфира составил 25%. Определенный методом криоскопии молекулярный вес (130) был близок к теоретическому для CF3CH2OC2H5.
В работе китайских исследователей из Шанхайского института органической химии описано взаимодействие
2-хлор-1,1,1-трифторэтана c алифатическими спиртами в водной среде, которое приводило к образованию
алкилтрифторэтиловых эфиров c достаточно хорошим выходом. Реакцию проводили в автоклаве в
условиях повышенной температуры и давления [18].
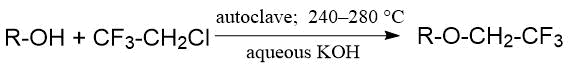
Выход эфиров варьировался в пределах 42-70 %. Увеличение длины углеводородной цепи, а также разветвленность, требовали более жестких условий: так в реакции с н‑бутанолом, 2-метилпропанолом, 1-метилпропанолом конверсия CF3CH2Cl достигала 60‑70% (280°С, 12 ч), а с трет-бутанолом составляла всего 7% (283°С, 14 ч) (Табл. 1.5).
Таблица 1.5. Выходы, характеристики и условия синтеза трифторэтиловых эфиров [18].
|
Формула эфира ROCH2CF3, |
T, °С |
Давление, атм. |
τ, ч |
Конверсия, % |
T.кип., °С |
Выход, % |
|
R = CH3 |
260 |
76 |
10 |
74 |
31-33 |
55 |
|
R = C2H5 |
240 |
60 |
11 |
87 |
48-50 |
67 |
|
R = n-C4H9 |
280 |
110 |
13 |
61 |
82-85 |
42 |
|
R = (CH3)2CHCH2 |
285 |
115 |
10 |
63 |
80-82 |
45 |
|
R = C2H5(CH3)CH |
280 |
115 |
11 |
70 |
81-83 |
64 |
|
R = (CH3)3C |
285 |
110 |
14 |
7 |
- |
- |
|
R = CF3CH2 |
250 |
102 |
13 |
77 |
60-62 |
70 |
Янг и Таррант показали [19], что при нагревании 1-хлор-1,1,2,2-тетрафторэтана (CHF2CF2Cl) с этилатом натрия (CH3CH2ONa) замещение протекало по атому хлора и целевой 1,1,2,2-тетрафторэтоксиэтан образовывался с выходом 66-72%.
В американском патенте US3637477 [20] описано взаимодействие трифторэтанола с хлордифторметаном (CHClF2) в присутствие КОН (тв.), которое приводило к образованию дифторметил 2,2,2-трифтоэтилового эфира (т.кип. 29-30°С):

Было установено, что конверсия хлордифторметана повышалась при значительном избытке трифторэтанола (2-4-х кратном), при повышении давления, а также при добавлении в реакционную смесь воды.
|
Параметры |
Конверсия CHClF2, % |
|
|
1 |
70°С, р = 100 kPa |
21,4 |
|
2 |
60-90°С, 1.55 MPa, 4 ч |
40,2 |
|
3 |
90-100°С, 1,59-1,17 MPa, 20 ч |
32 |
|
* |
80-95°С, 0,79 MPa, 2 ч |
53 |
|
* в присутствии воды |
||
В патенте Китая CN101659603 [21] рассмотрено взаимодействие 1,1,1,3,3,3-гексафторизопропанола с фторметилгалогенидами (CH2FX, X = Cl, Br, I) в различных условиях:
(CF3)2CHOH + CHFX → (CF3)2CHOCH2F
Выход целевого эфира в зависимости от используемого галогенида возрастал в ряду I > Br > Cl и достигал 85%.
1.4 Взаимодействие полифторалканолов с алкилсульфатами и сульфонатами
Подобно нефторированным спиртам, полифторалканолы образуют простые эфиры при алкилировании диалкилсульфатами.
Так в патенте США US3911024 описан синтез метиловых и этиловых эфиров взаимодействием галогенированных
изопропанолов (1,1,1,3,3,3-гексафтор-, 1-хлор-1,1,3,3,3-пентафтор- и 1,3-дихлор-1,1,3,3-тетрафтор-)
с диметилсульфатом (или диэтилсульфатом) в присутствии водного КОН (Табл. 1.6) [22]:
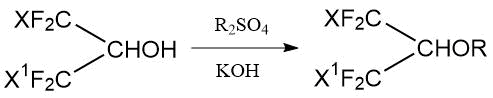
Таблица 1.6. Условия синтеза метил(этил)полифторхлоризопропиловых эфиров [23].
|
Эфир |
Условия реакции |
Конверсия,% |
Т.кип.,°С; nD20 |
|
(CF3)2CHOCH3 |
нагрев, 30 мин |
55,4 |
50; 1.27505 |
|
(CF3)2CHOC2H5 |
кипячение, 2 ч |
36,9 |
64,2; 1,28981 |
|
(CF3)CClF2CHOCH3 |
10°С в процессе прибавления диметилсульфата, затем нагрев при 45-50°С в течении 30 мин. |
67 |
80; 1,32029 |
|
(CClF2)2CHOCH3 |
10°С в процессе прибавления диметилсульфата, затем нагрев при 45-50°С в течении 30 мин. |
43,5 |
110; 1,36362 |
Багналл Р.Д. с сотр. (Bagnall, R.D.) [23] обрабатывали 2,2,3,3-тетрафторпропанол диметилсульфатом в растворе КОН (комнатная температура rt, 12 ч), выход 2,2,3,3-тетрафторпропил-метилового эфира составил 83 %:
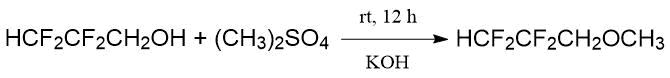
В этой же работе сообщено о синтезе фторгалогенированных метилпропиловых эфиров для их испытания
в качестве потенциальных ингаляционных анестетиков.
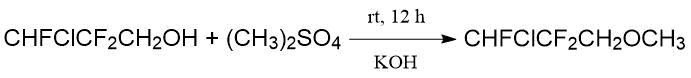
О.Шерер и Г.Хан (Schrerer Dr. O., Hahn Dr. H.) [24] также использовали диметилсульфат для получения 1,1,1-трифторэтил метилового эфира (40°С, 1 ч) (пример 3 в Табл. 1.7). Симметричный гексафтордиэтиловый эфир был получен при обработке алкоголята СF3CH2ONa трифторэтиловым эфиром толуолсульфоновой кислоты (100°С, 10 ч) (пример 1 в Табл. 1.7). Одностадийный вариант, согласно которому, смесь алкоголята и п-толуолсульфонилхлорида выдерживали в аналогичных условиях, привел к целевому эфиру с более низким выходом 63% (пример 2 в Табл. 1.7).
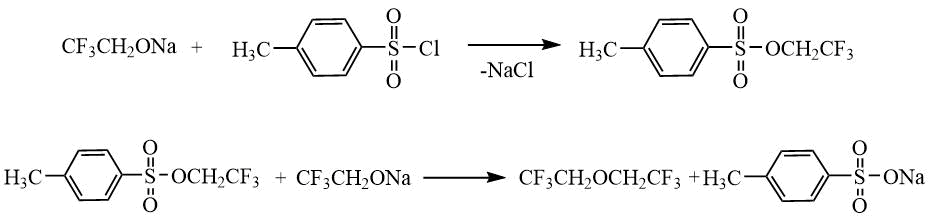
Таблица 1.7. Выходы и характеристики трифторэтилалкиловых эфиров, полученных реакцией спиртов с диметилсульфатом [24].
|
№ |
Формула эфира |
Выход,% |
Т.кип.,°С |
|
1 |
CF3CH2OCH2CF3 |
85 |
63.8-64 |
|
2 |
CF3CH2OCH2CF3 |
63 |
64 |
|
3 |
CF3CH2OCH3 |
80-85 |
31-32 |
Синтез 2,2,2-трифторэтил метилового эфира метоксилированием тозилата CH3C6H4SO3CH2CF3 описан В. Ли с соавт. [25]. Взаимодействие CH3C6H4SO3Cl с 2,2,2-трифторэтанолом в присутствии КОН (20% водн.) позволяло получать соответствующий тозилат (0°С, 7 ч, 96%). Последующая обработка CH3C6H4SO3CH2CF3 метилатом натрия (20°С, 6 ч) приводила к целевому эфиру (после ректификации: чистота 99.8 %, выход 88.6%).
Метиловый эфир п-толуолсульфокислоты был использован Цисманом с сотр. для получения метилового эфира 1H,1H,7H-тригидроперфторгептанола (CHF2(CF2)5CH2OH) [26] (3,5%-й водн. NaOH, кипячение, 16 ч, выход 40-50%; т.кип. 81-82°С (2 мм. рт. ст., d20 1,6323 г/см3). Аналогично был получен диэфир CHF2(CF2)5CH2O(CH2)6OCH2(CF2)CHF2. Эти эфиры рассматривались как потенциальные растворители, диэлектрики, смазочные и охлаждающие агенты.
Алкилирование алкоголятов полифторалканолов H(CF2CF2)nCH2OН
тозилатами нефторированных спиртов позволило Бажину с сотр. [7] выполнить синтез серии
эфиров общей формулы H(CF2CF2)nCH2OR (КОН,
ТГФ, Н2О, катализатор, -60°С, время по результатам двух стадий 8 ч, выход
87-96 %).
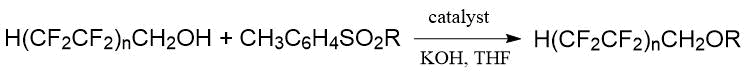
Японскими исследователями были синтезированы двумя методами F-трет-бутил метиловый и этиловый эфиры взаимодействием перфтор-трет-бутилатов натрия и калия с алкилсульфатом [27]. Первый метод заключался в реакции получаемого in situ перфтор-трет-бутилата калия с диэтилсульфатом в этаноле.
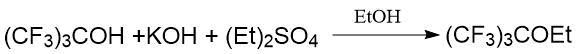
Второй метод включал реакцию предварительно выделенного перфтор-трет-бутилата натрия с диалкилсульфатом в тетраглиме.
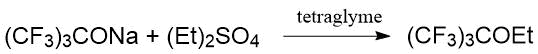
В работах А. И. Рахимова с сотр. [28, 29, 30] описано получение ди(полифторалкиловых) эфиров взаимодействием полифторалкилхлорсульфитов с полифторированными спиртами. Результаты представлены в Табл. 1.8.
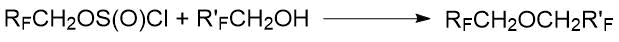
Таблица 1.8. Выходы и характеристики ди(полифторалкиловых) эфиров [28].
|
Формула эфира |
Метод*) |
Выход,% |
Т.кип.,°С/ мм рт. ст. |
nD20 |
d204 |
|
H(CF2CF2)2CH2OCH2(CF2CF2)2H |
1 |
59 |
103/2 |
1.3385 |
1.7344 |
|
2 |
52 |
- |
|||
|
HCF2CF2CH2OCH2CF2CF2H |
1 |
98 |
65/1 |
1.3575 |
1.6251 |
|
H(CF2CF2)3CH2OCH2(CF2CF2)3H |
1 |
57 |
130/1 |
1.3370 |
1.8014 |
|
HCF2CF2CH2OCH2(CF2CF2)2H |
2 |
85 |
83/2 |
1.3500 |
1.6790 |
|
HCF2CF2CH2OCH2(CF2CF2)3H |
2 |
51 |
95/1 |
1.3450 |
1.7310 |
|
HCF2CF2CH2OCH2(CF2CF2)4H |
1 |
34 |
130/1 |
- |
- |
|
H(CF2CF2)2CH2OCH2(CF2CF2)3H |
1 |
62 |
110/1 |
1.3380 |
1.7647 |
*) Метод 1: R´FCH2OH, СHCl3 (эфир), ДМФА (катализатор), RFCH2OS(O)Cl, -10°С, затем т.комн., 1 сут.
Метод 2: R´FCH2OH, ТЭА, пентан (гексан), RFCH2OS(O)Cl, -10°С, затем т.комн., 1 сут.
В работе [30] было отмечено, что вариант с использованием ДМФА являлся экономически более выгодным и приводил к более чистому целевому продукту, так как образующаяся по второму методу соль триэтиламмония существенно загрязняла целевые эфиры.
2. Присоединение спиртов к алкенам и алкинам
2.1. Присоединение спиртов к алкенам
Присоединение спиртов к фторолефинам и фторхлоролефинам во многих случаях протекает достаточно легко.
Реакционная способность полифторалкенов определяется стабилизирующим действием заместителей на карбанион, и изменяется следующим образом в ряду перфторалкенов:
CF2=CF2 < CF3CF=CF2 << (CF3)2C=CF2 [31]
При замене одного атома фтора на галоген относительная реакционная способность повышается:
CF2=CF2 < ClCF=CF2 < BrCF=CF2 [31]
Впервые о присоединении фторалкенов к спиртам было сообщено в патенте компании DuPont [32]. Тетрафторэтилен и хлортрифторэтилен присоединяли к спиртам в автоклаве при повышенных температурах (50-145°С) в присутствии алкоголятов натрия в качестве катализатора.

В статье Парка и Лэчера [33] исследовано взаимодействие спиртов с хлортрифторэтиленом. Реакцию осуществляли барботированием фторалкена через насыщенный раствор гидроксида калия в спирте:

где R=CH3, C2H5, iso-C3H7, н- C4H9.
Выход эфиров достигал 70-85%.
В работе [34] описана реакция спиртов (метанола, этанола, н-пропанола, н-бутанола и н-амилового спирта) с ТФЭ, в частности представлено подробное описание получения н-бутил-1,1,2,2-тетрафторэтилового эфира.
Реакция ТФЭ с н-бутанолом в присутствии основания (10% раствор н-С4Н9ОNa) протекала в относительно мягких условиях (0-38°С, давл.) с выходом целевого эфира 81%:
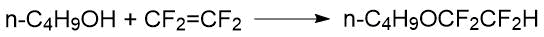
В статье И. Л. Кнунянца [35] рассмотрено взаимодействие перфторизобутилена с метанолом и этанолом. Реакция проходила при комнатной температуре в условиях барботирования перфторизобутилена через спирт при перемешивании. Кроме целевого продукта с достаточно высоким выходом (64,7 для метил-1,1,3,3,3-пентафтор-2-(трифторметил)пропилового эфира и 53% для этил-1,1,3,3,3-пентафтор-2-(трифторметил)пропилового эфира) в продуктах реакции присутствовали алкеновые производные (8-10%).
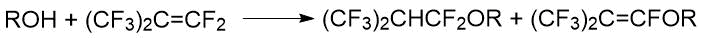
где R= CH3; C2H5
В других работах описано взаимодействие перфторизобутилена с 2-хлорэтанолом [36], а также с аллиловым эфиром [37]. В обоих случаях образование эфиров сопровождалось побочными процессами.
Перфторизобутилен в присутствии фторида цезия с хлордиметиловым и метил-1-хлорэтиловым эфирами образовывал метил(перфтор-трет-бутил)метиловый (т.кип. 65-67°С, выход 61,5%) и метил-1-(перфтор-трет-бутил)этиловый (т.кип. 83-85°С, выход 67,9%) эфиры соответственно [38]:

Для присоединения ТФЭ к спиртам, содержащим трифторметильную группу (например 2,2,2-трифторпропанолу) требовались жесткие условия реакции. Этот процесс описан Хенне и Смуком в работе [3] (Табл. 2.1). Для проведения реакции требовалось применение автоклава. Алкоголят из спирта и металлического натрия получали прямо в процессе реакции.
Таблица 2.1.
|
ROH |
Условия процесса |
Конв./ выход, % |
Т.кип, °С / мм рт. ст. |
dt |
|
CF3CH2OH |
180°С, 40 атм, 16 ч |
- /78,5 |
56.7 / 760 |
1.4874 |
|
CF3CH2СН2 OH |
200°С, 20 атм, |
54 / 59 |
88.2 / 744 |
1.4087 |
В японском патенте JP3482488 описан способ получения гексафторпропил 2,2,2-трифторэтилового эфира с выходом 89% путем взаимодействия 2,2,2-трифторэтанола с гексафторпропеном в присутствии оснований (Н2О, 25°С, давление, 24 ч) [39]. В качестве оснований использовались как неорганические (NaOH, KOH, NaH, Ca(OH)2 и CaH2), так и органические (первичные, вторичные и третичные амины) соединения. Было отмечено, что в качестве побочного продукта образовывался 1,2,3,3,3-пентафтор-1-(2,2,2-трифторэтокси)-1-пропена (~10 %).
Интересная особенность взаимодействия алкоголятов перфторированных спиртов с аллилгалогенидами
отмечена в работе канадских ученых Редвуда и Виллиса. Например, реакция аллилбромида
с гептафторизопропилатом цезия приводила к получению продукта замещения по галогену [40].
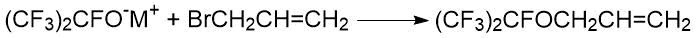
2.2 Присоединение спиртов к алкинам
В общих случаях полифторалканолы в присутствии алкоголятов взаимодействуют с ацетиленом с образованием виниловых эфиров:
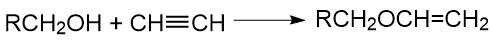
Так, 1,1,1-трифторизопропилвиниловый эфир был получен Лайоном с сотр. [41] при взаимодействии ацетилена с трифторизопропанолом (содержащим 12% алкоголята калия) при нагревании в ампуле (150°С, 260 psi, 4,5 ч).
Присоединение полифторалканолов к ацетилену в газовой фазе (фарфоровая труба, 18-20% ацетата цинка на угле СКЛТМ, 190-200°С, давл. изб. 12-15 мм рт ст) позволило Ростовскому с сотр. [42] получить виниловые эфиры H(CF2)nCH2OCH=CH2, (n=2, 3) с выходом 80 и 92%.
Список литературы
- Гудлицкий М., Химия органических соединений фтора, пер. с чешск. под ред. А.Н.Сергеева, ГНТИ ХЛ., М.,1961, 372 с.
- Mason C.T., Allan C.C., Preparation and Properties of some α-Fluoroethers, J. Am. Chem. Soc., 1956, 78, 1682-1684.
- A.L. Henne, M.A. Smook, Fluorinated Ethers, J. Am. Chem. Soc, 1950, 72, 4378-4379.
- Williamson, A., On etherification, J. Chem. Soc., 1852, 4, 229-239.
- Патент США 2452944 (1948), Fluorinated ethers, E.T. McBee, Wm.E. Weesner.
- Патент США 3465045 (1969), Fluorinated vinyl ethers and use thereof, A.G.Pittman, L.W.Wasley; Патент США 3799992 (1974), Fluorinated vinyl ethers and use thereof, A.G.Pittman, L.W.Wasley.
- D.N. Bazhin, T.I. Gorbunova, A.Ya. Zapevalov, V.I. Saloutin, Synthesis of polyfluorinated ethers, Russ. J. Appl. Chem., 2005, 78(10), 1646-1650.
- W. Huang, C. Jin, D.K. Derzon, T.A. Huber, J.A. Last, P.P. Provencio, A.S. Gopalan, M. Dugger, D.Y. Sasaki, Synthesis of etherlinked fluorocarbon surfactants ant their aggregational properties in organic solvents, J. of Colloid and Interface Sci, 2004, 272, 457-464.
- Boutevin, B. Youssef, B., Synthese d’ethers vinyliques a chaine laterale fluoree, Fluorine Chem, 1989, 44(3), 395-412.
- O.W. Steward, O.R. Pierce, Fluoroalkyl-and 3-(fluoroalkoxy)propylpolysiloxanes, J. Org. Chem., 1961, 26(8), 2943-2947.
- A. I. Rakhimov, E. V. Shurubtsova, and N. A. Storozhakov, Synthesis of Allyl Ethers Derived from Polyfluorinated Alcohols, Russian Journal of General Chemistry, 2007, 77(2), 317-318.
- H. Maciejewski, J. Karasiewich, B. Marciniec, Efektywna synthesa fluorofunkcyjnych (poly‑)siloxanow, Polimery, 2012, 57(6), 449-455.
- D.Lazzari, M.C.Cassani, G.Solinas, M.Pretto Fluoroalkyl allyl ethers: Useful building blocks for the synthesis of environmentally safer fluorinated multiblock molecules, J. Fluor. Chem., 2013, 156, 34-37.
- Патент США 0323672 (2014), Perfluoro-t-buthoxy allyl and propargyl ethers, I.T. Horvath, K.C. Lau, M.Y. Lui, E. Law, K.C.P. Wong.
- Boutevin, B., Youssef, B., Boileau, S., Garnault, A.M. Synthese d’ethers et de thioethers allyliques fluores par catalyse par transfert de phase, J. Fluor. Chem, 1987, 35, 399-410.
- L. Popova , A. Tsyrulnikova, S. Vershilov, J. Bazarnova, E. Aronova, L. Osetrova, Allyl type monomers for hard surface coating protection, E3S. Web of Conferences, 2019, 140, 7-14.
- Патент США 2336921(1943), Fluorine compound, A.F. Benning, J.D. Park.
- K. Wu, Q.-Y. Chen, Synthesis of trifluoroethyl ethers from 2,2,2-trifluoroethyl chloride (HCFC-133a) in high temperature aqueous medium, J. Fluor. Chem., 2002, 113, 79-83.
- Yong J.A., Tarrant P., A New method of preparing of esters of difluoroacetic acid, JACS, 1950, 72, 1860-1861.
- Патент США 3637477 (1972), Method of preparing of CF3CHClOCHF2, L.S.Croix.
- Патент CN101659603 (2010), Method of producting fluoromethyl 1,1,1,3,3,3-hexafluoroisopropyl ether, Weiguo Xu and Hua Li.
- Патент США 3911024 (1975), Fluorinated isopropyl derivatives, L.S.Croix.
- R.D. Bagnall, W. Bell, K. Pearson, New inhalation anaesthetics: II. Fluorinated methyl propyl ethers, J. Fluor. Chem., 1978, 11, 93-107.
- Патент Германии 1076113 (1960), Verfahren zur herstellung von 1,1,1-trifluoraethylalkylaethern, O. Dr. Scherer, H. Dr.Hahn, Hoechst AG.
- Патент Китая 109867612 (2019), Method for preparing hydrofluoroether through two-step process, W. Li, D. Zhang, D. Liu, Z. Guo, Zhejiang res inst chemical ind LTD.
- Патент США 2824141 (1958), Fluoroethers, W.A. Zisman, J.G. O’Rear.
- N. Takada, T. Abe, A. Sekiya, Preparation and physicochemical properties of F-tert-butyl alkyl ethers, J
- А.И. Рахимов, А.В. Налесная, О.В. Вострикова, Синтез ди(полифторалкиловых) эфиров, Ж. прикладной химии, 2004, 77(9), 1573-1574.
- A.I. Rakhimov, A.V. Nalesnaya, R.V. Fisechko, Features of catalysis in the reaction of polyfluoroalkyl chlorosulfites with saturated monohydric alcohols, Russ. J. Gen. Chem., 2008, 78(11), 2075-2081.
- Патент России 2346926 (2009), Способ получения простых полифторалкиловых эфиров, А.И. Рахимов, А.В. Налесная, Р.В. Фисечко, ВолгГТУ
- Chambers R.D., Fluorine in Organic Chemistry, New York etc. John Wiley and Sons, 1973, 385 p.
- Патент США 2409274 (1946), Polyfluoro organic ethers and their preparation, W. E. Hanford, G. W. Rigby, DuPont.
- J. D. Park, D. K. Vail, K. R. Lea and J. R. Lacher, Polyfluoro Alkyl Ethers and their Preparation, J. Am. Chem. Soc., 1950, 72, 1550-1552.
- J.D. Park, M.L. Sharrer, W.H. Breen and J.R. Lacher, The Action of Alkanols on Tetrafluoroethylene, J. Am. Chem. Soc., 1951, 73, 1329-1330.
- I.L. Knunyants, L.S. German and B.L. Dyatkin, Reactions of fluoroolefins. 6. Reactions of perfluoroisobutene and perfluoropropene with nucleophilic reagents, Russian Chemical Bulletin, 1956, 5(11), 1387-1394.
- R.J. Koshar, Th.C. Simmons, F.W. Hoffman, The addition of alcohols to octafluoroisobutene, J. Am. Chem. Soc., 1957, 79(7), 1741-1744.
- Курыкин М.А., Герман Л.С. Реакции транс-перфторпентена-2 с алкоголятами, Изв. АН СССР, Сер. хим., 1981, 11, 2647-2650.
- Делягина Н.И., Дяткин Б.Л., Кнунянц И.Л., Взаимодействие перфтор-трет-бутиланиона с α-галогенэфирами и имидиолгалогенидами, Ж. Орг. Хим., 1974, 10(5), 935-937.
- Патент Японии JP3482488 (2003), Method for producing fluorine-containing ether compound, J. Murata, A. Sekiya, M. Tamura.
- Redwood M.E., Willis C.J., Fully fluorinated alkoxides. Part II. Ethoxides, propoxides, and butoxides., Can. J. Chem., 1967, 45(4), 389-395.
- Патент США 2749369 (1956), Fluorinated ethers and method of producting, J.A. M.Lyon.
- АС СССР 784191 (1982). Способ получения фторсодержащих виниловых эфиров, Е.Н. Ростовский, Л.Д. Будовская, В.Н. Иванова.
Статья рекомендована к публикации д.х.н. С.М. Игумновым
Fluorine Notes, 2021, 136, 1-2


