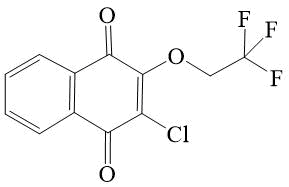
Поступило в редакцию: Апрель 2021
УДК 541.138: 547.621.81:547.655.6
Fluorine Notes, 2021, 135, 5-6
СИНТЕЗ И ИЗУЧЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ СВОЙСТВ2-ХЛОР-3-ПОЛИФТОРАЛКОКСИ- И 2,3-БИС(ПОЛИФТОРАЛКОКСИ)-[1,4]-НАФТОХИНОНОВ
С.М.Перегудова, В.И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
e-mail: vic-d.60@mail.ru
Aннотация: Методом циклической вольтамперометрии в апротонной среде (ДМФА) изучено электровосстановление вновь синтезированных 2-полифторалкокси-3-хлор-[1,4]-нафтохинонов 1-3, 7 и 2,3-бис(полифторалкокси)-[1,4]-нафтохинонов 4-6. Установлено, что потенциал восстановления Е01 [1,4]-нафтохинонов 1-3, 7, не зависит от длины полифторалкильного заместителя и составляет -0,35 В, а у нафтохинонов 4-6 соответственно -0,43В. Установлено, что потенциал восстановления нефторированных [1,4]-нафтохинонов 8, 9 больше чем у фторсодержащих аналогов 1-7.
Kлючевые слова: потенциал восстановления, циклическая вольтамперометрия, 2-полифторалкокси-3-хлор-[1,4]-нафтохиноны, 2,3-бис(полифторалкокси)-[1,4]-нафтохиноны,
Введение
[1,4]-Бензо и нафтохиноны широко распространены в природе - это вещества которые играют важную роль в окислительно-восстановительных процессах, клеточном дыхании и энергетическом обмене. Многие из них являются антиоксидантами, стимуляторами роста растений, антибиотиками и противоопухолевыми препаратами, нашедшими свое применение в медицине [1,2]. Важнейшим их свойством является способность нейтрализовать радикалы, образующиеся при воздействии на липиды активных форм кислорода [3]. Наиболее известными из них в растительном и животном мире являются филлохинон и токоферол (Рис. 1) [4]. Недостаток витамина Е приводит к заболеваниям нервной системы, мышечной слабости, бесплодию, онкологическим и сердечно-сосудистым заболеваниям.
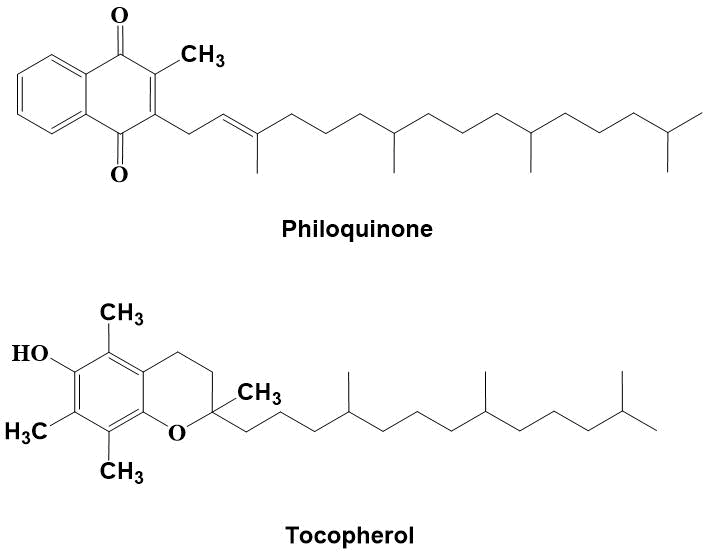
Рисунок 1. Антиоксиданты филлохинон и токоферол.
Хиноидная система данных соединений играет ключевую роль в обеспечении энергией живой клетки. Энергетический обмен как правило происходит на поверхности и внутри митохондриальной мембраны. Поэтому способность антиоксидантов проникать через мембрану митохондрий имеет очень большое значение для поддержания электрохимического баланса клетки живого организма. В значительной степени это зависит от заряда и липофильности полиметиленового заместителя хинона [5].
Наиболее важной реакцией нафтохинонов является их способность к обратимому восстановлению до двухатомных фенолов или нафтолов. Их восстановление осуществляется в две стадии. На первой стадии в результате одноэлектронного переноса образуются анион-радикалы – семихиноны [6]. На второй стадии анион-радикал присоединяет еще один электрон с образованием дианиона, который в протонной среде превращается в гидрохинон или 1,4-дигидроксинафталин (Рис. 2).
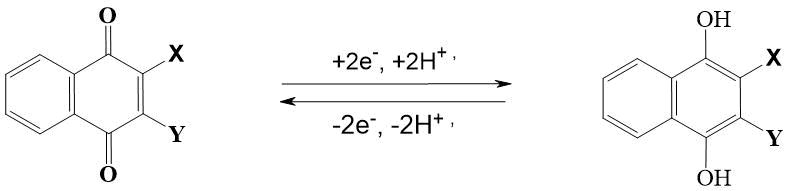
Рисунок 2. Превращение хинонов в гидрохиноны.
Способность хиноидной системы к восстановлению существенно зависит от донорно-акцепторных свойств X,Y-заместителей. Энергия восстановления (Е0) оценивается с помощью нормального редокс-потенциала, определяемого из уравнения Нернста [7].
Таким образом, Е0 является количественной характеристикой окислительной способности хинона, что важно для оценки перспектив его использования.
Обсуждение результатов
В настоящей работе мы изучили особенности восстановления новых фторсодержащих 1,4-нафтохинонов 1-7. В Таблице 1 представлены значения нормальных редокс-потенциалов Е0 для некоторых недавно [8] и вновь синтезированных 2-хлор-3-(полифтор)алкокси- и бис(полифторалкокси)-[1,4]-нафтохинонов, а также их нефторированных аналогов.
Все изученные соединения 1-11 восстанавливаются с последовательным обратимым присоединением двух электронов. Полученный результат полностью согласуется с исследованиями, проведенными ранее для других нафтохинонов [9]. Действительно, на первой стадии восстановления образуется соответствующий семихинон, который далее восстанавливается до дианиона. Потенциалы восстановления -E11/2 и -E21/2 исследованных соединений представлены в Таблице 1. Из этих данных видно, что потенциалы восстановления 1,4-нафтохинона 10 существенно сдвинуты в отрицательную область потенциалов по сравнению с потенциалами восстановления 2,3-дихлорнафтохинона 11. Наличие в молекуле 1,4-нафтохинона двух атомов хлора (соединение «контроль») приводит к облегчению процесса восстановления на 60мВ. Замещение одного атома хлора в соединении 11 на Rf-CH2-O-группу, где Rf = CF3 (1), CF2CF2H (2) и (CF2)5СF3 (3), приводит к сдвигу потенциалов восстановления в отрицательную область на 100мВ. Очевидно, заместители O-CH2-Rf в большей степени, чем Cl проявляют электронодонорные свойства и существенно затрудняют процесс восстановления.
Как оказалось, длина фторалкильного заместителя не оказывает существенного влияния на величины потенциалов восстановления [1,4]-нафтохинонов 1-3, что свидетельствует об отсутствии внутримолекулярного переноса заряда в соединениях этого типа строения.
Для наглядности на Рис. 3 представлены циклические вольамперограмы 1,4-нафтохинонов 1, 4, 11, полученные в ДМФА. Соединения 2, 3, 5-10 имеют аналогичные по форме катодные кривые.
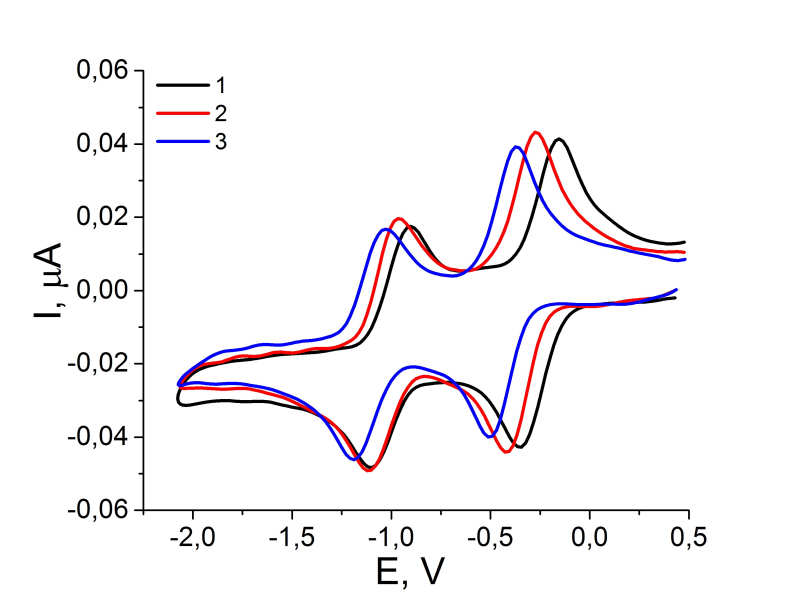
Рисунок 3. Циклические вольтамперограммы восстановления2,3-дихлор-[1,4]-нафтохинона 1, 2-хлор-3-(2,2,2-трифторэтокси)-[1,4]-нафтохинона 2 и 2,3-бис-(2,2,2--трифторэтокси)-[1,4]-нафтохинона 3.
Чтобы удостовериться в правильности суждения об отсутствии влияния размера заместителя [1,4]-нафтохинона на -E11/2 и -E21/2, мы синтезировали для электрохимических исследований новый 2-хлор-3-(2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-гексадекафторнонилокси)-[1,4]нафтохинон 3а (см. Таблицу 1, п. 7), отличающийся от соединений 1-3 заметной длинной фторсодержащего заместителя (см Схему 1). Его выход составил свыше 80%. Проведенные исследования показали, что заметного различия в потенциалах восстановления нафтохинонов 1 и 7, действительно, не имеется (см Таблицу 1).
Таблица 1. Потенциалы восстановления 2,3-замещенных-[1,4]-нафтохинонов 1-11.
|
No |
Соединение |
Потециал восстановлени |
||
|
- E11/2, В |
- E21/2, В |
|||
|
1 |
2-Хлор-3-(2,2,2-трифторэтокси)-[1,4]-нафтохинон 1
|
0.35 |
1.04 |
|
|
2 |
2-Хлор-3-(2,2,3,3-тетрафторпроп-окси)-[1,4]-нафтохинон 2 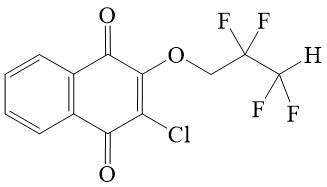
|
0.34 |
1.04 |
|
|
3 |
2-Хлор-3-(2,2,3,3,4,4,5,5,6,6,7,7,7-тридекафторгептилокси)-[1,4]нафтохинон 3 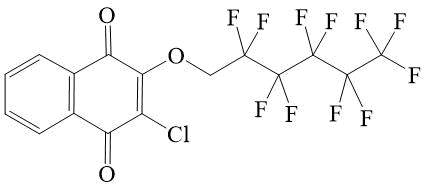
|
0.35 |
1.05 |
|
|
4 |
2,3-Бис-(2,2,2--трифторэтокси)-[1,4]-нафтохинон 4 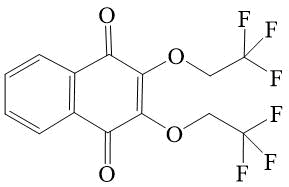
|
0.44 |
1.09 |
|
|
5 |
2,3-Бис-(2,2,3,3-тетрафторпропокси)-[1,4]-нафтохинон 5 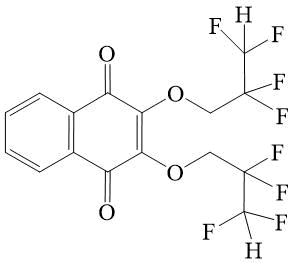
|
0.43 |
1.09 |
|
|
6 |
2,3-Бис-(2,2,3,3,4,4,5,5-октафторпентилокси)-[1,4]нафтохинон 6 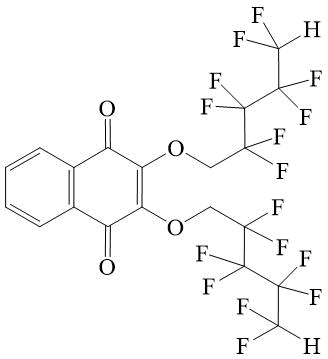
|
0.43 |
1.09 |
|
|
7 |
2-Хлор-3-(2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-гексадекафторнонилокси)-[1,4]нафтохинон 7 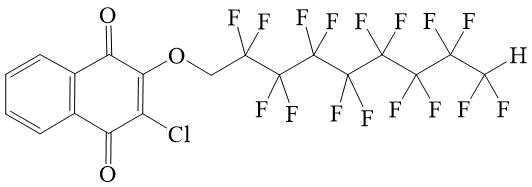
|
0.35 |
1.03 |
|
|
8 |
2-Хлор-3-этокси-[1,4]-нафтохинон 8 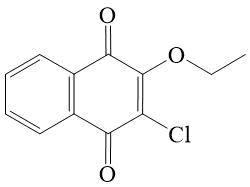
|
0.39 |
1.05 |
|
|
9 |
2-Бутокси-3-хлор--[1,4]-нафтохинон 9 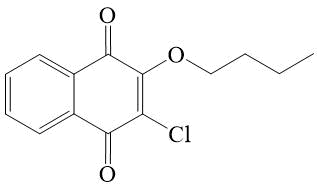
|
0,40 |
1,09 |
|
|
10 |
1,4-Нафтохинон* 10 
|
0.31 |
0.96 |
|
|
11 |
Дихлорнафтохинон (контроль) 11 
|
0.25 |
1.01 |
|
*Fritisch J., Tatwawadi S., Adams R., J.Phys. Chem., 1967, 71, 338.
Замещение второго атома хлора на O-CH2-Rf заместитель приводит к дальнейшему затруднению процессов восстановления на 90мВ. При этом величины потенциалов соединений 4-6 близки между собой, что подтверждает об отсутствие передачи электронных влияний алкильных заместителей на центр восстановления. Причем, циклические вольтамперограммы [1,4]-нафтохинонов 2, 3, 5-10 и 1, 4, 11 аналогичны по форме (см. Рис. 2) и отличаются лишь физическими характеристиками (см. Таблицу 1).
Для описания физико-химических свойств синтезированных соединений 1-3, 7, существенно важным является сравнение окислительно-восстановительных свойств полифторсодержащих и нефторированных [1,4]-нафтохинонов.
В этой связи нами были синтезированы близкие по структурному строению, описанные ранее производные [1,4]-нафтохинонов 3b и 3c, не содержащие в составе молекулы атомов фтора (cм. Схему 1).
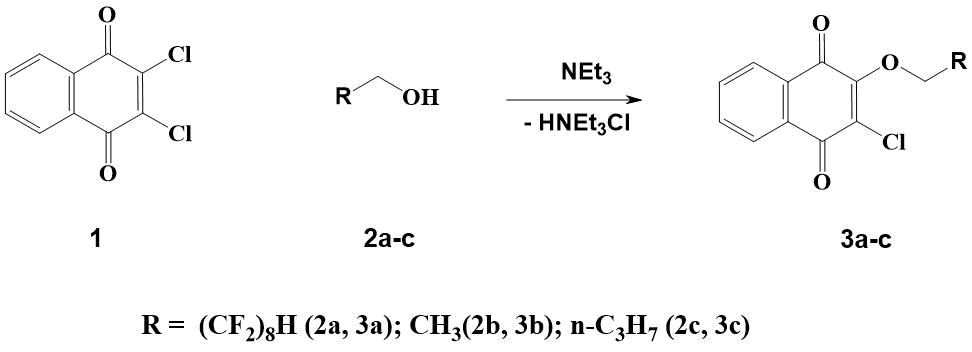
Схема 1. Синтез [1,4]-нафтохинонов 3а-с.
По имеющимся в литературе методам синтеза 3-хлор-2-этокси-[1,4]-нафтохинона 3b, его выход не превышает 15% [10,11].
Мы нашли, при нагревании 1 в этаноле при температуре 60-70С в присутствии NEt3 на протяжении 1,5 часа 3b образуется с выходом более 90%.
В зависимости от способа получения 2-бутокси-3-хлор-[1,4]-нафтохинона 3с, в одном случае он констатируется как жидкость [12], а в другом, как полутвердое вещество [13].
В этой связи мы синтезировали соединение 3с при нагревании 2,3-дихлор-[1,4]-нафтохинона в бутаноле при 65-70С в присутствии NEt3 по аналогичной методике получения 3b. При этом 3 был выделен с выходом 65%, как твердое в обычных условиях вещество.
Синтезированные таким образом нафтохиноны 3b,c были изучены с использованием метода циклической вольтамперометрии, как и соединения 8,9 соответственно. Причем, для сравнительной оценки влияния на хиноидную систему заместителей -ОСН2-Rf и -ОСН2-Alk, восстановление 8 и 9 проводилось в одинаковых условиях. Оказалось, что потенциалы восстановления 8, 9 близки между собой (см. Таблицу 1). В тоже время, в сравнении с потенциалами восстановления соединений 1-3, 7, имеющих полифторалкоксильные заместители, значения потенциалов 8, 9 сдвинуты на 50мВ в отрицательную область. Очевидно, это можно объяснить несколько большим электроно-донорным эффектом не содержащих атомы фтора ОAlk-групп.
Идентичность потенциалов восстановления в опытах in vitro в ряду нафтохинонов 1-3, 7, а также ряду 4-6, вовсе не означает, их одинаковую активность в организме. В живой клетке большое значение имеет гидрофильность-гидрофобность цитоплазмы, строение радикала, который необходимо нейтрализовать, размер и химическая природа заместителей антиоксиданта и т.п. Иначе говоря, в данном случае речь идет о его биодоступности. Действительно, in vitro антиоксидантная активность токотриенолов (ТКТ) выше, чем у альфа-токоферола. Однако в живом организме активность альфа-токоферола многократно выше чем у ТКТ и других антиоксидантов этого типа [14,15].
Синтезированные полифторалкоксизамещенные [1,4]-нафтохиноны 1-7 также могут быть использованы как антиоксидантные добавки в полимеры и композиты на их основе. В частности, во фторполимеры, в которых традиционные нефторированные антиоксиданты не могут растворяться в должной концентрации.
Выводы
В результате электрохимических исследований установлено, что 3-хлор-2-полифторалкокси-[1,4]-нафтохиноны 1-3, 7 восстанавливаются легче чем 2,3-бис(полифторалкокси)-[1,4]-нафтохиноны 4-6 (∆Е1 = 50 мВ). В свою очередь, потенциал восстановления нефторированных [1,4]-нафтохинонов 8, 9 больше чем у фторсодержащих соединений 1-7.
Катодные потенциалы восстановления фторсодержащих [1,4]-нафтохинонов 1-7 не зависят от длины фторалкильных заместителей.
В результате одноэлектронного восстановления 1-7 при низких катодных потенциалах образуются устойчивые анион-радикалы, что позволяет предположить их высокую окислительную способность.
Экспериментальная часть
Спектры ЯМР 1Н и 19F зарегистрированы в СDCl3 на спектрометре «Bruker Avance-400» с рабочими частотами 400 MГц и 376 МГц соответственно. Химсдвиги в ЯМР 1Н спектрах приведены в шкале δ (м.д.) относительно ТМС (внутренний стандарт), в ЯМР 19F - относительно CFCl3 (внешний стандарт). Константы спин-спинового взаимодействия приведены в Гц. Rf соединений определены методом ТСХ на пластинках фирмы Merck марки TLC Silica gel 60 F254.
Масс-спектры электронного удара получены на спектрометре FINNIGAN POLARIS Q при 70 эВ и температуре ионной камеры 250°C.
Элементный анализ соединений проводили в лаборатории элементного анализа ИНЭОС РАН.
Циклические вольтамперограммы регистрировали с использованием потенциостата IPC-Pro M. Скорость развертки потенциала составляла 200 мВ/с. Концентрация исследуемых соединений 2.10-3М.
Соединения 1-3 и 4-6 для изучения потенциалов восстановления получены, как описано в работе [8].
2-Хлор-3-(2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-гексадекафторнонилокси)-[1,4]нафтохинон (7).
В стеклянную круглодонную колбу, снабженную магнитной мешалкой с подогревом и обратным холодильником, помещали 226 мг (1 ммоль) 2,3-дихлор-[1,4]-нафтохинона, 432 мг (1 ммоль) 2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-гексадекафторнонилового спирта, 2,5 мл абсолютного ДМФА и 160 мг (1,5 ммоль) NEt3. Содержимое колбы перемешивали на протяжении трех часов при температуре 70-75°С. Реакционную массу охлаждали и прибавляли в нее 15 мл дистиллированной воды. Выпавший осадок отфильтровывали, промывали водой и сушили на стеклянном фильтре до постоянного веса. Получали 500 мг соединения 7. Выход 80,4%, т.пл. 81-82°С, Rf=0,40 (хлороформ-циклогексан = 2 : 1).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,16 (м, 1Н, Аr), 8,11 (м, 1H, Ar), 7,80 (м, 2Н, Аr) - ABCD-система); 6,06 (т.т, 1 Н, СF2H, 2JH-F = 52, 3JH-F = 4); 5,08 (т, 2Н, OCH2, 3JH-F=11).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -120,59 (уш.с, 2 F, CF2); -121,93 (уш.с, 6 F, 3CF2); -123,00 (уш.с, 2 F, CF2); -123,31(уш.с, 2 F, CF2); 129,32 (уш.с, 2 F, CF2); 136,99 (уш.с, 2 F, CF2).
Масс-спектр, m/z, (%): 622 (9) [M]+, 603 (8), 221 (100), 191 (16), 157 (72), 123 (27), 101 (22), 76 (19), 51 (78), 18 (21).
Найдено, %: С, 36,38; Н, 0,98; F, 49,01. C19H7ClF16O3. Вычислено, %: С, 36,65; Н, 1,13; F, 48,82.
2-Хлор-3-этокси-[1,4]-нафтохинон (8).
В стеклянную круглодонную колбу, снабженную магнитной мешалкой с подогревом и обратным холодильником помещали 226 мг (1 ммоль) 2,3-дихлор-[1,4]-нафтохинона, 3 мл абсолютного этанола и 320 мг (3 ммоль) NEt3. Реакционную массу перемешивали при температуре 65-70°С на протяжении полутора часов. Затем ее охлаждали и разбавляли 10 мл воды при интенсивном перемешивании на протяжении 10 минут. Выпавший осадок фильтровали, промывали водой и сушили на стеклянном фильтре, затем на фильтр-бумаге до постоянного веса. Получали 215 мг хроматографически и спектрально чистого соединения 8. Выход 91,1%, т. пл. 96-97°С*, Rf = 0,46 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,12 (м, 1Н, Аr), 8,07 (м, 1H, Ar), 7,74 (м, 2Н, Аr) - ABCD-система), 4,63 (кв, 2Н, OCH2, 3JН-Н =8), 1,46 (т, 3Н, CH3, 3JН-Н =8).
Найдено, %: С, 60,74; Н, 3,92. C12H9ClO3. Вычислено, %: С, 60,90; Н, 3,83.
2-Бутокси-3-хлор-[1,4]-нафтохинон (9).
226 мг (1 ммоль) 2,3-дихлор-[1,4]-нафтохинона 320 мг (3 ммоль) NЕt3 и 3 мл безводного бутанола помещали в стеклянную круглодонную колбу, снабженную магнитной мешалкой с подогревом и обратным холодильником. Реакционную массу перемешивали на протяжении четырех часов при температуре 70-75°С. Затем избыток бутанола удаляли на роторном испарителе, а остаток растворяли в 2 мл этанола. Из полученного раствора соединение 9 высаживали 15 мл воды. Продукт реакции экстрагировали циклогексаном (три раза по 10 мл). Полученный раствор сушили над безводным CaCl2 и пропускали через слой силикагеля (h=10 mm, Ø=20 mm). Раствор упаривали в вакууме и получали 1,6 г (62%) хроматографически и спектрально чистого соединения 9 в виде вязкого масла. При охлаждении в холодильнике и затирании 9 становится твердым веществом с т.пл. 30-31°С.
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,13 (м, 2Н, Аr), 7,75 (м, 2Н, Аr) - ABCD-система); 4,58 (уш.м, 2Н, OCH2), 1,79 (м, 2Н, CH2), 1,53 (м, 2Н, CH2), 0,98 (уш.м, 3Н, CH3).
Найдено, %: С, 63,41; Н, 5,09. C14H13ClO3. Вычислено, %: С, 63,52; Н, 4,95.
Электрохимические исследования
Измерения потенциалов восстановления -E11/2 и –E21/2 нафтохинонов 1-11 (см. Таблицу 1) проводились с использованием метода циклической вольтамперометрии. Электрохимические исследования проводили в атмосфере сухого аргона в 0,1М растворе Bu4NPF6 в безводном ДМФА. Измерения проводили в трехэлектродной электрохимической ячейке с неразделенным катодным и анодным пространством. Потенциалы измеряли относительно водного насыщенного каломельного электрода (нас.к.э.), отделенного от исследуемого раствора в ячейке мостиком, заполненным раствором фонового электролита. Вспомогательным электродом служила платиновая пластинка, расположенная в ячейке. В качестве рабочего электрода использовали торцевую часть стеклоуглеродного стержня, впаянного в стекло (площадь диска составляла 2 мм2).
Благодарности
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- K. Krohn, Anthracycline Chemistry and Biology II: Mode of Action, Clinical Aspects and New Drugs (Ser. Topics in Current Chemistry), Springer, 2008, 223 p.
- F. Arcamone, Doxorubicin. Anticancer Antibiotics. Medicinal Chemistry, (Series of Monograph) - London: Academic press, 1981, 378 p.
- Guzik, T.J., Korbut, R., Adamek-Guzik, T., Journal of Physiology and Pharmacology, 2003, 54(4), 469-487.
- Е.F.Bell, History of vitamin E in infant nutrition, Am. J. of Clinic. Nutrition, 1987, 46(1), 183‑186.
- Скулачёв В. П., Энергетика биологических мембран. М.: Наука, 1989, 564 с.
- Zhen Hui Lim et al., J. Phys. Chem., 2013, 117(8), 2396-2402.
- D.Wahl, A Short History of Electrochemistry - Part 2, Galvanotechtnik, 2005, 96(8), 1820‑1828.
- Dyachenko V.I., Fluorine notes, 2021, 1(134), 7-8.
- T.Fujinaga, K.Izutsu, T.Nomura, J. Electroanal.Chem., 1971, 29, 203.
- Fieser, L. F., Brown, R. H., J. Am. Chem. Soc., 1949, 71, 3609.
- Santos, Maria M. M. et al., Bioorganic & Medicinal Chemistry Letters, 2010, 20(1), 193-195.
- Jin-Cherng Lien et al., Chem. Pharm. Bull., 2002, 50(5), 672-674.
- Lee, D.-M., Ko, J. H., & Lee, K.-I. Monatshefte Für Chemie, Chemical Monthly, 2007, 138(8), 741–746.
- Yap S.P., Yuen K.H., Wong J.W., J. Pharm.Pharmacol., 2001, 53, 67-71.
- Leonard S.W., Paterson E., Atkinson J.K. et al., Free Radic. Biol. Med., 2005, 38, 857-866.
Статья рекомендована к публикации членом редколлегии к.х.н. М. А. Манаенковой
Fluorine Notes, 2021, 135, 5-6