Поступило в редакцию: Февраль 2021
УДК 547.621.81:547.655.6
Fluorine Notes, 2021, 134, 7-8
СИНТЕЗ 2-ХЛОР-3-ПОЛИФТОРАЛКОКСИ- И 2,3-БИС(ПОЛИФТОРАЛКОКСИ)-[1,4]-НАФТОХИНОНОВ
В.И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
e-mail: vic-d.60@mail.ru
Aннотация: Впервые изучено взаимодействие полифторированных алифатических спиртов 2а-d с 2,3-дихлор-[1,4]-нафтохиноном 1. Показано, что 2a-d в безводном диметилформамиде в присутствии NEt3 легко реагируют с 1, образуя 2-полифторалкокси-3-хлор-[1,4]-нафтохиноны 3a-c с выходом 83-93%. Избыток спирта 2а-d в этих условиях ускоряет скорость реакции и не приводит к замещению второго атома хлора. Взаимодействие 1 с карбинолами 2а-d в присутствии безводного К2СО3 при температуре 50-55оС позволяет получать 2,3-бис-полифторалкокси-[1,4]-нафтохиноны 4a-c с выходом 74-76%.
Kлючевые слова: полифторированные спирты, 2,3-дихлор-[1,4]-нафтохинон, поташ, 2-полифторалкокси-3-хлор-[1,4]-нафтохиноны, 2,3-бис(полифторалкокси)-[1,4]-нафтохиноны
Введение
[1,4]-Нафтохиноны являются одним из важнейших классов органических соединений, обладающих антиоксидантными свойствами [1]. 2-Метилнафтохинон входит в состав молекулы витамина К1 (Рис.1), регулирующего нормальный уровень коагуляции крови, а также обмен Са+2 в костной ткани [2]. Его избыток приводит к повышению свертывания крови, что осложняет лечение инфаркта, инсульта, а также других заболеваний, связанных с тромбообразованием [3]. Синтетические производные [1,4]-нафтохинона используются в качестве красителей для тканей, реагентов для фотометрического определения металлов, добавок в полимеры для продления срока их службы [4,5]. Конденсированные [1,4]‑нафтохиноны доксорубицин и дауномицин широко используются в терапии онкологических заболеваний [6,7]. С целью поиска новых противоопухолевых препаратов предпринимается синтез полициклических производных [1,4]-нафтохинонов, имеющих в своем составе СF3-группу [8,9]. Значительный интерес представляет синтез базовых фторсодержащих [1,4]-нафтохинонов – потенциальных прекурсоров для синтеза антиоксидантов, детекторов для аналитической химии, а также соединений, обладающих биологической активностью [10-11]. В связи с этим поиск новых методов синтез полифторалкил- содержащих [1,4]-нафтохинонов имеет большое значание.
Взаимодействие алифатических спиртов с 2,3-дихлор-[1,4]-нафтохиноном хорошо изучено [12-14]. В результате этой реакции осуществляемой, как правило, в полярных растворителях в присутствии карбонатов или алкоголятов щелочных металлов, происходит нуклеофильное замещение хлора на алкоголят-ион c образованием моно- или бис(алкокси)-[1,4]-нафтохинонов. В зависимости от соотношения реагентов и условий реакции замещается один или два атома галогена.
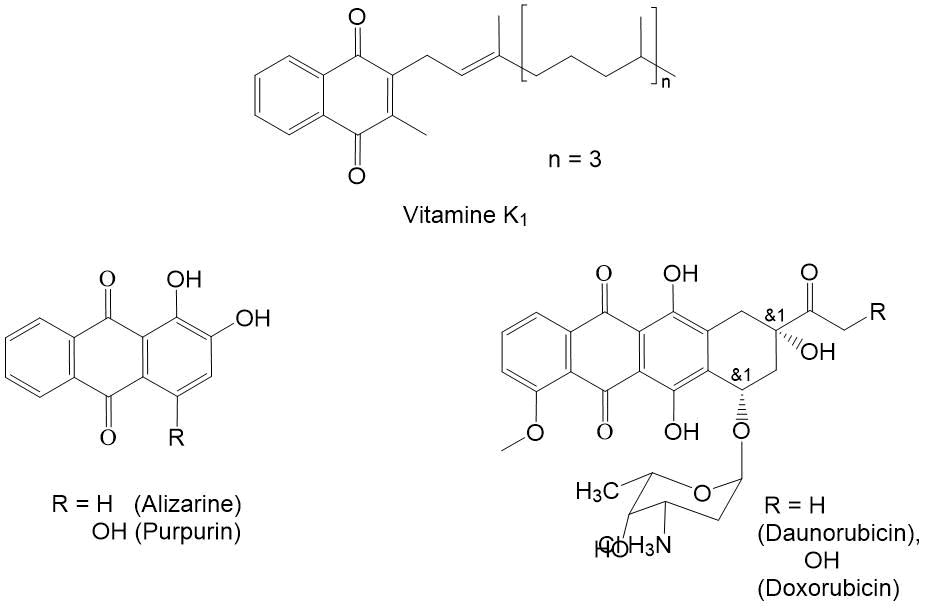
Рисунок 1. Используемые в медицине [1,4]-нафтохиноны.
В то же время, взаимодействие 2,3-дихлор-[1,4]-нафтохинонов с фторсодержащими спиртами, как платформы для синтеза полифторалкокси-[1,4]-нафтохинонов не изучено.
Нами показано, что первичные полифторированные спирты 2а-с в безводном диметилформамиде (ДМФА) в присутствии триэтиламина при 50-55°C легко вступают в реакцию с 2,3-дихлор-[1,4]-нафтохиноном, образуя соответствующие 2-хлор-3-(полифторалкокси)-[1,4]-нафтохиноны (3а-с) с выходом 83-93% (Схема 1).
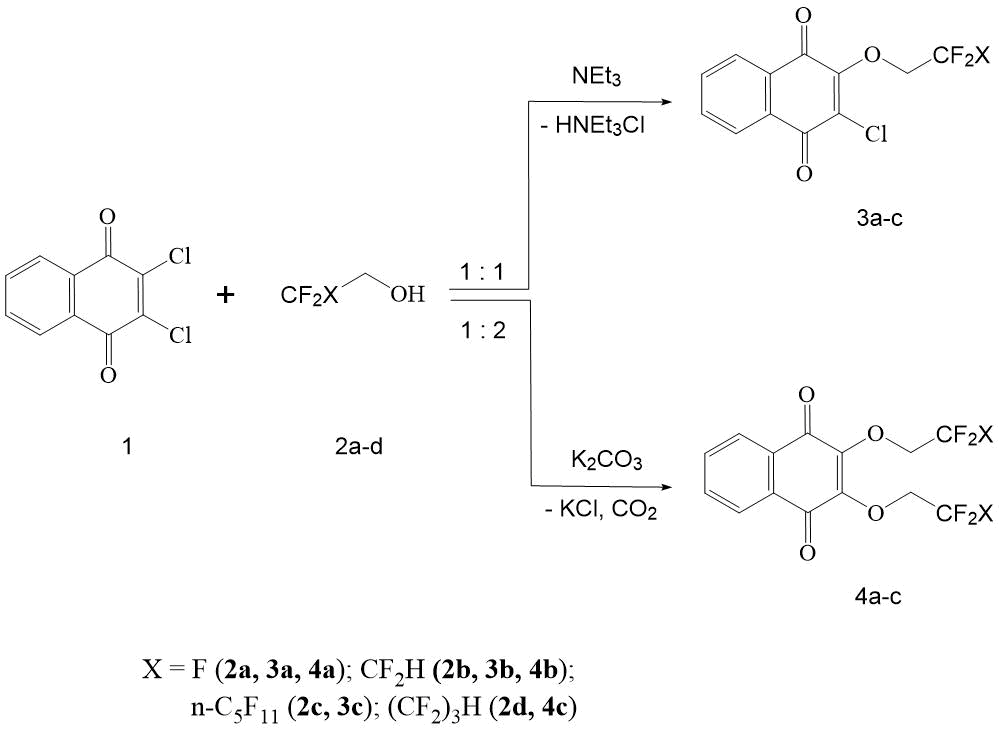
Схема 1. Образование 2-хлор-3-(полифторалкокси)-[1,4]-нафтохинонов и 2,3-бис-(полифторэтокси)-[1,4]-нафтохинонов.
Следует отметить, что данная реакция осуществляется уже при 20°С и повышение температуры лишь ускоряет ее во времени. Избыток полифторкарбинола, а также NEt3 ускоряет образование нафтохинонов 3а-с. Так, при трехкратном избытке NEt3 время синтеза 3b в сравнении с 3а существенно сокращается (см. Экспериментальную часть). Характерно, что в этих условиях реакция идет однозначно и не осложняется образованием побочных продуктов, а также продуктов замещения второго атома хлора в нафтохиноне 1. Таким образом, найденные условия реакции позволяют селективно получать продукты моно хлор замещения 3а-с с высоким выходом. Для образования 2,3-бис-(полифторэтокси)-[1,4]-нафтохинонов (4а-с) в реакции 1 и полифторированных спиртов 2а,d требуются более основные чем NЕt3 катализаторы -акцепторы НСl. В случае взаимодействия 2,3-дихлор-[1,4]-нафтохинона с нефторированными карбинолами, лучшие всего выходы дает проведение реакции в спирте в присутствии соответствующего алкоголята [12]. Также хорошие результаты получены при ведении этих превращений в ДМСО или CH3СN в присутствии карбонатов щелочных металлов [13].
Нами найдено, что 1 в безводном ДМФА в присутствии K2CO3 при 50-55°C легко вступают в реакцию c полифторированными спиртами 2а,b,d, образуя соответствующие 2-хлор-3-(полифторалкокси)-[1,4]-нафтохиноны 4а-с с выходом 74-76%. Взаимодействие осуществляется в гетерогенных условиях при интенсивном перемешивании на протяжении 2,5-3 часов.
В большинстве случаев выделение и очистка 3а-с и 4а-c отличается своей простотой, заключающейся лишь в разбавлении реакционной массы водой и фильтрации выпавшего в осадок продукта реакции.
Интересно отметить, что с увеличением атомарной массы (количества атомов фтора) полифторалкоксильных заместитетелей в 2,3-положении [1,4]-нафтохинонов 4а-c температура их плавления понижается. Так, 4а плавится при 81-82°C, 4b при 42-43°C, а 4c при 20°C представляет собой подвижное масло.
Реакционная способность атома хлора в соединениях, а также наличие карбонильных групп, позиционирует синтезированные нами моно- и бис(полифторалкокси)-[1,4]-нафтохиноны 3а-с и 4а-с как перспективные синтоны для дальнейших синтетических превращений, а также антиоксидантной модификации биополимеров.
Экспериментальная часть
Спектры ЯМР 1H и 19F зарегистрированы в СDCl3 на спектрометре «Bruker Avance 400» с рабочими частотами 400 MГц и 376 МГц соответственно. Химсдвиги в ЯМР 1Н спектрах приведены в шкале δ (м.д.) относительно ТМС (внутренний стандарт), в ЯМР 19F спектрах соединений 3а, 3b и 4а приведены в м.д. относительно СF3CO2H (внешний стандарт), в спектрах соединений 3c, 4b, 4с - относительно CFCl3 (внешний стандарт). Константы спин-спинового взаимодействия приведены в Гц. Rf соединений определены методом ТСХ на пластинках фирмы Merck марки TLC Silica gel 60 F254.
Масс-спектры электронного удара получены на спектрометре FINNIGAN POLARIS Q при 70 эВ и температуре ионной камеры 250°C.
Элементный анализ соединений проводили в лаборатории элементного анализа ИНЭОС РАН.
2-Хлор-3-(2,2,2-трифторэтокси)-[1,4]-нафтохинон (3а).
В стеклянную колбу, снабженную обратным холодильником с хлоркальциевой трубкой и магнитной мешалкой помещали 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 150 мг (1,5 ммоль) 2,2,2-трифторэтанола 2a и 1,2 мл безводного ДМФА. Затем, в реакционную массу при перемешивании по каплям прибавляли 150 мг (1,5 моль) триэтиламина. Температуру реакции поднимали до 50-55°С и перемешивали в этих условиях на протяжении полутора часов. Реакционную массу охлаждали до 20°С и разбавляли 10 мл воды. Выпавший осадок отфильтровывали, промывали водой и сушили до постоянного веса на стеклянном фильтре, затем в вакууме над Р2О5. Получали 260 мг хроматографически и спектрально чистого соединения 3а. Выход 89,7%, т. пл. 105-106°С, Rf=0,43 (СHCl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,18 (м, 1Н, Аr), 8,16 (м, 1H, Ar), 7,81 (м, 2Н, Аr) - ABCD-система; 4,93 (кв, 2Н, OCH2, 3JH-F=8).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): 2,77 (c, 3F, CF3).
Масс-спектр, m/z, (%): 290 (43) [M]+, 270 (10), 157 (75), 151 (53), 129 (20), 123 (83), 104 (27), 83 (25), 76 (38), 64 (15), 50 (33), 18 (53).
Найдено, %: С, 50,07; Н, 1,98; F, 19,29. C12H6ClF3O3. Вычислено, %: С, 49,59; Н, 2,08; F, 19,61.
2-Хлор-3-(2,2,3,3-тетрафторпропокси)-[1,4]-нафтохинон (3b).
В стеклянный колбу, оборудованную как в синтезе 3а, помещали 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 396 мг (3 ммоль) 2,2,3,3-тетрафторпропанола 2b и 1,2 мл безводного ДМФА. Затем в реакционную массу при перемешивании при 20°С прибавляли по каплям около 300 мг (3 ммоль) триэтиламина. Температуру реакцию поднимали до 50-55°С и перемешивали на протяжении получаса. Реакционную массу охлаждали до 20°С и разбавляли 10 мл воды. Выпавший осадок отфильтровывали, промывали водой и сушили до постоянного веса на бумажном фильтре, затем в вакууме над Р2О5. Получали 300 мг хроматографически и спектрально чистого соединения 3b. Выход 93,2%, т. пл. 119-120°С, Rf=0,40 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,19 (м, 1Н, Аr), 8,13 (c, 1H, Ar), 7,81 (м, 2Н, Аr) - ABCD-система; 6,21 (т.т, 1 Н, СF2H, 2JH-F = 52, 3JH-F = 4); 4,94 (т, 2Н, OCH2, 3JH-F=11).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -48,21 (c, 2F, CF2); -61,66 (c, 2F, CF2).
Найдено, %: С, 48,58; Н, 2,08; F, 23,22. C13H7ClF4NO3. Вычислено, %: С, 48,40; Н, 2,19; F, 23,55.
2-Хлор-3-(2,2,3,3,4,4,5,5,6,6,7,7,7-тридекафторгептилокси)-[1,4]нафтохинон (3c).
Получали по методу синтеза 3а из 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 385 мг (1,1 ммоль) 2,2,3,3,4,4,5,5,6,6,7,7,7-тридекафторгептанола 2с и 150 мг (1,5 моль) триэтиламина, перемешивание в течение трех часов. Получали 450 мг хроматографически и спектрально чистого соединения 3с. Выход 83,3%, т. пл. 82-83°С, Rf=0.57 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,19 (м, 1Н, Аr), 8,13 (м, 1H, Ar), 7,82 (м, 2Н, Аr) - ABCD-система); 5,10 (т, 2Н, OCH2, 3JH-F=11).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -80,71 (т, 3F, CF3, 3JF-F=11); -120,56 (тд, 2F, CF2, 3JF-Н=11, 4JF‑F = 4); -122,08 (м, 2F, CF2); -122,74 (м, 2F, CF2); -122,99 (м, 2F, CF2); -126,09 (т, 2F, CF2, 3JF‑F=15).
Найдено, %: С, 38,13; Н, 1,28; F, 46,04. C17H6ClF13O3. Вычислено, %: С, 37,77; Н, 1,12; F, 45,68.
2,3-Бис-(2,2,2--трифторэтокси)-[1,4]-нафтохинон (4а).
В стеклянную колбу помещали 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 300 мг (3 ммоль) 2,2,2-трифторэтанола 2a, 168 мг (3 ммоль) поташа и 2,5 мл безводного ДМФА. Реакционную массу перемешивали на магнитной мешалке при 50-55С на протяжении 2,5 часов. Затем реакционную массу разбавляли 10 мл воды. Выпавший осадок отфильтровывали, промывали водой и сушили до постоянного веса на стеклянном фильтре, затем в вакууме над Р2О5. Получали 270 мг хроматографически и спектрально чистого соединения 4а. Выход 76,3%, т. пл. 81-82°С, Rf=0.33 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,10 (д.кв, 2Н, Аr); 7,78 (д.кв, 2H, Ar), ABCD-cистема; 4,78 (кв, 4Н, 2 OCH2, 2J=8).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): 2,77 (c, 3F, CF3).
Найдено, %: С, 47,63; Н, 2,22; F, 31,82. C14H8F6O4. Вычислено, %: С, 47,47; Н, 2,28; F, 32,18.
2,3-Бис-(2,2,3,3-тетрафторпропокси)-[1,4]-нафтохинон (4b).
Получали из 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 396 мг (3 ммоль) 2,2,3,3-тетрафторпропанола 2b и 168 мг (3 ммоль) поташа, как описано в методике синтеза 4а, 210 мг хроматографически и спектрально чистого соединения 4b. Полученный фильтрат экстрагировали (3 х 10 мл) смесью этилацетат-циклогексан = 1:10. Органический слой отделяли, сушили над безводным поташем, фильтровали через силикагель и упаривали на роторном испарителе до постоянного веса. Получали еще 100 мг хроматографически чистого твердого соединения 4b. Общий выход 74,2%, т. пл. 42-43°С, Rf=0,34 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,09 (д.кв, 2Н, Аr); 7,79 (д.кв, 2H, Ar), ABCD-cистема; 6,15 (тт, 2Н, 2 CF2H, 2JH-F=64, 3JH-F = 4); 4,78 (т, 4Н, ОСН2, 2JH-F =16).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -125,40 (c, 2F, CF2); -138,86 (c, 2F, CF2).
Масс-спектр, m/z, (%): 418 (29) [M]+, 317 (74), 187 (54), 173 (100), 157 (19), 133 (36), 104 (98). 89 (28), 76 (68), 64 (16), 51 (77).
Найдено, %: С, 45,88; Н, 2,13; F, 35,98. C16H10F8O4. Вычислено, %: С, 45.95; Н, 2,41; F, 36,34.
2,3-Бис-(2,2,3,3,4,4,5,5-октафторпентилокси)-[1,4]нафтохинон (4с).
Соединение 4с получали из 226 мг (1 ммоль) 2,3-дихлор-[1,4]нафтохинона 1, 580 мг (2,5 ммоль) 2,2,3,3,4,4,5,5-октафторпентанола 2d и 168 мг (3 ммоль) поташа на протяжении трех часов, как описано в методике синтеза 4а. Реакционную массу разбавляли водой и экстрагировали (3 х 15 мл) смесью этилацетат-циклогексан = 1:10. Органический слой отделяли, сушили над безводным поташем, фильтровали через слой силикагеля и упаривали на роторном испарителе при температуре водяной бани 90-95°С. Получали 475 мг соединения 4с в виде желтого подвижного масла. Выход 76,8%, nD20 = 1,446, Rf=0,38 (СHСl3).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8,95 (д.кв, 2Н, Аr); 7,78 (д.кв, 2H, Ar), ABCD-cистема; 6,12 (тт, 2Н, 2 CF2H, 2JH-F=48, 3JH-F = 4); 4,93 (т, 4Н, ОСН2, 2JH-F =11).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -121,06 (т, 2F, CF2, 3JF-F=7); -125,55 (т, 2F, CF2, 3JF-F=7); -130,17 (м, 2F, CF2); -137,33 (м, 2F, CF2).
Найдено, %: С, 39,15; Н, 1.48; F, 48,91. C20H10F16O4. Вычислено, %: С, 38.85; Н, 1.63; F, 49,16.
Благодарности
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Масс-спектральные исследования проведены на средства гранта РФФИ № 20-03-00468 а.
Список литературы
- Thomson R.H., Naturally occurring quinones IV: recent advances. — London: Springer, 1997, 746 p.
- G. F. M. Ball, Vitamins: their role in the human body, Blackwell Science, 2004, 448 p.
- Maximilian Ackermann at al., Pulmonary vascular Endothelialitis, Trombosis and Angiogenesis in Covid-19, Nеw. Engl. J. Med., 2020, 383, 120-128.
- Pierce E., Histochemistry, trans. from Engl., M., 1962, 607 p.
- Burston M., Histochemistry of enzymes, trans. from Engl. M., 1965
- K. Krohn., Anthracycline Chemistry and Biology II: Mode of Action, Clinical Aspects and New Drugs (Ser. Topics in Current Chemistry) - Springer, 2008, 223 p.
- F. Arcamone., Doxorubicin. Anticancer Antibiotics., Medicinal Chemistry, (Series of Monograph) - London: Academic press, 1981, 378 p.
- Davydov, D. V. and Beletskaya, I. P., Russ. J. Organ. Chem., 2004, 40(1), 134-136.
- Sone, Toshihiko et al, PCT Int. Appl., 2015120304 (2015).
- (а) Zhang, Yan et al, Org. Lett., 2017, 19(6), 1302-1305; (b) Paul, Kamaldeep et al, Org. Lett., 2009, 11(20), 4728-4731.
- Lien, Jin-Cherng et al, Chem. Pharm.Bull., 2002, 50(5), 672-674.
- Dias, Gleiston G. et al, Chem. Comm. (Cambridge, United Kingdom), 2018, 54 (91), 12840.
- Monika Kadela-Tomanek at all., Molecules, 2017, 22, 447.
- Brandy, Yakini et al, Molecules, 2013, 18, 1973.
Статья рекомендована к публикации членом редколлегии к.х.н. М. А. Манаенковой
Fluorine Notes, 2021, 134, 7-8


