Поступило в редакцию: Февраль 2021
УДК 547.1'1
Fluorine Notes, 2021, 134, 3-4
ТРЁХКОМПОНЕНТНЫЙ ОДНОСТАДИЙНЫЙ СИНТЕЗ НОВЫХ НИТРИЛОВ 3-(1Н-ИНДОЛ-3-ИЛ)-2-ЦИАНО-4,4,4-ТРИФТОРБУТАНОВОЙ КИСЛОТЫ
О. Ю. Федоровский, Н. Д. Чкаников
Институт элементоорганических соединений им. А. Н. Несмеянова РAH, Российская Федерация, 119991 Москва, ул. Вавилова, 28
offskii@rambler.ru
Аннотация: Синтезирован новый высокоэлектрофильный алкен – 2-(2,2,2-трифтор-этилиден)малононитрил 1 и нитрилы 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2a - f на его основе. Соединения 2a, b получены C3-алкилированием производных индола 4a, b алкеном 1 с высокими выходами, которые, однако, не компенсируют низкий выход алкена 1. Для повышения суммарного выхода целевых нитрилов 2, разработана трехкомпонентная одностадийная реакция трифторацетальдегида этил полуацеталя, малононитрила и производных индола 4c - f. Максимальные выходы соединений 2c - f достигнуты при одновременном смешивании всех реагентов в эквимолярном соотношении и каталитическом количестве органического основания. Строение полученных соединений подтверждено методами 1Н, 13C и 19F ЯМР спектроскопии, масс-спектрометрии и масс-спектрометрии высокого разрешения.
Ключевые слова: 2-(2,2,2-трифторэтилиден)малононитрил, нитрилы 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты, трёхкомпонентный одностадийный синтез, трифторацетальдегид этил полуацеталь, индол и его производные, малононитрил.
Введение
В течение многих лет мы систематически изучали фторсодержащие высоко-электрофильные дицианоэтилены, полученные из полифторкарбонильных соединений и малононитрила [1 - 5]. Одним из субстратов, который в мягких условиях регеоселективно подвергается С-алкилированию по положению 3 подобными алкенами, является индол и его производные. 3-Замещенные индолы лежат в основе структур многих природных соединений, лекарственных препаратов и регуляторов роста растений [5 - 7]. Синтез новых фторсодержащих 3-замещенных индолов расширяет перспективу создания эффективных биологически активных соединений. Классическая схема синтеза фторсодержащих дицианоэтиленов включает С-оксиалкилирование малононитрила фторсодержащим карбонильным соединением в присутствии основания или кислоты Льюиса с последующей дегидратацией образующегося спирта. Этим методом получены дицианоэтилены из полифторированных кетонов, а также эфиров трифтор-пировиноградной кислоты [2, 4 - 6].
В настоящей работе изучены методы синтеза новых нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2a - f на основе трифторацетальдегида этил полуацеталя.
Обсуждение результатов
Изучение взаимодействия трифторацетальдегида этил полуацеталя (ТФЭП) с малононитрилом в присутствии каталитических количеств триэтиламина показало, что продукт С-оксиалкилирования 3 спонтанно дегидратируется с образованием алкена 1, присутствие которого в реакционной массе в количестве ~ 5 % подтверждается методами 1H и 19F ЯМР спектроскопии (Схема 1). Оказалось, что в составе реакционной смеси алкен 1 нестабилен, поскольку вступает в различные реакции с образованием побочных продуктов неустановленного строения. Попытка увеличить выходы алкена 1 меняя соотношение исходных соединений (ТФЭП и малононитрила) не привела к положительным результатам. Повышение температуры реакции и/или времени контакта реагентов приводят только к осмолению реакционной массы. Применение других основных катализаторов вместо триэтиламина, таких как DABCO, пиридин, хинолин, K2CO3, в различных соотношениях или использование их смесей с триэтиламином, не дает лучших результатов. Неполная конверсия двух последовательных обратимых реакций и их конечный продукт – высокореакционный алкен 1, легко вступающий в побочные необратимые реакции с исходными и/или промежуточными соединениями, существенно осложняют его получение. Высокореакционный дицианоэтилен 1 удалось выделить перегонкой реакционной массы с выходом 7%.
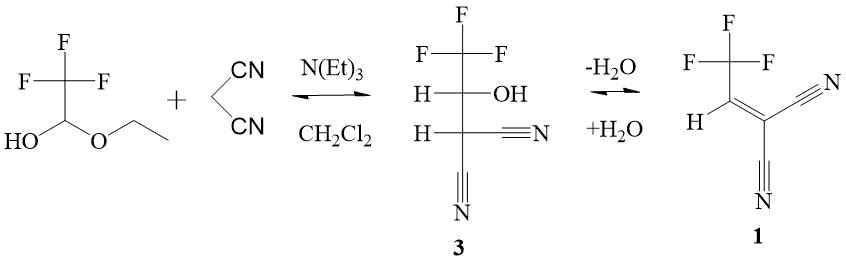
Схема 1. Двухстадийная схема синтеза алкена 2-(2,2,2-трифторэтилиден)малононитрила 1. В условиях синтеза ТФЭП постепенно гидролизуется выделяющейся реакционной водой.
Взаимодействие индола и 2-метилиндола с алкеном 1 в дихлорметане приводит к почти количественному образованию нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2a, b, которые выделены с выходами 92 и 89 %, соответственно. Вместе с тем, низкий выход алкена 1 побудил авторов к поиску новых, альтернативных методов синтеза соединений 2.
Спонтанное образование алкена 1 на стадии С-оксиалкилирования, позволило использовать 1 для С3-алкилирования производных индола 4 без предварительного выделения его из реакционной массы. Так, добавление N-метилиндола 4с к реакционной массе через четыре часа после её приготовления из эквимолярных количеств ТФЭП, малононитрила и каталитического количества триэтиламина в дихлорметане, привело к образованию соединения 2с с выходом 74 %.
Известно, что ТФЭП взаимодействует с индолом только при высокой температуре или в присутствии катализаторов Фриделя - Крафтса, а также при микроволновом облучении [8 - 11]. При комнатной температуре в условиях реакции ТФЭП не реагирует с индолом, и, следовательно, не может конкурировать с алкеном 1 в реакции замещения производных индола 4. Сопоставляя данные литературы и нашего эксперимента, стало очевидно, что все реагенты можно смешивать одновременно. Для сравнения, соединение 2с было получено второй раз, но теперь все реагенты смешивались одновременно. В такой одностадийной постановке синтеза соединение 2с было выделено с выходом 81%. Это позволило в настоящей работе реализовать стратегию синтеза in situ высокореакционного алкена - 2-(2,2,2-трифторэтилиден)малононитрила 1 в присутствии производных индола 4 и провести трёхкомпонентную одностадийную реакцию в условиях основного катализа (Схема 2). Соединения 2с - f образуются в результате регеоселективной электрофильной атаки интермедиата 1 по положению 3 производных индола 4, образование которого в реакционной массе подтверждено методами 1Н, 19F ЯМР спектроскопии.

Схема 2. Трёхкомпонентный одностадийный синтез нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2c - f.
c) R=Me, R1=R2=H; d) R=Bnz, R1=R2=H; e) R=R1=H, R2=Br; f) R=R2=H, R1=Ph.
Максимальные выходы соединений 2c - f (56 - 81 %) достигнуты при одновременном смешивании эквимолярных количеств ТФЭП, малононитрила и производных индола 4c - f в присутствии каталитического количества триэтиламина при комнатной температуре. Реакция С3-алкилирования производных индола 4c - f выигрывает конкуренцию с побочными превращениями образующегося in situ алкена 1, обеспечивая высокие выходы продуктов основной реакции – целевых нитрилов 2.
Таким образом, разработан эффективный метод синтеза новых нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2, представляющих несомненный интерес в плане поиска биологически активных соединений. Использование трехкомпонентного одностадийного синтеза с участием ТФЭП открывает новые возможности в синтезе различных трифторметилзамещенных соединений. В настоящее время одностадийные мультикомпонентные реакции стали ценным инструментом в современном органическом синтезе для сокращения стадий, повышения эффективности методов синтеза, а так же для снижения их себестоимости [12, 13]. Максимальная трансформация исходных соединений в конечные продукты 2 (80 - 85 %), обеспечивает практически полное отсутствие химических отходов, то есть, в данном случае реализуется принцип «экономии атомов», являющийся одним из основных для «зеленой химии» [14].
Экспериментальная часть
Все исходные соединения были куплены у компаний Merck и Sigma-Aldrich и использовались без дальнейшей очистки. Все элюенты и растворители (петролейный эфир с Ткип = 40-70°C (ПЭ), EtOAc (ЭА), ДХМ и триэтиламин) были очищены перегонкой перед использованием. Для контроля реакции и обнаружения веществ использовались пластинки ТСХ Merck Kieselgel 60 F254. Очистку продуктов проводили колоночной хроматографией с использованием силикагеля Merck Kieselgel 60 (0,06-0,20 мм).
Спектры ЯМР 1Н, 13С DEPT 135 и 19F записаны на спектрометре Bruker AvanceTM 400 с рабочей частотой 400, 100 и 376 МГц соответственно. Химические сдвиги протонов определены относительно остаточных сигналов CDCl3 (7.26 м.д.) и пересчитаны к сигналу SiMe4. Химические сдвиги ядер 19F определены с подавлением спин-спинового взаимодействия относительно трифторуксусной кислоты как внешнего стандарта и пересчитывали к сигналу CFCl3.
Масс-спектры получены на приборе Finnigan Polaris Q (ионная ловушка, ЭУ, энергия ионизирующих электронов 70 эВ) методом прямого ввода образца. В масс-спектре соединения 2е, содержащего атом брома, приведены данные для ионов, содержащие изотоп 79Br. Масс-спектры высокого разрешения зарегистрированы на приборе Bruker micrOTOF II (ионизация методом электрораспыления (ESI)). Измерения выполнены на положительных (напряжение на капилляре 4500 В) или на отрицательных (напряжение на капилляре 3200 В) ионах. Диапазон сканирования масс m/z 50 – 3000 Да, калибровка внешняя или внутренняя (Electrospray Calibrant Solution, Fluka). Использовали шприцевой ввод вещества для растворов в ацетонитриле, метаноле или воде, скорость потока 3 мкл∙мин–1. Газ-распылитель азот (4 л∙мин–1), температура интерфейса 180C [15].
2-(2,2,2-Трифторэтилиден)малононитрил (1)
В круглодонную колбу, снабжённую магнитной мешалкой, в атмосфере аргона загружают свежеперегнанный ДХМ (5 мл), малононитрил (3.3 г, 0.05 моль), трифторацетальдегид этил полуацеталь (7.2 г, 0.05 моль), триэтиламин (0.35 г) и перемешивают сутки при комнатной температуре. Затем растворитель и триэтиламин упаривают при пониженном давлении и при охлаждении добавляют Р2О5 (14.2 г, 0.1 моль), ставят нисходящий холодильник и ловушку с сухим льдом. Реакционную массу нагревают при пониженном давлении (~20 мм. рт. ст.). Алкен 1, после нисходящего холодильника, собирают в ловушку с сухим льдом. Получено прозрачное масло с резким раздражающим запахом, 0.52 г, выход 7%, Ткип = 80 - 85°C при ~20 мм. рт. ст. Вещество при 5°C осмоляется в течение недели.
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 7.13 (1Н, к, 6.3 Гц, СF3-СН=).
Спектр 19F ЯМР (CDCl3, δ, ppm.): -62.91 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 146 [М]+ (10.7).
Общая методика синтеза нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифтор-бутановой кислоты 2a, b С3-алкилированием производных индола 4a, b алкеном 1
В круглодонную колбу, снабжённую магнитной мешалкой, в атмосфере аргона загружают свежеперегнанный ДХМ (3 мл), замещенный индол 4a, b (1.78 ммоль), закрывают колбу септой, охлаждают до 0-5°C и шприцем по каплям добавляют алкен 1 (0.26 г, 1.78 ммоль), растворённый в 1 мл ДХМ. Охлаждение убирают и реакционную массу выдерживают 4 часа. Затем содержимое колбы разбавляют ДХМ (20 мл) и пропускают через слой силикагеля толщиной 1 см на пористом фильтре, при необходимости добавляя на фильтр 20 мл ДХМ. Раствор очищенного продукта упаривают при пониженном давлении.
2-[2,2,2-Трифтор-1-(1H-индол-3-ил)этил]малононитрил (2а)
Получено: 0.42 г, выход 92 %, светло-жёлтое канифоль-образное масло, Rf = 0.5 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 4.37-4.45 (2Н, м, наложение двух сигналов -CH-); 7.24-7.64 (5H, м, Ar); 8.54 (1Н, уш. c, NH).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 25.29 (с, -СH(CN)2); 42.40 (к, 30.5 Гц, CF3-СН-); 102.54; 110.71 (с, -CN); 110.81 (с, -CN); 112.06; 117.73; 121.08; 123.44; 124.47 (к, 280.9 Гц, -CF3); 124.72; 126.13; 135.60.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.89 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 262.9 [М]+ (9.4); 198.2 [M-СН(СN)2]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C13H8F3N3, найдено m/z: 262.0595 [M-H]-. Вычислено: 262.0598.
2-[2,2,2-Трифтор-1-(2-метил-1H-индол-3-ил)этил]малононитрил (2b)
Получено: 0.44 г, выход 89 %, светло-бежевый порошок, Rf = 0.2 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 2.32 (3Н, с, -Ме); 4.21-4.30 (1Н, м, CF3-СН-); 4.92 (1Н, д, 9.6 Гц, -СH(CN)2); 6.95-7.45 (4Н, м, Ar); 10.37 (1Н, уш. с., NH).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 11.46 (с, -Ме); 23.58 (с, -СH(CN)2); 43.37 (к, 30.7 Гц, CF3-СН-); 97.98; 110.92 (с, -CN); 111.16; 111.27 (с, -CN); 118.02; 119.85; 121.30; 124.72 (к, 281.7 Гц, -CF3); 125.15; 135.45; 136.98.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -65.64 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)):277 [М]+ (6.6); 212.1 [M-СН(СN)2]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C14H10F3N3, найдено m/z: 276.0759 [M-H]-. Вычислено: 276.0754.
Трёхкомпонентный one-pot синтез 2-[2,2,2-трифтор-1-(1-метил-1H-индол-3-ил) этил]малононитрила (2c)
В круглодонную колбу, снабжённую магнитной мешалкой, загружают свежеперегнанный ДХМ (3 мл), малононитрил (0.132 г, 2 ммоль), трифторацетальдегид этил полуацеталь (0.288 г, 2 ммоль), триэтиламин (0.1 г) и 4 гранулы молекулярных сит с размером пор 4Å. Колбу закрывают септой, трижды вакуумируют, заполняя аргоном, и выдерживают при комнатной температуре в течение 4 часов. Затем шприцем добавляют N-метилиндол 4с (0.262 г, 2 ммоль), растворённый в 1 мл ДХМ. Через сутки содержимое колбы разбавляют (20 мл) смесью ДХМ и ПЭ (1/1) и переносят на хроматографическую колонку, содержащую 100 мл силикагеля. Реакционную массу элюируют смесью ДХМ с ПЭ (1/1), постепенно повышая градиент растворителя добавлением ЭА до 3%. Раствор очищенного продукта упаривают при пониженном давлении и переупаривают с 20 мл ДХМ. Получено: 0.41 г, выход 74%, светло-жёлтое канифольобразное масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 3.82 (3H, с, -Ме); 4.36-4.44 (2Н, м, наложение двух сигналов -СН-); 7.25-7.63 (4Н, м, Ind); 7.44 (1Н, уш. с, Н(2) Ind).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 25.44 (с, -СH(CN)2); 33.28 (с, N-Me); 42.53 (к, 30.4 Гц, CF3-СН-); 100.90; 110.19; 110.65 (с, -CN); 110.72 (с, -CN); 117.81; 120.82; 123.08; 124.49 (к, 281.4 Гц, -CF3); 126.92; 128.82; 136.61.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.98 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 277 [М]+ (14.3); 212 [M-СН(СN)2]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C14H10F3N3, найдено m/z: 276.0751 [M-H]-. Вычислено: 276.0754.
Общая методика получения нитрилов 3-(1Н-индол-3-ил)-2-циано-4,4,4-трифторбутановой кислоты 2c - f трёхкомпонентным одностадийным синтезом
В круглодонную колбу, снабжённую магнитной мешалкой, загружают свежеперегнанный ДХМ (3 мл), замещённый индол 4с - f (4 ммоль), малононитрил (0.264 г, 4 ммоль), трифторацетальдегид этил полуацеталь (0.58 г, 4 ммоль), триэтиламин (0.15 г) и 5 гранул просушенных молекулярных сит с размером пор 4Å. Колбу закрывают септой, трижды вакуумируют, заполняя аргоном, и выдерживают при комнатной температуре в течение суток. Затем содержимое колбы разбавляют (20 мл) смесью ДХМ и ПЭ (1/1) и переносят на хроматографическую колонку, содержащую 100 мл силикагеля. Реакционную массу элюируют смесью ДХМ с ПЭ (1/1), постепенно повышая градиент растворителя добавлением ЭА до 3 %. Раствор очищенного продукта упаривают при пониженном давлении и затем переупаривают с 20 мл ДХМ.
2-[2,2,2-Трифтор-1-(1-метил-1H-индол-3-ил)этил]малононитрил (2c)
Получено: 0.9 г, выход 81%, светло-жёлтое канифоль-образное масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2). Спектральные данные приведены ранее.
2-[1-(1-Бензил-1H-индол-3-ил)-2,2,2-трифторэтил]малононитрил (2d)
Получено: 1.09 г, выход 78 %, светло-жёлтое канифоль-образное масло, Rf = 0.4 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 4.40-4.42 (2Н, м, наложение двух сигналов -СН-); 5.39 (2Н, с, -СН2-); 7.11-7.64 (9Н, м, Bnz, Ind,); 7.50 (1Н, с, Н(2) Ind).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 25.28 (с, -СH(CN)2); 42.49 (к, 30.4 Гц, CF3-СН-); 50.46 (с, -СН2-); 101.70; 110.62 (с, -CN); 110.75; 110.80 (с, -CN); 118.04; 121.01; 123.23; 124.46 (к, 280.9 Гц, -CF3); 126.73; 127.05; 127.98; 128.49; 128.97; 136.16; 136.40.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.85 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 353 [М]+ (8.9); 288 [M-СН(СN)2]+ (50.9); 91 [C7H7]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C20H14F3N3, найдено m/z: 352.1076 [M-H]-. Вычислено: 352.1067.
2-[1-(5-Бром-1H-индол-3-ил)-2,2,2-трифторэтил]малононитрил (2e)
Получено: 0.77 г, выход 56 %, светло-жёлтое канифоль образное масло, Rf = 0.2 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 4.28-4.35 (1Н, м, CF3-СН-); 4.42 (1Н, д, 5.2 Гц, ‑СH(CN)2); 7.23 (1Н, д, 6.2 Гц, Н(7)); 7.33 (1Н, уш. д, 8.6 Гц, Н(6)); 7.50 (1Н, уш. с. Н(4)); 7.72 (1Н, с, Н(2)); 8.77 (1Н, уш. с, NH).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 25.33 (с, -СH(CN)2); 42.51 (к, 30.7 Гц, CF3-СН-); 102.33; 110.49 (с, -CN); 110.57 (с, -CN); 113.58; 114.53; 120.40; 124.27 (к, 281.0 Гц, ‑CF3); 125.86; 126.58; 127.95; 134.39.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -67.94 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 341 [M]+ (11.6); 276 [M-СН(СN)2]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C13H7BrF3N3, найдено m/z: 339.9695 [M-H]-. Вычислено: 339.9703.
2-[2,2,2-Трифтор-1-(2-фенил-1H-индол-3-ил)этил]малононитрил (2f)
Получено: 1.02 г, выход 75 %, светло-бежевый порошок, Rf = 0.3 (ПЭ+ЭА, 0.8+0.2).
Спектр 1Н ЯМР (CDCl3, δ, ppm., J/Гц): 4.34-4.43 (1Н, м, CF3-СН-); 4.67 (1Н, д, 10.4 Гц, ‑СH(CN)2); 7.27-7.69 (9Н, м, Ind+Ph); 8.56 (1H, уш. с, NH).
Спектр 13С ЯМР DEPT 135 (CDCl3, δ, ppm., J/Гц): 23.46 (с, -СH(CN)2); 43.64 (к, 30.5 Гц, CF3-СН-); 98.61; 110.69 (с, -CN); 110.99 (с, -CN); 111.99; 119.04; 120.30; 122.29; 124.51; 124.77 (к, 282.4 Гц, -CF3); 128.72; 128.88; 129.24; 130.76; 136.20; 140.93.
Спектр 19F ЯМР (CDCl3, δ, ppm.): -65.03 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 339 [M]+ (9.7); 274 [M-СН(СN)2]+ (100).
Масс-спектр высокого разрешения (ESI, отрицательные ионы), C19H12F3N3, найдено m/z: 338.0921 [M-H]-. Вычислено: 338.0911.
2-(2,2,2-Трифтор-1-оксиэтил)малононитрил (3)
Вещество при хранении и нагреве не устойчиво, индивидуально не выделялось. ХС ЯМР для ядер 1Н, 19F и масс-спектр приведены для реакционной массы эквимолярных количеств ТФЭП (7.2 г), малононитрила (3.3 г) и триэтиламина (0.35 г) в ДХМ (5 мл). ХС протонов, мультиплетность и КССВ зависит от состава смеси.
Спектр 1H ЯМР (без растворителя, δ, ppm., J/Гц): 4.73 (1H, д, 2.3 Гц, ‑СН(СN)2); 4.78-4.85 (1H, м, СF3-СH-).
Спектр 19F ЯМР (без растворителя, δ, ppm.): -77.25 (с, -CF3).
Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 164 [М]+ (2.1); 146 [М-H2O]+ (9.3).
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации. Строение полученных соединений изучено с использованием оборудования «Центра исследования строения молекул» ИНЭОС РАН. Измерения масс-спектров высокого разрешения выполнены в Отделе структурных исследований ИОХ РАН.
Список литературы
- A. V. Fokin, V. Yu.Tyutin, N. D. Chkanikov, The chemistry of perfluoroalkyl-substituted dicyanoethylenes, Russ. Chem. Rev., 1992, 61, 766
- N. D. Chkanikov, K. V. Komarov, V. Yu. Tyutin, A. F. Kolomiets, A. V. Fokin, C-Alkylation of indoles with 1,1-bis(trifluoromethyl)-2,2-dicyanoethylene and 2-trifluoromethyl-3,3-dicyano-acrylic acid esters, Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1991, 5, 1193-1195.
- N. D. Chkanikov, A. S. Golubev, E. V. Belyaeva, New Approaches to the Synthesis of CF2X- Substituted Heterocyclic Anttitumor Cytostatic Agents, INEOS OPEN, 2019, 2(2), 33-40. DOI: IO.32931/io1906r.
- V. Yu. Tyutin, N. D. Chkanikov, A. F. Kolomietz, A. V. Fokin, Synthessis of esters of 3,3-dicyano-2-(trifluoromethyl)acrylic acid and their reactions with arylamines, J. Fluorine Chem., 1991, 51, 323-334.
- W. J. Middleton, 1,1-Dicyano-2,2-bis(trifluoromethyl)ethylene, J. Org. Chem., 1965, 30, 1402-1407.
- A. S. Golubev, P. V. Pasternak, A. F. Shidlovskii, L. N. Savel`eva, B. B. Averkiev, V. N. Nesterov, M. Yu. Antipin, A. S. Peregudov, N. D. Chkanikov., Synthesis and some heterocyclisation reactions of CF2H-and CF2Cl-substituted 1,1-dicyanoethylenes, J. Fluorine Chem., 2002, 114, 63-74.
- O. Yu. Fedorovskii, A. Yu. Volkonskii, A. S. Golubev, Yu. Ya. Spiridonov, N. D. Chkanikov, Synthesis of ethyl α-nitro-β-trifluoromethyl acrylate and β-trifluoromethyl-substituted tryptophan analogs and their plant growth regulating activity, Russian Chemical Bulletin, 2017, 66(6), 1116-1121.
- R. J. Sundberg, Indoles; San Diego, Academic. San Diego, 1996.
- Y. Maki, H. Kimoto, S. Fujii, M. Senga, L. A. Cohen., Thermal condensation of indoles with trifluoroacetaldehyde, Journal of Fluorine Chemistry, 1988, 39(1), 47-59.
- Y. Gong, K. Kato Recent., Applications of Trifluoroacetaldehyde Ethyl Hemiacetal for the Synthesis of Trifluoromethylated Compounds, Current Organic Chemistry 2004, 8(17), 1659-1675. DOI: 10.2174/1385272043369683.
- S. Peerannawar, A. Sood, A. Brown, C. Schäfer, J. Alonzo, S. Sutton, M. Christianson, R. Stocking, N. Naclerio, B. Török, S. M. Landge., Effect of solvent polarity on the regioselective hydroxyalkylation of indole with trifluoroacetaldehyde hemiacetals., Structural Chemistry, 2019, 30, 1941-1956.
- Yan-Hong He, Jian-Fei Cao, Rui Li, Yang Xiang, Da-Cheng Yang, Zhi Guan, L-Proline-catalized multicomponent synthesis of 3-indole derivatives, Tetrahedron, 2015, 71, 9299-9306.
- Zhu J. P., Bienayme` H., Multicomponent Reactions; Wiley-VCH: Weinheim, 2005.
- Trost B. M., Atom Economy. A Challenge for Organic Synthesis. Angew. Chem. Int. Ed. Engl., 1995, 34(3), 259–281.
- Tsedilin A. M., Fakhrutdinov A. N., Eremin D. B., Zalesskiy S. S., Chizhov A. O., Kolotyrkina N. G., Ananikov V. P., How sensitive and accurate are routine NMR and MS measurements?, Mendeleev Comm., 2015, 25, 454.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2021, 134, 3-4


