Поступило в редакцию: Декабрь 2020
УДК 54-056; 547-316; 542.943-92
Fluorine Notes, 2020, 133, 7-8
ПОЛУЧЕНИЕ ГЕКСАФТОРАЦЕТОНА ОКИСЛЕНИЕМ 2,2,4,4-ТЕТРАКИС(ТРИФТОРМЕТИЛ)ТИЭТАНА НИТРИТОМ НАТРИЯ
В.Э. Бойко, М.Д. Молчанов, В.Л. Дон, С.М. Игумнов
Институт элементоорганических соединений им. А. Н. Несмеянова РАН,
119991, Москва, ул. Вавилова, д. 28
e-mail: boykii@mail.ru
АО НПО «ПиМ-Инвест», 119991, Москва, Ленинский проспект, 47
Аннотация: Предложен удобный метод получения гексафторацетона из перфторпропилена через окисление 2,2,4,4-тетракис(трифторметил)тиэтана нитритом натрия.
Ключевые слова: гексафторацетон, 2,2,4,4-тетракис(трифторметил)тиэтан, нитрит натрия.
Гексафторацетон – один из важнейших продуктов фторорганической химии, он широко используется в органическом синтезе, поскольку трифторметильные группы, обладая существенным влиянием на соседние группы в молекуле, способны модифицировать в желаемом направлении физические свойства вещества [1]. Гексафторацетон является важным сырьем для получения фторированных мономеров, в частности акрилатов, используемых в фотолитографии [2], его используют в пептидном синтезе для защиты аминогрупп с одновременной активацией альфа-карбоксильной группы в аминокислотах, содержащих две карбоксильные группы (аспарагиновая, яблочная) путем образования пятичленных лактонов [3]. Восстановлением гексафторацетона получают гексафторизопропанол – востребованный растворитель в современном производстве электроники и важнейшее сырье для производства различной фармацевтической продукции, в частности анестетика последнего поколения севофлорана [4].
Гексафторацетон (ГФА) получают фторированием гексахлорацетона фтористым водородом в газовой фазе при высоких температурах [5], окислением гексафторпропена в газовой фазе кислородом на катализаторе [6], изомеризацией окиси перфторпропена под действием кислот Льюиса – пентафторида сурьмы [7], хлорфторида алюминия [8] и окислением 2,2,4,4-тетракис(трифторметил)тиэтана водным раствором йодата натрия с выходом 64-69% [9].
В поисках метода, пригодного для получения ГФА, не очень сложного аппаратурно, мы остановились на окислении 2,2,4,4-тетракис(трифторметил)тиэтана 1. Соединение 1 получали взаимодействием перфторпропена с элементарной серой в диметилформамиде с фтористым калием по методике [9] с выходом более 90%.
Описано получение ГФА окислением 1 водным раствором иодата натрия с выходом 64-69% [9], однако иодат натрия это дорогостоящий и труднодоступный реагент. Кроме того описан ряд других способов получения ГФА окислением 1, которые, несмотря на хорошие выходы, требуют сложного аппаратурного оформления – высоких температур [10], УФ облучения [11], работы с кислородом [12].
В качестве окислителя нами был выбран нитрит натрия, который, в отличие от иодата натрия, доступен и дешев, в ходе реакции азот (III) нитрит-иона восстанавливается до оксида азота (II). Окисление проводили в водном ацетонитриле, пробовали и другие растворители – бензонитрил, метанол, изопропанол, диметилформамид.
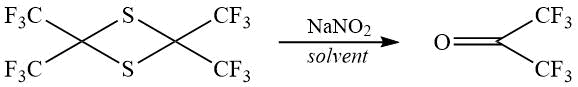
Максимальный выход в реакции окисления 1 нитритом натрия составил 58%, несмотря на то, что в некоторых случаях, судя по ЯМР, была достигнута полная конверсия продукта, и мы не наблюдали побочных продуктов. Исходя из полученных результатов нами был сделан вывод, что в качестве побочных продуктов образуются газообразные продукты, которые кипят ниже -77°С и не конденсируются в ловушку со смесью сухого льда с ацетоном. Проведенные эксперименты показали, что увеличение количества нитрита с 2,1 до 5,0 моль на моль 1 не приводит к увеличению выхода. Попытки увеличить выход путем добавления в реакционную смесь второго окислителя – изопропилнитрита, трет-бутилгидропероксида или азотной кислоты также не привели к улучшениям выхода. Другие окислители, которые мы пытались применить, а именно гипохлорид натрия и оксид кальция, привели к образованию в качестве побочных продуктов некоторых тиопроизводных, и таким образом к снижению выхода ГФА. Результаты экспериментов сведены в Табл. 1.
Таблица 1. Особенности протекания реакции 2,2,4,4-тетракис(трифторметил)тиэтана (1) с окислителями в зависимости от соотношения реагентов в различных растворителях.
|
Номер опыта |
1 : Окислитель (Мольное соотношение) |
Растворитель : вода (Объемное соотношение) |
Конверсия / Выход |
|
1 |
1 : NaNO2 ( 1 : 2,1 ) |
CH3CN : H2O ( 2 : 1 ) |
100 / 58 |
|
2 |
1 : NaNO2 ( 1 : 2,1 ) |
CH3CN |
100 / 58 |
|
3 |
1 : NaNO2 : HNO3 ( 1 : 2,1 : 0,5 ) |
CH3CN : H2O ( 2 : 1 ) |
32 / 16 |
|
4 |
1 : NaNO2 ( 1 : 3 ) |
CH3CN |
100 / 58 |
|
5 |
1 : NaNO2 ( 1 : 5 ) |
CH3CN |
100 / 58 |
|
6 |
1 : CaO ( 1 : 2,1 ) |
i-PrOH |
51 / 16 |
|
7 |
1 : NaNO2 : t-BuOOH ( 1 : 2,1 : 0,5 ) |
CH3CN : H2O ( 2 : 1 ) |
27 / 14 |
|
8 |
1 : NaNO2 ( 1 : 2,1 ) |
C6H5CN : H2O ( 2 : 1 ) |
95 / 58 |
|
9 |
1 : NaNO2 ( 1 : 2,1 ) |
СH3OH : H2O ( 10 : 1 ) |
100 / 58 |
|
10 |
1 : NaNO2 ( 1 : 2,1 ) |
СH3OH : H2O ( 5,5 : 1 ) |
100 / 58 |
|
11 |
1 : NaNO2 ( 1 : 2,1 ) |
СH3OH : H2O ( 4 : 1 ) |
100 / 58 |
|
12 |
1 : NaNO2 : i-PrONO ( 1 : 2,1 : 2,1 ) |
CH3CN : H2O ( 2 : 1 ) |
100 / 58 |
|
13 |
1 : NaNO2 : i-PrONO ( 1 : 2,1 : 2,1 ) |
i-PrOH : H2O ( 2 : 1 ) |
80 / 40 |
|
14 |
1 : NaNO2 : i-PrONO ( 1 : 3 : 2,1 )* |
C6H5NO2: H2O ( 1 : 1 ) |
100 / 50 |
|
15 |
1 : NaClO ( 1 : 2,1 ) |
ДМФА |
12.5 / 0 |
* Добавили каталитическое количество триэтилбензиламмоний хлорида (ТЭБАХ)
Несмотря на не самый большой выход (58%), предложенный нами способ получения ГФА хорош тем, что оперирует с доступными реагентами и прост в осуществлении.
Экспериментальная часть
Типовой эксперимент на примере опыта 1 (Табл. 1)
В колбу, снабженную мешалкой, термометром, капельной воронкой и обратным холодильником, соединенным с углекислотым холодильником, к 100 мл ацетонитрила добавляют 21 г (0,3 моль) нитрита натрия и 45 мл воды. Затем реакционную массу нагревают до 70-75°С и при этой температуре добавляют по каплям 50 г (0,137 моль) 2,2,4,4‑тетракис(трифторметил)тиэтана. Реакционную массу кипятят в течение двух часов. По спектру 19F в реакционной массе содержатся только гидраты ГФА. Из реакционной массы в вакууме выгоняют все жидкое содержимое досуха, затем дистиллят перегоняют, выделяя ацетонитрил и гидрат ГФА, который перегоняют из серной кислоты – в ловушке, охдаждаемой смесью сухого льда с ацетоном, 25 г ГФА. Выход 58%.
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строений молекул ИНЭОС РАН.
Список литературы
- Amara J.P., Swager T.M., Macromolecules 2006, 39, 5753-9.
- Swinson J. PharmaChem 2012, 11(5/6), 16-20.
- Albericio F.; Burger K.; Cupido T.; Ruiz J.; Spengler J., ARKIVOC, Commemorative Issue in Honor of Prof. Eusebio Juaristi on the occasion of his 55th anniversary, 2005, 6, 191-199.
- Ramig K., Synthesis, 2002, 17, 2627-2631.
- CN 104710296 (2015).
- Kurosaki Akito, Okazaki Susumu ChemistryLetters, 1988, 1, 17-20.
- US 3213134 (1965).
- Petrov V. A. et al, Journal of Fluorine Chemistry, 1996, 77(2), 139-142.
- Van Der Puy, Michael and Anello, Louis G., Organic Syntheses, 1985, 63, 154-9.
- Middleton W. J., Sharkey W. H. J.. Org. Chem., 1965, 30(5), 1384-1390.
- CN 102976908 (2013).
- US 4337361 (1982).
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2020, 133, 7-8


