Поступило в редакцию: Август 2020
УДК 543.429.23:661.489
Fluorine Notes, 2020, 132, 1-2
ЯМР спектроскопия продуктов на основе окиси тетрафторэтилена
Поспелова Н. Б. 1, Мокрушин И. Г2
1ФГУП "РНЦ "Прикладная химия", Пермский филиал, Пермь, Россия
2Пермский государственный национальный исследовательский университет, Пермь, Россия
Аннотация: Использование ЯМР фтора дает уникальную возможность контроля технологических процессов и анализа реакционноспособных продуктов, технологии производства которых разработаны в Пермском филиале ФГУП «PHЦ «Прикладная химия». В статье описаны известные способы получения окиси тетрафторэтилена, олигомеров и продуктов на их основе. Приводится детальная информация по контролю технологического процесса с помощью метода ЯМР спектроскопии на ядрах водорода и фтора.
Ключевые слова: спектроскопия ЯМР фтор-19; полифторированные соединения, ТФЭ, окись, тетрафторэтиленоксид.
Получение различных термостабильных и коррозионностойких материалов, устойчивых к ультрафиолетовому и радиационному облучению, требует разработки методов синтеза и анализа соединений. Среди них на первое место выходят перфторированные кислородсодержащие прекурсоры полимерных и композиционных материалов, обладающие заданными свойствами. Большое значение имеют перфторалкилвиниловые эфиры на основе олигомеров окиси тетрафторэтилена – окиси мономера-4 (ОТФЭ, ОМ-4, перфтороксиран), которые используются, например, для получения морозостойких каучуков. В данной работе проанализирован круг соединений, содержащих в своей основе фрагмент окиси тетрафторэтилена (-CF2CF2O-), производство которых освоено на базе ФГУП РНЦ «Прикладная химия», Пермский филиал. В публикации приведены характеристические химические сдвиги ЯМР (ХС) (отн. CFCl3), используемые нами для анализа. Сигналы «аналитических» групп позволяют подтвердить наличие соединения в смеси и «собрать молекулу» по интегральным интенсивностям остальных частей. Методики экспериментов и расчетов состава описаны нами ранее [1-3]. Растворитель либо многообразные соединения в реакционных смесях вносят вклад в изменение положении линии ЯМР фтора в пределах 3‑5 м.д., однако достаточный диапазон сдвигов (~400 м.д.) позволяет корректно выбрать аналитическую линию и определить соотношение идентифицированных компонентов. Примеси в целевых соединениях зависят от способов производства. Рассмотрим основные известные реакции получения ОТФЭ и её олигомеризации.
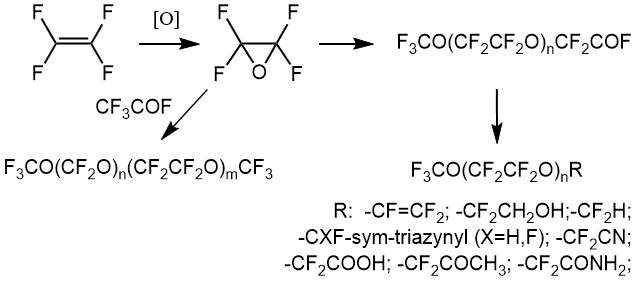
Окись тетрафторэтилена
Окись тетрафторэтилена (ОТФЭ) в промышленности получают как в газовой, так и в жидкой фазе. Газофазные способы отличаются простотой исполнения и аппаратурного оформления.
Одним из газофазных методов является процесс окисления тетрафторэтилена (ТФЭ) молекулярным кислородом на оксиде кремния при атмосферном давлении и температуре от 0° до 50°С с предварительной активацией газовой смеси при 190-300°C [4], в газовой фазе с УФ облучением длиной волны в области 1800-3000 Å при температуре -30°÷+150°C и давлении 2 атмосферы [5-6]. В результате реакции наряду с окисью тетрафторэтилена образуется большое количество как газообразных (карбонилфторид, перфторциклопропан, угольный ангидрид), так и жидких (полиоксиперфторметилен) и твердых побочных продуктов.
Ранее описан процесс фотохимического окисления тетрафторэтилена кислородом в присутствии источника свободных радикалов: фтора, хлора, брома, йода, окиси и двуокиси азота, бромистого водорода и трифторметилгипофторита, дающих газообразные свободные радикалы в каталитических количествах. Кислород предварительно смешивают с инертным газовым разбавителем. Свободно-радикальные реагенты берутся в очень малых количествах, например, концентрация брома в газовой смеси составляет от 4·10-5 до 6·10-5 об.%. С целью уменьшения взрывоопасности процесса кислород предварительно смешивают с инертным разбавителем, например, азотом в соотношении 1:1. Отношение кислорода к фторолефину предпочтительно 1:1 [6].
Жидкофазные процессы окисления в технологическом отношении более безопасны.
Известен процесс окисления тетрафторэтилена (ТФЭ) молекулярным кислородом в среде перфторированного или хлорфторированного растворителя в присутствии озона при температуре от 0 до 40°С. В качестве побочных продуктов образуется карбонилфторид (COF2) и перфторциклопропан. Также известен способ окисления ТФЭ кислородом в жидкой фазе в присутствии источника свободных радикалов, образующихся в каталитических количествах. В качестве источника свободных радикалов используется хлор, бром, иод, окись и двуокись азота, бромистый водород; а растворителя – полифторированные углеводороды и эфиры. [6].
Ранее описан способ жидкофазного окисления ТФЭ кислородом в присутствии источника свободных радикалов, в качестве которого использует фторокситрифторметан (CF3OF) или элементный фтор, и процесс ведут при температуре 15-60°С в среде хладона-318 (перфторциклобутана). Инициатор добавляют к азот-кислородной смеси (N2:O2 = 1:1) в количестве 1-3 об.%. Соотношение ТФЭ:O2 поддерживается равным единице. Процесс жидкофазного окисления тетрафторэтилена молекулярным кислородом в среде инертного фторхлоруглеродного растворителя ведут при перемешивании и использовании в качестве инициатора окисления бис(фторокси)дифторметана с УФ облучением [7].
В лабораторных условиях описано получение ОТФЭ окислением ТФЭ молекулярным кислородом в присутствии молекулярного фтора [8], кислородом в газовой фазе при -50 ÷ 125 °C и УФ облучении [9], озоном в 1,1,2-трихлор-1,2,2-трифторэтане при 0 °C [10-11]. Реакция, по всей видимости, идет через образование моль-озонида с последующим образованием карбонилдифторида и дифтороксирана. Окись тетрафторэтилена может быть получена также электрохимическим фторированием окиси этилена в плавиковой кислоте [6].
Сообщается о получении ОТФЭ в качестве одного из продуктов радикальной реакции гексафтор-1,3-бутадиена с оксидом азота (IV) NO2 при 27-160 °C. Среди продуктов атаки олефинового углерода диоксидом азота идентифицированы CF3C(O)F, C(O)F2, NO, FNO, SiF4 (из стекла). ТФЭ может вступать в реакцию в аналогичных условиях [12].
Таким образом, способы получения окиси тетрафторэтилена ранее былиизучены достаточно широко. На площадке ФГУП РНЦ «Прикладная химия» окись тетрафторэтилена получали без промежуточного выделения по методам [6,7] с дальнейшим превращением в целевые продукты. Спектроскопия ЯМР дополнялась хроматографическим анализом и ИК-спектроскопией. Контроль состава газовой смеси из реактора проводился методом ГЖХ на приборе ЛХМ-72, детектор - катарометр, колонка длиной 5 м, диаметром 4 мм заполнена силанизированным силохромом. Газ-носитель - гелий подают со скоростью 1,5-2 л/час, температура колонки 20°С. Кроме того, состав продуктов идентифицировали по ИК-спектру. В спектре присутствует полоса 1610 см-1, характерная для ОТФЭ [6].
Олигомеры окиси тетрафторэтилена
Для получения фторангидридов перфторполиэфироксикислот, в находящуюся в реакторе жидкую фазу, содержащую растворитель, подают газообразный тетрафторэтилен, газообразный кислород и газообразный или жидкий инициатор (или инициаторы). Альтернативно инициатор (или инициаторы) можно в полном количестве вводить в жидкую фазу, находящуюся в реакторе, перед началом процесса. Этот вариант можно использовать, например, когда инициатор(ы) при комнатной температуре представляет собой жидкость. Полученные в результате реакции пероксидированные перфторполиэфиры содержат перфтороксиалкиленовые звенья формул (СF2СF2O) и (СF2O) Молярные концентрации звеньев (СF2СF2O) обычно варьируются от 5 до 95%, преимущественно от 20 до 90%. По этому способу согласно изобретению обычно получают пероксидированные перфторполиэфиры, в которых соотношение концевых COF-групп к нефункциональным концевым группам очень низкое, причем это соотношение обычно составляет менее 5%, преимущественно менее 2%. Среднечисловой молекулярный вес полученных продуктов обычно варьируется от нескольких сотен до нескольких сотен тысяч – от 500 до 100000 Да [13]. Необходимо отметить, что на одной установке в промышленных масштабах возможно получение всей линейки продуктов, как преимущественно фторангидридов (далее «олигомеры»), так и «закрытых» полиэфиров. [14].
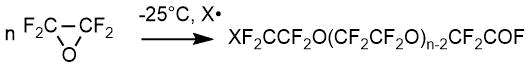
Таким образом, концевые группы, одинаковые или различные, представляют собой следующие радикалы: XСF2-, XСF2СF2-, -CFO и -СF2СOF, где X фрагмент инициатора(ров) и/или молекулы растворителя. Обычно X означает F, Cl, перфторалкильную или перфторалкокси-группу. Когда инициатор содержит две связи О-F, этот фрагмент может быть связан с двумя растущими полимерными молекулами, причем он внедряется в молекулярную цепь пероксидированного перфторполиэфирного продукта. Следовательно, природа концевых групп варьируется от продукта к продукту, причем зависит от природы инициатора(ров) и растворителя, а также от условий процесса.
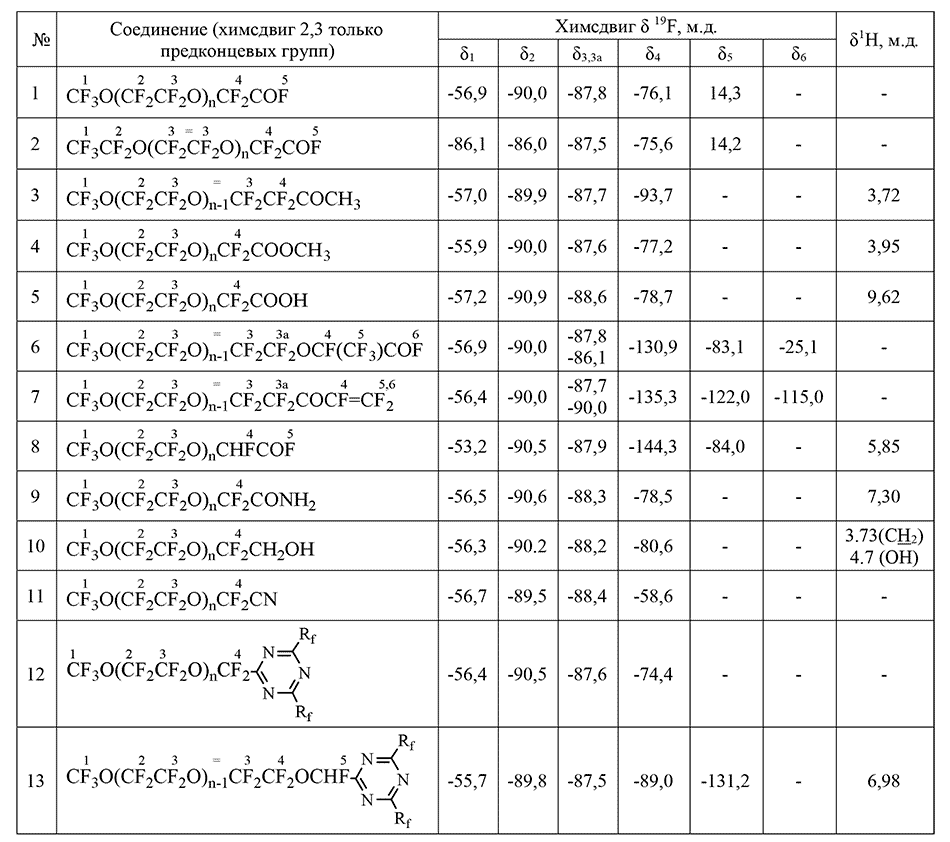
Основное условие возможности количественного анализа метода ЯМР – наличие хотя бы одной полосы поглощения, не перекрывающейся с другими и позволяющей однозначно выделять это соединение из смеси промежуточных или побочных продуктов на любой стадии получения. Время анализа составляет 25 минут, предельная случайная погрешность составляет 1,2% отн. В Таблице 1 представлены спектральные характеристики олигомеров – основных продуктов реакций ОТФЭ с фторангидридами в апротонных растворителях типа диглимов (в качестве примесей могут быть продукты взаимодействия ОТФЭ с растворителем – соответствующие сложные и простые эфиры) [15]. Эти олигомеры, как вещества, содержащие реакционноспособную фторангидридную группу, могут быть превращены в различные производные: кислоты, эфиры, амиды, спирты, нитрилы и т.п. Общий у всех соединений фрагмент CF3O(CF2CF2O) имеет на спектре сигналы практически в той же области, что олигомер 2, однако, наличие у каждого соединения собственной характеристической полосы позволяет анализировать их смеси в любом соотношении компонентов. Именно такая задача возникает при контроле полноты протекания реакций получения того или иного соединения, то есть необходимо уметь анализировать реакционную смесь, содержащую, как правило, сразу несколько компонентов. Так, например, при контроле получения эфиров 12, реакционная смесь различных стадий может содержать исходный олигомер 3, его примеси 5-7, 9 и конечный эфир 12. Близкие химические сдвиги имеют соединения 3, 6 и 7, но практика показала, что закономерность в химических сдвигах δ (CF2COF) 76 м.д. < δ (CF2COOCH3) 77 м.д. < δ (CF2COOH) 78 м.д. соблюдается достаточно строго.
Таблица 1. Cпектральные характеристики олигомеров окиси тетрафторэтилена и их производных.
Перфторполиоксоалкилвиниловые эфиры
Общая схема получения перфторполиоксоалкилвиниловых эфиров выглядит следующим образом [16]:
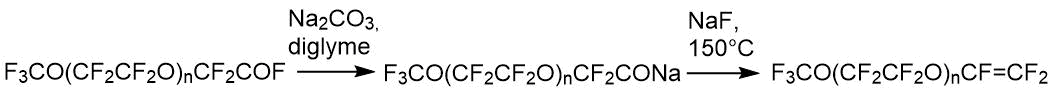
Приведенная цепочка реакций проанализирована методом ЯМР на всех стадиях от исходных до конечных продуктов. Общий у всех соединений фрагмент CF3O(CF2CF2O)n- характеризуется на спектре 19F линиями поглощения в следующих областях – триплет -55 ÷ -57 м.д. (CF3O-), квартет предконцевой -89 ÷ -90 м.д. (CF3OCF2-) и мультиплет внутреннего фрагмента 87 м.д. (-CF2CF2O-)n. Кроме перечисленных линий поглощения у каждого соединения на спектре 19F есть свои характерные линии. Так, олигомер 1 имеет сигнал в области -76 м.д., соответствующую –CF2COF, соединение 2 характеризуется специфической полосой поглощения -129 м.д. (-CF(CF3)-), а конечный эфир 3 характерный для трех фторов у двойной связи набор линий поглощения -115, -122, -135 м.д. Наличие таких характерных неперекрывающихся сигналов позволяет однозначно идентифицировать качественный, а при сопоставлении интегральных интенсивностей сигналов и количественный состав как основных, так и промежуточных продуктов приведенных реакций. Присутствие водородсодержащих примесей и воды в соде или диглиме в условиях нашего производства приводило к образованию таких побочных продуктов как гидриды общей формулы F3CO(CF2CF2)nCFHCF3. Их наличие контролируется с помощью спектроскопии ПМР, в которой гидрид дает дублет квартетов (JH-F=51.8 Гц, J H-СF3=2.7 Гц) и полосу поглощения 6,05 м.д. На спектре 19F характеристическая полоса поглощения, соответствующая -CHF- группе, находится в области -145 м.д., то есть образование такого гидрида может быть проконтролировано как качественно, так и количественно.
Гидриды могут быть использованы в качестве разделительных жидкостей для погружных насосов. Кроме гидридов общей формулы 4 были синтезированы и проанализированы гидриды CF3O(CF2CF2O)nCF2H. На спектре 19F таких гидридов есть характерная линия – дублет триплетов в области -84,3 м.д. ( JCF2-H=67.0 Гц, J CF2-F=6.0 Гц), на спектре ПМР триплет в области 6,45 м.д. (JH-CF2≈67.0 Гц) соответственно.
Перфторполиэфироксикислоты и их метиловые эфиры
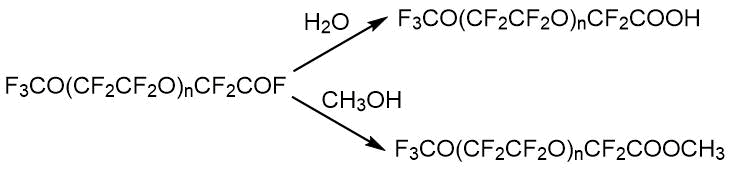
Анализ кислот CF3O(CF2CF2O)nCF2COOH с n=1-4 на основе олигомеров окиси тетрафторэтилена методом ЯМР 19F не представляет особой трудности. При любых n кислота имеет свою характеристическую линию в области 78,4 м.д. В качестве примесей в образцах кислот был обнаружен её метиловый эфир и остатки свободного и связанного диглима, ранее не описанные [17]. Образование эфира 7 идет из присутствующего в исходном олигомере эфира общей формулы CF3O(CF2CF2O)n-1CH3. Его образование подтверждено специальным опытом, включающим различную обработку полученной кислоты и анализом ЯМР исходного олигомера и кислоты после обработки (1H, CF2OCH3 3,76 м.д.). В среднем, исходный олигомер содержал 8 мол.% эфиров 8. При получении перфторкислот 5 в кислой среде -CF2CF2OCH3 переходит в -CF2COOCH3 с исчезновением из спектра линии -94 м.д. и появлением сигнала замещенной метилкарбоксильной группы 3,70 м.д. Фторирование в жестких условиях эффекта не дает, содержание OCH3 остается на уровне 8%. Диглим может быть полностью удален обработкой серной кислотой, при этом остается около 5% эфиров.
Другим товарным продуктом являются метиловые эфиры перфторполиэфироксикислот. На спектрах образцов метилового эфира кислот отлично видно наличие простого эфира, получающегося в процессе наработки исходного олигомера из-за взаимодействия с диглимом. Анализ различных фракций перегонки метиловых эфиров показал, что при 111°С смесь содержит максимальное количество простого эфира и примесь диглима, а к 130°С линия простых эфиров исчезает.
Спирты на основе перфторполиэфироксикислот
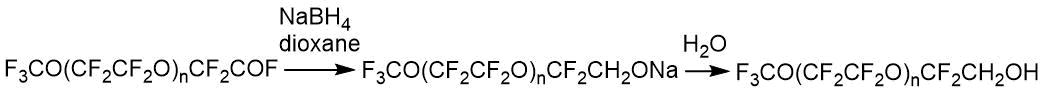
Целевые спирты могут быть использованы для получения акрилатов. Методом ЯМР 19F проанализированы спирты с n=1-5.
Таблица 2. Химические сдвиги ЯМР основных групп проанализированных спиртов.
|
Группа |
Химсдвиг, м.д. |
|
-CH2- |
1H: 3.73 t |
|
-OH |
1H: 4.7 ( м.б. взаимодействие с примесями) |
|
-(CF2CF2O)n- |
19F: -88,2 |
|
-CF2CH2- |
19F: -80,6 |
|
CF3O- |
19F: -56,3 |
|
CF3OCF2O- |
19F: -90,2 |
В присутствии воды на первой стадии могут образовываться соответствующие кислоты, которые фиксируются на спектре в области -77,6 м.д. (-CF2COOH). Нехарактерное положение сигнала группы –OH также может свидетельствовать о кислой среде в исследуемой смеси. Среди продуктов последующего гидролиза отмечается образование трифторуксусной кислоты с характерным химсдвигом в -75,6 м.д. При этом в некоторых экспериментах ее количество доходило до 12 мол.%.
Полиоксиметилены

В ряду фторорганических соединений в последнее время получили широкое распространение кислородсодержащие
производные, имеющую структуру простых полиэфиров I и II, которые
получают окислением тетрафторэтилена молекулярным кислородом в присутствии химического инициатора.
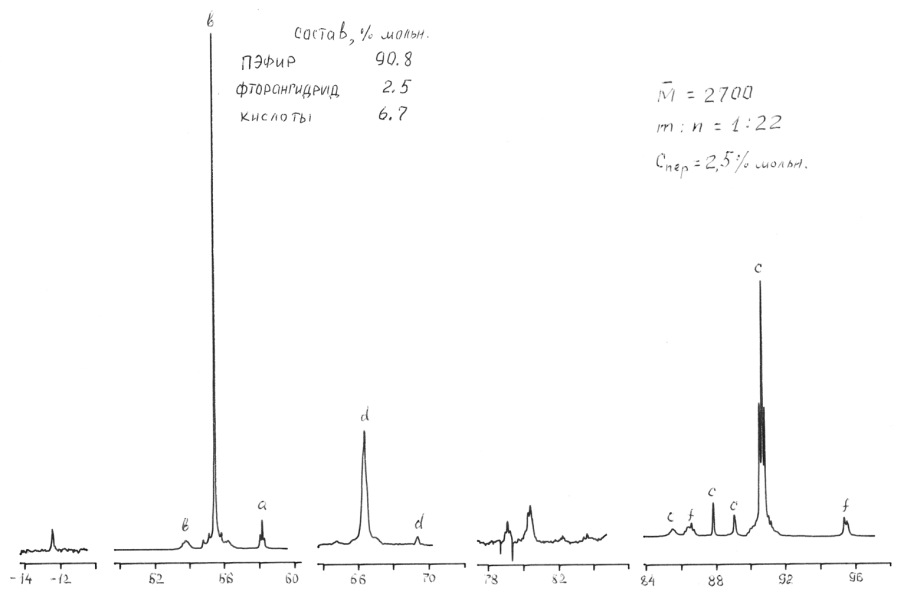
Рисунок 1. ЯМР 19F спектр сырца полиэфира I.
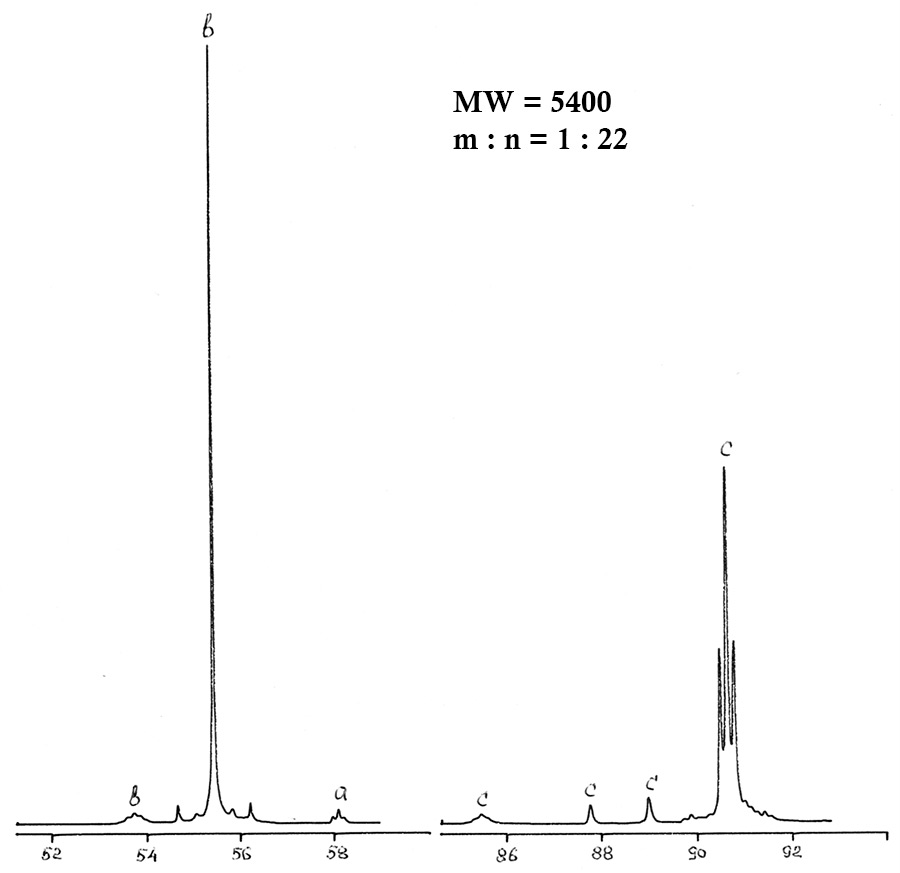
Рисунок 2. ЯМР 19F спектр полиэфира II после обработки.
Практика показала, что традиционные методы анализа – хроматография, ИК-спектроскопия, химический анализ – не дают исчерпывающей информации о полиэфирах, не позволяют определять их фрагментарный состав и вести контроль за синтезом. Анализ ЯМР 19F позволяет определять фрагментарный состав и среднюю молекулярную массу и процент звеньев содержащих перекисный (активный) кислород. Cуммарная погрешность составляет 7% отн. в диапазоне измерения молекулярной массы от 102 до 104 дальтон (а.е.м.). Отнесение линий полиэфиров II вида CF3O(CF2O)m(O)x(CF2CF2O)n(O)yCF3 приведено в Таблице 3.
Таблица 3. Химические сдвиги 19F основных групп проанализированных полиэфиров.
|
Группа |
Химсдвиг 19F, м.д. |
Обозначение на спектре |
|
-CF2O- |
-52,7÷-54,4 |
b |
|
-CF2CF2O-O- |
-85,2÷-94,4 |
f |
|
-CF2O-O- |
-64,2÷-66,2 |
d |
|
CF3O- |
-57,2 |
a |
|
CF3CF2O- |
-86,0÷-89,6 |
c |
Технология получения полиоксиметиленов ПОМ включает наработку сырца c молекулярным весом 2400-3400 Да в среде хладона-318, отгонку растворителя, термостабилизацию и (в некоторых случаях) химическую обработку для уменьшения количества перекиси и фторангидридов, с целью повышения стабильности и инертности целевых полиэфиров. В процессе синтеза полиэфиров I образуются функциональные соединения – фторангидриды и кислоты, перевод которых в «закрытые» структуры производится обработкой фтором. Полноту обработки контролируют по исчезновению на спектре линий в области -79÷-80 и +12,4 м.д. Обработка фтором позволяет избавиться и от других водородсодержащих примесей, присутствие которых качественно регистрируется на ПМР спектре.
Методом ЯМР-спектроскопии исследовалась зависимость молекулярной массы от количества сработанного мономера. Найдено, что зависимость в приведенном интервале носит линейный характер.
Заключение
Таким образом, анализ на основе метода ЯМР 19F, дополненный ПМР спектроскопией, учитывая его скорость и информативность, позволяет контролировать процесс получение различных полиэфиров и их производных, управлять выходом целевых продуктов, оперативно оптимизировать технологию.
Список литературы
- Поспелова Н. Б., Мокрушин И. Г. Особенности ЯМР-анализа перфторированных соединений. Вестник Пермского Университета. Серия «Химия». 2016, 3(23) 85-91.
- Поспелова Н. Б., Мокрушин И. Г. Способ идентификации димеров и тримеров гексафторпропилена методом ЯМР 19F. Fluorine notes, 2017, 115, 5-6.
- Emsley J. W., Feeney J., Sutcliffe L. H. High resolution nuclear magnetic resonance spectroscopy. Elsevier, 1966, Т. 2.
- Cavanaugh R., Atkins G. Epoxidation of tetrafluoroethylene and chlorotrifluoroethylene. Патент США 3775440, 1973.
- Ginsburg, V.A. et al., Doklady Chemistry, 1963, 149(1), 188. (Doklady Akademii Nauk SSSR, 1963, 149(1), 97).
- Сошин В. А. и др., Способ получения окиси тетрафторa этилена, Патент России 1840802, 2010.
- Мухаметшин Ф. М. и др., Способ получения окиси тетрафторэтилена, Патент России 1840594, 2007.
- Maksimov, B. N. Russian Journal of Organic Chemistry, 1994, 30(12), 1935.
- Mezentsev, A. I.; Poluektov, V. A. Russian Journal of Physical Chemistry, 1983, 57(7), 1014. (Zhurnal Fizicheskoi Khimii, 1983, 57(7), 1672).
- Agopovich, John W.; Gillies, Charles W. Journal of the American Chemical Society, 1980, 102(25), 7572.
- Agopovich, John W.; Gillies, Charles W. Journal of the American Chemical Society, 1983, 105(15), 5047.
- Czarnowski, Joanna. Journal of Fluorine Chemistry, 2008, 129(4), 261.
- Сианези, Д., Марраччини, А., Марчионни, Д., Способ получения пероксидированных перфторполиэфиров. Патент России 2070558, 1997.
- Максимов Б. Н., Барабанов В. Г., Серушкин И. Л. Промышленные фторорганические продукты. Спр. изд., 1996.
- Leo W. J. Fluorocarbon ethers of tetrafluoroethylene epoxide. Патент США 3250806, 1966.
- Мухаметшин Ф. М. и др. Способ получения перфторполиэфиров, Патент России 1840618, 2007.
- В.А. Пономаренко, С.П. Круковский, А.Ю. Алыбина, Фторсодержащие цепные полимеры, Москва, 1973, 56-80.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2020, 132, 1-2


