Поступило в редакцию: Август 2020
УДК 547.1
Fluorine Notes, 2020, 131, 7-8
СИНТЕЗ МЕТИЛПЕРФТОРАЛКИЛ- И 1,1-ДИХЛОРПЕРФТОРАЛКИЛСУЛЬФИДОВ
A.A. Тютюновab, С.Р. Стерлинa, С.М. Игумновab
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
bАО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
e-mail: tuytuynov@rambler.ru
Аннотация: Показано, что декарбоксилирование солей перфторалкилкарбоновых кислот в присутствии метилроданида в ДМФ приводит к образованию метилперфторалкилсульфидов с выходами 60-70%. Под действием хлорсульфоновой кислоты в среде CF3CO2H они превращаются в метил-1,1-дихлорперфторалкилсульфиды с выходами 60-65%.
Ключевые слова: метилперфторалкилсульфиды, хлорсульфоновая кислота, 1,1-дихлорперфторалкилсульфиды.
Известно, что α,ω-бис(метилтио)перфторалканы (C4-C10) гидролизуются 98% серной кислотой до соответствующих перфторированных карбоновых кислот при температурах 150÷180оС [1]. В тоже время показано, что гидролиз H2SO4(конц.) метил-α-хлор-α-фторэтилсульфидов осуществляется в мягких условиях при комнатной температуре или нагреве в течение 10 минут [2]. В свою очередь при действии более сильной хлорсульфоновой кислоты на метил-α-хлор- или -α-бромперфторалкилсульфиды в растворе CH2Cl2 уже при 0оС наблюдается как гидролиз до метилтиоэфиров, так и расщепление с образованием тиоацилгалогенидов [3]. Между тем под действием кислот Льюиса (AlCl3, SbF5) полифторалкилсульфиды расщепляются с образованием сложной неидентифицируемой смеси продуктов либо (TiF4, TiCl4) тиоацилгалогенидов [3-4].
Различие в легкости гидролиза между низшими и высшими метилперфторалкил- сульфидами под действием H2SO4(конц.) вероятно связано с их разной растворимостью. Так, H(CF2)4SCH3 в присутствии H2SO4(конц.) при 100оС в течение 2 часов нацело гидролизуется. Однако H(CF2)8SCH3 в аналогичных условиях практически не реагирует, а при добавлении к данной смеси в качестве растворителя трифторуксусной кислоты, гидролиз завершается уже при 80оС за несколько часов.
Таким образом, на практике алкилперфторалкилсульфиды, как и их кислородные аналоги, могут использоваться для синтеза различных производных перфторированных карбоновых кислот, и выбор в пользу простых эфиров или тиоэфиров зависит от доступности последних.
С целью синтеза метилового эфира перфторвинилоксиуксусной кислоты – CF2=CFOCF2CO2CH3, который является востребованным полупродуктом для получения фторсодержащих мономеров, по модифицированному методу [5] нами получен ранее не описанный метилперфторвинилоксиэтилсульфид (2a) (Схема 1). В ходе изучения возможности гидролиза сульфида 2a до перфторвинилоксиуксусной кислоты показано, что вследствие высокой реакционной способности CF2=CFO-группы провести селективно гидролиз CF2S-группы действием H2SO4(конц.) или HSO3Cl в среде гексана или хлористого метилена, а также в присутствии ряда кислот Льюиса: SbCl5, AlCl3, BBr3, BF3.Et2O не удается.
В процессе этих исследований обнаружено, что при взаимодействии сульфида 2a с хлорсульфоновой кислотой в растворе трифторуксусной кислоты происходит замещение атомов фтора в -положении к атому серы на хлор с образованием дихлорида 3a и фторсульфоновой кислоты (Схема 1). При проведении данной реакции с недостатком (1,25 экв.) HSO3Cl удается минимизировать параллельно протекающие реакции по CF2=CFO-группе и выделить дихлорид 3a с выходом ~40% (с учетом конверсии 2a).
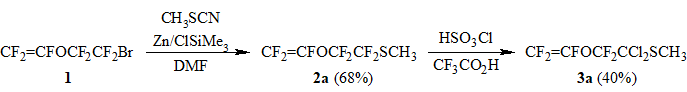
Схема 1.
Поскольку подобного превращения CF2S-группы в CCl2S-группу в перфторалкил сульфидах под действием хлорсульфоновой кислоты ранее описано не было, мы исследовали применимость данной реакции для синтеза различных 1,1-дихлорперфторалкилсульфидов.
Одним из наиболее простых и доступных методов синтеза перфторалкилсульфидов является разработанный ранее подход, который заключается в декарбоксилировании солей перфторкарбоновых кислот в присутствии дисульфидов или роданидов [6-9]. Нами исследована возможность использования для этой цели доступного метилроданида (т.кип. 130÷131оС), температура кипения которого позволяет осуществлять данную реакцию в открытой системе. Оказалось, что при декарбоксилировании CF3CO2Na или C2F5CO2Na в присутствии CH3SCN соответствующие сульфиды 2b-c образуются с выходами ~10-20%. В свою очередь при декарбоксилировании солей высших перфторалкилкарбоновых кислот в DMF метилперфторалкилсульфиды 2d-h образуются с выходами 60-70% (Схема 2, Таблица 1).
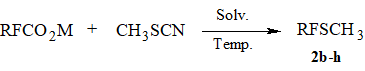
Схема 2.
Таблица 1. Синтез метил перфторалкил сульфидов 2b-h.
|
№ п/п |
RFCO2M |
Solv. |
Temp., oC |
Выход RFSCH3 (2b-h), % |
|
1 |
CF3CO2Na |
DMF |
140÷160 |
5 (2b) |
|
2 |
CF3CO2Na |
Сульфолан |
150÷180 |
10 (2b) |
|
3 |
CF3CO2Na |
DMF+FeCl2(30%) |
140÷160 |
6 (2b) |
|
4 |
C2F5CO2Na |
DMF |
140÷150 |
20 (2c) |
|
5 |
n-C3F7CO2Na |
Сульфолан |
150÷160 |
54 (2d) |
|
6 |
n-C3F7CO2K |
Сульфолан |
150÷160 |
55 (2d) |
|
7 |
n-C3F7CO2K |
Диглим |
150÷160 |
50 (2d) |
|
8 |
n-C3F7CO2K |
Тетраглим |
150÷160 |
56 (2d) |
|
9 |
n-C3F7CO2K |
DMF |
140÷150 |
69 (2d) |
|
10 |
n-C3F7CO2Na |
DMF |
140÷150 |
70 (2d) |
|
11 |
n-C3F7CO2K |
PhCN |
160÷170 |
47 (2d) |
|
12 |
n-C3F7CO2Na |
NMP |
140÷150 |
58 (2d) |
|
13 |
n-C3F7CO2Na |
DMF+CuCl(5%) |
140÷150 |
46 (2d) |
|
14 |
n-C3F7CO2Na |
DMSO |
140÷150 |
62 (2d) |
|
15 |
n-C3F7CO2K |
DMA |
140÷150 |
65 (2d) |
|
16 |
n-C5F11CO2Na |
DMF |
140÷150 |
70 (2e) |
|
17 |
H(CF2)4CO2Na |
DMF |
140÷150 |
63 (2f) |
|
18 |
H(CF2)8CO2Na |
DMF |
140÷150 |
60 (2g) |
|
19 |
n-C6F13CO2Na |
DMF |
140÷150 |
65 (2h) |
Взаимодействие полученных данным способом сульфидов 2b-g с хлорсульфоновой кислотой в среде трифторуксусной кислоты осуществляется аналогично вышеописанному с образованием метил 1,1-дихлорперфторалкил сульфидов 3b-f (Схема 3).
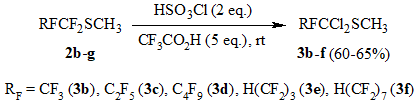
Схема 3.
Традиционная трактовка механизма обмена галогенов в α-галогенсульфидах под действием галогеноводородов предполагает промежуточное образование сульфониевых солей, образующихся в результате протонирования атома серы [10-11].
Полигалоидированные сульфиды также способны вступать в реакцию обмена галогенов под действием галогеноводородов [12-13]. Однако в этом случае более вероятно, что протонируется не атом серы, электронодонорные свойства которого снижаются под действием электроноакцепторных заместителей, а атом галогена, что позволяет рассматривать такой обмен как нуклеофильное замещение с электрофильным содействием.
Все выше сказанное в равной степени относится и к взаимодействию метилперфторалкилсульфидов с HSO3Cl/CF3CO2H. Атомы фтора в -положении к атому серы обладают определенной анионоидной подвижностью и протонируются с образованием HF, который быстро реагирует с хлорсульфоновой кислотой, давая фторсульфоновую кислоту и HCl – источник хлорид-аниона, участвующего в кислотно катализируемом замещении атомов фтора.
Очевидно, что ключевым фактором в реакциях обмена α-атомов фтора во фторалифатических сульфидах является их анионоидная подвижность. Особенно ярко это проявляется в реакционной способности диперфторалкилдисульфидов, дифторметиленовые группы которых, прилежащие к дисульфидному фрагменту с легкостью гидролизуются в водном ТГФ или ряде других растворителей. В данном случае гидролиз осуществляется вероятней всего через промежуточное образование соответствующих диацилдисульфидов, которые далее под действием воды распадаются до карбоновой кислоты и серы [14].
Таким образом, в результате исследований разработан простой метод синтеза высших метилперфторалкилсульфидов, показано, что они взаимодействуют с HSO3Cl в среде трифторуксусной кислоты с образованием метил-1,1-дихлорперфторалкил- сульфидов и продемонстрирована легкость гидролиза диперфторалкилдисульфидов до соответствующих карбоновых кислот.
Экспериментальная часть
ЯМР 1H и 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 300 и 282 MHz, соответственно, внешний стандарт CDCl3. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7,26) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение. Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra). Элементный анализ выполнен в лаборатории микроанализа ИНЭОС РАН.
Метилперфтор-2-винилоксиэтилсульфид (2a).
В двухлитровую колбу, снабженную механической мешалкой, термометром, капельной воронкой и обратным холодильником, выход которого соединен со склянкой Тищенко с H2SO4(конц.) наливают 600 мл DMF и при перемешивании присыпают 112 г (1,7 моль) цинковой пыли, и прибавляют 9 г триметилхлорсилана. Смесь перемешивают в течение 10-15 минут. Затем при интенсивном перемешивании прибавляют смесь 338 г (1,22 моль) перфторбромэтилвинилового эфира (1), 107 г (1,46 моль) CH3SCN, 6 г хлортриметилсилана в 100 мл DMF с такой скоростью чтобы температура в колбе была 25÷30оС, температуру контроллируют баней с холодной водой и скоростью прибавления. Далее смесь перемешивают в течение 3 часов при 25÷30оС, в вакууме (10 Торр) отгоняют продукт в охлаждаемый (-40÷-30оС) приемник, отгонку осуществляют до температуры кипения дистиллята 40÷45оС. Полученный дистиллят промывают равным объемом 5% соляной кислоты, перегоняют в вакууме 10 Торр из равного объема H2SO4(конц.) и ректифицируют.
Получают 210 г 2a (выход 68%), чистота 99%, т. кип. 101оС.
Найдено, %: C, 24,44; H, 1,49; F, 54,10; S, 13,10. C5H3F7OS.
Вычислено, %: C, 24,60; H, 1,24; F, 54,48; S, 13,13.
ЯМР 1H, δ: 2,6 (с, CH3);
ЯМР 19F, δ: -137,6 (дд, 1F, 3JFF-trans = 112 Гц, 3JFF-cis = 68 Гц, OCF), -125,6 (дд, 1F, 2JFF = 90 Гц, =CF-trans), -118,1 (дд, 1F, 2JFF = 90 Гц, =CF-cis), -97,2 (с, 2F, SCF2), -89,5 (c, 2F, OCF2).
Метил-1,1-дихлорперфтор-2-винилоксиэтилсульфид (3a).
В трехгорлую колбу на 500 мл, снабженную магнитной мешалкой, термометром, капельной воронкой и обратным холодильником, соединенным со склянкой Тищенко с H2SO4(конц.), вносят 60 г (0,24 моль) сульфида 2a и 140 г трифторуксусной кислоты. Далее при перемешивании и температуре 10оС добавляют по каплям 35 г (0,3 моль) хлорсульфоновой кислоты. Смесь перемешивают в течение нескольких часов и оставляют стоять в течение суток при 15÷20оС. Затем реакционную смесь аккуратно выливают на лед, нижний слой отделяют, промывают водой, смешивают с равным объемом 25% водного аммиака и перемешивают в течение 10-15 минут, отделяют и перегоняют в вакууме 10 Торр над P2O5. Полученный дистиллят ректифицируют, разделяя исходный сульфид 2a и дихлорсульфид 3a.
Получают 21 г 3a (выход ~40% с учетом конверсии 2a), с примесью 7% CF3CFHOCF2CCl2SCH3, т.кип. 161,5оС.
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -136,9 (дд, 1F, 3JFF-trans = 112 Гц, 3JFF-cis = 68 Гц, OCF), -124,8 (дд, 1F, 2JFF = 90 Гц, =CF-trans), -117,2 (дд, 1F, 2JFF = 90 Гц, =CF-cis), -81,7 (c, 2F, OCF2).
Декарбоксилирование CF3CO2Na в присутствии CH3SCN в DMF.
Смесь 51,85 г (0,38 моль) трифторацетата натрия и 30,1 г (0,41 моль) метилроданида в 140 мл DMF нагревают при перемешивании в течение 2 часов, постепенно повышая температуру реакционной смеси от 140 до 170оС с одновременной отгонкой продуктов реакции, температура кипения которых повышается до ~80оС. В результате получено 13,75 г смеси, в которой по данным ЯМР 1H, 19F и хром-масс основными фторорганическими продуктами являются CF3SCH3 (δ: -45) и CF3CO2Me (δ: -76) в мольном соотношении 1:3. Выход CF3SCH3 не превышает 10%.
Декарбоксилирование C3F7CO2M в присутствии CH3SCN в различных растворителях (Таблица 1).
Смесь (0,08 моль) соли перфтормасляной кислоты и 6,4 г (0,088 моль) метилроданида в 50 мл растворителя нагревают при перемешивании на масляной бане с одновременной отгонкой продуктов в приемник (-78оС) в течение 2 часов. Полученный дистиллят взвешивают и анализируют методами ЯМР 1H, 19F и ГЖХ.
Общий метод синтеза метилперфторалкилсульфидов 2c-h.
Смесь натриевой соли перфторалкилкарбоновой кислоты (0,33 моль) и 30 г (0,41 моль) метилроданида в 200 мл сухого DMF нагревают при перемешивании на масляной бане до температуры 140÷150оС с одновременной отгонкой продуктов реакции в приемник (-78оС), снабженный сухоледным холодильником, выход которого соединен со склянкой Тищенко с H2SO4(конц.). Нагревание осуществляют до прекращения газовыделения в течение ~2 часов. В случае высококипящих сульфидов по окончании реакции продукт вместе с DMF отгоняют в вакууме 10 Торр.
Полученный дистиллят промывают разбавленной соляной кислотой, смешивают при охлаждении с половинным количеством H2SO4(конц.) и продукт отгоняют в вакууме 10 торр в охлаждаемый (-78оС) приемник. Полученный продукт дополнительно ректифицируют. Выход 2с ~20%; 2d-h 60-65%.
Метилперфторэтилсульфид (2c). Т. кип. 37÷38оС (лит. 36,5оС [2]).
ЯМР 1H, δ: 2,6 (с, CH3);
ЯМР 19F, δ: -97,8 (c, 2F, SCF2), -85,9 (c, 3F, CF3).
Метилперфтор-н-пропилсульфид (2d). После ректификации получается продукт чистотой 95% с примесью метил перфтор-изо-пропил сульфида. Т. кип. 64÷65оС (лит. 61оС [15]).
ЯМР 1H, δ: 2,6 (с, CH3);
ЯМР 19F, δ: -126,5 (c, 2F, CF2), -93,8 (m, 2F, SCF2), -82,8 (c, 3F, CF3).
Метилперфтор-н-пентилсульфид (2e). Т. кип. 111÷111,5оС.
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -128,4+-124,3+-122,2 (c, 2F+2F+2F, (CF2)3), -93,1 (m, 2F, SCF2), -83,6 (m, 3F, CF3).
Метил-4H-перфтор-н-бутилсульфид (2f). Т. кип. 116÷117оС.
ЯМР 1H, δ: 2,5 (с, 3H, CH3), 6,1 (тт, 1H, 2JHF = 51 Гц, 3JHF = 4,8 Гц, HCF2);
ЯМР 19F, δ: -139,9 (д, 2F, 2JHF = 51 Гц, HCF2), -131,8+-123,9 (c, 2F+2F, (CF2)2), -92,8 (c, 2F, SCF2).
Метил-8H-перфтор-н-октилсульфид (2g). Т. кип. 74÷74,5оС/10 Торр.
Найдено, %: C, 24,12; H, 1,13; F, 67,73; S, 7,00. C9H4F16S.
Вычислено, %: C, 24,12; H, 0,90; F, 67,83; S, 7,15.
ЯМР 1H, δ: 2,3 (с, 3H, CH3), 5,9 (тт, 1H, 2JHF = 51 Гц, 3JHF = 4,8 Гц, HCF2);
ЯМР 19F, δ: -139,9 (д, 2F, 2JHF = 51 Гц, HCF2), -132,1+-125,5+-123,9+-123,3+-122,0 (c, 2F+2F+4F+2F+2F, (CF2)6), -93,1 (m, 2F, SCF2).
Метилперфтор-н-гексилсульфид (2h). Т. кип. 133÷134оС (лит. 131÷132оС [16]).
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -128,4+-124,8+123,5+-122,1 (c, 2F+2F+2F+2F, (CF2)4), -93,1 (m, 2F, SCF2), -83,7 (m, 3F, CF3).
Общий метод синтеза метил-1,1-дихлорперфторалкилсульфидов 3b-f.
К охлажденному до 10оС раствору (0,2 моль) сульфида 2b-g в 114 г (1 моль) трифторуксусной кислоты при перемешивании приливают 46,6 г (0,4 моль) хлорсульфоновой кислоты. Смесь выдерживают в течение ночи, аккуратно выливают на лед, нижний слой отделяют, промывают водой и перегоняют в вакууме над P2O5. Продукт дополнительно очищают ректификацией.
Метил-1,1-дихлор-2,2,2-трифторэтилсульфид (3b). Т. кип. 113,5÷114оС (лит. т. кип. 57оС/100 Торр [2]).
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -78,5 (c, CF3).
Метил-1,1-дихлорперфтор-н-пропилсульфид (3c). Т. кип. 132,5оС.
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -112,2 (c, 2F, CF2CCl2), -77,6 (m, 3F, CF3).
Метил-1,1-дихлорперфтор-н-пентилсульфид (3d). Т. кип. 54,5÷55оС(10 Торр).
ЯМР 1H, δ: 2,4 (с, CH3);
ЯМР 19F, δ: -128 (м, 2F, CF2), -118,5 (c, 2F, CF2), -107,8 (c, 2F, CF2CCl2), -83 (m, 3F, CF3).
Метил-1,1-дихлор-4H-перфтор-н-бутилсульфид (3e). Т. кип. 55,5оС/10 Торр.
ЯМР 1H, δ: 2,35 (с, 3H, CH3), 5,9 (тт, 1H, 2JHF = 52 Гц, 3JHF = 4,8 Гц, HCF2);
ЯМР 19F, δ: -138,6 (д, 2F, 2JFF = 52 Гц, HCF2), -125,9 (c, 2F, CF2), -108,8 (c, 2F, CF2CCl2).
Масс-спектр (M/Z, отнесение): 281[M+H]+, 261[M-F]+, 245[M-Cl]+, 233[M-SCH3]+, 94[ClCSCH3]+, 79[ClCS]+(100%), 67[SCl]+, 63[CF2CH]+, 59[C2Cl]+, 51[CF2H]+, 47[SCH3]+, 45[CHS]+.
Метил-1,1-дихлор-8H-перфтор-н-октилсульфид (3f). Т. кип. 70оС/0,5 Торр.
Найдено, %: C, 22,39; H, 0,99; Cl, 14,60; F, 55,36; S, 6,74. C9H4Cl2F14S.
Вычислено, %: C, 22,47; H, 0,84; Cl, 14,74; F, 55,29; S, 6,67.
ЯМР 1H, δ: 2,3 (с, 3H, CH3), 5,75 (тт, 1H, 2JHF = 52 Гц, 3JHF = 4,8 Гц, HCF2);
ЯМР, 19F δ: -139,5 (д, 2F, 2JFF = 52 Гц, HCF2), -131,8+-125,3+-123,5+-117,5 (c, 2F+2F+4F+2F, (CF2)5), -107,8 (c, 2F, CF2CCl2).
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Литература
- R.B. Ward J.Org.Chem., 1965, 30, 3009-3011.
- R.C. Terrell, T. Ucciardi, J.F. Vitcha J.Org.Chem., 1965, 30, 4011-4013.
- T. Nguyen, C. Wakselman J.Fluor.Chem., 1987, 35, 523-530.
- K.E. Rapp, J.T. Barr, R.L. Pruett, C.T. Bahner, J.D. Gibson, R.H. Lafferty Jr. J.Am.Chem.Soc., 1952, 74, 749-753.
- M. Tordeux, C. Francese, C. Wakselman J.Fluor.Chem., 1989, 43, 27-34.
- B. Quiclet-Sire, R.N. Saicic, S.Z. Zard Tetrahed.Lett., 1996, 37, 9057-9058.
- N. Roques J.Fluor.Chem., 2001, 107, 311-314.
- B. Exner, B. Bayarmagnai, F. Jia, L.J. Goossen Eur.J.Org.Chem., 2015, 21, 17220-17223.
- B. Exner, B. Bayarmagnai, C. Matheis, L.J. Goossen J.Fluor.Chem., 2017, 198, 89-93.
- F. Boberg, G. Winter, G.R. Schultze Chem.Ber., 1956, 89, 1160-1169.
- Ю.В. Поконова. Галоидсульфиды (Способы получения, свойства, применение галоидтиоэфиров). Изд. Ленинградского университета, Ленинград, 1977.
- F. Boberg, G. Winter, G.R. Schultze Liebigs Ann.Chem., 1959, 621, 8-19.
- L. Saint-Jalmes J.Fluor.Chem., 2006, 127, 85-90.
- W.V. Rochat, G.L. Gard J.Org.Chem., 1969, 34, 4173-4176.
- R.N. Haszeldine, B. Higginbottom, R.B. Rigby, A.E. Tipping J.Chem.Soc.,Perkin Trans. 1, 1972, 155-159.
- R.N. Haszeldine, A.E. Tipping, Patent DE 2238458, 1973.
Статья рекомендована к публикации членом редколлегии к.х.н. М.А. Манаенковой
Fluorine Notes, 2020, 131, 7-8


