Поступило в редакцию: Июль 2020
УДК 547.257.11
Fluorine Notes, 2020, 131, 1-2
НОВАЯ РЕАКЦИЯ ВОССТАНОВЛЕНИЯ (ТРИФТОРМЕТИЛ)ТРИБУТИЛСТАННАНА ДО (ДИФТОРМЕТИЛ)ТРИБУТИЛСТАННАНА
А.С. Голубев, П.Н. Остапчук
Институт элементоорганических соединений им. А.Н. Несмеянова РAH, Российская Федерация, 119991 Москва, ул. Вавилова, 28.
Факс: (499) 135 5085. E-mail: golubev@ineos.ac.ru
Аннотация. Разработан новый способ получения (дифторметил)трибутилстаннана н-Вu3SnCF2H восстановлением н-Вu3SnCF3 боргидридом лития в диглиме.
Ключевые слова: (дифторметил)трибутилстаннан, (трифторметил)трибутилстаннан, боргидрид лития, восстановление.
Введение дифторметильной группы в органические молекулы часто используется при разработке новых медицинских и агрохимических препаратов [1]. Несколько лет назад был разработан способ дифторметилирования арил-, гетероарил- и ß-стирилиодидов с использованием (дифторметил)трибутилстаннана н-Вu3SnCF2H. Синтез н-Вu3SnCF2H проводили реакцией трибутилолово-гидрида с (трифторметил)триметилсиланом Me3SiCF3, при этом для очистки н-Вu3SnCF2H использовалась колоночная хроматография [2].
В рамках текущего проекта по синтезу дифторметил-содержащих физиологически активных соединений нам потребовался н-Вu3SnCF2H, не содержащий н-Вu3SnCF3. В экспериментах по синтезу н-Вu3SnCF2H согласно протоколу, приведенному в работе [2], мы всегда наблюдали образование (трифторметил)трибутилстаннана н-Вu3SnCF3 в качестве побочного продукта. Колоночная хроматография действительно позволяет значительно уменьшить содержание примеси н-Вu3SnCF3. Тем не менее, полностью избавиться от н-Вu3SnCF3 удается лишь за счет значительных потерь целевого н-Вu3SnCF2H. Для получения н-Вu3SnCF2H, не содержащего н-Вu3SnCF3, нами разработана новая реакция восстановления н-Вu3SnCF3 до н-Вu3SnCF2H.
Нами найдено, что (трифторметил)трибутилстаннан н-Вu3SnCF3 реагирует с боргидридом лития LiBH4 в диглиме с образованием (дифторметил)трибутилстаннана н-Вu3SnCF2Н (Cхема 1).
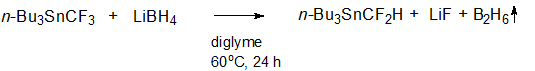
Схема 1.
Использование 1,5 эквивалента LiBH4 и умеренный нагрев (60оС) позволило достичь полной конверсии исходного н-Вu3SnCF3 и хорошего выхода целевого Вu3SnCF2Н (60-70%) за разумное время (24 ч). Реакция образования Вu3SnCF2Н наблюдалась и при комнатной температуре, но при этом конверсия не превышала 50% за 24 ч. Контроль завершения реакции осуществляли методом спектроскопии ЯМР 19F{1H} (исходный н-Вu3SnCF3 наблюдался в виде синглета со сдвигом -45.13 м.д. и 119Sn сателлитами: 2J (19F,119Sn) = 214 Гц, продукт н-Вu3SnCF2Н - в виде синглета со сдвигом 124.62 м.д. и 119Sn сателлитами: 2J (19F,119Sn) = 212 Гц) или методом спектроскопии ЯМР 119Sn (квартет со сдвигом -22.7 м.д. и константой 2J (19F,119Sn) = 218 Гц для н-Вu3SnCF3 и триплет со сдвигом -49.4 м.д. и константой 2J (19F,119Sn) = 214 Гц для н-Вu3SnCF2Н).
Основным побочным продуктом реакции оказался бис(трибутилолово)оксид. Его образование происходит, по-видимому, за счет следов воды в реагентах (LiBH4 крайне гигроскопичен).
В реакции восстановления участвовал всего один гидрид-ион молекулы LiBH4. Поскольку в ходе реакции выделялся диборан, то процесс восстановления проводили в токе азота. Поток выходящих газов направляли в колонну с водой или ацетоном.
К концу реакции наблюдали четкое разделение реакционной массы на две фазы. Исследование фаз показало, что продукт концентрируется практически полностью в нижней фазе. В верхней фазе находились непрореагировавший LiBH4 и оставшийся диборан. Их взаимодействие приводит, как известно [3,4], к образованию LiB2H7. Последний связывает диглим в виде сольватного комплекса строения LiB2H72 молекулы диглима, что и явилось, по-видимому, причиной расслоения реакционной массы.
Обработка реакционной массы водой потребовала особого внимания. Рекомендуется выливать реакционную массу в ледяную воду. Добавление воды к реакционной массе в одном из опытов вызвало энергичную реакцию, которая привела к выплескиванию содержимого реакционной колбы.
Наши попытки использовать боргидрид натрия NaBH4 в диглиме для восстановления н-Вu3SnCF3 по аналогии с восстановлением (трифторметил)триметилсилана Me3SiCF3 до (дифторметил)триметилсилана Me3SiCF2Н [5] не привели к успеху. Мы наблюдали образование н-Вu3SnCF2Н, однако, достичь существенной конверсии в диапазоне температур 20-50оС не удалось. Интересно, что при восстановлении Me3SiCF3 до Me3SiCF2Н боргидридом натрия в процессе участвуют по крайней мере 3 гидрид-иона молекулы NaBH4 [5].
Таким образом, нами разработан новый способ получения (дифторметил)трибутилстаннана н-Вu3SnCF2H восстановлением н-Вu3SnCF3 боргидридом лития в диглиме. Новый метод позволяет избежать использования небезопасного и склонного к окислению трибутилолово-гидрида. Достоинством метода также является возможность получения н-Вu3SnCF2Н, не содержащего н-Вu3SnCF3.
Экспериментальная часть
Спектры ЯМР 1Н ,19F и 119Sn были зарегистрированы на спектрометре Bruker AvanceTM400 (400.13 MГц для1H, 376.50 MГц с развязкой от протонов для 19F, 149.21 MHz для 119Sn). Химические сдвиги протонов определяли относительно остаточного сигнала хлороформа (7.28 м.д.) и пересчитывали к сигналу SiMe4. Химические сдвиги ядер 19F определяли относительно трифторуксусной кислоты как внешнего стандарта. Химические сдвиги ядер 119Sn определяли относительно Me4Sn как внутреннего стандарта (δ 0.0 м.д.).
(Трифторметил)трибутилстаннан н-Вu3SnCF3 был приготовлен из бис(трибутилолово)оксида и (трифторметил)триметилсилана Me3SiCF3 согласно методике, приведенной в работе [6].
Реакцию проводили в постоянном токе сухого азота в 3-х горлой колбе. Колба была снабжена трубкой для ввода сухого азота, капельной воронкой и отводом, соединенным с поглотительной колонной с водой или ацетоном. К раствору 7.0 г (19.5 моль) (трифторметил)трибутилстаннана в 30 мл сухого диглима прибавили боргидрид лития (0.64 г, 29.3 ммоль) в виде раствора в диглиме (9.8 мл 3М раствора в диглиме). Прибавление боргидрида лития сопровождалось разогревом реакционной смеси до 35оС. Реакционную смесь нагревали при перемешивании при 60 оС в течение 24 ч. Контроль реакции (ЯМР 19F) показал полную конверсию исходного. Реакционную массу вылили в ледяную воду (200 мл), экстрагировали толуолом (50 мл + 30 мл). Объединенные органические фазы упарили в вакууме на роторном испарителе. Остаток перегнали, получили 4.2 г (63%) жидкости с т.кип. 89-93оС/0.3 Тор, которая представляла собой (дифторметил)трибутилстаннан н-Вu3SnCF2Н и примерно 6 мол. % диглима. (Дифторметил)трибутилстаннан н-Вu3SnCF2Н может быть дополнительно очищен на столбике силикагеля, элюент петролейный эфир:этилацетат 100:1, для обнаружения молибдат церия (Hanessian's Stain).
ЯМР 1H (CDCl3) δ 6.45 (т, J = 44.9 Гц, 1H), 1.70 – 1.44 (м, 6H), 1.44 – 1.24 (м, 6H), 1.21 – 0.97 (м, 6H), 0.93 (т, J = 7.3 Гц, 9H).
ЯМР 19F{1H} (CDCl3) δ -124.62 с, 119Sn сателиты: 2J (19F,119Sn) = 212 Гц).
ЯМР 119Sn (CDCl3) δ -51.94 (т, J = 214.4 Гц) (см. также [2]).
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Yerien D. E., Barata‐Vallejo S., Postigo A., Difluoromethylation reactions of organic compounds, Chemistry–A European J., 2017, 23(59), 14676-14701.
- Prakash G. K. S., Ganesh S. K., Jones J.-P., Kulkarni A., Masood K., Swabeck J. K., Olah G. A. Copper‐mediated difluoromethylation of (hetero)aryl iodides and β‐styryl halides with tributyl(difluoromethyl)stannane, Angewandte Chemie, 2012, 124(48), 12256-12260.
- Brown H. C., Stehle P. F., Tierney P. A., Singly-bridged compounds of the boron halides and boron hydrides., J. Am. Chem. Soc., 1957, 79(8), 2020-2021.
- Титов Л. В., Гаврилова Л. А., Известия АН СССР, Сер. хим., 1976, 244-248.
- Тютюнов А. А., Бойко В. Э., Игумнов С. М., Необычная реакция (трифторметил)-триметилсилана с боргидридом натрия, Fluorine Notes, 2011, вып. 1(74).
- Prakash G. K. S., Yudin A. K., Deffieux D., Olah G. A., Synthetic methods, Part 197, Facile preparation of (trifluoromethyl)tributyltin and transtrifluoromethylation of disilyl sulfides to the corresponding trifluoromethylsilanes, Synlett, 1996, 2, 151-153.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2020, 131, 1-2


