Поступило в редакцию: Июнь 2020
УДК 547.541.513;547.539.1
Fluorine Notes, 2020, 130, 5-6
СИНТЕЗ 4-CF3-ЗАМЕЩЕННЫХ МОНО- И ДИХЛОРФЕНИЛСУЛЬФОНИЛХЛОРИДОВ
Т.П.Васильева*, В.И. Дяченко
Институт элементоорганических соединений им. А. Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
e-mail: vic-d.60@mail.ru
Aннотация: При использовании доступных 4-СF3-замещенных моно- и дихлорариламинов 1a и 4, по реакции Мейервейна с высоким выходом получены соответствующие сульфонилхлориды 3a и 6. Ключевой стадией является медь (I) катализируемая реакция солей диазония с SO2 в солянокислом водном растворе. Разработаны препаративные методы синтеза сульфохлоридов 3a,b и 6, хорошо поддающиеся масштабированию.
Kлючевые слова: N-хлорсукцинимид, 2,6-дихлор-4-трифторметиланилин, диазотирование, хлорид меди (I), 4-CF3-содержащие фенилсульфонилхлориды
Арилсульфонилхлориды являются одним из важнейших классов органических соединений. Многие из них нашли применение в производстве антибактериальных и дезинфицирующих средств, полимеров, отбеливателей, гербицидов и ряда других веществ, широко используемых в промышленности, медицине и сельском хозяйстве [1,2]. Несмотря на появление антибиотиков, получаемые на основе арилсульфонилхлоридов сульфаниламидные препараты до сих пор не утратили своего значения и успешно используются в терапии инфекционных заболеваний [3]. Это особенно актуально в случае развития резистентности к антибиотикам при тяжелых септических осложнениях. К тому же, наличие в составе молекул антибактериальных и других биологически активных соединений атомов фтора и CF3-групп приводит к повышению их липофильности, улучшению фармако-кинетических свойств и снижению терапевтических доз препарата [4,5].
В настоящее время появилось много публикаций о возможности использования фторсодержащих арилсульфонилхлоридов в синтезе производных синефрина, обладающих специфической индукцией апоптоза [6], соединений с высокой противоопухолевой активностью [7], веществ, снижающих уровень сахара в крови [8]. С использованием фторзамещенных сульфонилхлоридов синтезированы ингибиторы гамма-секретазы [9], блокаторы рецепторов брадикинина В1 [10], антагонисты рецептора окситоцина для лечения аутизма и потери памяти [11]. 4-Фторфенилсульфамиды (S)-триптамина предложены в качестве противораковых агентов [12], фторсодержащие сульфамиды гетероциклических соединений рекомендованы для лечения когнитивных нарушений, ассоциированных с болезнью Альцгеймера и Паркинсона [13].
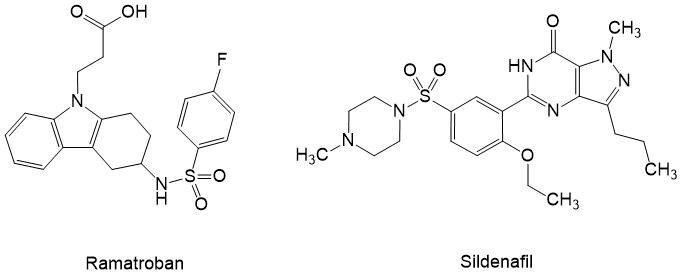
Рисунок 1.
Высокоэффективным антиагрегантами тромбоцитов, полученным на основе арилсульфонилхлоридов, зарекомендовали себя Ramatroban [14] и Sildenafil, обладающие способностью снимать спазмы мелких сосудов легких и других органов [15] (Рис.1). Особенно это важно сейчас, когда стало известно, что одна из основных причин летального исхода при коронавирусной инфекции СOVID-19, вызванной вирусом SARS-CoV-2, является тромбообразование и сужение просвета альвеол.
В этой связи поиск эффективных методов синтеза фторсодержащих арилсульфонилхлоридов, как билдингблоков для органической и фармацевтической химии является актуальной задачей.
Целью настоящей работы является поиск и разработка эффективных методов синтеза 4-CF3-содержащих бензолсульфонилхлоридов - 2-хлор-4-(трифторметил)бензолсульфонил-хлорида (3a), 2,6-дихлор-4-(трифторметил)бензолсульфонилхлорида (6), а также 2-хлор-4-цианобензолсульфонилхлорида (3b), широко востребованных в органическом синтезе [6-13]. Несмотря на то, что сульфонилхлориды 3a, 3b и 6 часто используются для получения биологически активных веществ, методики их синтеза в литературе не описаны. Традиционные методы сульфонилирования соответствующих бензолов при помощи HSO3Cl, HSO3F, SO2Cl2 и др. [16,17], для получения соединений 3a, 3b, 6 оказались малоперспективными. Это связано как с труднодоступностью для сульфонилирования исходных СF3-содержащих хлорбензолов, так и с высокой вероятностью получения смеси изомерных орто-, пара- продуктов реакции.
В связи с этим для разработки приемлемых методов синтеза 3a и 6 мы использовали реакцию Мейервейна, заключающуюся в хлорсульфонилировании солей диазония в солянокислом водном растворе SO2 в присутствии солей меди (I) [18] (cм. Схему 1).
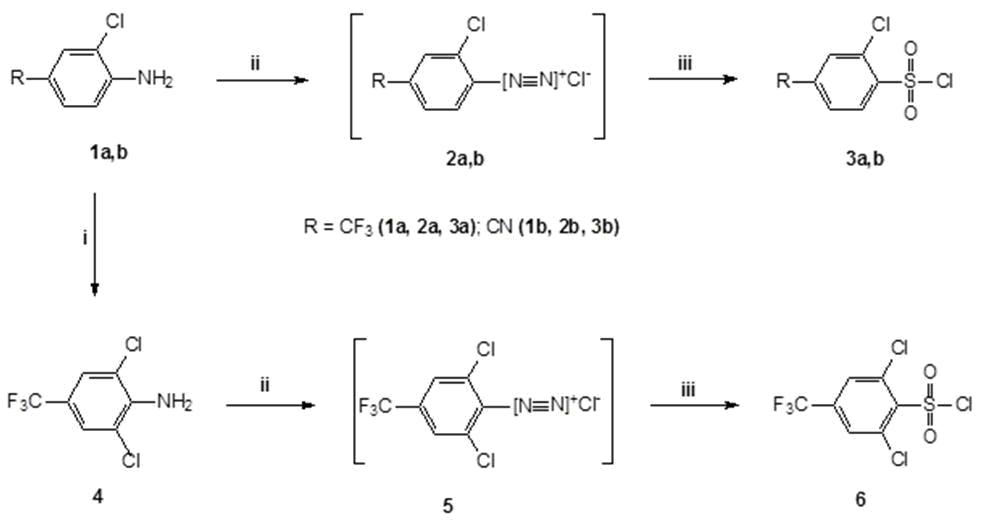
Схемa 1. Реагенты и условия: i) N-хлорсукцинимид, МеCN, 60-85С; ii) NaNO2, HCl/H2O, -5С, iii) SOCl2/H2O, 7-18С, 1-2 mol % CuCl, 0С.
В пользу избрания этого метода синтеза целевых сульфонилхлоридов свидетельствовала доступность соответствующих исходных CF3-содержащих ариламинов 1а,b и 4, а так же то, что ранее был описан частный пример получения в этих условиях 2-хлор-4-цианобензолсульфохлорида [19]. К сожалению, в данном патенте не приводятся ни методика синтеза исходного ариламина 1b, ни физические характеристики полученного сульфонилхлорида 3b. В тоже время сопоставимость по влиянию на ароматическое ядро электроноакцепторных свойств CF3- и СN-грyпп позволяла надеяться на успешное применение данного метода для синтеза фторсодержащих сульфонилхлоридов 3a и 6.
Исходные галогенсодержащие ариламины 1b и 4 получали хлорированием коммерчески доступных 4-аминобензонитрила и 2-хлор-4-(трифторметил)анилина 1а N‑хлорсукцинимидом, как описано в работе [20]. Известный же способ получения 1b восстановлением 3-хлор-4-нитробензонитрила является более трудоемким [21].
Установлено, что оптимальными условиями хлорирования данных ариламинов N-хлорсукцинимидом является осуществление реакции в ацетонитриле при 60-85С на протяжении 2-3 часов. При этом 4-амино-3-хлорбензонитрил 1b образуется с выходом 92%. Таким же образом был получен 2,6-дихлор-4-трифторметиланилин 4 с выходом около 93% (см. Схему 1). Ранее в патенте [22] сообщалось о получении соединения 4 гидролизом 4-трифторметил-2,6-дихлорфенилизоцианата. Однако, ни методика синтеза, ни физические характеристики 4 в этой работе также приведены не были.
Синтез сульфонилхлоридов 3a,b и 6 мы осуществляли в три этапа: 1) генерирование in situ диоксида серы из SOCl2 c H2O; 2) получение в солянoкислом водном растворе из соответствующих ариламинов и NaNO2 соли диазония; 3) взаимодействие в этих условиях солей диазония 2а,b и 5 с SO2 в присутствии хлорида меди (I) (см. Схему 1). Оказалось, что в случае ариламинов, имеющих в своем составе гидрофобные заместители, хлорсульфонилирование имеет свои особенности. Так, при получении солей диазония 2а и 5, промежуточно образующиеся хлоргидраты ариламинов 1а и 4, как и образующиеся из них диазонийхлориды, в типичных условиях реакции Мейервейна выпадают в осадок. Это приводит к тому, что диазотирование осуществляется в гетерогенных условиях, что существенно снижает контроль реакции и выход конечных продуктов. Плохая растворимость солей 1а, 4 и 2а, 5 в водной среде, очевидно, связана с наличием в их составе помимо атомов хлора сильно гидрофобной CF3-грyппы, поэтому диазотирование этих ариламинов мы проводили не в солянокислом водном растворе, а в системе Н2О-HCl-AcOH. Действительно, использование в качестве со-растворителя незначительного количества AcOH в данных превращениях существенно влияет на растворимость исходных и промежуточных продуктов реакции. В свою очередь, это значительно облегчает образование целевых соединений. Таким образом, сульфонилхлориды 3a и 6 были получены с выходами 71% и 76% соответственно.
По-видимому, данный подход к синтезу 3a и 6 может быть успешно применен для получения и других полифтор- и полифторалкилсодержащих сульфонилхлоридов.
Экспериментальная часть
Спектры ЯМР и 19F зарегистрированы в СDCl3 на спектрометре «Bruker Avance-400» с рабочими частотами 400 MГц и 376 МГц соответственно. Химсдвиги в 1Н ЯМР спектрах полученных соединений приведены в шкале δ (м.д.) относительно ТМС (внутренний стандарт), 19F - относительно CFCl3 (внешний стандарт). Константы спин-спинового взаимодействия приведены в Гц. Rf полученных соединений определены методом ТСХ на пластинках фирмы Merck марки TLC Silica gel 60 F254. Исходные 4-аминобензонитрил (CAS 873-74-5) и 2-хлор-4-трифторметиланилин (CAS 21803-75-8) фирмы Sigma-Aldrich. Элементный анализ полученных соединений проводили в лаборатории элементного анализа ИНЭОС РАН.
2-Хлор-4-трифторметилбензолсульфонилхлорид (3а).
Стадия А. Получение раствора SO2 в разбавленной соляной кислоте. В трехгорлую двухлитровую круглодонную колбу, снабженную магнитной мешалкой и термометром, помещали 522 мл Н2О и охлаждали льдом до 0-7С. В этих условиях на протяжении 1 часа при перемешивании в колбу добавляли по каплям 88 мл (1,205 моль) SOCl2
Стадия Б. Получение раствора хлористоводородной соли диазония 2а. В трехгорлую пол-литровую колбу, снабженную термометром и магнитной мешалкой, помещали 190 мл концентрированной HCl и 38 мл АсОН. К полученной смеси кислот при перемешивании прибавляли раствор 55 г (0,28 моль) ариламина (1а) в 35 мл АсОН. Затем температуру реакционной массы понижали до -10-5С и при интенсивном перемешивании по каплям прибавляли в нее раствор 20,9 г (0,3 моль) NaNO2 в 83 мл воды. После перемешивания при ‑5-0С в течение 1 часа реакционную массу переносили в капельную воронку для проведения заключительной стадии реакции.
Стадия С. В двухлитровую колбу, содержащую полученный раствор SO2 в разбавленной соляной кислоте (см. Стадию А) прибавляли 0,5 г (5,06 ммоль) хлорида меди (I). Температуру реакционной массы при перемешивании понижали до 0-7С и затем из капельной воронки прибавляли к ней холодный (0-5С) раствор хлористоводородной соли диазония 2а (см. Стадию Б). После перемешивания реакционной массы при 0С на протяжении 1,5 ч, охлаждение убирали, а температуру реакции доводили до 18С. Для выделения продукта реакции к реакционной смеси приливали 150 мл ССl4, перемешивали 5 минут и отделяли органический слой. Водный слой экстрагировали 100 мл бензола, затем 150 мл СН2Сl2. Объединенные органические растворы промывали холодной водой, сушили над МgSO4, растворитель удаляли, остаток перегоняли в вакууме. Получали 55, 4 г (71%) сульфонилхлорида 3а в виде бледно желтого масла, имеющего т.кип. 88-89С при 1,5 мм Hg. При стоянии вещество 3а становится твердым, образуя прозрачные кристаллы с т.пл. 38-40С. Его спектральная чистота составляет 97%, Rf=0,39 (CCl4).
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 7,78 (д, 1Н, Аr, 3JН-Н=8,4); 7,92 (c, 1H, Аr); 8,31 (д, 1Н, Аr, 3JН‑Н=8,4).
ЯМР 19F (CDCl3, δ, м.д., J/Гц): -63,47 (c, 3F, CF3).
Найдено, %: С, 30,03; Н, 1,02; F, 20,20. C7H3Cl2F3O2S. Вычислено, %: С, 30,11; Н, 1,08; F, 20,43.
4-Амино-3-хлорбензонитрил (1b).
К раствору 50 г (0,423 моль) 4-аминобензонитрила в 420 мл МеСN при температуре 60С и перемешивании прибавляли порциями 56,51 г (0,423 моль) N-хлорсукцинимида. Затем температуру реакции повышали до 85С и перемешивали в этих условиях на протяжении 3 часов. После этого реакционную массу упаривали на роторном испарителе до половины объема, а к оставшемуся раствору при интенсивном перемешивании приливали 390 мл 5%-ного водного р-ра NaOH. Выпавший твердый осадок светло-желтого цвета отфильтровывали, промывали водой, петролейным эфиром, а затем сушили над КОН до постоянного веса при 20 мм. рт. ст. Получали 59,3 г соединения 1b, выход 92%, т.пл.103-104С (в лит.[20] т.пл. 97-99С).
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 4.53 (уш.с, 2Н, NH2); 6,76 (д, 1Н, Аг, 3JH-H=8,4), 7,33 (уш.д, 1Н, Аr, 3JH-H=8,4); 7,52 (уш.с, 1Н, Аr). По данным ТСХ Rf=0,40 (CHCl3). ЯМР 1Н чистота соединения составила 98,5%.
2-Хлор-4-цианобензолсульфонилхлорид (3b).
Получали аналогично синтезу 3а. В трехгорлую двухлитровую литровую круглодонную колбу, снабженную магнитной мешалкой и термометром, помещали 528 мл Н2О и охлаждали льдом до 0-7С. В этих условия в колбу при перемешивании на протяжении 1 часа из капельной воронки прибавляли 88,6 мл (1,23 моль) SOCl2, затем 0,319 г (3,22 ммоль) СuCl. После этого в реакционную массу при охлаждении до 0-5С из капельной воронки прибавляли раствор соли диазония 2b, полученной смешением растворов 43,32 г (0,284 моль) ариламина 1b в 285 мл концентрированной HCl и 21.1 г (0,306 моль) NaNO2 в 84 мл воды. После перемешивания реакционной массы в этих условиях на протяжении 1,5 ч охлаждение прекращали, температуру реакции доводили до 18оС. Образовавшийся при этом осадок отфильтровывали и промывали холодной водой. Сырой продукт экстрагировали 400 мл метиленхлорида, а полученный раствор пропускали через слой силикагеля. Фильтрат упаривали до половины объема и прибавляли к нему 77 мл ССl4. Полученный раствор упаривали на роторном испарителе до начала кристаллизации и охлаждали. Выпавший осадок отфильтровывали, промывали холодным ССl4 и сушили в вакууме над Р2О5 при 20 мм рт. ст. Получали 44,3 г (66%) спектрально чистого сульфонилхлорида 3b в виде светло-желтого кристаллического вещества с т. пл. 102-103С, Rf=0.57 (хлороформ).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 7,81 (д, 1Н, Аr, 3JН-Н=8,4); 7,95 (c, 1H, Ar); 8,29 (д, 1Н, Аr, 3JН-Н=8,4).
Найдено, %: С, 35,73; Н, 1,28; Cl, 30,04; N 5,91. C7H3Cl2NO2S. Вычислено, %: С, 35,59; Н, 1,27; Cl, 30,08; N, 5.93.
2,6-Дихлор-4-трифторметиланилин (4).
Получали в ацетонитриле из 107,71 г (0,551 моль) 2-хлор-4-трифторметиланилина 1а и 80,91 (0,606 моль) N-хлорсукцинимида аналогично синтезу соединения 1b на протяжении 2 часов. Растворитель удаляли в вакууме, а к остатку прибавляли 200 мл петролейного эфира. Выпавший осадок сукцинимида отфильтровывали, а фильтрат упаривали на роторном испарителе. Оставшееся масло перегоняли в вакууме масляного насоса, получая 4 в виде бледно-желтого масла с т.кип 61-62С при 1-2 мм рт. ст. Выход 117,7 г (93%), Rf=0,75 (CCl4-CHCl3=1:1). При охлаждении 4 превращается в твердое вещество с т. пл. 33-35оС (в лит. [22] т. пл. 32-35оС).
ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 4,80 (уш. с, 2Н, NH2); 7,50 (c, 2Н, Ar).
ЯМР 19F (СDСl3, δ, м.д., J/Гц): -61,97 (c, 3F, CF3).
Найдено, %: С, 36,27; Н, 1,65; F, 24,71; N, 5,98. C7H4Cl2F3N. Вычислено, %: C, 36,52; H 1,74; F, 24,78; N, 6.09.
2,6-Дихлор-4-трифторметилбензолсульфонилхлорид (6).
Получали аналогично синтезу 3а. В двухлитровую трехгорлую круглодонную колбу, снабженную магнитной мешалкой и термометром, помещали 429 мл Н2О, охлаждали до 0‑7С и на протяжении 1 часа при перемешивании в колбу прикапывали 72 мл (0,986 моль) SOCl2, затем прибавляли 0,45 г (4,55 ммоль) хлорида меди (I). Затем в реакционную массу, при охлаждении до 0-5оС, из капельной воронки на протяжении 1,5 ч прибавляли раствор соли диазония 5. В свою очередь, 5 получали прибавлением к смеси 232 мл концентрированной HCl и 35 мл АсОН сначала раствора 53,17 г (0,231 моль) ариламина 4 в 35 мл АсОН, затем 17.2 г (0,249 моль) NaNO2 в 69 мл воды. После перемешивания при 0-5оС на протяжении 1,5 ч, охлаждение убирали, температуру реакционной массы доводили до 18С. Образовавшийся при этом осадок отфильтровывали, промывали холодной водой и сушили в вакууме над Р2О5 при 15 мм Hg. Получали 55,12 г (76%) спектрально чистого сульфонилхлорида 6 в виде желтых кристаллов с т. пл. 48-50С, Rf=0,42 в ССl4, чистота ≥98%,.
ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 7,82 (с, 2Н, Аr).
ЯМР 19F (CDCl3, δ, м.д., J/Гц): -61,32 (c, 3F, CF3).
Найдено, %: С, 26,77; Н, 0,61; F, 18,05. С7Н2Cl3F3O2S. Вычислено, %: С, 26,79; Н, 0,64; F, 18,18.
Выводы
Показано, что пара-СF3-замещенные ариламины, содержащие в орто-положении один или два атома хлора, легко взаимодействуют в условиях реакции Мейервейна с SO2, образуя соответствующие сульфонилхлориды 3а, 6 с высокими выходами.
Разработаны препаративные методы получения сульфонилхлоридов 3а,b и 6, широко востребованных в качестве строительных блоков в синтезе биологически активных веществ. Изучены перспективы масштабирования при их наработке.
Благодарности
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Список литературы
- Джильберт Э. Е., Сульфирование органических соединений, пер. с англ., М., 1969.
- Houben-Weyl, Methoden der organischen Chemie, Bd 9, Stuttg., 1955.
- In the book S. N. Kozlov, R. S. Kozlov, Modern Antimicrobial Chemotherapy: A Guide for Physicians, 3rd ed. Publishing House “Medical Information Agency Russia”, Article: 108458, ISBN: 978-5-8948-1999-0, 2017, 400 pp.
- H-J. Böhm, D. Banner, St. Bendels, M. Kansy, B. Kuhn, K. Müller, U. Obst-Sander, M. Stahl, ChemBioChem, 2004, 5, 637.
- T. Hiyama, Organofluorine Compounds, Springer Berlin Heidelberg, Berlin, Heidelberg, 2000.
- Vanden Berghe, Wim; De Bosscher, Karolien; Van Calenbergh, Serge; Haegeman, Guy; Lacey, Carl Jeffrey; Gossye, Valerie; Arias, Ruben Hoya; Gerlo, Sarah /Patent US 20090029999, 2009.
- Bystroem, Styrbjoern; Hedgecock, Charles; Homan, Evert; Lundbaeck, Thomas; Martinsson, Jessica; Sari, Meral; Faernegaardh, Katarina; Joensson, Mattias / WO 2012035171, 2012.
- Liang, Yanshu; Zhu,Yingjie; Guo, Guimei; Lu, Liang; Long, Li / Faming Zhuanli Shenqing, Patent CN 103012314, 2013.
- Adeniji, A. O.; Wells, R. M.; Adejare, A. Current Medicinal Chemistry, 2012, 19(15), 2458‑2471.
- Reich, Melanie; Schunk, Stefan; Jostock, Ruth; Hees, Sabine; Germann, Tieno; Engels, Michael Franz-Martin, WO 2010051977, 2010.
- Bissantz, Caterina; Grundschober, Christophe; Nettekoven, Matthias; Plancher, Jean-Marc; Vifian, Walter, WO 2014111356, 2014.
- Guo, Zhenbo; Xu, Yiming; Peng, Yujie; Haroon ur Rashid; Quan, Wei; Xie, Peng; Wu, Lichuan; Jiang, Jun; Wang, Lisheng; Liu, Xu, Bioorganic & Medicinal Chemistry Letters, 2019, 29(9), 1133-1137.
- Chu, Chester; Lister, Andrew; Nordvall, Gunnar; Petersson, Carl; Rotticci, Didier; Sohn, Daniel, WO 2006126939, 2006.
- Motobayashi Y., Imagawa W., Saida K. Ramatroban (Baynas): a review of its pharmacological and clinical profile, Folia Pharmacol. Jpn., 2001, 118(6), 397-402.
- Shmal'ts A.A., Gorbachevskiy S.V. Riociguat and sildenafil for pulmonary hypertension: similarity and difference, Pulmonologiya, 2016, 26(1), 85-91. (In Russian) https://doi.org/10.18093/0869-0189-2016-26-1-85-91.
- Сайкс Питер, Механизмы реакций в органической химии / Пер. с англ. Н. Г. Луценко; Под ред. В. Ф. Травеня. - 4-е изд. - М. : Химия, 1991, 446c., ISBN 5-7245-0191-0.
- Титце Л., Айхер Т. Препаративная органическая химия: Пер. с нем. / Под ред. Ю.Е. Алексеева. М.: Мир, 1999, 704 с.
- Meerwein H. et al. Reaction of aromatic diazo compounds upon α,β-unsaturated carbonyl compounds, Journal fur Praktische Chemie (Leipzig), 1939, 152, 237-266.
- Fritson I., Liberg D., East S., Mackinnon C., Prevost N., WO 2014184234, 2014.
- Nicson T.E., Roche-Dalson C.A., Synthesis, 1985, 669.
- Grivsky E/M., Hitchings G.H., Ind. Chim. Belge, 1974, 39, 490.
- Fаerbenfabriken BayerA.-G, Patent FR 1545142, 1968.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2020, 130, 5-6


