Поступило в редакцию: Май 2019
УДК 547.728
Fluorine Notes, 2019, 125, 9-10
СИНТЕЗ ФТОРСОДЕРЖАЩИХ ЛИГАНДОВ РЯДА БЕНЗОФУРАНА И СВОЙСТВА ИХ КОМПЛЕКСОВ С ЕВРОПИЕМ (III) В ВОДНЫХ РАСТВОРАХ
Пугачёв Д.Е.1,2, Затонский Г.В.2, Васильев Н.В1,2*.
1Московский государственный областной университет, ул. Радио, 10-а, Москва, 105005, Россия;
e-mail: nikolai-vasilev@mail.ru
2ФГУП Государственный научно исследовательский институт Биологического приборостроения, Волоколамское
шоссе, 75, кор. 1, Москва, 125424, Россия;
e-mail: pugachovdmitry@gmail.com
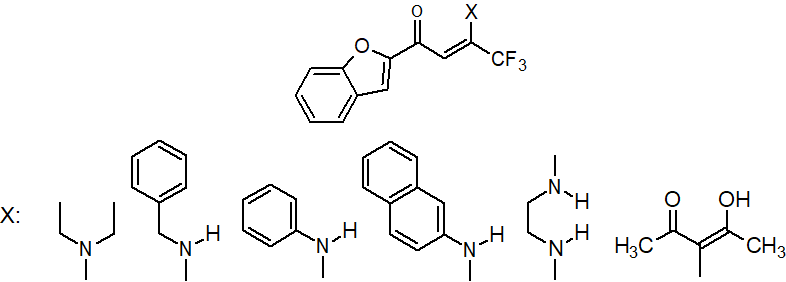
Аннотация: Синтезированы новые представители фторсодержащих енаминонов и трикетонов ряда бензофурана с целью изучения их комплексов сионом европия как потенциальных люминесцирующих реагентов для иммунофлуоресцентного анализа. Полученные соединения образуют комплексы с ионом европием (III) в водных растворах, но с течением времени гидролизуются, формируя комплексы соответствующихβ-дикетонов, что прослеживается по изменению спектральных характеристик во времени.
Ключевые слова: бензофуранилтрифторметилсодержащие комплексоны, реакция Кляйзена, енаминоны, дикетоны, трикетоны, хелаты европия, люминесцентно-спектральные свойства, иммунофлуоресцентный анализ.
Известно, что фторсодержащие комплексоны ароматического и гетероароматического рядовактивно применяются для иммунофлуоресцентного лантанидного анализа (LIFA). Фторированные заместители обеспечивают повышенную устойчивость образующихся комплексов и увеличивают способность к гидрофобному вытеснению воды из внутренней сферы,что снижает тушение люминесценции в водных растворах. Известно также, что бензофурановый фрагмент обеспечивает оптимальные спектральные характеристики, в том числе, хорошую сенсибилизацию кванта в длинноволновой области (≥350 нм). Так, 2‑бензофураноилтрифторацетон 2, полученный впервые в работе [1], и его гомологи образуют достаточно устойчивые комплексы с европием в присутствие триоктилфоосфиноксида (ТОФО), которые проявляют значительные флуорогенные свойства [2, 3]. Целью настоящего исследования явилось изучение методов получения фторсодержащих енаминокетонов и трикетонов бензофуранового ряда и исследование их в качестве сенсибилизирующих комплексоновEu3+.
Фторсодержащие енаминоны являются таутомерами соответствующих иминов и достаточно хорошо изучены, благодаря серии работ, обобщенных в обзорах [4-6]. Эти соединения являются электронными аналогами енольных форм β‑дикетонов и проявляют хорошие свойства комплексонов по отношению к ряду металлов [7-9].
Исходным реагентом для получения енаминонов являлся 2‑бензофураноилтрифторацетон 2, полученный по модифицированной методике с применением гидрида лития в качестве основного реагента (схема 1).

Схема 1. Получение бензофураноилтрифторацетона 2.
Прямое взаимодействие аминов с фторированными β‑дикетонами не всегда позволяет получать имины или изомерные им енаминоны, и, как правило, осуществляется нерегиоселективно [10]. Наши попытки осуществить синтез енаминонов 5 взаимодействием дикетона 2 с первичными аминами также не закончились выделением индивидуальных соединений. Первично образующиеся соли аминов 3, при нагревании подвергались вторичным превращениям с образованием смолообразных продуктов (схема 2).
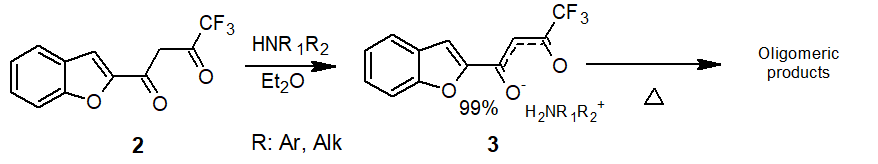
Схема 2. Взаимодействие аминов с β-дикетоном 2.
В связи с этим была выбрана двустадийная схема получения енаминонов, основанная на промежуточном использовании хлоренона 4 (схема 3). На первой стадии взаимодействием дикетона 2 с хлористым тионилом в присутствии каталитического количества DMF был получен с удовлетворительным выходом (83 %) хлоренон 4. Бензофуранилхлоренон 4 образуется в виде легкоплавких кристаллов, которые легко очищаются при перегонке в вакууме. Взаимодействие хлоренона 4 с аминами осуществляется при комнатной температуре в сухом диэтиловом эфире. В качестве акцептора хлороводорода в случае алифатических аминов использовался их двойной избыток, для ароматических аминов применялся триэтиламин (схема 3). Выходы образующихся соединений 5a-d достаточно высоки (≥78%).
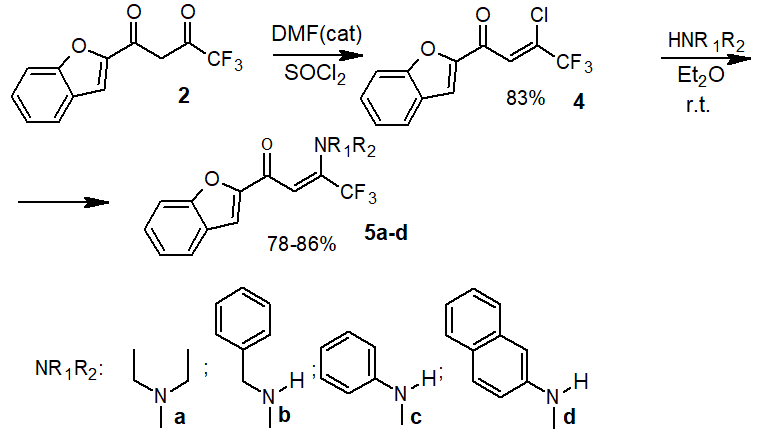
Схема 3. Получение енаминонов 5a-e.
Для увеличения хелатирующей способности исследуемых енаминонов в среде триэтиламина был получен бис-замещенный енаминон 5e на основе этилендиамина (схема 4).
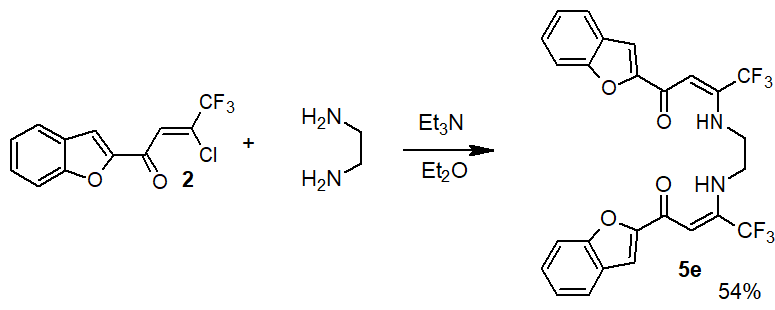
Схема 4. Получение бис-енаминона 5е.
Для енаминонов 5 характерно наличие Z/E–изомерии, которая фиксируется в спектрах ЯМР, что отмечалось ранее для фторсодержащих енаминонов [11-13].Для соединений 5a и 5e характерны только Z или E форма, соответственно.
Замещение галогена в хлореноне 2 может быть произведено также и карбанионом, генерированным из ацетилацетона (схема 5). Реакция происходит в присутствии триэтиламина, при этом в результате замещения хлора образуется трикетон 6,который, судя по спектру ЯМР1Н, находится в енольной форме. Взаимодействие хлоренона 2 с гексафторацетилацетоном в аналогичных условиях не удалось осуществить вследствие пониженной нуклеофильности соответствующего карбаниона.
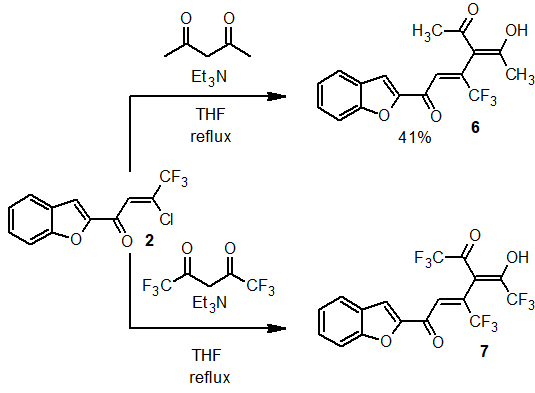
Схема 5. Получение замещенных ацетилацетонов 6, 7.
Длины волн поглощения енаминонов 5a-e для водных растворов в УФ- и видимом диапазоне приведены в таблице 1. В сравнении с исходным дикетоном 2 для енаминонов характерно наличие полос поглощения в более длинноволновой области. Экстинция некоторых соединений (5a, e) сравнима или превышает экстинцию дикетона 2. При добавлении европия до соотношения 3:1 (кроме соединения 5e, для которого использовали соотношение 2:1, исходя из дентатности лиганда) для большинства соединений наблюдается батохромный сдвиг максимумов поглощения или изменение оптической плотности. Использование эффективного солиганда триоктилфосфиноксида [14] также увеличивает степень батохромного смещения полос поглощения на ~ 2-3нм.
Таблица 1.Спектральные свойства лигандов 2, 5a-е, 6 иих комплексов с Eu3+.
|
Лиганд |
λmax(ε) нм(×104M-1×см-1) |
+Eu3+ λmax(ε) нм(×104M-1×см-1) |
|
2 |
352(2.67) |
356(2.61) |
|
5a |
338(2.70) |
338(2.36) |
|
5b |
357(2.08) 390(1.56) |
310(1.29) 370(0.96) 398(1.04) |
|
5c |
380(1.76) |
379(1.28) |
|
5d |
390(1.67) |
417(1.34) |
|
5e |
361(2.44) 399(2.89) |
363(2.02) 402(2.40) |
|
6 |
300(1.15) плечо 330(0.95) |
320 (0.91) |
Данные, приведенные в таблице 1, свидетельствуют об образовании комплексов, что подтверждается дополнительными экспериментами по конкурентному вытеснению лигандов известным комплексоном 2-нафтоилтрифторацетоном. Люминесцентные свойства комплексов соединений с ионом европия в соотношении 3:1 и 2:1 (для 5e) определялись в водно-мицеллярном (0.1% тритон X-100) 0.05 М Трис-буфере, как в присутствии ТОФО, так и без него.
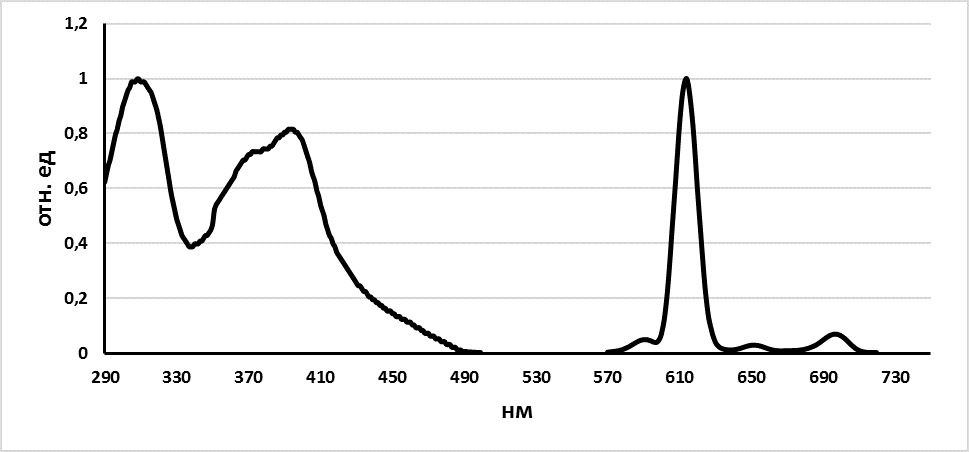
Рисунок 1. Спектры поглощения и люминесценции комплекса 5b, (отнормирован относительно максимального значения (для опт. плотности 0.129 (310 нм), для люминесценции 12900 отн.ед (614 нм). С(Eu3+) = 3.3×10-6 М)).
В спектрах эмиссии комплексов европия с фторсодержащими лигандами 5 и 6 отмечается типичная картина - основной максимум при 614 нм (100%) и минорные максимумы на длинах волн 592 (5.0 %), 653 нм (3.0 %), 699 нм, (7.0 %) и 749 нм (<1.0%) (рисунок 1). В целом люминесценция комплексов лигандов 5 и 6 в водных средах затушена в сравнении с 2. При этом люминесценция растворов комплексов во времени не уменьшается, а возрастает (рис. 2) и одновременно происходит гипсохромное смещение максимума возбуждения люминесценции (рисунок 3).
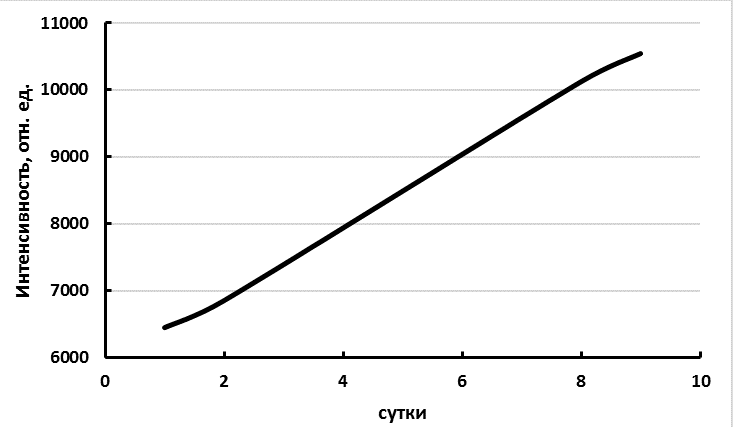
Рисунок 2. Изменение интенсивности люминесценции комплекса 5b во времени(регистрация эмиссии Eu3+(3.3×10-6 М) на 614 ±2 нм, возбуждение на 354 нм).
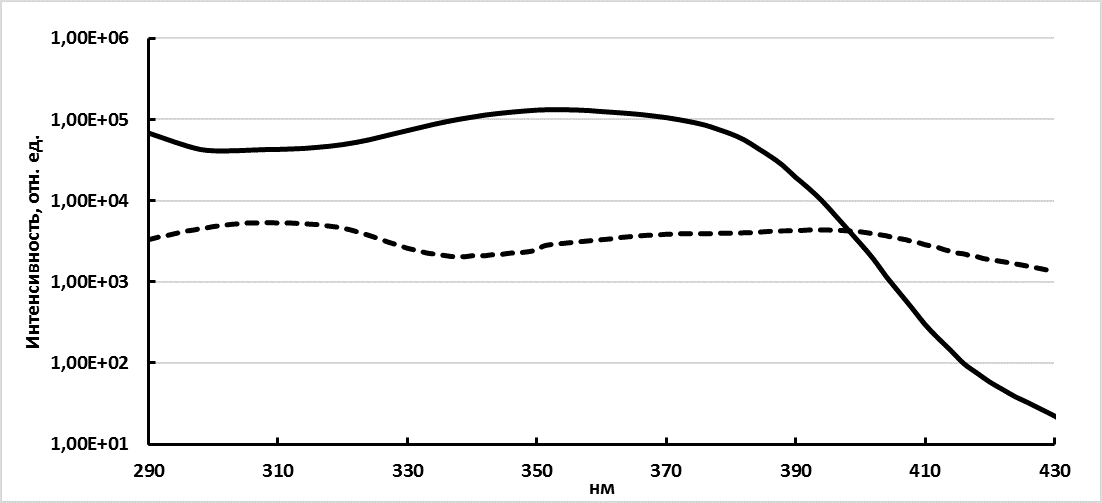
Рисунок 3. Изменение спектра возбуждения комплекса 5b через 9 суток(Пунктирная линия – спектр возбуждения в 1-й день, сплошная линия – через 9 суток. Регистрация на эмиссии Eu3+(3.3×10-6 М) на 614±2 нм, ось ординат в lg масштабе).
Таким образом, полученные спектральные данные свидетельствуют в пользу того, что комплексы европия с енаминонами 5 в водных растворах претерпевают гидролитические реакции и превращаются в комплексы исходного дикетона 2(схема 6).
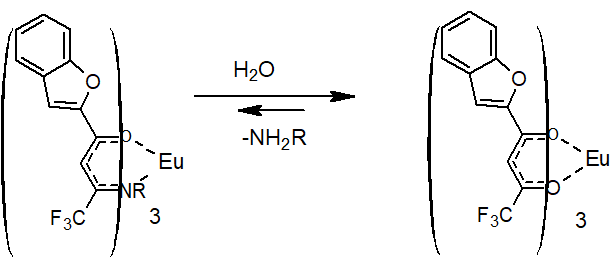
Схема 6. Гидролиз комплекса енаминона 5, в соответствии с спектральными характеристиками
Синтезированные в результате проведения исследования фторсодержащие лиганды ряда бензофурана 5, 6, как и ожидалось, образуют комплексы с ионами европия (III). Комплексы обладают существенной экстинцией и умеренной люминесценцией. Обнаружено, что комплексы енаминонов 5, судя по спектральным данным, подвержены гидролизу и превращаются в комплексы фторированных β-дикетонов. Таким образом, особенность свойств этих соединений определяет возможности их дальнейшего исследования в методиках, связанных с биочипированием в безводных условиях.
Экспериментальная часть
Спектры ЯМР 1H, 19F растворов веществ в ДМСО-d6 и CDCl3 записаны на спектрометре JNM-ECX400 (с рабочими частотами 400 и 376 МГц). Химические сдвиги приведены в м.д. относительно внешних эталонов: ТМС (1H); CFCl3 (19F). Элементный анализ выполнен на приборе Perkin Elmer CHN РЕ 2400 SII. Температура плавления определялась в стеклянных капиллярах на приборе Gallenkamp MPD350.BM3.5. Спектры поглощения снимались на приборе Shimadzu UV-1650PC в 1 см кварцевой кювете в диапазоне 290-500 нм. Люминесценция комплексов с ионом европия 2, 5a-e и 6 регистрировалась на микропланшетном ридере Varioscan Flash фирмы Thermofisher Scientific с временной задержкой 100 мкс (td), в течение которой «отсекалась» основная люминесценция мешающих веществ, и временем интегрирования 1000 мкс (tg).
В работе использовались коммерческие реагенты и растворители, приготовленные в соответствии с известными рекомендациями [15]. Использовался 2-бензофуранилметилкетон (99%), Sigma Aldrich.
1-(Бензофуран-2-ил)-4,4,4-трифторбутан-1,3-дион (2)
(модифицированная методика)
Смесь 2-бензофуранилметилкетона 1 (7.00 г, 43.80 ммоль), LiH (1.05 г, 131.00 ммоль) и CF3COOMe (10.10 г, 78.80 ммоль) в сухом ТГФ (140 мл) медленно нагревают до 60оС, и после начала экзотермии нагревание прекращают. По окончании экзотермической реакции смесь дополнительно кипятят 1 час, охлаждают до комнатной температуры, летучие компоненты упаривают при пониженном давлении (10 мм рт.ст). Подкисляют реакционную смесь охлажденным 3% раствором соляной кислоты (~0oC) до pH 2 и экстрагируют хлороформом (3×90 мл). Органический слой промывают водой (2×50 мл), сушат Na2SO4, упаривают растворитель под вакуумом. Соединение используют дальше без дополнительной очистки. Выход 10.81 г (96%), т. пл. = 72-74oC. По литературным источникам т. пл. = 74oC [3].
1-(Бензофуран-2-ил)-3-хлор-4,4,4-трифторбут-2-ен-1-он (4)
К раствору дикетона 2 (10.00 г, 39.10 ммоль) в 100 мл SOCl2 добавляют ДМФА (100 мкл, 1.96 ммоль) и кипятят 3.5 ч. Затем отгоняют SOCl2 в вакууме водоструйного насоса. Остаток растворяют в CHCl3 (150 мл) и промывают H2O (60 мл). Сушат органический слой Na2SO4, растворитель отгоняют в вакууме. Вещество перегоняют, собирая фракцию – 115-119оС (1 мм рт. ст.). Выход 83%, т. пл. =80-82оС. 1H ЯМР (400 МГц, CDCl3): δ 7.35 (ддд, 1Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.54 (ддд, 1Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.61 (дд, 1Н, аром., J = 8.0 Гц, 1.2 Гц), 7.65 (д, 1Н, 1.0 Гц), 7.67 (д, 1Н, аром., J = 0.8 Гц), 7.75 (дд, 1Н, аром., J = 8.0 Гц, 1.2 Гц). 19F ЯМР (376 МГц, CDCl3) δ -76.5 (c, CF3). Вычислено для C12H6ClF3O2: С 52.48; Н 2.20. Найдено С 52.57; Н 2.09.
Общая методика получения енаминонов (5a, b)
К раствору соответствующего амина (2.08 ммоль) в сухом диэтиловом эфире (5 мл) прикапывают 4 (0.22 г, 0.80 ммоль) в сухом диэтиловом эфире (10 мл), перемешивают при комнатной температуре, контролируя ход реакции по ТСХ (хлф/гекс. 3:1), приблизительно 5-8 часов. После завершения реакции, добавляют H2O (20 мл), органический слой отделяют, промывают H2O (2x10 мл), сушат Na2SO4 и отгоняют летучие компоненты в вакууме.
1-(Бензофуран-2-ил)-4,4,4-трифтор-3-диэтиламинобут-2-ен-1-он (5a)
Высаживают из хлороформа гексаном. Выход 82%, т. пл. = 92-94оС. 1H ЯМР (400 МГц, DMSO-d6): δ 1.10 (уш. с, 3Н, CH3), 1.25 (уш. с, 3Н, CH3.), 3.15 (уш. с, 1Н, CH2.), 3.55 (уш. с, 1Н, CH2), 5.51 (c, 1Н, CH=), 7.09 (c, 1Н, аром.), 7.28 (ддд, 1Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.35 (ддд, 1Н, аром.J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.60 (дд, 1Н, аром.,J = 8.0 Гц, 1.2 Гц), 7.67 (дд, 1Н, аром., J = 8.0 Гц, 1.2 Гц). 19F ЯМР (376 МГц, CDCl3) δ -76.82 (c, CF3). Вычислено для C16H16F3NO2: С 61.73; Н 5.18; N 4.50. Найдено С 61.56; Н 5.27; N 4.62.
1-(Бензофуран-2-ил)-4,4,4-трифтор-3-бензиламинобут-2-ен-1-он (5b)
Перекристаллизовывают из 95% этанола. Выход 86%, т. пл. =65-69 оС. 1H ЯМР (400 МГц, DMSO-d6): δ 4.64 (д, 2Н, CH2, J = 1.0 Гц), 6.33 (c, 1Н, CH=), 7.28-7.39 (м, 6Н, аром.), 7.47 (ддд, 1Н, бензофур.,J = 8.0, 2.4 Гц, 1.2 Гц), 7.68 (д, 1Н, бензофур., J = 8.0, 1.2 Гц), 7.76 (д, 1Н, аром., J = 8.0 Гц), 7.79 (д, 1Н, аром., J = 8.0 Гц), 10.72 (уш. с, NH). 19F ЯМР (376 МГц, CDCl3) δ -76.2 (c, CF3). Вычислено для C19H14F3NO2: С 66.09; Н 4.09; N 4.06. Найдено С 66.00; Н 3.99; N 4.11.
Общая методика получения енаминонов (5c-e)
К раствору соответствующего амина (0.80 ммоль) и триэтиламина (0.18 г, 1.80 ммоль) в сухом диэтиловом эфире (5 мл) прибавляют 3 (0.22 г, 0.80 моль) в сухом диэтиловом эфире (10 мл) при перемешивании и при комнатной температуре, контролируя ход реакции по ТСХ (хлф/гекс. 3:1). После завершения реакции, добавляют H2O (20 мл), органический слой отделяют, сушат Na2SO4 и отгоняют растворитель в вакууме.
1-(Бензофуран-2-ил)-4,4,4-трифтор-3-фениламинобут-2-ен-1-он (5c)
Перекристаллизовывают из 95% этанола. Выход 78%, т. пл. =112-114 oC. 1H ЯМР (400 МГц, DMSO-d6): δ 6.19 (c, 1Н, CH=), 7.12 (c, 1Н, бензофур.), 7.2-7.3 (м, 4Н, аром.,), 7.31-7.39 (м, 3Н, аром.), 7.49 (дд, 1Н, бензофур., J = 8.0 Гц, 1.2 Гц), 7.65 (дд, 1Н, бензофур., J = 8.0 Гц, 1.2 Гц), 12.00 (уш. с, NH).19F ЯМР (376 МГц, CDCl3) δ -76.50 (c, CF3). Вычислено для C18H12F3NO2: С 65.26; Н 3.65; N 4.23. Найдено С 64.97; Н 3.55; N 4.14.
1-(Бензофуран-2-ил)-4,4,4-трифтор-3-(2-нафтиламино)бут-2-ен-1-он (5d)
Перекристаллизовывают из 95% этанола, Выход 82%, т. пл. с разл. = 105-108 оС. 1H ЯМР (400 МГц, DMSO-d6): δ 6.21 (c, 1Н, Z CH=), 6.50 (c, 1Н, E CH=), 7.1-7.9 (м, 24H), 11.62 (уш. с, 1Н, E-NH), 12.12 (уш. с, Z-NH). 19F ЯМР (376 МГц, CDCl3) δ -76.32 (д, E-CF3), -76.49 (д, Z-CF3). Вычислено для C22H14F3NO2: С 69.29; Н 3.70; N 3.67. Найдено С 69.35; Н 3.83; N 3.55.
N, N'-бис(3-(бензофуран-2-ил)-1-трифторметил-3-оксопроп-1-ен-1-ил)-1,2-диаминоэтан (5e)
Перекристаллизовывают из 95% этанола, Выход 54%, т. пл. = 167-169 оС. 1H ЯМР (400 МГц, CDCl3): δ3.73 (м, 4Н, CH2,), 6.44 (c, 2Н, CH=), 7.31(ддд, 2Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.46 (ддд, 2Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.48 (с, 2Н, аром.), 7.58 (дд, 2Н, аром., J = 8.0 Гц, 1.2 Гц),7.60 (дд, 2Н, аром., J = 8.0 Гц, 1.2 Гц), 10.72 (уш. с, 2Н, NH).19F ЯМР (376 МГц, CDCl3) δ -66.24 (c, CF3). Вычислено для C26H18F6N2O4: C 58.22; H 3.38; N 5.22. Найдено С 58.16; Н 3.45; N 5.31.
1-(Бензофуран-2-ил)-4-(1-гидроксиэтилиден)-3-(трифторметил)гекс-2-ен-1,5-дион (6)
К раствору ацетилацетона (0.25 г, 2.50 ммоль) в 10 мл диэтилового эфира добавляют триэтиламин (0.27 г, 2.67 ммоль) в 4 мл диэтилового эфира при охлаждении. После прибавляют хлоренон 4 (0.68 г, 2.50 ммоль) в 6 мл диэтилового эфира. Перемешивают 2 ч при комнатной температуре, затем кипят 18 ч. Затем фильтруют выпавшую соль Et3N×HCl. Фильтрат упаривают при пониженном давлении. Растворяют в кипящем гексане, фильтруют и убирают кристаллизоваться при -18оС. Фильтруют, промывают ледяным гексаном. Выход 41%, т. пл. с разл. = 130-133оС. 1H ЯМР (400 МГц, DMSO-d6): δ 2.05 (c, 6Н,CH3), 7.35 (ддд, 1Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц), 7.55 (ддд, 1Н, аром., J = 8.0 Гц, 2.4 Гц, 1.2 Гц) 7.74 (дд, 1Н, аром., J = 8.0 Гц, 1.2 Гц).19F ЯМР (376 МГц, CDCl3) δ -67.963 (с, CF3). Вычислено для C17H13F3O4: С 60.36; Н 3.87. Найдено С 60.41; Н 3.83.
Общая методика получения растворов комплексов енаминонов (5a-f) с Eu3+ и ТОФО в водно-мицеллярном Трис-буфере
Растворяют необходимое количество лиганда (5a-e) в 2 мл ДМФА с образованием раствора концентрацией 5×10-3М. Отбирают аликвоту в 100 мкл и разбавляют 0.05 М Трис-буфером (рН 7.2) до концентрации лиганда 10-4М. Добавляют свежеприготовленный раствор 10-4М Eu3+ (EuNO3) в 10-5М НСI,10-3М ТОФОв этаноле и необходимое количество Трис-буфера для получения конечного раствора лиганд:Eu:ТОФО = (1.00:0.33:1.00)x10-5 М, который оставляют для формирования комплекса в отсутствии освещения на 2 часа. Для приготовления мицеллярного раствора добавляют в исходный раствор Трис-буфера 10% раствор Тритона Х-100 в этаноле доконечнойконцентрации ПАВа 0.1%. Из растворов комплексов отбирают 200 мкл для исследования люминесцентно-спектральных характеристик.
Список литературы
- B. Barkley, R. Levine, J. Amer. Chem. Soc., 1951, 73, 4625-4627.
- Т. С. Кострюкова, Н. П. Ивановская, Г. В. Затонский, Н. С. Осин, Н. В. Васильев, Биоорг. Хим., 2015, 41(2), 212-217.
- Д. В. Романов, А. И. Лямин, Н. П. Ивановская, А. Е. Жедулов, Н. С. Осин, Н. В. Васильев, Патент РФ № 2373200. от 27.04.09г., опубл. 20.11.09г.
- A-Z. A. Elassar, A. A. El-Khair, Tetrahedron, 2003, 59(43), 8463-8480.
- S. V. Druzhinin, E. S. Balenkova, V. G. Nenajdenko, Tetrahedron, 2007, 63, 7753-7808.
- V. G. Nenajdenko, E. S. Balenkova, Reviews and Accounts, 2011, 1, 246-328.
- M. Y. Khuhawar, A. G. Bhatti, J. Chromatography, 1991, 558, 187-195.
- E. F. Zhilina, P. A. Slepukhin, N. S. Boltacheva, M. G. Pervova, D. L. Chizhov, V. I. Filyakova, V. N. Charushin,Russ. J.Gen. Chem., 2012, 82(12), 1962-1969.
- S. D. Cosham, G. Kociok-Köhn, A. L. Johnson, J. A. Hamilton, M. S. Hill, K. C. Molloy, R. Castaing, Eur. J. Inorg. Chem., 2015, 26, 4362-4372.
- К. И. Пашкевич, В. И. Салоутин, И. Я. Постовский, Успехи Химии, 1981, 50, 325-354.
- A. L. Krasovsky, V. G. Nenajdenko, E. S. Balenkova, Russ. Chem. Bull., 2001, 50(8), 1395-1400.
- I. H. Jeong, S. L. Jeon, Y. K. Min, B. T. Kim, Tetrahedron Lett., 2002, 43, 7171-7174.
- N. M. D. Brown, D. C. Nonhebe, Tetrahedron, 1968, 24, 5655-5664.
- Д. Е. Пугачёв, Т.С. Кострюкова, Г.В. Затонский, С.З.Вацадзе, Н.В. Васильев. Хим. гетероцикл. соед., 2018, 54(5), 528-534.
- Спутник химика. Гордон А.; Форд Р.; М.: Мир, 1976, 571 с.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2019, 125, 9-10


