Поступило в редакцию: Июнь 2019
УДК 541.64:547.322:547.422:547.412.92
Fluorine Notes, 2019, 125, 3-4
СИНТЕЗ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ 1- (1,1,1,3,3,3-ГЕКСАФТОР-2-ФЕРРОЦЕНИЛПРОП-2-ИЛ)-1Н-ИМИДАЗОЛА
А. А. Сименел1,2,В. И. Дяченко1*, С. М. Игумнов1,3
1Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А. Н. Несмеянова РАН, РФ
119991, ГСП-1, Москва, В-334, ул. Вавилова, 28
2НИТУ«МИСиС», РФ, 119049, Москва, Ленинский пр., 2
3ЗАО НПО «ПиМ-Инвест», 119991, Москва, ул. Вавилова,28
е-mail: vic-d.60@mail.ru
Аннотация: 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)-1Н-имидазол (3) был синтезирован по 2 методикам: при взаимодействии 1,1,1,3,3,3-гексафтор-2-ферроценилпропан-2-ола с N, N-карбонилдиимидазолом (CDI) в кипящем толуоле и при нуклеофильном замещении хлора имидазолом в 1-(2-хлор-1,1,1,3,3,3-гексафторпроп-2-ил) ферроцене в присутствии KI. В экспериментах in vivo была изучена противоопухолевая активность на модели солидной опухоли карциномы Ca755.
Ключевые слова: ферроцен, имидазол, 1,1,1,3,3,3-гексафтор-2-ферроценилпропан-2-ол, 1-(2-хлор-1,1,1,3,3,3-гексафторпроп-2-ил)ферроцен, противоопухолевая активность.
Включение ферроценового фрагмента в структуру органических соединений часто приводит к появлению биологической активности, которая связана с аномальной биодеградацией ферроценовых соединений. Ферроценсодержащие гетероциклические соединения с успехом зарекомендовали себя в качестве потенциальных лекарственных средств для лечения заболеваний различного генезиса [1-3]. Кроме того, было показано, что ферроценовые производные гетероциклов проявляют выраженную противоопухолевую активность в сочетании с низкой токсичностью, что было показано in vitro и in vivo на моделях трансплантируемых солидных опухолей [4-6]. В то же время, введение фторсодержащих или перфторированных алкильных заместителей в биологически активные соединения, по-прежнему, является важным методом синтеза потенциальных лекарственных препаратов. Так, введение фтора в биологически активные соединения, приводит к увеличению их липофильности и улучшению проникновения через клеточную мембрану [7]. Включению их в метаболизм также способствует «эффект маскировки», связанный с соразмерностью атомов водорода и фтора, сопоставимостью электроотрицательности фтора и кислорода [8].
Целью настоящей работы является поиск новых методов синтеза фторсодержащих ферроценилазолов из промышленно доступных ферроцена и гексафторацетона и изучение их противоопухолевой активности. И 1,1,1,3,3,3-гексафтор-2-ферроценил-пропан-2-ол (1) (см. Схему 1), который легко получается в результате их взаимодействия, мог стать отправной точкой синтетического плана целевого соединения 3. Удобным синтетическим методом получения гетероциклических производных ферроцена является алкилирование азолов гидрокси(алкил)ферроценами в двухфазной водно-органической системе (вода-метиленхлорид) при катализе сильной минеральной, не способной к окислению, кислотой (например HBF4). Обычно протонирование гидроксильной группы в этих условиях приводит к образованию в мягких условиях термодинамически стабильных ферроценилкарбокатионов, способных к N-алкилированию различных гетероциклических соединений. Оказалось, что в случае карбинола 1, катион не образуется из-за дестабилизационного электроноакцепторного влияния двух CF3-групп, поэтому мы адаптировали к Схеме 1 другие методы синтеза соединения 3.
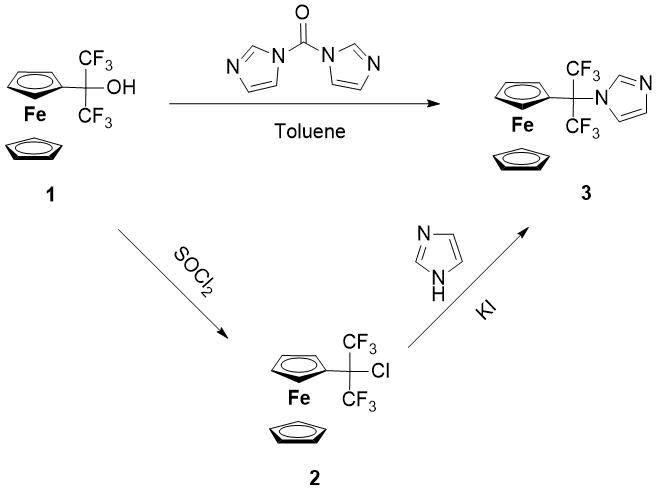
Схема 1. Синтез 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)-1Н-имидазола (3)
Оказалось, что при кипячении в безводном толуоле на протяжении трех часов 1,1,1,3,3,3-гексафтор-2-ферроценилпропан-2-ола (1) и 20%-ного избытка 1,1-карбонилдиимидазола соответствующий 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)-1Н-имидазол 3 образуется с выходом 71%.
Впервые полученный нами действием на карбинол 1 тионилхлорида, стабильный 1-(1,1,1,3,3,3-гексафтор-2-хлорпроп-2-ил)-ферроцен (2) [9] лег в основу второго метода синтеза соединения 3. Суть его заключается в нуклеофильном замещении хлора имидазолом в присутствии незначительного избытка KI и трет-бутилата калия. Так, при кипячении исходных реагентов в безводном толуоле на протяжении 24 часов целевой 1-(1,1,1,3,3,3-гексафтор-2-хлорпроп-2-ил)-ферроцен образуется с выходом 73%.
Исследование in vivo острой токсичности и противоопухолевой активности 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)имидазола (3) было проведено на мышах (модель солидной опухоли карцинома Са-755). Было показано, что соединение (3) обладает противоопухолевым эффектом против карциномы Са-755, вызывая ингибирование ее роста на 80% (2) по сравнению с контролем (1) (см. Рис.1).
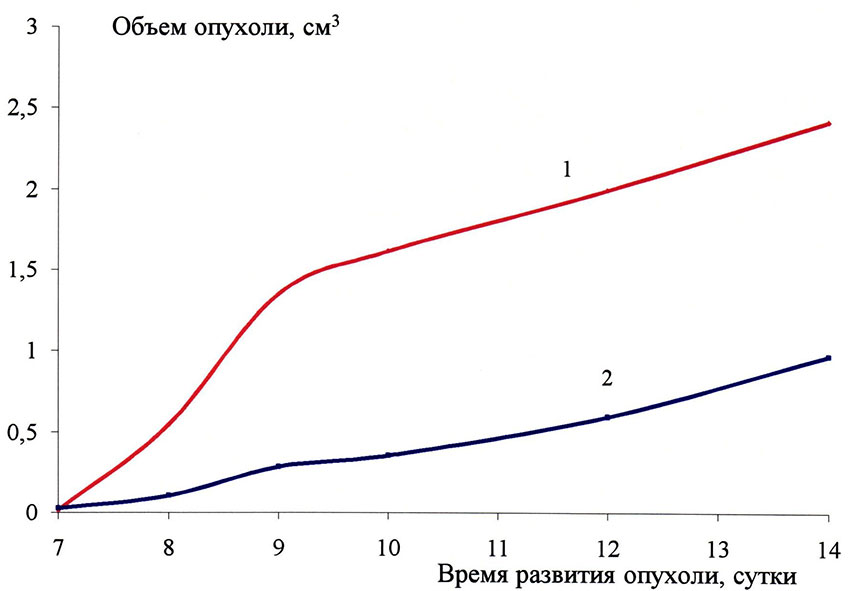
Рис.1. Влияние 1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)имидазола 3 на подавление развитие карциномы Ca-755 (2); контроль (1)
Внешний вид животных, получавших препарат, их аппетит, активность, подвижность, поведенческие реакции, деятельность желудочно-кишечного тракта соответствовали норме и свидетельствовали о физически бодром, здоровом состоянии мышей.
Необходимо особо отметить, что соединение 3 при однократном пероральном введении в диапазоне доз 400-800 мг/кг не только хорошо переносится животными, но и вызывает значительное (67-98%) увеличение массы их тела в сравнении с контролем.
Наблюдаемая чувствительность карциномы Са-755 к соединению (3) при хорошей переносимости этого соединения животными (MD = 800 мг/кг), а также значительное увеличение массы их тела, указывает на необходимость дальнейшего углубленного изучения механизма противоопухолевого действия и иных фармакологических свойств фторалкил содержащих ферроценов этого типа.
Экспериментальная часть
Спектры ЯМР 1H, 13C и 19F зарегистрированы на спектрометре Bruker Avance 400 (при 400, 100 и 375 МГц соответственно) в ДМСО-d6 и CDCl3 при 30°C. Химсдвиги в ПМР и 13C спектрах приведены относительно остаточных протонов D-растворителя, химсдвиги в спектрах ЯМР 19F - относительно CF3CO2H. Константы спин-спинового взаимодействия приведены в МГц.. Масс-спектры электронного удара получены на спектрометре FINNIGAN POLARIS Q при 70 эВ и температуре ионной камеры 250°C. Температуру плавления определяли на приборе Stuart SMP 30 (Bibby Scientific). Коммерчески доступные имидазол и N,N-карбонилдиимидазол (CDI) (Acros Organics) использовались без дополнительной очистки. 1,1,1,3,3,3-Гексафтор-2-ферроценилпропан-2-ол (1) и 1- (1,1,1,3,3,3-гексафтор-2-хлорпропил-2)ферроцен синтезировали по описанным ранее методикам [9].
Онкобиологическое изучение соединения формулы 3 проведено в Федеральном Государственном бюджетном учреждении науки Институте биохимической физики им. Н. М. Эмануэля Российской академии наук (ИБХФ РАН).
Синтез 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпропил-2)-1Н-имидазола (3)
Метод 1. Смесь 0,352 г 1,1,1,3,3,3-гексафтор-2-ферроценилпропан-2-ола (1) и 0,18 г (1,2 ммоль) 1,1-карбонилдиимидазола кипятили в безводном толуоле в течение трех часов. Реакционную массу охладили, добавили 50 мл эфира и экстрагировали 20%-ным раствором фосфорной кислоты (250 мл). Объединенные водные фракции подщелачивали до рН 5 и экстрагировали хлористым метиленом (250 мл). Органическую часть сушили над безводным сернокислым натрием. Растворитель удаляли. Продукт очищали колоночной хроматографией на силикагеле, элюент – хлористый метилен. Получали 0,285 г соединения 3 в виде красно-коричневого масла, которое кристаллизуется при охлаждении, т.пл. 30-31°С. Выход 71%. Тпл 30-31°С, Масс-спектр, m/z: (%): 402 (100) [M]+, 335 (55) [M-Im]+. 1Н ЯМР спектр, (δ, ppm): 4,03-4,29 (м, 9H, Fc), 4,61 (кв, 1H, CH) 7,11 (с, 1Н, СН); 7,19 (с, 1Н, СН); 7,47 (с, 1Н, СН). 19FЯМР спектр, (δ, ppm): –7.31 (с). 13C ЯМР спектр, (δ, ppm): 68.36 (Cp); 69.24 (Cp); 70.01 (Cp); 70.28 (кв, 2J=31); 79.68 (ipso-Cp); 118.65 (Im(C-4)); 119.05 (Im(C-5)); 121.71 (кв, CF3, 1J = 287); 136.25 (Im(C-2)). Вычислено C16H12F6FeN2: C, 47.79; H, 3.01; F, 28.35; Fe, 13.89; N, 6.97. Найдено: C, 47.40; H, 3.07; Fe, 13.76; N, 6.70;
Метод 2. Смесь 0,370 г (1 ммоль) 1-[1,1,1,3,3,3-гексафтор-2-хлорпроп-2-ил]-ферроцена (2), 0,102 г (1,2 ммоль) имидазола, 0,135 г (1,2 ммоль) трет-бутилата калия и безводного йодида калия (0,12 ммоль) кипятили в безводном толуоле в течение суток. Реакционную массу охлаждали, растворитель удаляли, остаток хроматографировали на колонке (силикагель, элюент – хлористый метилен). После удаления растворителя в вакууме получали 0,294 г соединения (3) в виде красно-коричневого масла, которое кристаллизуется при охлаждении, т.пл. 30-31С. Выход 73%.Тпл 30-31°С, Масс-спектр, m/z: (%): 402 (100) [M]+, 335 (55) [M-Im]+.
Изучение противоопухолевой активности
1-(1,1,1,3,3,3-гексафтор-2-ферроценилпропил-2)-1Н-имидазола (3).
Карциному 755 (Ca755) трансплантировали подкожно мышам f1 (C57Bl / 6xDBA2) - самцам BDF1 (60 животных) весом 20-22 г в соответствии со стандартной процедурой. Соединение (3) вводили на следующий день после трансплантации опухоли. Суточные дозы составляли 10,0 и 20,0 мг/кг. Масляный раствор (10 мг/мл) соединения (3) вводили внутрибрюшинно, начиная со следующего дня после трансплантации опухоли. Каждая группа включала от пяти до семи животных, включая контрольную группу животных. Кинетику роста опухоли изучали путем измерения ее размера в течение всего периода развития. Были измерены два размера опухоли, и объем опухоли был рассчитан как V = ab2/2, где a - длина, а b - ширина и высота опухоли. Как оценивалось ранее, плотность опухолевой ткани равна 1,0 г/см3. Поэтому, масса опухоли в граммах равна объему опухоли в см3. Индекс торможения роста опухоли (ТРО) рассчитывали как (C-T) / C,%, где C и T - средняя масса опухоли в группах контрольных и обработанных животных, соответственно.
Таким образом в экспериментах in vivo было показано, что соединение 3 обладает ярко выраженным противоопухолевым действием в отношении карциномы Са-755, вызывая ингибирование роста на 80% по сравнению с контролем.
Изучение острой токсичности
1-(1,1,1,3,3,3-гексафтор-2-ферроценилпропил-2)-1Н-имидазола (3).
Определение острой токсичности соединения 3 проводили при однократном пероральном введении интактным мышам линии BDF1 в диапазоне доз от 400 до 800 мг/кг. Соединение вводили животным в виде раствора в подсолнечном масле в концентрации 10 мг/мл. Объем вводимого перорально раствора соединения 3 колебался в зависимости от дозы в пределах от 0,8 мл до 1,6 мл.
В исследованном диапазоне доз соединение 3 не вызывало гибели животных при наблюдении за ними в течение одного месяца, что позволяет отнести его к разряду малотоксичных веществ.
Выводы
- Взаимодействие 1,1,1,3,3,3-гексафтор-2-ферроценилпропан-2-ола с N,N-карбонилдиимидазолом (CDI) в кипящем толуоле, а также нуклеофильное замещение хлора имидазолом в 1-(2-хлор-1,1,1,3,3,3-гексафторпроп-2-ил)-ферроцене в присутствии KI приводит к образованию 1-(1,1,1,3,3,3-гексафтор-2-ферроценилпроп-2-ил)-1Н-имидазола (3) с высокими выходами.
- В экспериментах in vivo на интактных мышах линии BDF1 было показано, что соединение 3 обладает противоопухолевым действием в отношении карциномы Са-755, вызывая ингибирование ее роста на 80% в сравнении с контролем.
- Низкая токсичность CF3-содержащего ферроценилимидазола 3, хорошая его переносимость животными, а также значительное (1,6-2 раза) увеличение массы их тела, что не характерно при терапии противоопухолевыми препаратами, свидетельствует о необходимость дальнейшего углубленного изучения этого типа соединений.
Благодарности
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН им. А. Н. Несмеянова.
Список литературы
- E. W. Neuse, J. Inorg. Organomet. Polymer. Mater. 2005, 15 (1), 3.
- V. N. Babin, Yu A. Belousov, V. I. Borisov, V. V. Gumenyuk, Yu. S. Nekrasov, L. A. Ostrovskaya, I. K. Sviridova, N. S. Sergeeva; A. A. Simenel and L. V. Snegur. Russ. Chem. Bull. 2014, 63, 2405.
- F. A. Larik, A. Saeed, T. A. Fattah, U. Muqadar, P. A. Channar. Appl Organometal Chem. 2017, 31, 1.
- L. V. Snegur, S.I. Zykova, A. A. Simenel, Y. S. Nekrasov, Z. A. Starikova, S. M. Peregudova, M.M. Ilyin, V.V. Kachala, I.K. Sviridova, N.S. Sergeeva. Russ. Chem. Bull. 2013, 62, 2056.
- L. V. Snegur, Yu. S. Nekrasov, N. S. Sergeeva, Zh V. Zhilina, V. V. Gumenyuk, Z. A. Starikova, A. A. Simenel, N. B. Morozova, I. K. Sviridova and V. N. Babin. Appl. Organomet. Chem. 2008, 22, 139.
- G. Jaouen, A. Vessières, S. Top. Chem. Soc. Rev. 2015, 44, 8802.
- Hans-Joachim Böhm, David Banner, Stefanie Bendels, Manfred Kansy,Bernd Kuhn, Klaus Müller, Ulrike Obst-Sander, and Martin Stahl, Fluorine in Medicinal Chemistry, ChemBioChem 2004, 5, 637-643. DOI: 10.1002/cbic.200301023
- R. Filler, in «Organofluorine Chemicals and Their Industrial Applications», ed. by R. E. Banks, Ellis Horwood, Ltd.,Chichester, UK (1979), Chap. 6.
- V. I. Dyachenko, A. S. Peregudov, I. V. Anan´ev, M. Yu. Antipin, Yu. S. Nekrasov,V. I. Sokolov, and S. M. Igumnov. Russ. Chem. Bull., 2011, 60, 764.
Статья рекомендована к публикации членом редколлегии В.В. Корниловым
Fluorine Notes, 2019, 125, 3-4


