Поступило в редакцию: Март 2019
УДК 543.429.23: 661.489
Fluorine Notes, 2019, 124, 7-8
ЯМР АНАЛИЗ В ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ЭФИРА ПЕРФТОР(ВИНИЛОКСИ)БУТАНОВОЙ КИСЛОТЫ
Поспелова Н. Б.1, Мокрушин И. Г.2, Галеев А. Р. 2, Тиунов А. В. 3
1ФГУП "РНЦ "Прикладная химия", Пермский филиал
2Пермский государственный национальный исследовательский университет
3ООО «Промхимпермь», Пермь, Россия
Аннотация: Детально описаны и уточнены спектральные характеристики фторсодержащих соединений на всех стадиях синтеза метилового эфира перфтор(винилокси)бутановой кислоты, включая стадию получения фторсульфатирующей смеси и оксисления гексафторпропилена. Проанализированы смеси в различных соотношениях. Описаны способы записи реакционно-способных соединений и методика количественной оценки состава смесей на каждой стадии производства.
Ключевые слова: ядерный магнитный резонанс, ЯМР фтор-19, перфторированные соединения, окись гексафторпропилена, фторсульфатирующая смесь, мономеры мембран.
Введение
Электрохимические ионообменные мембраны используются практически повсеместно – от технологии получения каустической соды до литиевых батарей в мобильных телефонах. Мономером в производстве таких мембран могут быть фторсодержащие соединения, например, производимый на базе ФГУП РНЦ «Прикладная химия» метиловый эфир перфтор-4-(винилокси)бутановой кислоты. Стадии получения мономера содержат соединения, обладающие высокой коррозионной активностью, что исключило возможность использования традиционного хроматографического метода анализа. Простейший эксперимент ЯМР – снятие обзорного спектра с интегрированием резонансных линий – позволил установить структуру практически всех получающихся соединений как основных, так и побочных реакций. Контроль за качественным и количественным составом продуктов осуществляется по методикам на основе метода ЯМР 19F.
Смеси проанализированы на спектрометре Bruker WP80SY 80 MHz. Эталон в спектрах 19F (м.д., отн. CFCl3): гексафторбензол -162.90 м.д.; в ПМР спектрах принят сигнал растворителя (δ, м.д., отн. TMS): 2.05 - acetone-D6; 2.50 - DMSO-D6, 7.26 - CDCl3.
При проведении количественного ЯМР анализа фторангидридов сульфокислот в смеси с исходными соединениями
и примесями, образующимися при электрохимическом фторировании либо электролизе необходимо проинтегрировать
каждый отдельно стоящий сигнал либо группу сигналов. Затем суммировать полученные значения Σ(I)=I1+I2+…+In.
Отдельно определяется интегральная площадь аналитической линии Ia, количество
атомов ее давших a, общее количество атомов n в определяемой молекуле, давших сигнал. Мольное содержание
рассчитывают по формуле: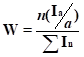
Химсдвиги сигналов (отн. CFCl3), используемые нами в качестве аналитических, далее на схемах отмечены звездочками. Сигналы «аналитических» групп позволяют предположить наличие соединения в смеси и «собрать молекулу» по интегральным интенсивностям остальных частей [1, 2]. Проводилась стандартная статистическая обработка результатов: проверка на анормальность, принадлежность нормальному распределению; определение допустимого расхождения между параллельными определениями, границ случайной составляющей погрешности, предельной систематической погрешности.
Литературный обзор
Перфторированные виниловые эфиры были использованы в качестве сомономеров для образования центров отверждения во фторированных полимерах и в качестве мономеров для получения фторсодержащих полимеров, имеющих специальные функции, такие как фторэластомер и катионообменные группы, в мембране с селективной проницаемостью при производстве хлора и щелочи. Способы синтеза перфторированных виниловых эфиров, имеющих сложноэфирную группу, раскрыты в патентах [3,4]. Классические способы включают в себя следующие трудоемкие реакции: (1) этерификация перфтордиацилфторида с гексафторпропиленоксидом с получением перфтор(2-метил-3-оксаалкан)диацилфторидов на фториде цезия, (2) сольволиз и синтез диметаллической соли и (3) термический синтез разложение и этерификация с получением желаемого продукта с относительно низким выходом.
В статье Ямабе с коллегами описан эффективный и простой синтез перфторированных виниловых эфиров, имеющих сложноэфирную группу, путем пиролиза асимметричного диацилфторида, имеющего FC(O)–CF(CF3)–O– группу на одном конце и группу FC(O)–CF2 – на другом конце при температуре около 290–370°C в газовой фазе без потери функциональной группы –COF [5].
Результаты и обсуждение.
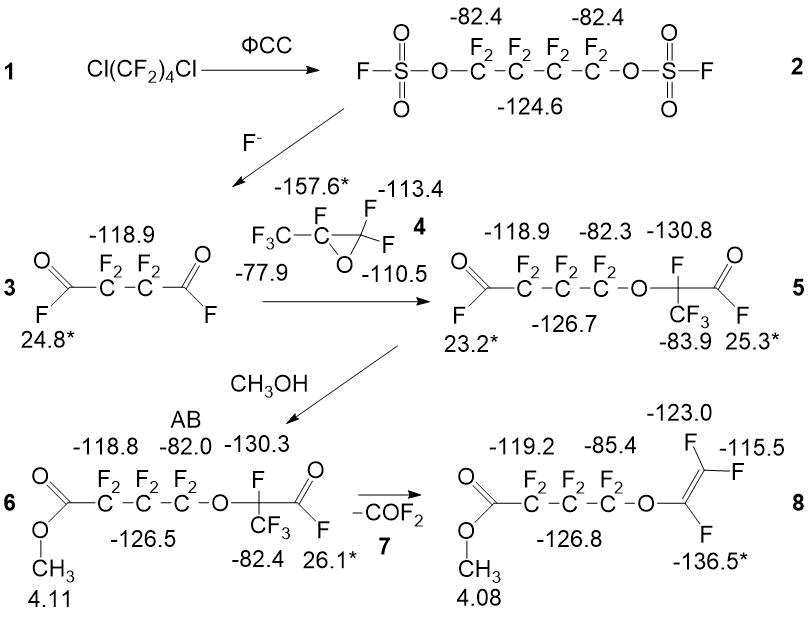
Рисунок 1. Схема получения мономера и спектральные характеристики образующихся соединений
Схема получения мономера и спектральные характеристики соединений, получающихся на этапах синтеза приведены на рисунке 1. Соединение 5 получено по известной методике с использованием фтористого калия и последующим пиролизом [6]. В зависимости от состава смеси химические сдвиги исходного хладона-318 лежат в области -68 м.д. (-CF2CF2Cl) и -119 м.д. (-CF2CF2Cl); образующегося карбонилдифторида COF2 -19÷-22 м.д. Время анализа 25-30 мин, предельная суммарная погрешность определения основного компонента не превышает 3 % относ. Для спектров типа АВ, приведен химсдвиг центра линии.
Первым этапом производства мономера является получение фторсульфатирующей смеси (ФСС) на основе фторангидридов сульфокислот [7, 8]. Выбор метода ЯМР для анализа фторсульфатирующей смеси обусловлен её крайне высокой реакционной и коррозионной активностью, а возможность хроматографического анализа практических исключена. Анализ методом ЯМР включает запись спектров 0,5 мл смеси в 5 мм фторопластовой ампуле с внутренним капилляром с дейтероацетоном или дейтеродиметилсульфоксидом с добавкой гексафторбензола в качестве эталона. Возможно одноразовое использование и стандартных стеклянных ампул. Время проведения анализа ФСС 30-40 мин, предельная суммарная погрешность определения основных компонентов не превышает 2% относ. Спектральные характеристики компонентов ФСС, таких как фторсульфат хлора, фторпиросульфат хлора, ди(фторсульфурил)оксид, ди(фторсульфурил)пероксид, фторсульфоновая кислота, приведены на рисунке 2.
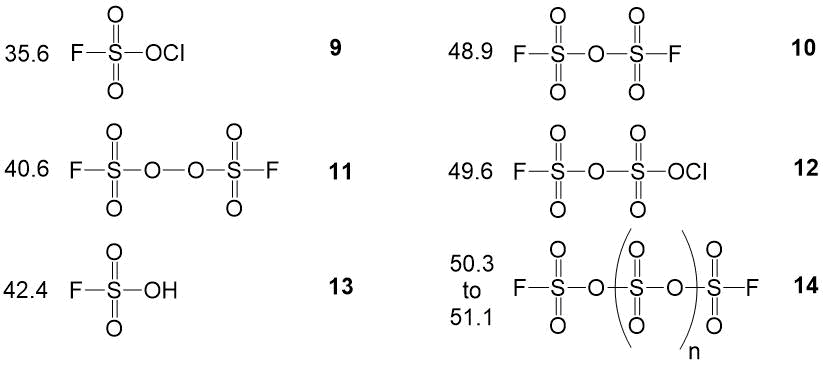
Рисунок 2. Спектральные характеристики компонентов фторсульфатирующей жидкости.
Отдельно стоит описать ЯМР спектры окиси гексафторпропилена и обнаруженных примесей [9]. В качестве аналитического мы используем химсдвиг фтора CF-CF3. Положение ЯМР сигналов фтора в окиси гексафторпропилена очень сильно зависит от состава смеси и может находиться в пределах 157,6±3 м.д. Используемая нами методика ЯМР анализа технологической окиси гексафторпропилена включает пробулькивание газообразных продуктов окисления гексафторпропилена через 1 мл дейтерохлороформа с добавкой эталонного гексафторбензола в стекляной 5 мм ампуле в течении 2-2,5 минут со скоростью 120-180 мл/мин. Точный количественный анализ состава получаемого 2,2,3-трифтор-3-(трифторметил)оксирана осложняется как физическими и химическими характеристиками исследуемых продуктов, так и недостаточными данными по растворимости окиси ГФП и примесей в дейтерированных растворителях. Спектральные характеристики обнаруженных продуктов приведены на рисунке 3. В качестве примеси обнаружено хлорпроизводное 11, образующееся, по-видимому, при подготовке образца к анализу.
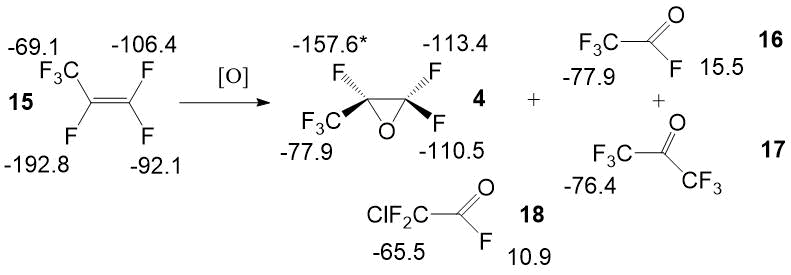
Рисунок 3. Спектральные характеристики окиси гексафторпропилена и обнаруженных примесей.
В процессе отработки технологии нами идентифицирован ряд побочных продуктов, спектральные характеристики которых приведены на рисунке 4.
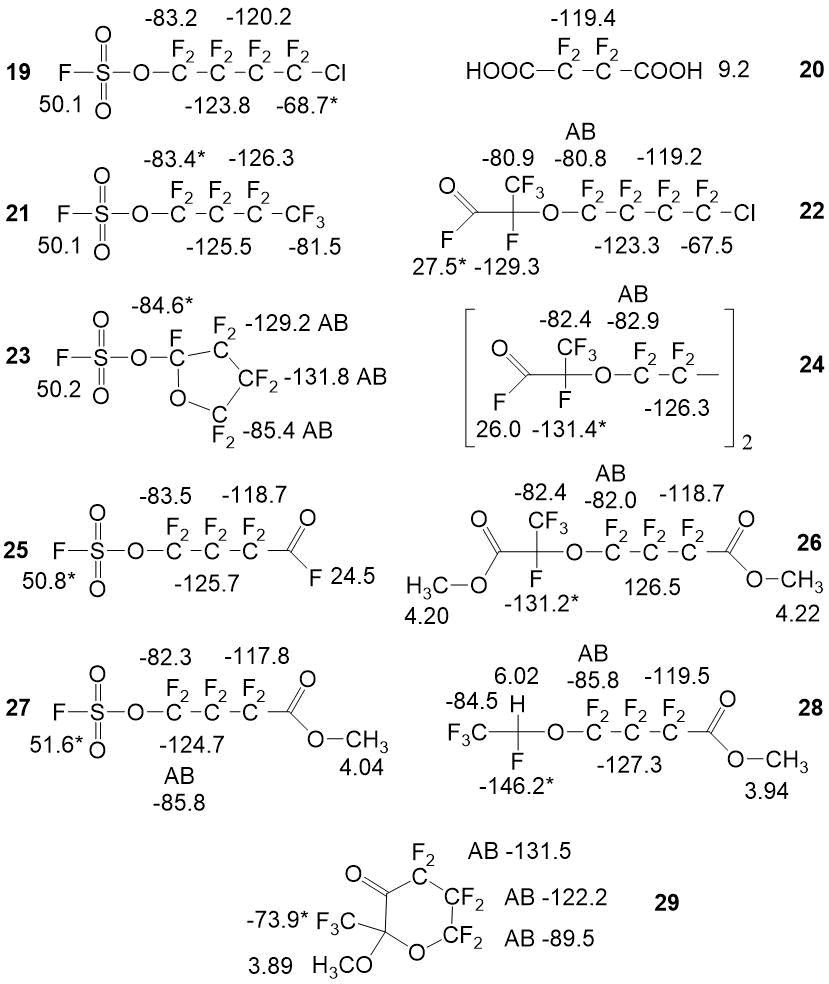
Рисунок 4. Спектральные характеристики обнаруженных примесей на стадиях синтеза целевого мономера.
Заключение
Метод ЯМР может быть успешно использован не только для установления структуры получающихся соединений, но и в качестве арбитражного метода при отклонении процесса синтеза метилового эфира перфторвинилоксибутановой кислоты от заданных технологических параметров. В публикации приводятся методики количественного определения состава крайне реакционноспособных фтосодержащих соединений.
Нами описаны спектральные характеристики и методика количественного анализа следующих соединений: 1,4-дихлорперфторбутан 1, 1,4-бис-фторсульфонилоксиперфторбутан 2, дифторангидид перфторянтарной кислоты 3, окись гексфаторпропилена 4, фторангидрид 4-(3-оксоперфторпропан-2-ил)окси-перфторбутановой кислоты 5 и её метиловый эфир 6, карбонилдифторид 7, метиловый эфир перфтор-4-(винилокси)бутановой кислоты 8, фторсульфат хлора 9, оксидисульфурилфторид 10, перекись бис-сульфурилфторида 11, фторпиросульфат хлора 12, фторсульфоновая кислота 13, дифторангидриды полисерных кислот 14, гексафторпропилен 15, фторангидрид трифторуксусной кислоты 16, гексафторацетон 17, фторангидрид дифторхлоруксусной кислоты 18, 4-хлор-1-фторсульфонилперфторбутан 19, перфторянтарная кислоты 20, 1-фторсульфонилоксиперфторбутан 21, 4-хлор-1-фторсульфонилокси-перфторбутан 22, 2-фторсульфонилперфторфуран 23, 1,4-бис((3-оксопропан-2-ил)окси)перфторбутан 24, фторангидрид 4-фторсульфонилперфторбутановой кислоты 25, метиловый эфир 4-(3-метокси-3-оксоперфторпропан-2-ил)окси-перфторбутановой кислоты 26, метиловый эфир 4-фторсульфонилперфторбутановой кислоты 27, метиловый эфир 4-(1-гидроперфторпропан-2-ил)окси-перфторбутановой кислоты 28, 2-метокси-2-(трифторметил)дигидро-2H-перфторпиран-3(4H)-он 29.
Список литературы
- Dolbier, W. R. Guide to Fluorine NMR for Organic Chemists. John Wiley & Sons, 2006. 235 c.
- Поспелова Н. Б., Мокрушин И. Г. Особенности ЯМР-анализа перфторированных соединений. Вестник Пермского Университета, Серия «Химия». 2016, 3(23), с 85-91.
- Патент US2713593A, 1955.
- Патент US3682872A, 1972.
- Yamabe M. et al. Synthesis of perfluorinated vinyl ethers having ester group. Journal of Fluorine Chemistry. 1999, 94(1), 65-68/
- Molchanov A.P., Kostikov R.R. Product subclass 2: 1-halo-1-(organooxy)alk-1-enes. Sci. Synth. 2006, 24, 129–166.
- Патент SU1787932 A1, 1993.
- Патент US3536733, 1970.
- Патент РФ 2169730, 2001.
Статья рекомендована к публикации членом редколлегии С.М. Игумновым
Fluorine Notes, 2019, 124, 7-8


