Поступило в редакцию: Март 2019
Fluorine Notes, 2019, 123, 7-8
Исследование SNF-подхода для получения функционализированных нитронилнитроксилов
Павел Федюшин,1 Лариса Гурская,1 Елена Пантелеева,1,2 Борислав Кощеев,1 Александр Максимов,1 Татьяна В. Рыбалова,1,2 Елена Зайцева,1,2 Евгений Третьяков1,2 *
1Новосибирский институт органической химии им. Н.Н. Ворожцова, пр. Академика Лаврентьева, д.9, Новосибирск, 630090, Россия.
2Новосибирский государственный университет, ул. Пирогова, д. 2, Новосибирск 630090, Россия
E-mail: tretyakov@nioch.nsc.ru
Аннотация: Установлено, что литиевое производное 4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксила вступает в реакцию с перфторароматическими соединениями, в результате чего образуются продукты замещения атома фтора, а именно фторированные арил(гетарил)-замещенные нитронилнитроксилы. В результате реакций с участием перфторбензола и перфторпиридина получены фторированные нитроксилы с удовлетворительными выходами (25–60%), однако в случае перфторбифенила выход был низким (~5%). Молекулярное и кристаллическое строение полученных нитронилнитроксилов установлено с помощью РСА их монокристаллов, радикальная природа подтверждена данными ЭПР.
Ключевые слова: нуклеофильное замещение фторированных аренов и гетароаренов; нитронил нитроксиды; рентгеноструктурный анализ.
Введение
Органические соединения с открытой электронной оболочкой (или Парамагнитные органические соединения) благодаря разнообразию их молекулярного дизайна, структурной гибкости и технологическим характеристикам являются перспективными компонентами для электронных и спиновых устройств нового поколения [1]. На протяжении нескольких последних десятилетий замещенные нитроксильные радикалы (R–NN) широко использовались в качестве органических носителей неспаренного электрона, что позволило открыть материалы с уникальными спин-связанными свойствами, такие как полностью органические электромагнитные переключатели [2], ферромагниты и ферримагниты [1], магниты с отрицательным магнитным сопротивлением [3] и магнитные полимеры на основе графена [4].
Как правило, нитронилнитроксилы получают путем конденсации бис-гидроксиламинов с различными альдегидами (или полиальдегидами) с последующим окислением соответствующих 1,4-дигидроксиимидазолидинов [5]. Тем не менее, реакции ароматических альдегидов, содержащих сильные электроноакцепторные заместители, иногда оказываются безуспешными [5b, 6], что, возможно, происходит ввиду малой устойчивости продуктов конденсации. Прямое введение NN группы в органические структуры с использованием незамещенных в положении 2 (H–NN) нитронилнитроксилов в качестве синтетической единицы является альтернативным перспективным способом получить доступ к разнообразным радикальным производным R–NN. За всю историю химии нитронилнитроксилов проведено множество успешных нуклеофильных реакций и реакций кросс-сочетания металлорганических производных M–NN и различных электрофилов для получения функционализированных R–NN [7, 8]. Особенно результативным при получении функционализированных нитронилнитроксилов оказалось использование парамагнитного производного лития Li–NN (Схема 1) [9].
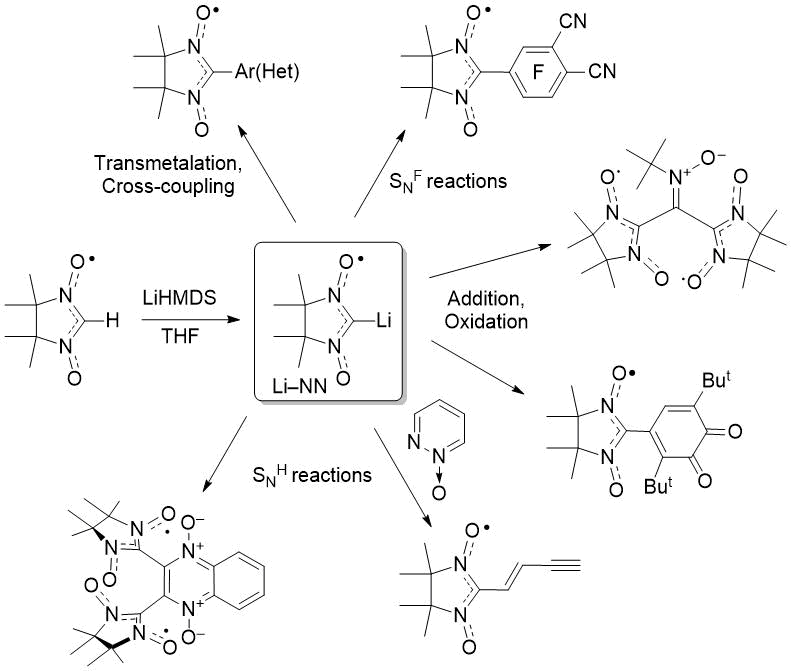
Схема 1. Применение производного лития Li–NN в синтезе.
Ранее мы сообщили о возможности замещения атомов фтора в перфторбензонитриле и перфторфталонитриле под действием Li–NN и, таким образом, о получении цианотетрафторфенил- и дицианотрифторфенилзамещенных нитронилнитроксилов [10, 11]. В данной работе исследована возможность использования данной реакции для получения различных полифторированных функционально-замещенных аренов и гетаренов.
Результаты и обсуждение
Для проведения реакций Li–NN генерировали действием гексаметилдисилазана лития (LiHMDS) на H–NN при -90 °С в тетрагидрофуране (ТГФ; Схема 1) [12] и обрабатывали соответствующим перфторароматическим соединением. После относительно короткого периода (4 ч) получали смесь соединений (контроль по ТСХ), из которой целевые продукты замещения атома фтора ‒ соответственно замещенные нитронил нитроксиды 1–4, выделяли с помощью колоночной хроматографии с последующей кристаллизацией (Схема 2).
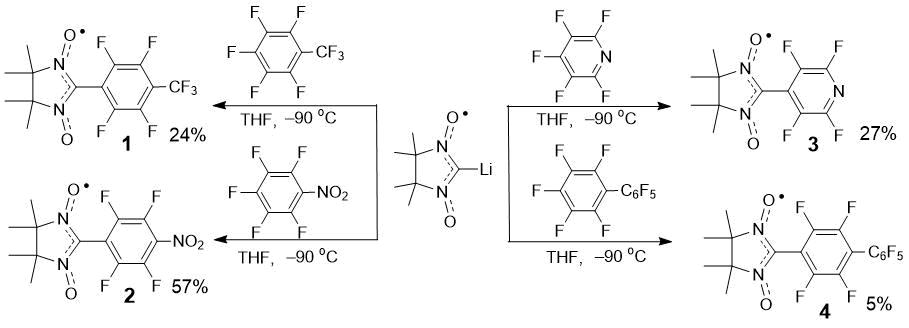
Схема 2. Синтез замещенных нитронил нитроксидов 1–4.
Строение всех нитронилнитроксилов определено методом монокристальной дифрактометрии (Рис. 1). Избранные геометрические параметры веществ 1–4 изображены в Таблице 1, из которой следует, что длина связей и углы между связями в этих нитронилнитроксилах находятся в пределах статистических значений [13]; длины связей C‒N и N‒O в парамагнитном фрагменте ‒ среднестатистические [7]. Двугранные углы между плоскостями нитронилнитроксила и ароматических фрагментов находятся в пределах 57–70°.
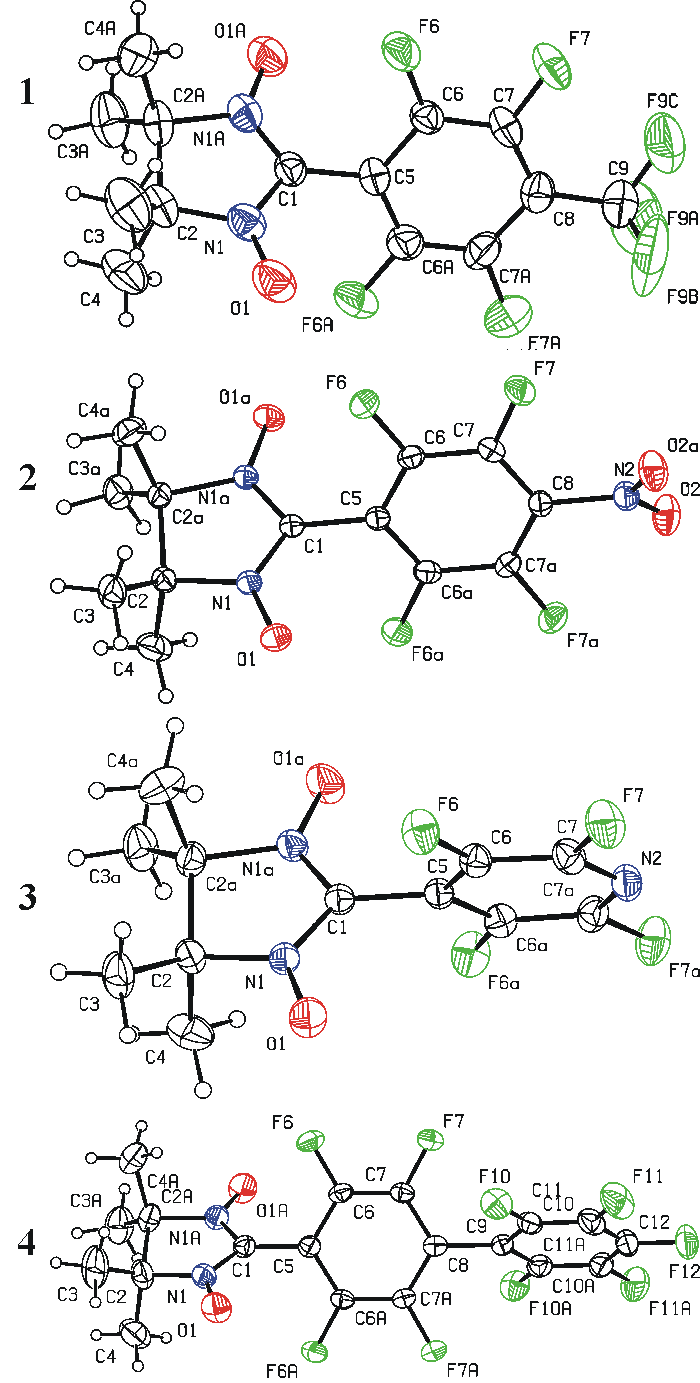
Рисунок 1. Молекулярное строение (ORTEP диаграмма с 30% эллиптической вероятностью) и нумерация атомов нитронилнитроксилов 1–4.
Таблица 1. Избранные геометрические параметры соединений 1–4.
|
Связи (Å) Углы (°) |
1 |
2 |
3 |
4 |
|
O1–N1 |
1.255(8) |
1.275(2) |
1.276(2) |
1.266(4) |
|
O1a–N1a |
1.272(8) |
1.275(2)* |
1.276(2)* |
1.277(4) |
|
N1–C1 |
1.362(8) |
1.336(2) |
1.337(2) |
1.339(5) |
|
N1a–C1 |
1.319(8) |
1.336(2) |
1.337(2) |
1.338(5) |
|
N1–C2 |
1.490(9) |
1.506(2) |
1.504(2) |
1.515(5) |
|
N1a–C2a |
1.528(9) |
1.506(2)* |
1.504(2)* |
1.501(5) |
|
C2–C2a |
1.586(9) |
1.573(3) |
1.546(2) |
1.571(6) |
|
C1–C5 |
1.456(9) |
1.470(3) |
1.469(3) |
1.465(5) |
|
O1-N1-C1 |
124.3(6) |
125.9(2) |
126.2(1) |
125.5(3) |
|
O1-N1-C2 |
122.4(5) |
122.1(1) |
123.1(1) |
123.2(3) |
|
C1-N1-C2 |
113.3(5) |
111.8(2) |
110.2(1) |
110.8(3) |
|
O1a-N1a-C1 |
125.1(5) |
125.9(2)* |
126.2(1)* |
125.9(3) |
|
O1a-N1a-C2a |
121.4(5) |
122.1(1)* |
123.1(1)* |
122.6(3) |
|
C1-N1a-C2a |
113.5(5) |
111.8(2)* |
110.2(1)* |
111.3(3) |
|
N1-C1-N1a |
109.7(5) |
110.9(2) |
110.7(2) |
110.6(3) |
|
α** |
57(1) |
70.3(2) |
69.9(2) |
60.4(6) |
*Молекулы расположены на оси второго порядка, таким образом длины связей одинаковы.
** Угол между
плоскостями для фрагмента нитронилнитроксила и ароматического заместителя.
Спектры ЭПР для разбавленных, не содержащих кислорода растворов веществ 1–4 в хлороформе (10–4 M) являются квинтетами триплетов, g = 2.0060(1) (Рисунок 2a-e). В случае вещества 4 зарегистрирован спектр ЭПР высокого разрешения, чтобы показать более сложное расщепление каждой линии квинтета. Мы приписали квинтетное и триплетное расщепление соответственно двум эквивалентным атомам азота и двум эквивалентным атомам фтора, ближайшим к нитронилнитроксильному фрагменту. Сложная картина, наблюдаемая для радикала 4, хорошо воспроизводится, если принимать во внимание 12 hfs констант сверхтонкого расщепления (hyperfine structure ‒ сверхтонкая структура) на протонах четырех метильных групп и двух пар hfs констант на удаленных атомах фтора. Точные значения hfs -констант, использованных для моделирования, приведены в Таблице 2. Следует отметить, что, несмотря на схожесть строения веществ 1–4, значения AN и AF немного разнятся, что отражает различия в их электронном строении и формах линий ЭПР-спектров.
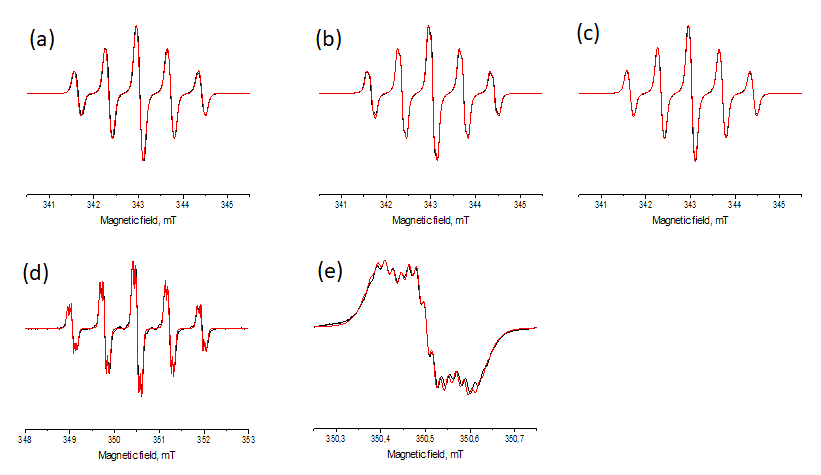
Рисунок 2. ЭПР-спектры разбавленных, не содержащих кислорода растворов в хлороформе для 1 (a), 2 (b), 3 (c), 4 (весь спектр, d), 4 (центральная компонента, e). Линии черного цвета – экспериментальные спектры; линии красного цвета – численное моделирование с параметрами, заданными в Таблице 2.
Таблица 2. Параметры, использованные для моделирования ЭПР спектров.
|
Вещество |
giso |
2AN,mT |
2AFortho, mT |
|
1 |
2.0060 |
0.71 |
0.07 |
|
2 |
2.0060 |
0.71 |
0.08 |
|
3 |
2.0060 |
0.71 |
0.07 |
|
4* |
2.0061 |
0.73 |
0.07 |
*Для моделирования ЭПР-спектра с высоким разрешением для вещества 4 (Рис. 2e) были использованы следующие величины hfs: 2AN = 0.73 mT; 2AF = 0.07 mT; 12AH = 0.015 mT; 2AF = 0.02; 2AF = 0.015 mT.
Заключение
Была исследована возможность применения реакции литиевого производного 4,4,5,5- тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксила с перфторароматическими соединениями для получения полифторарил(гетарил)-замещенных нитронилнитроксилов. Установлено, что во всех случаях реакция протекает путем региоспецифического замещения атомов фтора в пара-положении относительно функциональной группы. Все синтезированные радикалы стабильны и были полностью описаны как в растворе, так и в твердом состоянии. Полученные результаты открывают путь к новым нитронилнитроксилам с фторированными электроноакцепторными заместителями; такие радикалы, в свою очередь, могут быть полезными для применения в областях молекулярного магнетизма и материаловедении.
Экспериментальная часть
1.Материалы и оборудование
4,4,5,5-Тетраметил-4,5-дигидроo-1H-имидазол-3-оксид-1-оксил (H–NN) [9b] синтезирован как описано ранее, использован свежеперегнанный над бензофенон-кетилом натрия ТГФ. Другие реагенты высокой чистоты коммерчески доступны и использовались сразу после поступления. Колоночная хроматография выполнялась на силикагеле (0.063–0.200 мм). Инфракрасные (ИК) спектры регистрировались на приборе Tensor 27 для образцов, таблетированных с KBr (0.25%). Оптические спектры регистрировались на спектрофотометре HP Agilent 8453 (10–5–10–4 M растворы в EtOH). Массы молекулярных ионов определялись масс-спектрометрией высокого разрешения (HRMS) на приборе DFS Thermo Scientific (EI, 70 eV).
ЭПР спектры получены в разбавленных, не содержащих кислорода растворах в хлороформе при 295 K и концентрации ~10–4 M с помощью спекторметра Bruker X Band (9 ГГц) Elexys E 540. Для определения изотропных g-факторов (giso), были записаны ЭПР спектры в области X-band в стандартном режиме (CW) для смеси исследуемого радикала с базовым тритильным радикалом (Finland trityl). Затем, известное значение giso для Finland trityl было использовано для моделирования спектра, и целевое значение giso было исключено. Моделирование линий спектра ЭПР раствора осуществлялось с использованием программы Easy Spin которая доступна по ссылке: http://www.easypin.org.
2. Методы синтеза и описание
Общий метод получения нитронилнитроксидов. Раствор LiHMDS (1.0 M, 1.1 мл., 1.1 ммоль) в ТГФ добавляли при температуре 90 °C и активном перемешивании в раствор 4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксила (157 мг, 1.0 ммоль) в ТГФ (20 мл) в атмосфере аргона. Реакционную смесь перемешивали при температуре -90 °C в течение 30 мин. Далее раствор перфторарена (1.1 ммоль) в ТГФ (5 мл) добавляли при температуре –90 °C в атмосфере аргона, перемешивание продолжали, протекание реакции контролировали TСХ (Силуфол F254, элюент – EtOAc). Через 4 ч изменения на TСХ прекращались, охлаждение убирали, реакционную массу оставляли при перемешивании для достижения комнатной температуры, затем приводили в контакт с атмосферой. Флэш-хроматография (SiO2, колонка 3×4 см, элюент – EtOAc) с последующим удалением растворителя при пониженном давлении и комнатной температуре приводила к твердой смеси. Полученную твердую смесь разделяли колоночной хроматографией (SiO2, колонка 3 × 20 см, элюент – CH2Cl2). Фракцию, содержащую целевой радикал, концентрировали при пониженном давлении до объема ~5 мл, затем добавляли n-гептан (5 мл) и выдерживали в течение ~60 ч при температуре 0–5 °C для медленной кристаллизации нитронилнитроксильного радикала.
2-(4-Трифторметил-2,3,5,6-тетрафторфенил)-4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксил (1). Выход 90 мг (24%); кристаллы фиолетового цвета; ИК (KBr) ṽmax, см−1: 409, 503, 536, 602, 677, 706, 719, 874, 970, 999, 1028, 1140, 1155, 1180, 1217, 1265, 1331, 1377, 1390, 1433, 1468, 1495, 1551, 1606, 1662, 2991, 3014, 3441; UV-vis (EtOH) max/nm (lg ): 553 (2.66), 373 (3.77), 294 (4.04), 203 (4.01); HMRS: вычислено для C14H12F7N2O2• [M+] 373.0782; обнаружено 373.0783.
2-(4-Нитро-2,3,5,6-тетрафторфенил)-4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксил (2). Выход 200 мг (57%); кристаллы коричневого цвета; ИК (KBr) ṽmax, см−1: 417, 446, 476, 538, 608, 712, 768, 785, 804, 874, 972, 999, 1011, 1086, 1142, 1176, 1217, 1265, 1356, 1375, 1389, 1429, 1456, 1486, 1551, 1576, 1626, 2413, 2858, 2931, 2947, 3001, 3442; UV-vis (EtOH) max/nm (lg ): 555 (2.70), 373 (3.5), 318 (4.13), 204 (4.08); HMRS: вычислено для C13H12F4N3O4• [M+] 350.0759; обнаружено 350.0758.
2-(2,3,5,6-Тетрафторпиридин-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксид-1-оксил (3). Выход 83 мг (27%); кристаллы фиолетового цвета; ИК (KBr) ṽmax, см−1: 453, 538, 567, 646, 696, 715, 868, 958, 972, 993, 1018, 1136, 1169, 1252, 1271, 1375, 1427, 1450, 1475, 1487, 1547, 1655, 1849, 2993, 3437; UV-vis (EtOH) max/nm (lg ): 551 (2.64), 371 (3.89), 288 (4.04), 202 (3.86); HMRS: вычислено для C12H12F4N3O2• [M+] 306.0860; обнаружено 306.0865.
2-(Перфторбифенил-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1H-имидазол-3-оксидe-1-оксил (4). Выход 24 мг (5%); кристаллы фиолетового цвета; ИК (KBr) ṽmax, cm−1: 540, 706, 733, 870, 964, 984, 997, 1043, 1134, 1173, 1223, 1267, 1377, 1429, 1487, 1508, 1527, 1595, 1659, 2943, 2995, 3442; UV-Vis (C2H5OH), λmax/nm (lg ε): 549 (2.83), 370 (3.77), 281 (4.10), 237 (4.15), 202 (4.23); HMRS: вычислено для C19H12F9N2O2• [M+] 471,0750; обнаружено 471,0747.
3. Кристаллографический анализ
Рентгеноструктурные исследования кристаллов проводились на дифрактометре Bruker Kappa Apex II CCD с использованием φ, ω-сканов с шириной фреймов (0.5°) с MoKα излучением (λ = 0.71073 Å) и графитового монохроматора при 296 K. Все структуры были решены прямыми методами и уточнены методом наименьших квадратов с полной матрицей для всех F2 в анизотропном приближении с использованием программы SHELX-97 [14]. Положения атомов H были рассчитаны по модели «наездника» (riding model). Поправки на поглощение проводились опытным путем с помощью компьютерной программы SADABS [15]. Для того чтобы исключить вклад в дифракцию неупорядоченного растворителя в кристаллах 4 и тем самым получить набор дифракционных интенсивностей, свободных от растворителя, была применена процедура PLATON/SQUEEZE [16].
Кристаллографические данные для всех веществ перечислены в Таблице 3. CCDC 1899824 (1), 1899825 (2), 1899826 (3), и 1899827 (4) содержит дополнительные кристаллографические данные для данной статьи. Указанная информация может быть получена путем свободного доступа из The Cambridge Crystallographic Data Centre по ссылке: www.ccdc.cam.ac.uk/data_request/cif.
Таблица 3. Кристаллографические данные, совокупность данных и уточненные показатели для нитронил нитроксидов 1–4.
|
1 |
2 |
3 |
4 |
|
|
Кристаллографические данные |
||||
|
Chemical formula |
C14H12F7N2O2 |
C13H12F4N3O4 |
C12H12F4N3O2 |
C19H12F9N2O2 |
|
Mr |
373.26 |
350.26 |
306.25 |
471.31 |
|
Crystal system |
Orthorhombic |
Orthorhombic |
Monoclinic |
Tetragonal, |
|
Space group |
Pna21 |
Ibca |
C2/c |
P ̶ 421c |
|
a, (Å) |
8.215(2) |
10.3733(5) |
14.0067(7) |
19.9841(7) |
|
b |
17.781(4) |
11.0785(7) |
10.7414(7) |
19.9841(7) |
|
c |
10.996(2) |
25.589(2) |
10.5168(8) |
10.0603(4) |
|
β (°) |
90 |
90 |
122.419(4) |
90 |
|
V (Å3) |
1606.1(5) |
2940.7(3) |
1335.7(2) |
4017.7 (3) |
|
Z |
4 |
8 |
4 |
8 |
|
F(000) |
756 |
1432 |
628 |
1896 |
|
Dx (Mg m-3) |
1.544 |
1.582 |
1.523 |
1.558 |
|
Radiation type |
Mo Kα |
Mo Kα |
Mo Kα |
Mo Kα |
|
μ (mm-1) |
0.16 |
0.15 |
0.14 |
0.16 |
|
Crystal size (mm) |
0.48 × 0.23 × 0.04 |
0.65 × 0.24 × 0.04 |
0.40 × 0.20 × 0.08 |
0.90 × 0.37 × 0.09 |
|
Совокупность данных |
||||
|
Tmin, Tmax |
0.684, 0.862 |
0.786, 0.862 |
0.805, 0.862 |
0.776, 0.862 |
|
No. of measured, |
25890, |
10284, |
12295, |
43866, |
|
Rint |
0.126 |
0.050 |
0.054 |
0.049 |
|
θ range (°) |
2.2 ̶ 25.1 |
1.6 ̶ 25.0 |
2.6 ̶ 27.5 |
1.4 ̶ 25.1 |
|
Range of h, k, l |
h = -9→ 9, k = -21→ 21, l = -12→ 13 |
h = -12→ 12, k = -13→ 13, l = -30→ 30 |
h = -18→ 18, k = -13→ 13, l = -13→ 13 |
h = -23→ 23, k = -23→ 23, l = -11→ 11 |
|
Уточненные показатели |
||||
|
R[F2 > 2σ(F2)], wR(F2), S |
0.072, 0.210, 1.04 |
0.033, 0.135, 1.14 |
0.046, 0.132, 1.03 |
0.050, 0.142, 1.09 |
|
No. of reflections |
2846 |
1305 |
1535 |
3555 |
|
No. of parameters |
229 |
113 |
99 |
293 |
|
No. of restraints |
1 |
0 |
0 |
0 |
|
Δ>max, Δ>min (e Å-3) |
0.34, -0.32 |
0.31, -0.31 |
0.28, -0.30 |
0.24, -0.26 |
Благодарности
Данная работа выполнена при поддержке Министерства образования и науки Российской Федерации в рамках программы 5-100. Авторы выражают благодарность Российскому Фонду Фундаментальных Исследований (проект 18-33-00203); а также Химическому исследовательскому центру коллективного пользования СО РАН за регистрацию спектров и аналитические вычисления.
Список литературы
- (a) O. Kahn, Molecular Magnetism, Wiley-VCH, New York, 1993; (b) Molecular Magnetism, Eds. K. Itoh and M. Kinoshita, Kodansha & Gordon and Breach, Tokyo, 2000; (c) Magnetism: Molecules to Materials II–IV, Eds. J. S. Miller and M. Drillon, Wiley-VCH, Weinheim, 2001–2005; (d) p-Electron Magnetism From Molecules to Magnetic Materials, Ed. J. Veciana, Springer, Berlin, 2001; (e) Molecular Nanomagnets, Eds. D. Gatteschi, R. Sessoli, and J. Villain, Oxford University Press, New York, 2006; (f) Stable Radicals: Fundamentals and Applied Aspects of Odd Electron Compounds, Ed. R. G. Hicks, Wiley, Chichester, 2010; (g) Y. Morita, S. Suzuki, K. Sato, T. Takui, Synthetic Organic Spin Chemistry for Structurally Well-defined Open-shell Graphene Fragments, Nat. Chem. 3 (2011) 197–204.
- (a) K. Matsuda, M. Irie, A Diarylethene with Two Nitronyl Nitroxides: Photoswitching of Intramolecular Magnetic Interaction, J. Am. Chem. Soc. 122 (2000) 7195–7201; (b) K. Matsuda, M. Irie, Photoswitching of Magnetic Interaction: Diarylethene Photochromic Spin Couplers, Polyhedron 20 (2001) 1391–1395; (c) A. Ito, Y. Nakano, T. Kato, K. Tanaka, Tetraarylethylene Having Two Nitroxide Groups: Redox-switching of Through-Bond Magnetic Interaction by Conformation Change, Chem Commun. (2005) 403–405.
- (a) M. M. Matsushita, H. Kawakami, Y. Kawada, T. Sugawara, Negative Magneto-resistance Observed on an Ion-radical Salt of a TTF-based Spin-polarized Donor, Chem. Lett. 36 (2007) 110–111; (b) M. M. Matsushita, H. Kawakami, T. Sugawara, M. Ogata, Molecule-based system with coexisting conductivity and magnetism and without magnetic inorganic ions, Phys. Rev. B: Condens. Matter Mater. Phys. 77 (2008) 195208; (c) T. Sugawara, H. Komatsu, K. Suzuki, Interplay between Magnetism and Conductivity Derived from Spin-polarized Donor Radicals, Chem. Soc. Rev. 40 (2011) 3105–3118.
- M. Slota, A. Keerthi, W. K. Myers, E. Tretyakov, M. Baumgarten, A. Ardavan, H. Sadeghi, C. J. Lambert, A. Narita, K. Müllen, L. Bogani, Magnetic Edge States and Coherent Manipulation of Graphene Nanoribbons, Nature 557 (2018) 691–695.
- (a) J. H. Osiecki, E. F. Ullman, Studies of Free Radicals. I. α-Nitronyl nitroxides, a New Class of Stable Radicals, J. Am. Chem. Soc. 90 (1968) 1078–1079; (b) E. F. Ullman, J. H. Osiecki, D. G. B. Boocock, R. Darcy, Stable Free Radicals. X. Nitronyl Nitroxide Monoradicals and Biradicals as Possible Small Molecule Spin Labels, J. Am. Chem. Soc. 94 (1972) 7049–7059.
- (a) Y. Hosokoshi, M. Tamura, H. Sawa, R. Kato, M. Kinoshita, Two-dimensional Ferromagnetic Intermolecular Interactions in Crystals of the p-Cyanophenyl Nitronyl Nitroxide Radical, J. Mater. Chem. 5 (1995) 41–46; (b) O. V. Koreneva, G. V. Romanenko, Y. G. Shvedenkov, V. N. Ikorskii, V. I. Ovcharenko, Molecular Magnets Based on M(hfac)2 and Spin-labeled Nitrile, Polyhedron 22 (2003) 2487–2497.
- E. V. Tretyakov, V. I. Ovcharenko, The Chemistry of Nitroxide Radicals in the Molecular Design of Magnets, Russ. Chem. Rev. 78 (2009) 971–1012.
- S. Suzuki, F. Nakamuraa, T. Naota, Direct Synthetic Method for (Nitronyl Nitroxide)-substituted π- Electronic Compounds by Palladium-catalyzed Cross-Coupling Reaction with a Zinc Complex, Mater. Chem. Front. 2 (2018) 591–596.
- (a) M. V. Varaksin, E. V. Tretyakov, I. A. Utepova, G. V. Romanenko, A. S. Bogomyakov, D. V. Stass, R. Z. Sagdeev, V. I. Ovcharenko, O. N. Chupakhin, Synthesis of nitroxyl radical by direct nucleophilic functionalization of a C-H bond in the azadiene systems, Russ. Chem. Bull. 61 (2012) 1469–1473; (b) E. V. Tretyakov, I. A. Utepova, M. V. Varaksin, S. E. Tolstikov, G. V. Romanenko, A. S. Bogomyakov, D. V. Stass, V. I. Ovcharenko, O. N. Chupakhin, New Approach to Synthesis of Nitronyl and Imino Nitroxides Based on SNH Methodology, ARKIVOC viii (2011) 76–98; (c) E. V. Tretyakov, S. E. Tolstikov, G. V. Romanenko, A. S. Bogomyakov, V. K. Cherkasov, D. V. Stass, V. I. Ovcharenko, A Novel Route to Spinlabeled Dihydrooxepines and o-Benzoquinones, Russ. Chem. Bull. 60 (2011) 2325–2330; (d) S. Suzuki, T. Furui, M. Kuratsu, M. Kozaki, D. Shiomi, K. Sato, T. Takui, K. Okada, Nitroxide-Substituted Nitronyl Nitroxide and Iminonitroxide, J. Am. Chem. Soc. 132 (2010) 15908–15910.
- E. V. Tretyakov, P. A. Fedyushim, E. V. Panteleeva, D. V. Stass, I. Y. Bagryanskaya, I. V. Beregovaya, A. S. Bogomyakov, Substitution of a Fluorine Atom in Perfluorobenzonitrile by a Lithiated Nitronyl Nitroxide, J. Org. Chem. 82 (2017) 4179–4185.
- (a) P. Fedyushin, E. Panteleeva, I. Bagryanskaya, K. Maryunina, K. Inoue, D. Stass, E. Tretyakov, An approach to fluorinated phthalonitriles containing a nitronyl nitroxide or iminonitroxide moiety, J. Fluor. Chem. 217 (2019) 1–7; (b) O. N. Chupakhin, I. A. Utepova, M. V. Varaksin, E. V. Tretyakov, G. V. Romanenko, D. V. Stass, V. I. Ovcharenko, SNH Approach in the Synthesis of Nitronyl Nitroxides, J. Org. Chem. 74 (2009) 2870–2872.
- L. V. Politanskaya, G. A. Selivanova, E. V. Panteleeva, E. V. Tret'yakov, V. E. Platonov, P. V. Nikul'shin, A. S. Vinogradov, Y. V. Zonov, V. M. Karpov, T. V. Mezhenkova, A. V. Vasil'ev, A. B. Koldobskij, O. S. Shilova, M. V. Morozova, Y. V. Burgart, E. V. Shchegol'kov, V. I. Saloutin, V. B. Sokolov, A. Yu. Aksinenko, V. G. Nenajdenko, M. Yu. Moskalik, V. V. Astahova, B. A. Shainyan, A. A. Tabolin, S. L. Ioffe, V. M. Muzalevskij, E. S. Balenkova, A. V. Shastin, A. A. Tyutyunov, V. E. Bojko, S. M. Igumnov, A. D. Dil'man, N. Y. Adonin, V. V. Bardin, S. M. Masoud, D. V. Vorob'eva, S. N. Osipov, E. V. Nosova, G. N. Lipunova, V. N. Charushin, D. O. Prima, A. G. Makarov, A. V. Zibarev, B. A. Trofimov, L. N. Sobenina, K. V. Belyaeva, V. YA. Sosnovskih, D. L. Obydennov, S. A. Usachev, Sovremennaya ftororganicheskaya himiya v Rossii, Uspekhi himii 88 (2019) in press; DOI: 10.1070/RCR4871.
- F. H. Allen, O. Kenard, D. G. Watson, L. Bramer, A. G. Orpen, R. Taylor, Tables of Bond Lengths determined by X-Ray and Neutron Diffraction. Part I. Bond Lengths in Organic Compounds, J. Chem. Soc. Perkin Trans. II 12 (1987) s1–s7.
- G. M. Sheldrick, SHELX-97, Programs for Crystal Structure Analysis (Release 97-2), University of Göttingen, Germany, 1997.
- SADABS, v. 2008-1, Bruker, AXS, Madison, WI, USA, 2008.
- (a) A. L. Spek, PLATON, A Multipurpose Crystallographic Tool (Version 10M), Utrecht University, The Netherlands, 2003; (b) A. L. Spek, Single-crystal Structure Validation with the Program PLATON, J. Appl. Crystallogr. 36 (2003) 7–13.
Дополнительные материалы с данными ИК и УФ спекторв см. PDF версию статьи.
Статья рекомендована к публикации членом редколлегии Проф., д.х.н. В.Г.Ненайденко
Fluorine Notes, 2019, 123, 7-8


