Поступило в редакцию: Сентябрь 2018
Fluorine Notes, 2018, 121, 1-2
Синтез фторированных хиральных аминокислот радикальным перфторалкилированием дегидро-аминокислот, катализируемый Эозином Y.
Томоко Ядзима*, Мако Икегами
Химический факультет кафедры Естественных наук университета Очаномидзу, Отсука, Бункуо-ку, Токио 112-8610, Япония
Email: yajima.tomoko@ocha.ac.jp
Аннотация: Фторсодержащие аминокислоты являются одними из наиболее полно изученных веществ в медицинской области. Ранее нами были описаны несколько способов синтеза β-перфторалкил аминокислот, основанных на радикальном перфторалкилировании под воздействием УФ-излучения или в условиях катализа. В данной статье представлен синтез β-перфторалкил аминокислоты до дегидроаминокислот путем перфторалкилирования, инициируемого облучением видимым светом в отсутствии металлов, с использованием Эозина Y в качестве органического катализатора. Применение хиральной индукции позволило получить хиральные аминокислоты с высокой стереоселективностью. Этот экологичный метод позволяет получить различные производные хиральных перфторалкил аминокислот.
Ключевые слова: органический краситель; перфторалкилирование; аминокислота; хиральная индукция; видимое излучение.
Фтор-содержащие молекулы, в частности фторированные аминокислоты и их пептиды, являются одними из наиболее перспективных веществ в области медицинской и супрамолекулярной химии [1–4]. Ввиду активных исследований пептидных лекарственных препаратов [5, 6], представляет интерес разработка определенных пептидов. Перфторалкил-содержащие α-аминокислоты могут служить новой основой для пептидов, поскольку они обладают химической стабильностью, термостойкостью и гидрофобностью. В тоже время, количество известных эффективных способов синтеза перфторалкил-содержащих хиральных аминокислот ограничено [2, 4]. Нами были описаны несколько синтетических подходов для β-перфторалкил-α-аминокислот на основе реакции радикального типа [7–9]. Несмотря на то, что представленные нами ранее методы синтеза обеспечивали получение различных перфторалкил аминокислот, однако они имели недостатки, такие как, необходимость использования металлического индия или ртутной лампы высокого давления для радикального инициирования, а также низкие выходы, или низкую селективность.
В последнее время активно изучаются окислительно-восстановительные реакции, инициируемые облучением видимым светом, особенно с использованием органического красителя в качестве катализатора. Данные реакции протекают в отсутствии металлов и являются надежными процессами, удобными для производства лекарственных препаратов [10–12]. В предыдущей работе мы исследовали йодоперфторалкилирование алкенов и алкинов, катализируемое Эозином Y [13]. Реакция прошла гладко и, при облучении видимым светом в течение 1 часа и использовании всего 1 моля Эозина Y, а также различных перфторалкил йодидов в качестве источников фтора, был получен соответствующий йодоперфторалкилированный продукт (Схема 1). К сожалению, реакция оказалась ограничена простыми алкенами и алкинами с концевой двойной связью, поэтому мы применили этот способ реакции к дегидроаминокислотам для синтеза перфторалкил аминокислот в отсутствии металлов. Нами описано перфторалкилирование дегидро-аминокислот, инициируемое облучением видимым светом и катализируемое Эозином Y. Стереоселективная реакция была проведена с использованием хиральной индукции.
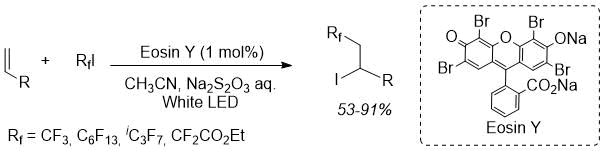
Схема 1. Предыдущее фотоиндуцированное йодоперфторалкилирование.
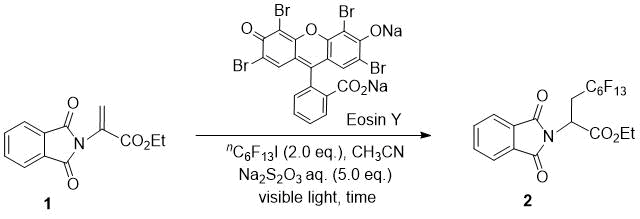
Для начала нами было исследовано фотоиндуцированное присоединение радикала перфторгексилйодида к N-фталимид-защищенной дегидроаминокислоте 1 для оптимизации условий проведения реакции (Таблица 1). Согласно нашим предыдущим условиям, была проведена реакция 1 с 2.0 эквив. перфторгексил йодида с использованием 1 мол.% Эозина Y, в качестве фотокатализатора, с облучением в течение 1 часа 12-Вт белой светоизлучающей диодной (LED) лампой в CH3CN, в присутствии водного Na2S2O3 (№ 1) [13]. Соответствующий гидроперфторгексилированный продукт 2 был получен с выходом 7%; хотя в нашей предыдущей статье реакцией с простыми олефинами при тех же условиях был получен йодоперфторалкилированный продукт. Нами было увеличено время реакции (№№ 2–4); большее время реакции позволило повысить выход продукта, и при облучении в течение 16 часов выход продукта увеличился до 65%. Использование 5 мол.% Эозина Y дало такой же эффект (№ 5). При этом использование LED с излучением зеленого цвета снизило выход продукта (№ 6).
Таблица 1. Оптимизация условий реакции.
|
No |
Эозин Y |
Источник света |
Время (ч) |
Выход |
|
1 |
1 моль% |
12-В Белый LED |
1 |
7% |
|
2 |
1 моль % |
12- В Белый LED |
5 |
24% |
|
3 |
1 моль % |
12- В Белый LED |
8 |
40% |
|
4 |
1 моль % |
12- В Белый LED |
16 |
65% |
|
5 |
5 моль % |
12- В Белый LED |
5 |
65% |
|
6 |
1 моль % |
6-В Зеленый LED |
16 |
19% |
Далее были изучены реакции с использованием хиральных субстратов с различными перфторалкиловыми йодидами (Таблица 2). Реакция между хиральным субстратом 3 [7], содержащим фталимид и камфорсультам, с перфторалкил йодидом под воздействием света на протяжении 6 часов с использованием 1 мол.% Эозина Y прошла гладко и позволила получить продукт 2a с выходом 82% в виде одного стереоизоимера (№ 1). В тоже время использование перфторгексил хлорида вместо перфторгексил йодида, не приводит к получению желаемого перфторалкилированного продукта. При этом реакция с использованием перфторбутил- или изопропилйодида дала соответствующий перфторалкилированный продукт 2b или 2c с хорошим выходом и высокой диастереоселективностью (№ 2, 3). Необходимо отметить, что при реакции с трифторметил йодидом выходы продукта оказались ниже, но при увеличении времени реакции повысился и выход продукта (№ 4, 5). В нашей предыдущей статье [7] диастереоселективность 2d была ниже, чем у перфторалкильных аддуктов; в тоже время наилучшая стереоселективность была получена в процессе указанной окислительно-восстановительной реакции под действием света. Реакция с использованием йододифторацетата в качестве источника фторалкила, несмотря на время реакции 16 часов, приводит к образованию продукта с выходом всего 53%, однако использование 5 мол.% Эозина Y увеличило выход продукта до 73% (№№ 6, 7). Впоследствии, путем удаления побочных сультамов и снятия фталимидной защиты, из данных продуктов могут быть легко получены аминокислоты [7].
Таблица 2. Стереоселективное гидроперфторалкилирование.
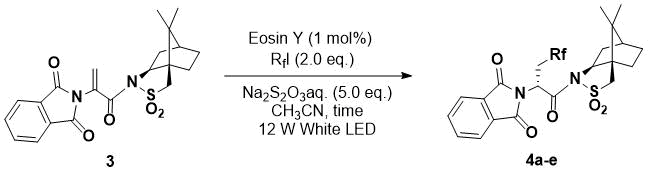
|
№ |
Rf = |
Время (ч) |
Продукт |
Выход |
% dea |
|
1 |
C6F13 |
6 |
4a |
82% |
>98 |
|
2 |
C4F9 |
6 |
4b |
89% |
>98 |
|
3 |
i-C3F7 |
6 |
4c |
84% |
>98 |
|
4b |
CF3 |
6 |
4d |
44% |
>98 |
|
5c |
CF3 |
16 |
4d |
72% |
>98 |
|
6 |
CF2CO2Et |
16 |
4e |
53% |
>98 |
|
7d |
CF2CO2Et |
16 |
4e |
73% |
>98 |
aСоотношение диастереомеров определялось данными 1H ЯМР. Были использованы:
b19 экв. CF3I,
c16 экв. CF3I,
d5 мол.% Эозина Y.
Для установления происхождения водорода, был проведен эксперимент с использованием D2O (Схема 2). Реакцией между 3 и перфторгексилйодидом с использованием D2O вместо H2O было получен продукт продукт с выходом 83%, содержащий 66% -дейтерированного производного.
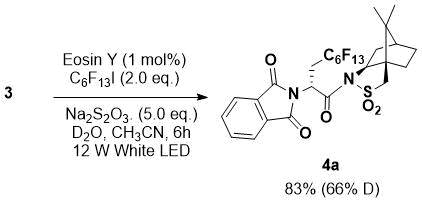
Схема 2. Эксперимент с изотопной меткой.
Возможное течение реакции гидроперфторалкилирования показано на схеме 3. Перфторалкильный радикал был получен окислительным тушением фото-возбужденного Эозина Y [7]. Для получения каптодативно-стабилизированного промежуточного радикала A, к дегидро-аминокислоте был добавлен перфторалкильный радикал [8]. Затем, для получения аниона B, радикал A восстанавливался Na2S2O3. Конечное стереоселективное протонирование B с использованием D2O привело к получению соответствующего гидроперфторалкилированного продукта. В случае данной реакции нежелательно перемещение радикала йода, поскольку промежуточный радикал А стабилен и стерически напряжен по сравнению с реакцией с деценом.
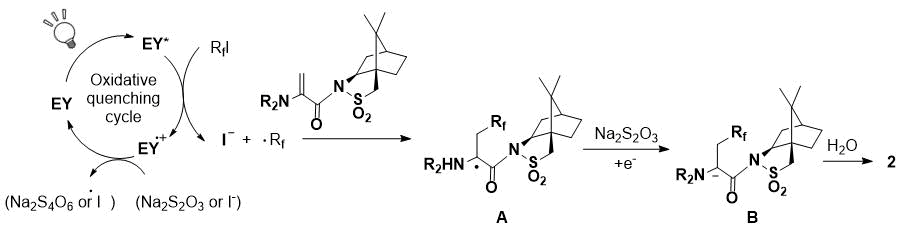
Схема 3. Предлагаемый механизм.
Нами было выполнено гидроперфторалкилирование дегидроаминокислот, инициируемое облучением видимым светом, катализируемое Эозином Y, с использованием перфторалкил йодидов в качестве источников фторалкильного радикала. Использование камфорсультама в качестве субстрата, обладающего хиральной индукцией, позволило получить превосходную стереоселективность, реакция оказалась пригодной для проведения с различными перфторалкил йодидами. Описанный метод - новый и эффективный способ для синтеза хиральных перфторалкил аминокислот.
Экспериментальная часть
Все реакции проводились в атмосфере азота. Облучение видимым светом было проведено 12 В LED лампой (Hayashi watch-works Co., Ltd., SPA-10SW). 1H, 13C и 19F ЯМР спектры регистрировались на спектрометрах JEOL JNM-ECS400 (399.78 МГц для 1H, 100.5 МГц для 13C, и 376.2 МГц для 19F) или JNM-ECX500 (500.16 МГц для 1H, 125.8 МГц для 13C, и 470.6 МГц для 19F) в CDCl3 в качестве растворителя с тетраметилсиланом (δ 0 м.д. для 1H), и в CDCl3 (δ 76.9 м.д. для 13C) с CFCl3 (: 0 м.д. для 19F)в качестве внутреннего стандарта, если не указано другое. ИК-спектры были сняты на JASCO FTIR-4100. Масс-спектры были получены с помощью Thermo Fisher Exactive (ESI, APCI), JEOL JMS-T100GC (FD) или JEOL JMS-700 (FAB). Нанесенный Merck Kieselgel 60 F254 и Кanto силикагель 60 (сферический нейтральный) использовались для тонкослойной хроматографии и флэш-хроматографии соответственно. Все реагенты использовались без дополнительной очистки.
Общий метод перфторалкилирования при облучении видимым светом.
В двухгорловую колбу, содержащую олефин (0.2 моль) в CH3CN (5 мл) в атмосфере азота добавляли эозин Y-2Na (1.4 мг, 0.002 моля) растворенный в воде (1 мл), Na2S2O3 (158.0 мг, 1.0 моля) и перфторалкил йодид (0.4 моля). Смесь облучалась 12 В белой LED лампой при комнатной температуре и перемешивании. По окончании реакции смесь экстрагировали диэтиловым эфиром, сушили Na2SO4, фильтровали, концентрировали в вакууме. Для получения желаемого продукта сырой продукт очищали флэш-хроматографией (силикaгель, гексан).
Этил 2-(1,3-Диоксоизоиндолин-2-ил)-3-перфторгексилпропаноат (2)
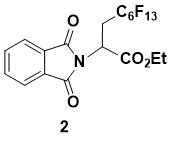
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.90 (m, 2H), 7.78 (m, 2H), 5.32 (dd, J = 10.0, 4.0 Гц, 1H), 4.27 (m, 2H), 3.17 (m, 2H), 1.24 (t, J = 7.2 Гц, 3H); 13C ЯМР (150 МГц, CDCl3) 167.3, 167.0, 134.5, 131.6, 123.8, 62.9, 45.2, 29.6 (t, JC–F = 20.2 Hz, C6F13C), 14.0; IR (KBr) 2987, 1724, 1718, 1387, 1236, 1072, 860, 848, 720, 530 см-1; HRMS (ESI-) m/z рассчитано для C19H11F13NO4 [M-H] - 564.0481, найдено 564.0479.
Данное вещество ранее было получено и описано [7].
N-{(R)-2-(1,3-Диоксоизоиндолин-2-ил)-3-перфторгексилпропаноил}-(1R,2S,4S)-борнан- 10,2-сультам (4a)
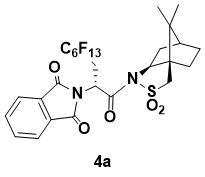
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.86 (m, 2H), 7.73 (m, 2H), 5.67 (dd, J = 9.4, 3.2 Гц, 1H), 4.06 (m, 1H), 3.53 (d, J = 13.6 Гц, 1H), 3.28 (d, J = 13.6 Гц, 1H), 3.21 (m, 1H), 2.75 (m, 1H), 2.10 (m, 2H), 1.87 (m, 3H), 1.36 (m, 2H), 0.88 (s, 6H); 13C ЯМР (150 МГц, CDCl3) 167.6, 166.6, 134.3, 132.0, 123.5, 67.0, 53.4, 48.4, 47.6, 46.5, 45.1, 37.8, 33.3, 30.7 (t, JC–F = 29.1 Гц, C6F12C), 26.2, 20.5, 19.8; IR (KBr) 1707, 1334, 1318, 1238, 1226, 1190 см-1;HRMS (ESI+) m/z рассчитано для
C27H23F13N2O5SNa [M+Na]+ 757.1012, найдено 757.0995.
Данное вещество ранее было получено и описано [7]
N-{(R)-2-(1,3-Диоксоиндолин-2-ил)-3-перфторбутилпропаноил}-(1R,2S,4S)-борнан- 10,2-сультам (4b)
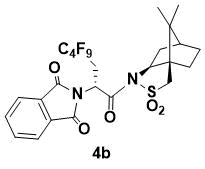
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.86 (m, 2H), 7.74 (m, 2H), 5.67 (dd, J = 9.4, 3.2 Hz, 1H), 4.07 (m, 1H), 3.42 (d, J = 13.6 Гц, 1H), 3.36 (d, J = 13.6 Гц, 1H), 3.23 (m, 1H), 2.76 (m, 1H), 2.14 (m, 1H), 2.05 (m, 1H), 1.88 (m, 3H), 1.38 (m, 2H), 0.88 (s, 6H); 13C ЯМР (150 МГц, CDCl3) 167.6, 166.6, 134.3, 132.1, 123.6, 67.0, 53.5, 48.5, 47.7, 46.5, 45.2, 37.9, 33.4, 30.6 (t, JC–F = 29.1 Hz, C6F12C), 26.3, 20.5, 19.8; HRMS (ESI+) m/z рассчитано для C25H24F9N2O5S [M+H]+ 635.1262, найдено 635.1248.
N-{(R)-2-(1,3-Диоксоиндолин-2-ил)-3-перфторизопропилпропаноил}-(1R,2S,4S)-борнан- 10,2-сультам (4c)
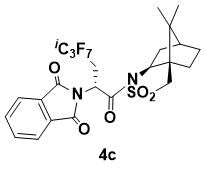
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.84 (m, 2H), 7.75 (m, 2H), 5.67 (m, 1H), 4.06 (dd, J = 7.2, 4.8 Гц, 1H), 3.58 (m, 1H), 3.41 (d, J = 13.6 Гц, 1H), 3.34 (d, J = 13.6 Гц, 1H), 2.50 (m, 1H), 2.14 (m, 2H), 1.88 (m, 3H), 1.38 (m, 2H), 0.87 (s, 3H), 0.85 (s, 3H); 13C ЯМР (100 МГц, CDCl3) 167.1, 166.4, 134.3, 131.8, 123.5, 66.9, 53.4, 48.4, 47.6, 47.4, 45.1, 37.8, 33.3, 28.8 (d, JC–F = 20.1 Hz, i-C3F7C), 26.2, 20.5, 19.8; HRMS (ESI+) m/z рассчитано для C24H23F7N2O5SNa [M+Na]+ 607.1108, найдено 607.1097.
Данное вещество ранее было получено и описано [7]
N-{(R)-2-(1,3-Диоксоизоиндолин-2-ил)-3-трифторметилпропаноил}-(1R,2S,4S)-борнан- 10,2-сультам (4d)
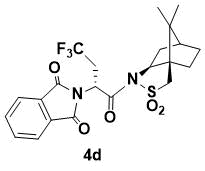
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.85 (m, 2H), 7.76 (m, 2H), 5.55 (dd, J = 10.4, 3.2 Hz, 1H), 4.07 (dd, J = 7.2, 4.8 Гц, 1H), 3.39 (d, J = 13.6 Гц, 1H), 3.35 (d, J = 13.6 Гц, 1H), 3.17 (m, 1H), 2.76 (m, 1H), 2.15 (m, 1H), 2.09 (m, 1H), 1.91 (m, 3H), 1.37 (m, 2H), 0.88 (s, 6H); 13C ЯМР (100 МГц, CDCl3) 167.6, 166.6, 134.3, 132.0, 123.5, 67.0, 53.4, 48.4, 47.6, 46.4, 45.1, 37.8, 33.3, 30.2, 26.2 (q, JC–F = 29.3 Гц, CF3C), 20.5, 19.8; IR (KBr) 1785, 1699, 1400, 1298, 1207, 1120, 1085, 1039 см-1; HRMS (ESI+) m/z рассчитано для C22H23F3N2O5SNa [M+Na]+ 507.1172, найдено 507.1166.
Данное вещество ранее было получено и описано [7]
N-{этил (R)-2-(1,3-Диоксоизоиндолин-2-ил)-4,4-дифторпентаноил}-(1R,2S,4S)-борнан-
10,2-сультам (4e)
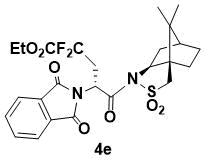
Порошок белого цвета. 1H ЯМР (400 МГц, CDCl3) 7.83 (m, 2H), 7.71 (m, 2H), 5.59 (dd, J = 10.4, 3.2 Hz, 1H), 4.30 (m, 1H), 4.05 (dd, J = 7.2, 4.8 Гц, 1H), 3.39 (d, J = 13.6 Гц, 1H), 3.33 (d, J = 13.6 Hz, 1H), 3.17 (m, 1H), 2.76 (m, 1H), 2.15 (m, 1H), 2.09 (m, 1H), 1.92 (m, 3H), 1.37 (m, 2H), 1.35 (t, J = 8.0 Гц, 3H), 0.87 (s, 6H); 13C ЯМР (100 МГц, CDCl3) 167.9, 166.8, 134.2, 132.1, 123.6, 66.3, 53.4, 48.4, 47.7, 47.6, 45.2, 37.9, 33.4, 26.3, 20.6, 19.8; IR (KBr) 1785, 1699, 1400, 1298, 1207, 1120, 1085, 1039 см-1; HRMS (ESI+) m/z рассчитано для C25H29F2N2O7S [M+H]+ 539.1663, найдено 539.1657.
Благодарности
Данное исследование выполнено при поддержке Grant-in-Aid for Scientific Research on Innovative Areas “Advanced Molecular Transformations by Organocatalysts” (No. 26105717) и Scientific Research (C) (16K05687) MEXT, Япония. Данное исследование выполнено при поддержке фонда Koyanagi. Авторы также выражают благодарность ЗАО НПО ПиМ-Инвест за предоставление перфторгексил хлорида и Tosoh F Tech Inc. за предоставление трифторметил йодида.
Литература
- Prakash, R. D. In Organofluorine Compounds in Biology and Medicine, Elsevier, 2015, pp 101−132.
- Uneyama, K. Recent Advances in the Synthesis of Fluorinated Amino Acids, In Fluorine in Medicinal Chemistry and Chemical Biology, Ojima, I., Ed.; Wiley-Blackwell: New York, 2009 pp 213−256.
- Bégué, J.-P.; Bonnet-Delpon, D. In Bioorganic and Medicinal Chemistry of Fluorine, John Wiley & Sons: Hoboken, 2008; pp 146−179.
- Welch, J. T.; Eswarakrishnan, S. In Fluorine in Bioorganic Chemisty, John Wiley & Sons: New York, 1991 pp 7−65.
- Peptide-based Drug Discovery: Challenges and New Therapeutics, Thurston, D., Ed.; Royal Society of Chemistry, 2017.
- Peptide Drug Discovery and Development: Translational Research in Academia and Industry, Castanho, M., Santos N. C. Eds.; Wiley-VCH Verlag, 2011
- Yajima, T.; Yamaguchi, K.; Hirokane, R.; Nogami, E. J. Fluor. Chem., 2013, 150, 1−7.
- Yajima, T.; Tonoi, T.; Nagano, H.; Tomita, Y.; Mikami, K. Eur. J. Org. Chem., 2010, 2461−2464.
- Yajima, T.; Nagano, H. Org. Lett., 2007, 9, 2513−2515.
- Fukuzumi, S.; Ohkubo, K. Org. Biomol. Chem., 2014, 12, 6059-6071.
- Romero, B. A.; Nicewicz, D. Chem. Rev., 2016, 116, 10075-10166.
- Hari, D. P.; König, B. Chem. Comm., 2014, 50, 6688-6699.
- Yajima, T.; Ikegami, M. Eur. J. Org. Chem., 2017, 15, 2126-2129.
- Sun, X.; Wang, W.; Li, Y.; Ma, J.; Yu, S., Org. Lett., 2016, 18, 4638−4641.
- Jiang, H.; He, Y.; Chen,Y.; Yu, S. Org. Lett., 2017, 19, 1240−1243.
- Wang, Y.; Wang, J.; Li, G.-X.; He, G.; Chen, G. Org. Lett., 2017, 19, 1442−1445.
- Tiwari, D. P.; Dabral, S.; Wen, J.; Wiesenthal, J.; Terhorst, S.; Balm, C. Org. Lett., 2017, 19, 4295−4298.
Статья рекомендована к публикации членом редколлегии Проф. Norio Shibata
Fluorine Notes, 2018, 121, 1-2


