Поступило в редакцию: Сентябрь 2018
УДК 541.1
Fluorine Notes, 2018, 120, 5-6
Синтез некоторых 1,3-дикетонов тиофенового ряда, содержащих линейные перфторированные заместители
И.В. Тайдаков, Ю.А. Крещенова, Е.А. Долотова
Федеральное государственное бюджетное учреждение науки Физический институт им.П.Н. Лебедева Российской
академии наук
Российская Федерация, 119991, ГСП-1, Москва, Ленинский проспект, д.53.
e-mail:
taidakov@gmail.com
Аннотация: Предложен простой препаративный метод получения 1,3-дикетонов, содержащих 2-тиенильный и линейные перфторированные заместители С5-С8 путем конденсации 2-ацетилтиофена и соответствующих сложных эфиров перфторированных кислот в присутствии NaH в среде тетрагидрофурана. Определены оптимальные условия протекания реакции, обеспечивающие высокие воспроизводимые выходы продуктов.
Ключевые слова: перфторированные 1,3-дикетоны, тиофен, конденсация Кляйзена.
Жирноароматические 1,3-дикетоны, содержащие перфторированные заместители, являются важными исходными соединениями в синтезе координационных соединений d- f-элементов, обладающих многими практически свойствами (способностью к люминесценции, летучестью в вакууме, растворимостью в органических растворителях) [1]. Они широко используются в качестве экстрагентов в процессах разделения продуктов ядерного цикла и редкоземельных элементов [2,3], в аналитической химии [4], а также находят применение в органическом синтезе [5]. Некоторые представители данного класса соединений, такие, как 2-теноилтрифторацетон (НТТА, 4,4,4-трифтор-1-(2-тиенил)-бутандион-1,3), и в меньшей степени, трифторбензоилацетон (HTFBA, 4,4,4-трифтор-1-фенил-бутандион-1,3), являются многотоннажными продуктами, выпускаемыми химической промышленностью и методы их синтеза хорошо разработаны [6].
Рисунок 1.
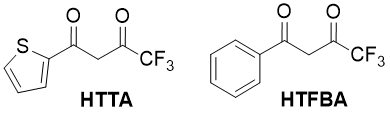
Однако для исследовательских целей значительный интерес представляют соединения, содержащие перфторированные заместители средней длины (3-10 атомов углерода в линейной цепи). В частности, было показано, что умеренное удлинение перфторированного заместителя в ряду 1,3-дикетонов пиразольного ряда приводит к усилению интенсивности люминесценции комплексных соединений европия с такими дикетонами, причем одновременно падает степень кристалличности пленок, полученных из этих соединений, и изменяется их растворимость в органических растворителях [7]. Указанные факторы играют значительную роль при поиске новых материалов для активных слоев органических светоизлучающих диодов (OLED – organic light-emitting diode, ОСИД) и других оптоэлектронных устройств [8].
В рамках работ по поиску новых эффективных люминофоров на основе координационных соединений лантаноидов представлялось интересным синтезировать аналоги хорошо известного лиганда НТТА, имеющие в своем составе более тяжелые перфторированные заместители.
Основным методом синтеза таких дикетонов является конденсация Кляйзена 2-ацетилтиофена со сложными эфирами перфорированных кислот. Для самого 2-теноилтрифторацетона в литературе предложено несколько десятков вариантов проведения конденсации, отличающихся выбором основания, растворителя и реакционных условий. Тем более удивительным представляется тот факт, что для дикетонов, несущих радикалы С2F5 [9] и С3F7 [10], описано всего по одному варианту проведения реакции – с NaOMe в качестве основания в среде диэтилового эфира. Дикетоны, содержащее заместители С4-С8 до настоящего времени не были описаны вовсе.
Схема 1.
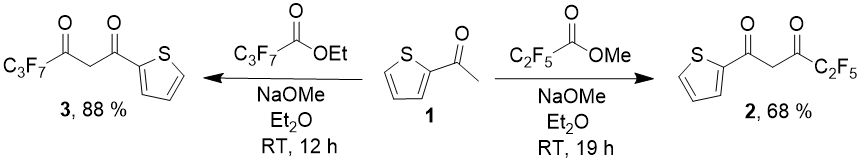
В обоих случаях требуется трудоемкая процедура выделения продукта, включающая перегонку с паром, осаждение медного (для соединения 2) или магниевого (для соединения 3) хелата, их кислотное разложение и последующую вакуумную перегонку целевого соединения.
Нами был предложен метод проведения конденсации метиловых или этиловых сложных эфиров перфторированнх карбоновых кислот в присутствии гидрида натрия в качестве основания в среде безводного тетрагидрофурана (ТГФ). Продукт реакции выделяют одностадийной вакуумной перегонкой.
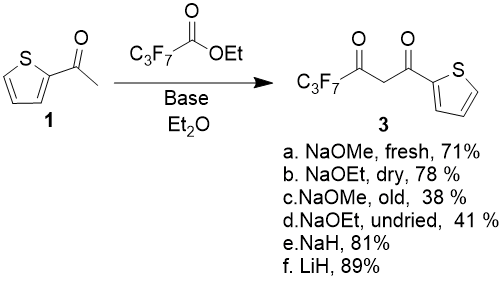
Были протестированы различные основания, прежде всего, этилат и метилат натрия, однако было установлено, что выходы продукта сильно колеблются в зависимости от качества алкоголята.
Так, при конденсации 2-ацетилтиофена с метил 2,2,3,3,4,4,4-гептафторбутаноатом (в качестве модельного соединения) в среде диэтилового эфира максимальные выходы продукта составили 71 и 79 % при использовании коммерческого сухого NaOMe из только что открытой тары и свежеприготовленного NaOEt, предварительно высушенного в вакууме 0,1 торр при 60 °С на протяжении 6 часов, однако тот же метилат натрия, из тары, вскрытой 6 месяцев назад, и этилат натрия, полученный отгонкой из раствора в абсолютном EtOH на роторном испарителе при 60 °С и 10 торр без дополнительной сушки, дают выходы продуктов конденсации 38 и 41 % соответственно. Мольные соотношения кетона, сложного эфира и основания во всех экспериментах было 1:1.05:2, начальная концентрация кетона в растворе 0.2 моль/л, реакцию проводили при температуре 5 °С (2 часа), после чего дополнительно кипятили 5 часов.
Таким образом, явная зависимость выходов реакции от качества применяемого алкоголята и необходимость достаточно трудоемкого приготовления высокоактивного препарата не позволяет рекомендовать его в качестве оптимального основания, по крайней мере, при небольших загрузках реагентов.
Помимо алкоголятов натрия, были также протестированы NaH (60 % дисперсия в минеральном масле) и LiH. В тех же условиях при использовании 2 эквивалентов гидридов были достигнуты выходы продуктов 81 и 89 %, однако гидрид лития существенно дороже, а поэтому не имеет значительных преимуществ. Оптимальным основанием, таким образом, следует считать NaH. Хотя для конденсации теоретически достаточно 1 моль основания, лучшие выходы были достигнуты при использовании не менее 2 моль NaH в расчете на 1 моль кетона. Таким образом достигается полное связывание выделяющегося в процессе конденсации спирта, и кроме того нивелируются погрешности, связанные с непостоянством состава дисперсии гидрида и его частичным разложением в процессе хранения. Дополнительным преимуществом его использования является легкий контроль за ходом реакции по интенсивности выделения водорода.
Схема 2.
Для проведений реакций конденсации с участием гидрида натрия в литературе рекомендуется использовать самые различные растворители, например, циклогесан, толуол, бензол, ксилолы, диэтиловый эфир [11]. Все вышеуказанные растворители имеют общий недостаток - реакционная смесь все время остается гетерогенной, причем по мере выделения натриевого производного дикетона ее вязкость постепенно растет. Как правило, это приводит к невозможности перемешивать реакционную массу, и как следствие, к опасным перегревам, приводящим к снижению выхода продукта. Применение тетрагидрофурана решает данную проблему, поскольку натриевые производные дикетонов в нем хорошо растворимы даже в случае присутствия в молекуле тяжелых перфторированных групп. Кроме того, ТГФ отлично растворяет как 2-ацетилтиофен, так и сложный эфир перфтроркислоты, хотя без растворителя они не всегда смешиваются друг с другом. Таким образом, по мере протекания реакции смесь реагентов становится все менее вязкой, и проблема нарушения теплоотвода не возникает.
Существенным условием достижения высоких выходов дикетонов является режим и порядок смешения реагентов. Нами было установлено, что оптимальным является добавление по каплям раствора обоих компонентов к суспензии NaH в ТГФ, причем температура смеси не должна превышать + 10 °С. На загрузках порядка 100 ммоль исходных для завершения реакции требуется 4-6 часов. Рекомендуемое иногда в литературе кипячение реакционной массы не требуется, более того, в данных условиях оно снижает выход продукта на 20-25 % из-за осмоления.
Схема 3.
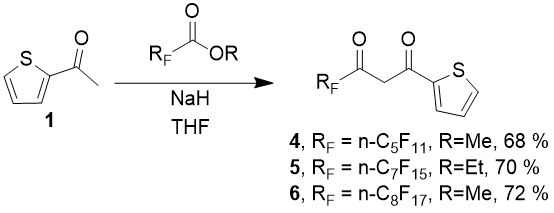
Следует особо отметить, что реакция конденсации при использовании гидридов щелочных металлов является автокаталитической (ускоряется по мере накопления алкоголята натрия в смеси), что может привести к опасным последствиям [12]. Добавление в суспензию гидрида перед началом реакции небольшого количества абсолютного EtOH (порядка 0,2-0,5 мл на 100 ммоль гидрида) устраняет указанную проблему и позволяет гладко провести синтез.
Поскольку по окончании реакции смесь может содержать некоторое количество непрореагировавшего NaH, рационально перед разложением добавить абсолютный этанол в количестве, эквивалентном количеству загруженного NaH. После этого можно безопасно добавлять водный раствор HCl до слабо-кислой среды. Для повышения выхода продута следует избегать перегревов массы, и проводить все операции при температуре не выше + 10 °С.
Выделение продуктов проводят обычным образом, причем из-за высокой кислотности перфторированных дикетонов следует избегать щелочных промывок. Наилучшим способом очистки является перегонка сырого дикетона в вакууме (0,5-1 торр), причем перегонять без разложения удается даже тяжелые дикетоны, так как наличие длинных перфторированных заместителей существенно понижает температуру кипения и повышает летучесть по сравнению с их алифатическими аналогами.
Синтезированные соединения представляют собой светло-желтые или бесцветные кристаллические вещества. Температуры плавления и кипения закономерно возрастают по мере удлинения цепи. Все они были охарактеризованы набором физико-химических методов, состав и чистота также была подтверждена результатами элементного анализа.
По данным 1Н ЯМР в растворах в CDCl3 все три дикетона существуют исключительно в енольной форме. Об этом свидетельствуют уширенные синглеты при 14,9 -15,3 м.д. соответствующие резонансному поглощению протонов ОН-группы енольной формы, а также только один узкий синглет при 6,5 м.д. соответствующий сигналу протонов СН-группы при двойной связи енола. Сигналов, которые можно было бы отнести к резонансному поглощению протонов СН2-группы кетонной формы обнаружить не удается [13]. Спектры 19F ЯМР полностью соответствуют предполагаемым структурам.
Напротив, спектры 13С ЯМР малоинформативны – хотя в них присутствуют четкий сигнал при 180-185 м.д., соответствующий четвертичному атому углерода карбонильной группы, три сигнала в области 136,133, 129 м.д., которые следует отнести к атомам углерода СН-групп тиофенового кольца, и сигнал при 95-97 м.д., несомненно относящиеся к СН-группе при кратной связи енола, остальные четвертичные сигналы имеют слишком низкую интенсивность и высокую мультиплетность за счет многочисленных КССВ атомов углерода и фтора, чтобы их можно было разделить и идентифицировать. Однако они также подтверждают существование только одного (енольного ) таутомера в растворе [14].
Таким образом был разработан удобный препаративный метод получения дикетонов тиофенового ряда, содержащих перфторированные заместители средней длины, и впервые получены с высокими выходами и охарактеризованы три новых представителя этого класса соединений: 4,4,5,5,6,6,7,7,8,8,8 -ундекафтор-1-(2-тиенил)-октандион-1,3 (4), 4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-пентадекафтор-1-(2-тиенил)-декандион-1,3 (5) и 4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафтор-1-(2-тиенил)-ундекандион-1,3 (6).
Экспериментальная часть
Тетрагидрофуран (ч.д.а., Компонент-Реактив, Россия) перегоняют над металлическим натрием в присутствии бензофенона и хранят в атмосфере аргона. Метиловые или этиловые эфиры перфторированных кислот (ЗАО НПО «Пим-Инвест», Россия) выдерживают в течение 7 дней над молекулярными ситами 4Ǻ. Остальные реактивы производства Acros Organics (Бельгия) используют без дополнительной очистки. Гидрид натрия использовался в виде коммерческой 54-60 % суспензии (дисперсии) в вазелиновом масле. Точное содержание NaH не устанавливают.
ЯМР 1H, 19F и 13С спектры были записаны на спектрометре «Bruker AM-300» при 300, 282 и 151 MГц, соответственно при 25°С для растворов в CDCl3. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7,26) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение. Элементный анализ выполнен в Лаборатории микроанализа ИНЭОС РАН.
Общая методика получения 1,3-дикетонов.
К суспензии NaН 2,0 г (50 ммоль, 60 % дисперсия) в 100 мл абсолютного ТНФ в атмосфере Ar при интенсивном перемешивании магнитной мешалкой осторожно добавляют 0,2 мл абс. EtOH, охлаждают в бане со льдом до 0÷5°С, и медленно (2 часа) прикапывают при этой температуре смесь 3,2 г (25 ммоль) 2-ацетилтиофена и 25 ммоль соответствующего метилового или этилового эфира перфторкарбоновой кислоты, растворенных в 40 мл ТГФ. Реакционная смесь постепенно становится розовой, затем коричневой. Прибавление регулируют таким образом, чтобы выделение водорода не было слишком бурным. По окончании реакции смесь перемешивают еще 6 часов при 20÷25°С или оставляют на ночь. Затем смесь охлаждают до 0÷5°С, прикапывают 5 мл абс. EtOH и перемешивают 20 минут. Раствор выливают в делительную воронку, содержащую смесь 100 г измельченного льда и 10 мл конц. НСl и экстрагируют 3*50 мл этилацетата. Объединенные органические экстракты промывают 50 мл насыщ. раствора NaCl, сушат MgSO4 и упаривают в вакууме. Остаток перегоняют при 0,5 торр из колбы Кляйзена без дефлегматора.
4,4,5,5,6,6,7,7,8,8,8 -ундекафтор-1-(2-тиенил)-октандион-1,3 (4)
Светло-желтая кристаллическая масса. Выход – 7,2 г (68 %), т.кип. 92÷95°С/0,5 торр. Найдено (%):C, 34,19; H, 1,22; F, 49,57. C12H5F11O2S. Вычислено (%):C, 34,14; H, 1,19; F, 49,50. ЯМР 1H δ: 15,3 (уш.с., 1H, OH), 7,88 (д, 1Н, J = 3,8 Гц, СHTh), 7,80 (д, 1Н, J = 4,8 Гц, СHTh), 7.23 (т, 1Н, J = 10,1 Гц, СHTh), 6,51 (с, 1Н, СH=); ЯМР 19F δ: -81,61 (c, 3F, CF3), -121,23 (c, 2F, CF2), -123.31 (c, 4F, CF2),-126.97 (c, 2F, CF2).
4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-пентадекафтор-1-(2-тиенил)-декандион-1,3 (5)
Бесцветная кристаллическая масса. Выход – 9,3 г (70 %), т.кип. 122÷124°С/0,5 торр. Найдено (%):C, 32,26; H, 1,05; F, 54,61. C14H5F15O2S. Вычислено (%):C, 32,20; H, 0,97; F, 54,57. ЯМР 1H δ: 14,9 (уш.с., 1H, OH), 7,88 (д, 1Н, J = 3,7 Гц, СHTh), 7,79 (д, 1Н, J = 4,9 Гц, СHTh), 7.23 (т, 1Н, J = 4,5 Гц, СHTh), 6,50 (с, 1Н, СH=); ЯМР 19F δ: -81,65 (c, 3F, CF3), -121,16 (т, 2F, J = 11,3 Гц, CF2), -122.30 (c, 2F, CF2), -122.76 (c, 2F, CF2), -123.10 (c, 2F, CF2) -123.51(c, 2F, CF2), -126.91 (c, 2F, CF2).
4,4,5,5,6,6,7,7,8,8,9,9,10,10,11,11,11-гептадекафтор-1-(2-тиенил)-ундекадион-1,3 (6)
Бесцветная кристаллическая масса. Выход – 10,2 г (72 %), т.кип. 142÷145°С/0,5 торр. Найдено (%):C, 31,54; H, 0,91; F, 56,58. C15H5F17O2S. Вычислено (%): C, 31,48; H, 0,88; F, 56,44. ЯМР 1H δ: 15,0 (уш. с., 1H, OH), 7,88 (д, 1Н, J = 3,7 Гц, СHTh), 7,79 (д, 1Н, J = 4,8 Гц, СHTh), 7.23 (т, 1Н, J = 4,4 Гц, СHTh), 6,51 (с, 1Н, СH=);19F δ: -81,66 (c, 3F, CF3), -121,16 (т, 2F, J = 11,3 Гц, CF2), -122.26 (c, 2F, CF2), -122.64 (c, 4F, CF2), -123.09 (c, 2F, CF2) -123.50(c, 2F, CF2), -126.92 (c, 2F, CF2).
Благодарности
Авторы выражают глубокую признательность компании ЗАО НПО «Пим-Инвест» за любезное предоставление образцов эфиров перфторированных кислот (этил перфторнонаноата, кат. № 0385, метил перфторгексаноата, кат. № 1282 и метил перфтороктаноата, кат. № 1406). Работа была выполнена при частичной финансовой поддержке Российского научного фонда (грант РНФ № 17-72-20088) и Российского фонда фундаментальных исследований (грант РФФИ № 18-02-00653 a).
Литература
- Compr. Coord. Chem. II V.1, 2nd Ed., J. A. McCleverty, T.J. Meyer, 2003 Elsevier Ltd., N.Y., 2003, p. 97.
- A.-S. Chauvin, F. Gumy, I. Matsubayashi, Y. Hasegawa, J.-C. G. Bünzli, Eur. J. Inorg. Chem. 2006, 473–480.
- V. Babain, V. Romanovskii, V. Starchenko, A. Shadrin, G. Kudinov, S. Podoinitsyn, Y. Revenko, J. Nuclear Sci. and Techn., 2002, 39, 267-269.
- Е. Nakamura, Y.Hiruta, T. Watanabe, N. Iwasawa, D.Citterio, K. Suzuki, Anal. Sci., 2015, 31(9), 923-928.
- A. Kel’in, A. Maioli, Current Org. Chem.,2003, 7(18), 1855-1886.
- V. G. Isakova, T. S. Khlebnikova, F. A. Lakhvich, Russ. Chem. Rev., 2010, 79(10), 849 – 879.
- E.A. Varaksina, I.V. Taydakov, S.A. Ambrozevich, A.S. Selyukov, K.A. Lyssenko, L.T. Jesus, R.O. Freire, J. of Lumin., 2018, 196, 161–168.
- I.V.Taydakov, A. A. Akkuzina, R. I. Avetisov, A. V. Khomyakov, R. R. Saifutyarov, I. Ch. Avetissov, J. of Lumin., 2016, 177, 31-39.
- R.A. Moore, R. Levine, J. Org. Chem., 1964, 29, 1439 – 1444.
- L. B. Barkley, R. Levine, JACS, 1951, 73, 4625-4627.
- Organic reactions,V.1, R. Adams, John Wiley & Sons, Inc., N.Y., 1942, p.266.
- Advanced Organic Chemistry, 6th Ed., J. March, M.B. Smith, John Wiley & Sons, Inc., Hoboken, 2007, p.1455.
- A. G. Cook, P. M. Feltman, J. Chem. Educ., 2007, 84 (11), 1827-1829.
- M. P. Sammes, P. N. Maini, Magnet. Res. Chem.,1987, 25, 372-374.
Статья рекомендована к публикации членом редколлегии д.х.н. С.Р. Стерлиным
Fluorine Notes, 2018, 120, 5-6


