Поступило в редакцию: Июль 2018
УДК 547-302+547-304.2+547-316
Fluorine Notes, 2018, 119, 5-6
Модификация аминогруппы полифторированных арилендиаминов в реакциях с альдегидами и хинонами
Т.А. Ваганова, И.П. Чуйков, Е.В. Малыхин*
ФГБУН Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН, 630090, РФ, Новосибирск, проспект акад. Лаврентьева, 9
E-mail: malykhin@nioch.nsc.ru
Аннотация. Найдены условия взаимодействия малореакционноспособных полифторароматических диаминов с бензальдегидом и гексафторнафтохиноном, приводящие к селективному получению функционализированных ариламинов. Выходы моно-N-бензилиденарилендиаминов составляют 30-35 %, полифторариламинонафтохинонов – 50-55 %; продукты охарактеризованы методами ИК, ЯМР 1H и 19F спектроскопии, масс-спектрометрии. Изучены спектральные характеристики соединений в УФ-видимом диапазоне и оценена перспективность использования в качестве сигнальных компонент супрамолекулярных сенсоров.
Ключевые слова: Полифторированные арилендиамины, моно-N-бензилиден-полифтор-арилендиамины, полифторариламинонафтохиноны, хромофоры.
Полигалогенароматические моно- и диамины широко используются как структурные блоки в синтезе высокотехнологичных материалов, фармакологических и агрохимических субстанций [1]. Перспективными материалами для высоких технологий представляются органические со-кристаллы, на основе которых разрабатываются материалы с NLO, фотохромными, магнитными и иными свойствами [2]. Например, эффект обратимой перестройки супрамолекулярной структуры (твердофазного перехода) при внешнем воздействии может быть использован в термо- и фотохромных молекулярных сенсорах и переключателях [3]. Нами была предложена и детально исследована группа новых объектов для инженерии со-кристаллов – ассоциаты полигалогенароматических моно- и диаминов с 18-краун-6, представляющие собой супрамолекулярные водородносвязанные ансамбли [4,5]. При этом для ряда замещенных полифторариламинов обнаружены драматические изменения флуоресцентных характеристик кристаллов, как по интенсивности, так и по длине волны при переходе от свободного амина к ассоциату с 18-краун-6 [5]. Эти эффекты открывают возможность использования супрамолекулярных ансамблей для разработки твердофазных супрамолекулярных хемоспецифических индикаторов и сенсоров, в которых рецепторную и сигнальную функции исполняют два простых органических соединения, соединенные водородной связью. Разрушение межмолекулярной связи при захвате аналита макроциклическим рецептором сопровождается изменением детектируемых характеристик сигнальной группы. Для увеличения чувствительности сенсора актуален поиск сигнальных аминокомпонент, обладающих эффективными хромо- или флуорофорными свойствами.
Рациональным подходом к синтезу функционализированных полигалогенариламинов является модификация одной из аминогрупп в арилендиаминах. Полигалогенированные арилендиамины являются доступными соединениями, поскольку существует технологичный и экономичный способ их синтеза – моно- и бис-аминодефторирование полигалогенаренов ряда бензола, нафталина и пиридина безводным аммиаком, используемым в качестве реагента и растворителя одновременно [6-8]. Наиболее очевидными способами функционализации арилендиаминов по аминогруппе с образованием хромо- и флуорофорных систем, включая сопряженные, представляются реакции с альдегидами и хинонами. Конденсация аминов с альдегидами с образованием альдиминов (N-арилиденанилинов) имеет большой потенциал благодаря возможности широкого варьирования структуры ароматических заместителей при полярной двойной связи C=N, что дает инструмент управления их свойствами. Ароматические альдимины, в том числе, содержащие полифторированные фрагменты, известны как объекты для супрамолекулярных систем, жидкокристаллических сред, молекулярных устройств и пр. [9]. Эффективные хромо- и флуорофоры хиноидного типа могут быть присоединены к аминогруппе путем нуклеофильного замещения атома водорода или галогена [10-14]. Помимо заявленной цели, комбинация аминогруппы, полифторароматического и хинонового фрагментов в структуре молекулы представляет интерес в отношении исследования её биоактивности [10-12]. Целью настоящей работы является исследование возможности синтеза функционализированных полифторариламинов в реакциях арилендиаминов с альдегидами и хинонами.
Результаты и обсуждение
A priori существуют две проблемы, препятствующие препаративному использованию указанных выше реакций: низкая реакционная способность аминогруппы в полифторированных субстратах и необходимость ограничить превращение модификацией одной из двух аминогрупп. Известно, что исчерпывающее фторирование бензольного кольца понижает реакционную способность фенилендиаминов по отношению к ацилирующим агентам в ~10-5 раз в результате суммарного акцепторного эффекта электроотрицательных атомов фтора [15]. По этой причине пентафторанилин не взаимодействует с бензальдегидом в условиях, типичных для нефторированных ариламинов. Для синтеза иминов пентафторанилин реакцией с тионилхлоридом предварительно превращают в N-сульфинилпентафторанилин, который при взаимодействии с ароматическими альдегидами дает нужные продукты с высокими выходами [16]. Однако применимость этого подхода для функционализации одной из двух аминогрупп в арилендиаминах не очевидна. В принципе, взаимодействие пентафторанилина с альдегидами может быть осуществлено при длительном кипячении в безводном растворителе с использованием водоотнимающих агентов (в присутствии MgSO4 в CH2Cl2 [17], молекулярных сит в толуоле [18]), а также при 160 °С без растворителя [19]. Описано также получение N,N’-бис-бензилиденовых производных тетрафтор-мета-фенилендиамина [20]. Примеров модификации арилендиаминов с сохранением одной из аминогрупп в литературе не обнаружено.
Для исследования реакций с бензальдегидом как модельным реагентом выбраны полифторарилендиамины с тремя базовыми типами ароматического остова (схема 1): 2,5-дифтор-1,3-фенилендиамин (1a), 2,6-диамино-3,5-дифторпиридин (2a) и 2,7-диамино-гексафторнафталин (3a). Использованы безводный толуол в качестве растворителя и три типа водоотнимающих агентов – P2O5, MgSO4 и активированные молекулярные сита. Контроль степени превращения осуществляли методом спектроскопии ЯМР 19F. Активность полифторированных субстратов по отношению к бензальдегиду, как и ожидалось, низка: после выдерживания при 110 °С в течение 24 ч в присутствии молекулярных сит в реакционной массе сохраняется от 50% (1a) до 70% (2a и 3a) непрореагировавшего диамина. P2O5 и MgSO4 ускоряют конденсацию, но вызывают значительное осмоление реакционной смеси. Наиболее эффективным и мягким приемом удаления воды является азеотропная отгонка с растворителем; эти условия позволяют достичь полной степени превращения бензальдегида за ~10 ч. Во всех случаях по мере накопления в системе моно-N-бензилиденарилендиамина (соединения 1b, 2b, 3b) свободная аминогруппа в нем подвергается модификации параллельно с аминогруппой в исходном диамине. С увеличением продолжительности реакции увеличивается отношение бис- к мономодифицированным продуктам, независимо от способа удаления воды. Варьирование температуры в интервале 80-110°С также не влияет существенно на селективность реакции.
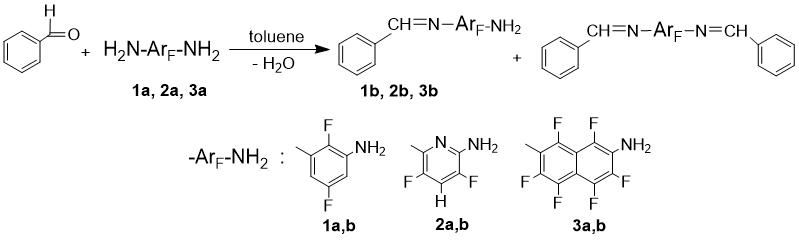
Схема 1. Взаимодействие полифторарилендиаминов с бензальдегидом.
По результатам оптимизации для синтеза моно-N-бензилиденарилендиаминов выбран следующий режим: использование 20% избытка субстрата по отношению к альдегиду, азеотропная отгонка выделяющейся воды с толуолом (растворителем), прекращение реакции при конверсии 60-70 %. После этого непрореагировавший бензальдегид отгоняют с толуолом при пониженном давлении и получают смесь моно- и бис-иминов с исходным диамином (примерное мольное соотношение 5 : 1 : 5 соответственно, по данным ЯМР 19F и ГХ-МС). Благодаря значительному различию полярности этих соединений, целевой моно-N-бензилиденарилендиамин может быть выделен хроматографически с использованием смеси безводных элюентов гексан+диэтиловый эфир с градиентом полярности 12÷5 : 1 соответственно. Первые фракции элюата содержат следовое количество бензальдегида и бис-имин, промежуточные – смесь бис- и моноиминов, далее элюируется практически чистый моноимин, наиболее полярный диамин выделяют диэтиловым эфиром. Таким способом удается получить моно-N-бензилиденарилендиамины 1b, 2b, 3b (Схема 1) с выходом ~30% (см. экспериментальную часть). Соединения синтезированы впервые и охарактеризованы набором спектральных методов. Следует отметить, что полученные имины чувствительны к влаге воздуха и остаточной влаге в растворителях. При исследовании оптических характеристик веществ в УФ-видимом диапазоне (растворы в ацетонитриле, с = 10-4 М) в спектрах регистрируются малоинтенсивные полосы поглощения соответствующих диаминов, увеличивающиеся при стоянии раствора, что вызвано, скорее всего, гидролизом иминной функции. По этой причине спектральные характеристики моно-N-бензилиденарилендиаминов 1b, 2b, 3b получены вычитанием спектров исходных диаминов из спектров экспериментальных образцов. Точное соотношение соединений в растворах удалось определить не во всех случаях, поэтому в качестве показателя интенсивности полос поглощения в УФ-спектрах иминов 1b и 3b приведены оптические плотности. Из полученных данных следует, что моно-N-бензилиденарилендиамины 1b, 2b, 3b имеют полосы поглощения в более длинноволновой области, чем исходные диамины (различие λmax составляет 40-80 нм, спектральные характеристики представлены в экспериментальной части), что является следствием увеличения длины сопряженной системы. Таким образом, в модельной реакции показано, что предложенный способ модификации полифторированных арилендиаминов может быть использован для синтеза аминосодержащих хромофоров в видимом диапазоне.
Взаимодействие нефторированных ариламинов с бензохиноном осуществляется в метаноле при комнатной температуре и приводит к образованию 2,5-бис-аминопроизводных с высокими выходами [10]. Еще быстрее протекает замещение галогенов в полигалогенированных (Hal = Cl, F) бензо- и нафтохинонах различными незаряженными нуклеофилами – аминами, спиртами, тиоспиртами [11, 13]. Нами в качестве нуклеофилов использованы полифторированные арилендиамины с различным остовом и степенью фторирования: 2,5-дифтор-1,3-фенилендиамин (1a), 2,7-диаминогексафторнафталин (3a), 2,4,5-трифтор-1,3-фенилендиамин (4a), 4-хлор-трифтор-1,3-фенилендиамин (5a) и 2,4-диаминотрифторпиридин (6a). Установлено, что пара-бензохинон не взаимодействует с этими диаминами даже при кипячении в толуоле в течение 72 ч; возвращаются исходные соединения. Гексафтор-1,4-нафтохинон (7) также не образует продуктов замещения при действии полностью галогенированных диаминов 3a, 5a, 6a в тетрагидрофуране при нагревании. Добавление триэтиламина как связующего агента для HF не влияет на результат. За сутки в этих условиях происходит полное разрушение нафтохинона 7 при сохранении диаминов. В отличие от этого, более нуклеофильные соединения 1a и 4a, в которых одно из орто-положений к аминогруппе не занято атомом фтора, реагируют с нафтохиноном 7 в присутствии NEt3 в ТГФ при 45-50 °С в атмосфере аргона с образованием полифторариламинонафтохинонов 1c и 4c (схема 2). Наибольший выход продуктов наблюдается при продолжительности реакции 20 ч. Следует отметить, что это превращение, в отличие от реакции с бензальдегидом, протекает селективно по одной аминогруппе; полифторированные бис-хиноновые производные арилендиаминов не были зафиксированы. Изомерная селективность в реакции несимметричного фенилендиамина 4a также высока, модификации подвергается только аминогруппа, имеющая в орто-положении атом водорода. Впервые синтезированные соединения 1c и 4c выделены хроматографически с выходами 50-60 % и охарактеризованы спектральными методами.
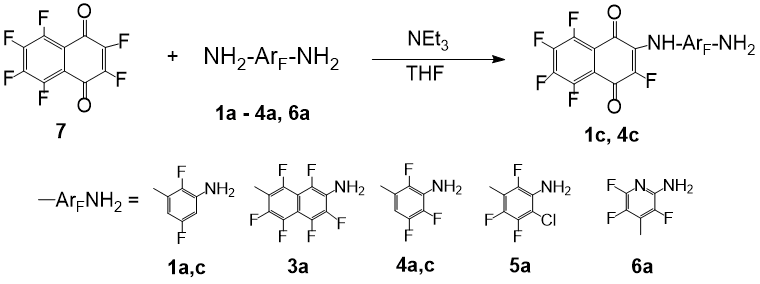
Схема 2. Взаимодействие полифторарилендиаминов с гексафторнафтохиноном.
Соединения 1c и 4c, содержащие пентафторнафтохиноновый фрагмент, окрашены в цвет бордо, окраска их концентрированных растворов в ТГФ переходит в темно-оранжевую при разбавлении на ~3 порядка. Спектры поглощения этих соединений в УФ-видимом диапазоне отличаются от спектров диаминов 1a, 4a и хинона 7. В спектрах полифтораминонафтохинонов 1c и 4c появляется новый максимум поглощения при 455-460 нм, который находится в более длинноволновой области по сравнению с характеристиками исходных соединений (различие λmax составляет ~110 нм). Это свидетельствует о взаимодействии неподеленной пары электронов на атоме азота с π-системами хинонового и бензольного фрагментов. Таким образом, реакция частично фторированных арилендиаминов с нафтохиноном 7 является приемлемым методом синтеза биполярных хромофоров с длинной цепью сопряжения.
Изложенные результаты свидетельствуют, что реакции с альдегидами и полифторхинонами могут быть использованы для модификации одной из аминогрупп в малореакционноспособных полифторарилендиаминах с образованием хромо- и флуорофорных систем. Выходы целевых продуктов в реакциях с бензальдегидом составляют 30-35 %, а в реакциях гексафторнафтохинона с полифторфенилендиаминами, не содержащими атом фтора в орто-положении к аминогруппе – 50-55 %. Полифторированные ариламинонафтохиноны типа 1с и 4с являются перспективными сигнальными компонентами супрамолекулярных сенсоров, поскольку неподеленные пары электронов на атомах азота аминогрупп обеспечивают формирование биполярного хромофора с протяженной π-системой и, соответственно, передачу электронных эффектов при образовании/разрушении ассоциатов с макроциклическим рецептором. Возможность использования моно-N-бензилиден-арилендиаминов 1b, 2b, 3b для создания супрамолекулярных объектов ограничена их высокой чувствительностью к влаге. Тем не менее, этот метод в принципе продуктивен для получения сопряженных хромо- и флуорофорных полифторариламинов. Для развития этого синтетического подхода необходим поиск таких пар реагентов (диаминов и альдегидов), которые обеспечат образование относительно устойчивых альдиминов.
Экспериментальная часть
Спектры ЯМР 1H и 19F регистрировали на приборе Bruker АV-300 (300.13 и 282.36 МГц, соответственно), в качестве внутреннего стандарта использовали сигналы остаточных протонов дейтерорастворителя относительно ТМС (δ = 0 м.д.) и С6F6 (δ = 0 м.д.) соответственно. ИК спектры регистрировали на приборе Bruker Tensor 27 для образцов в таблетках с KBr. УФ-видимые спектры регистрировали на спектрометре Varian Cary 5000 для растворов образцов в ацетонитриле. Регистрацию масс-спектров и определение точных значений масс молекулярных ионов осуществляли на приборе Thermo Scientific DFS, ЭУ, 70 эВ. ГХ-МС анализ проводили с использованием комплекса HP G1081A, включающего хроматограф НР 5890 серии II и масс-селективный детектор НР 5971(ЭУ, 70 эВ); капиллярная колонка HP5 (5% бифенила и 95% диметилсилоксана), 30 м×0.25 мм×0.25 мкм; газ-носитель – He, 1 мл мин-1; режим программирования температуры: 50 ºС (2 мин), нагревание со скоростью 10 ºС мин-1 до 280 ºС (5 мин); температура испарителя 280 ºС; температура источника ионов 173 ºС; данные собирали со скоростью 1.2 скан с-1 в диапазоне 30 - 650 а.е.м.
Толуол осушали кипячением над CaCl2 с последующей перегонкой. Тетрагидрофуран абсолютировали кипячением над натриевой солью кетила бензофенона с последующей перегонкой. Коммерческие бензальдегид и триэтиламин очищали перегонкой. Оптически чистый ацетонитрил осушен над CaH2 и перегнан перед регистрацией УФ спектров. 2,6-Диамино-3,5-дифторпиридин (2a), 2,4,5-трифтор-1,3-фенилендиамин (4a), 2,4-диамино-3,5,6-трифторпиридин (6a) синтезировали по методике [6], 2,7-диаминогексафторнафталин (3a) – по методике [7], 2,5-дифтор-1,3-фенилендиамин (1a) и 2,4,5-трифтор-6-хлор-1,3-фенилендиамин (5a) – по методике [8], гексафтор-1,4-нафтохинон (7) – по методике [21]; точки плавления и спектры ЯМР соединений соответствовали приведенным в литературе. УФ-видимые спектры, λmax/нм (logε): 1a 245 (4.0), 279 (3.0); 2a 227 (3.8), 319 (3.9); 3a 219 (4.2), 252 (4.9), 290 (3.6); 4a 205 (4.3), 230 (3.7), 283 (2.8). УФ-видимый спектр соединения 7 в хлороформе, λmax/нм (logε): 246 (3.9), 260 (4.2), 268 (4.2), 343 (3.3) [22].
Взаимодействие полифторированных арилендиаминов с бензальдегидом (типовая методика). Полифторарилендиамин (2.4 ммоля) растворяли в толуоле (8-10 мл), при перемешивании добавляли бензальдегид (0.21 г, 2 ммоля). Смесь перемешивали при 120 °С в течение 4-6 ч, отгоняя воду азеотропно с растворителем. Реакцию прекращали по достижении конверсии арилендиамина 55-60 % (по данным ЯМР 19F). Толуол и непрореагировавший бензальдегид отгоняли при пониженном давлении. Продукт выделяли колоночной хроматографией на силикагеле с использованием смеси безводных элюентов с варьируемой полярностью (гексан-диэтиловый эфир = 12÷5 : 1).
N1-бензилиден-2,5-дифтор-1,3-фенилендиамин (1b) синтезирован из диамина 1a (0.35 г), выход 0.15 г (32%). Масло желтого цвета. УФ-видимый спектр, λmax/нм (logε): (D): 261 (0.47), 315 (0.21). Спектр ЯМР 1Н, хлороформ-d, δ/м.д., J/Гц: 5.06 (уш.с, 2Н, NH2), 6.28 (ддд, 1Н, Н4, JFH = 10, JFH = 6, JHH = 3), 6.52 (ддд, 1Н, Н6, JFH = 9, JFH = 6, JHH = 3), 7.48-7.57 (м, 3H, H3’, H5’, H4’), 8.0 (м, 2H, H2’, H6’), 8.57 (уш.с, 1H, C=H). Спектр ЯМР 19F, хлороформ-d, δ/м.д., J/Гц: 8.5 (ддд, 1F, F2, JFF = 13, JFH = 6, JFH = 6), 44.5 (ддд, 1F, F5, JFF = 13, JFH = 10, JFH = 9). Найдено: m/z 232.0816 [M]+. C13H10N2F2. Вычислено: М = 232.0812.
N2-бензилиден-3,5-дифтор-2,6-диаминопиридин (2b) синтезирован из диамина 2a (0.35 г), выход 0.17 г (37%). Вязкая масса оранжевого цвета, стеклующаяся при стоянии. УФ-видимый спектр, λmax/нм (logε): 268 (4.1), 358 (3.9). Спектр ЯМР 1Н, хлороформ-d, δ/м.д., J/Гц: 4.49 (уш.с, 2Н, NH2), 7.21 (дд, 1Н, Н4, JFH ~9), 7.45-7.51 (м, 3H, H3’, H5’, H4’), 7.97 (м, 2H, H2’, H6’), 9.08 (уш.с, 1H, C=H). Спектр ЯМР 19F, хлороформ-d, δ/м.д., J/Гц: 22.5, 24.9 (оба д, по 1F, F3 и F5, JFH ~9). Найдено: m/z 233.0771 [M]+. C12H9N3F2. Вычислено: М = 233.0764.
N2-бензилиденгексафтор-2,7-диаминонафталин (3b) синтезирован из диамина 3a (0.64 г), выход 0.20 г (29%). Легкоплавкий порошок желто-оранжевого цвета. УФ-видимый спектр, λmax/нм (logε): (D): 266 (0.43), 328 (0.13). Спектр ЯМР 1Н, хлороформ-d, δ/м.д., J/Гц: 4.14 (уш.с, 2Н, NH2), 7.47-7.55 (м, 3H, H3’, H5’, H4’), 7.95 (м, 2H, H2’, H6’), 8.65 (уш.с, 1H, C=H). Спектр ЯМР 19F, хлороформ-d, δ/м.д., J/Гц: 8.9 (м, 1F, F6), 10.4 (м, 1F, F3), 11.4 (м, 2F, F4, F5), 16.5 (дм, 1F, F8, JFF = 66), 23.4 (дм, 1F, F1, JFF = 66). Найдено: m/z 354.0589 [M]+. C17H8N2F6. Вычислено: М = 354.0592.
Взаимодействие полифторированных арилендиаминов с гексафтор-1,4-нафтохиноном (типовая методика). Арилендиамин (1 ммоль) растворяли в тетрагидрофуране (5-7 мл), при перемешивании добавляли хинон 7 (0.27 г, 1 ммоль), после растворения которого по каплям добавляли триэтиламин (0.10 г, 1 ммоль). Смесь перемешивали при 45-50 °С в атмосфере аргона в течение 20 ч. К полученной массе добавляли воду (20 мл), экстрагировали диэтиловым эфиром (3х20 мл), объединенный эфирный экстракт промывали водой и сушили над MgSO4, эфир отгоняли при пониженном давлении. Продукт выделяли колоночной хроматографией на силикагеле, элюент гексан-диэтиловый эфир (5:1).
2- (3’- амино- 2’, 5’- дифторфениламино)- пентафтор- 1, 4- дигидро-нафталин-1,4-дион (1c) синтезирован из диамина 1a (0.14 г), выход 0.22 г (57%). Т.пл. 198-201 °С. УФ-видимый спектр, λmax/нм (logε): 228 (4.4), 270 (4.3), 333 (3.6), 453 (3.5). ИК-спектр, ν/см-1: 3462, 3371, 3232 (N-H), 3086 (Сaр-Н), 1682 (C=O). Спектр ЯМР 1Н, ацетон-d6, δ/м.д., J/Гц: 5.12 (уш.с, 2Н, NH2), 6.32 (ддд, 1Н, Н4', JFH = 9, JFH = 6, JHH = 3), 6.48 (ддд, 1Н, Н6', JFH = 10, JFH = 7, JHH = 3), 7.93 (уш.с, 1Н, NH). Спектр ЯМР 19F, ацетон-d6, δ/м.д., J/Гц: 11.6 (ддд, 1F, F2’, JFF = 12, JFH = 7, JFH = 6), 15.0, 17.8 (оба м, по 1F, F6, F7), 21.7 (уш.с, 1F, F2), 23.4, 25.0 (оба м, по 1F, F5, F8), 44.4 (ддд, 1F, F5', JFF = 12, JFH = 10, JFH = 9). Найдено: m/z 390.0232 [M]+. C16H5O2N2F7. Вычислено: М = 390.0234.
2- (3’- амино- 2’, 4’,5’- трифторфениламино)- пентафтор- 1, 4-дигидро-нафталин-1,4-дион (4c) синтезирован из диамина 4a (0.16 г), выход 0.21 г (52%). Т.пл. 179-180 °С. УФ-видимый спектр, λmax/нм (logε): 228 (4.4), 269 (4.4), 335 (3.6), 457 (3.6). ИК-спектр, ν/см-1: 3417, 3367, 3259 (NH2), 3081 (Сaр-Н), 1691 (C=O). Спектр ЯМР 1Н, ацетон-d6, δ/м.д., J/Гц: 5.22 (уш.с, 2Н, NH2), 6.58 (ддд, 1Н, Н6', JFH = 11, JFH ~8, JFH ~8), 7.97 (уш.с, 1Н, NH). Спектр ЯМР 19F, ацетон-d6, δ/м.д., J/Гц: 4.1 (ддд, 1F, F4’, JFF = 21, JFF = 11, JFH = 8), 15.0, 17.9 (оба м, по 1F, F6, F7), 17.6 (ддд, 1F, F2', JFF ~11, JFF ~11, JFH = 8), 18.9 (ддд, 1F, F5', JFF = 21, JFF ~11, JFH ~11), 19.8 (уш.с, 1F, F2), 23.4, 25.0 (оба м, по 1F, F5, F8). Найдено: m/z 408.0145 [M]+. C16H4O2N2F8. Вычислено: М = 408.0140.
Аналитические и спектральные исследования выполнены в Химическом исследовательском центре коллективного пользования СО РАН.
Список литературы
- Wozniak A.I., Yegorov A.S., Ivanov, V.S., Igumnov S.M., Tcarkova K.V. Recent progress in synthesis of fluorine containing monomers for polyimides // J. Fluorine Chem. 2015, vol. 180, p. 45–54; Fujiwara, T., O’Hagan, D. Successful fluorine-containing herbicide agrochemicals // J. Fluorine Chem. 2014, V.167, p. 16–29; Muller, K., Faeh, C., Diederich, F. Fluorine in Pharmaceuticals: Looking Beyond Intuition // Science 2007, V. 317, p. 1881–1886.
- Ostrowska, M., Fritsky, I.O., Gumienna-Kontecka, E., Pavlishchuk, A.V. Metallacrown-based compounds: Applications in catalysis, luminescence, molecular magnetism, and adsorption // Coord. Chem. Rev. 2016, vol. 327-328, p. 304-332; Lacroix, P.G., Malfant, I., Lepetit, C. // Second-order nonlinear optics in coordination chemistry: An opendoor towards multi-functional materials and molecular switches // Coord. Chem. Rev. 2016, vol. 308, p. 381–394; Braga, D., Grepioni, F., Maini, L., d’Agostino, S. Making crystals with a purpose; a journey in crystal engineering at the University of Bologna. IUCrJ 2017, vol. 4, p. 369–379; Busseron, E., Ruff, Y., Moulin, E., Giuseppone, N. Supramolecular self-assemblies as functional nanomaterials // Nanoscale 2013, vol. 5, p. 7098–7140; Chi, Z., Zhang, X., Xu, B., Zhou, X., Ma, C., Zhang, Y., Liu, S., Xu, J. Recent advances in organic mechanofluorochromic materials // Chem. Soc. Rev. 2012, vol. 41, p. 3878−3896.
- Yuan, M.-S., Wang, D.-E., Xue, P., Wang, W., Wang, J.-C., Tu, Q., Liu, Z., Liu, Y., Zhang, Y., Wang, J. Fluorenone Organic Crystals: Two-Color Luminescence Switching and Reversible Phase Transformations between π−π Stacking-Directed Packing and Hydrogen Bond-Directed Packing // Chem. Mater. 2014, vol. 26, p. 2467−2477; Ushakov, E.N., Martyanov, T.P., Vedernikov, A.I., Pikalov, O.V., Efremova, A.A., Kuz'mina, L.G., Howard, J.A.K., Alfimov, M.V., Gromov, S.P. Self-assembly through hydrogen bonding and photochemical properties of supramolecular complexes of bis(18-crown-6)stilbene with alkanediammonium ions // J. Photochem. Photobiol. A – Chem. 2017, vol. 340, p. 80−87; Hinoue, T., Miyata, M., Hisaki, I., Tohnai, N. Guest-Responsive Fluorescence of Inclusion Crystals with p-Stacked Supramolecular Beads // Angew. Chem. Int. Ed. 2012, vol. 51, p. 155–158.
- Ваганова, Т.А., Гатилов, Ю.В., Малыхин Е.В. Кристаллические ассоциаты 18-краун-6 и полифторарилендиаминов: строение, свойства, селективность образования // Изв. АН. Сер. хим. 2007, c. 1746-1756 [Vaganova, T.A., Gatilov, Yu.V., Malykhin, E.V. Crystal associates of 18-crown-6 and polyfluoro(het)arylenediamines: structure, properties, and selectivity of formation // Russ. Chem. Bull. Int. Ed. 2015, vol. 64, p. 1746−1756]; Vaganova, T.A., Gatilov, Yu.V., Malykhin, S.E., Pishchur, D.P., Larichev, Yu.V., Rodionov, V.I., Malykhin, E.V. Design and supramolecular structure of crystal associates of polyfluoroarylenediamines and 18-crown-6 (2:1) // J. Mol. Struct. 2017, vol. 1133, p. 122–134.
- Vaganova, T.A., Gatilov, Yu.V., Pishchur, D.P., Chuikov, I.P., Malykhin, E.V. Controlled self-assembly of π-stacked/H-bonded 1D crystal structures from polyfluorinated arylamines and 18-crown-6 (2 : 1). Associate vs. co-former fluorescence properties // CrystEngComm 2018, vol. 20, 807–817.
- Ваганова, Т.А., Кусов, С.З., Родионов, В.И., Шундрина, И.К., Малыхин, Е.В. Селективное моно- и диаминирование полифторированных производных бензола и пиридина жидким аммиаком // Изв. АН. Сер. хим. 2007, c. 2163–2170 [Vaganova, T.A., Kusov, S.Z., Rodionov, V.I., Shundrina, I.K., Malykhin, E.V. Selective mono- and diamination of polyfluorinated benzenes and pyridines with liquid ammonia // Russ. Chem. Bull. Int. Ed., vol. 56, p. 2239–2246].
- Vaganova, T.A., Kusov, S.Z., Rodionov, V.I., Shundrina, I.K., Sal’nikov, G.E., Mamatyuk, V.I., Malykhin, E.V. Amination of octafluoronaphthalene in liquid ammonia. 2,6- and 2,7-Diaminohexafluoronaphthalenes selective preparation // J. Fluorine Chem. 2008, vol. 129, p. 253–260.
- Rodionov, V.I., Vaganova, T.A., Malykhin, E.V. Selective mono- and diamination of some poly-halogenbenzenes in anhydrous ammonia // J. Fluorine Chem. 2015, vol. 180, p. 98–102.
- Moussallem, C., Allain, M., Mallet, C., Gohier, F., Frère, P. Fluorine–fluorine type II versus πF–π stacking interactions in the supramolecular organizations of extended thiophene derivatives end capped by imino-perfluorophenyl units // J. Fluorine Chem. 2015, vol. 178, 34–39; Yeap, G.Y., Ha, S.T., Boey, P.L., Mahmood, W. A. K., Ito, M. M., Youhei, Y. Synthesis and characterization of some new mesogenic schief base esters N-[4-(4-n-hexadecanoyloxybenzoyloxy)-benzylidene]-4-substituted anilines // Mol. Cryst. Liq. Cryst. 2006, vol. 452, p. 73–90; Collings, P.J., Hird, M. Introduction to Liquid Crystals Chemistry and Physics // Philadelphia, Taylor & Francis Ltd, 1997, 298 p.; Bilgin-Eran, B., Yörür, Ç., Tschierske, C., Prehm, M., Baumeister, U. Liquid crystals based on semiperfluorinated imines and salicylaldimato metal complexes. A comparative study of alkyl, alkoxy and polyether substituents // J. Mater. Chem. 2007, vol. 17, p. 2319–2328; Zhu, S., Zhu, S., Jin, G., Li, Z. Strong phenyl–perfluorophenyl π–π stacking and C–H···F–C hydrogen bonding interactions in the crystals of the corresponding aromatic aldimines // Tetrahedron Lett. 2005, vol. 46, p. 2713–2716.
- Nain-Perez, A., Barbosa, L.C.A., Picanco, M.C., Giberti, S., Forlani, G. Amino-substituted para-Benzoquinones as Potential Herbicides // Chem. Biodiversity 2016, 13(8), 1008–1017.
- Горюнов, Л.И., Трошкова, Н.М., Невинский, Г.А., Штейнгарц, В.Д. Синтез производных 2-амино-пентафтор-1,4-нафтохинона // Журн. орг. химии 2009, т. 45, с. 851–856 [Goryunov, L.I., Troshkova, N.M., Nevinskii, G.A., Shteingarts, V.D. Synthesis of 2-Aminopentafluoro-1,4-naphthoquinone Derivatives // Russ. J. Org. Chemistry, 2009, vol. 45, p. 835–841].
- Barbosa, L.C.A., Pereira, U.A., Maltha, C.R.A., Teixeira, R.R., Moreira Valente, V.M., Oliveira Ferreira, J.R., Costa-Lotufo, L. V., Moraes, M.O., Pessoa, C. Synthesis and Biological Evaluation of 2,5-Bis(alkylamino)-1,4-benzoquinones // Molecules 2010, vol. 15, p. 5629–5643; Park, H., Carr, B.I., Li, M., Ham, S.W. Fluorinated NSC as a Cdc25 inhibitor // Bioorg. Med. Chem. Lett. 2007, vol. 17, p. 2351–2354.
- The Quinonoid Compounds (1988): Part 1, vol. 1. Editors(s): Patai, S., Rappoport, Z. John Wiley & Sons Ltd. 1988, 878 p. DOI:10.1002/9780470772119.
- Bayen, S., Barooah, N., Sarma, R. J., Sen, T. K., Karmakar, A., Baruah, J.B. Synthesis, structure and electrochemical properties of 2,5-bis(alkyl/arylamino)1,4-benzoquinones and 2-arylamino-1,4-naphthoquinones// Dyes Pigm. 2007, vol. 75, p. 770–775.
- Ando, S., Matsuura, T., Sasaki, S. in Hougham G. (Ed), Fluoropolymers 2: Properties // New York, Kluwer Academic/Plenum Publishers, 1999, p. 277–303.
- Li, A., Bin, X., Zhu, S. Synthesis of N-pentafluorophenyl aromatic aldimines C6F5N= CHAr and an X-ray structure analysis of N-pentafluorophenyl-4-methylphenyl aldimine, C6F5N=CHC6H4CH3-4 // J. Fluor. Chem. 1994, vol. 68, p. 145–148.
- Sasaki, I., Amou, T., Ito, H., Ishiyama, T., Iridium-catalyzed ortho-C–H borylation of aromatic aldimines derived from pentafluoroaniline with bis(pinacolate)diboron // Org. Biomol. Chem. 2014, vol. 12, p. 2041-2044.
- Casey, C.P., Johnson, J.B. Isomerization and Deuterium Scrambling Evidence for a Change in the Rate-Limiting Step during Imine Hydrogenation by Shvo's Hydroxycyclopentadienyl Ruthenium Hydride // J. Am. Chem. Soc. 2005, vol. 127, p. 1883–1894.
- Герасимова, Т.Н., Семиколенова, Н.В., Фокин, Е.П. Некоторые превращения полизамещенных N-бензилиденанилинов // Изв. СО АН СССР, сер. хим. наук 1977, т. 2, с. 142–145 [Gerasimowa, T.N., Semikolenova, N.V.; Fokin, E.P. Some reactions of polyfluoro-substituted N-benzylidenanilines // Izv. SO AN SSSR, Ser. Khim. Nauk 1977, vol. 2; p. 142–145 (in Russian)]. CA 1977, 87:134160.
- Мурза, M.M.; Татауров, Г.П., Попова, Л.И., Светкин Ю.В. Фторсодержащие ароматические азометины // Журн. орг. химии 1977, т. 13, c. 1046–1047 [Murza, M.M.; Tataurov, G.P.; Popova, L.I.; Svetkin, Yu.V. Liquid-crystalline substances. Fluorine-containing aromatic azomethines // J. Org. Chemistry USSR (English Translation) 1977, vol. 13, p. 961]. CA 1977, vol. 87, 134286.
- Bogachev, A.A., Kobrina, L.S., Yakobson, G G. The interaction of polyfluoroaromatic compounds with oxygen containing radicals // J. Fluorine Chem. 1985, vol. 29, p. 143.
- Якобсон, Г.Г., Штейнгарц, В.Д., Ворожцов-мл., Н.Н. О взаимодействии октафторнафталина с азотной кислотой // Журн. Всесоюз. хим. о-ва им. Д.И.Менделеева 1964, т. 9, с.702–704 [Yakobson, G.G., Shteigarts, V.D., Vorozhtsov-Jr, N.N. Reaction of octafluoronaphthalene with nitric acid // Zhurn. Vsesoyuz. Khim. O-va im. D.I. Mendeleeva 1964, vol. 9, N 6, p. 702–704 (in Russian)]. CA. 1965, vol. 62, 9078b
Статья рекомендована к публикации членом редколлегии д.х.н. В.Е. Платоновым
Fluorine Notes, 2018, 119, 5-6


