Поступило в редакцию: Июль 2018
УДК 547.825
Fluorine Notes, 2018, 119, 3-4
Синтез и строение 4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила
Бурый Д.С.1, Аксенов Н.А.2, Доценко В.В.1,2
1Кубанский государственный университет, ул. Ставропольская 149, 350040 Краснодар, Российская Федерация
2Северо-Кавказский федеральный университет, ул. Пушкина 1, 355009 Ставрополь, Российская Федерация
e-mail: victor_dotsenko_@mail.ru
Аннотация: Реакция Гуарески-Торпа между 1,1,5,5-тетрафторацетилацетоном и цианотиоацетамидом приводит к образованию 4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила. Строение продукта изучено методами ЯМР и РСА.
Ключевые слова: 1,1,5,5-тетрафторацетилацетон, цианотиоацетамид, синтез пиридинов по Гуарески-Торпу, рентгеноструктурный анализ.
Фторсодержащие азагетероциклы зарекомендовали себя как класс соединений, представляющих большой практический интерес. Так, пиридины и их конденсированные аналоги, имеющие фторсодержащую боковую цепь, проявили себя в качестве хороших микробицидов [1], сильных анальгетиков [2], противовирусных агентов [3], ингибиторов тирозинкиназы c-Src для терапии рака [4] и т. д. Также фторсодержащие пиридины были использованы в качестве прекурсоров для азокрасителей тиено[2,3-b]пиридинового ряда, пригодных для окрашивания полиэфирных волокон [5]. В общем случае, фторсодержащие гетероциклы могут быть легко получены либо реакцией фторсодержащих 1,3-дикарбонильных соединений с динуклеофильными агентами [6], либо через реакции замещения/конденсации с участием полифторалкенов [7]. Одним из наиболее удобных и общих подходов к (фторалкил)замещенным пиридинам является циклизация Гуарески-Торпа между фторсодержащими 1,3-дикарбонильными соединениями (или их скрытыми аналогами) и метиленактивными амидами, тио- и селеноамидами [1,8-13].
Схема 1
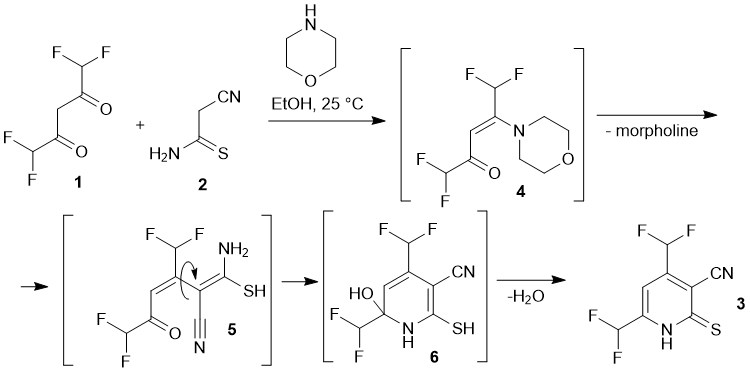
Тем не менее, область применения данной реакции ограничена в основном использованием 1,3-дикетонов и кетоэфиров, несущих трифторметильные заместители. Эти соображения побудили нас провести дополнительные исследования с другими фторированными дикетонами, с целью расширить ряд (фторалкил)замещенных пиридинов. Последние предполагется использовать в качестве прекурсоров для синтеза новых фторсодержащих азинов. В данной работе описано взаимодействие между 1,1,5,5-тетрафторацетилацетоном 1 и цианотиоацетамидом 2. Мы обнаружили, что реакция протекает в мягких условиях в присутствии каталитических количеств вторичного амина, с образованием 4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила 3 с умеренным выходом (Схема 1). Предположительно, реакция протекает через стадии образования невыделяемых промежуточных продуктов 4-6. Пиридин 3 был получен в виде крупных красно-оранжевых кристаллов, нерастворимых в воде, умеренно растворимых в холодном EtOH (и легко – в горячем спирте), также растворимых в ацетоне, ДМФА и ДМСО. Структура соединения 3 была изучена с помощью методов ЯМР-спектроскопии (1H, 13C DEPTQ, 19F, 1H–13C HSQC, 1H–13C HMBC), а также рентгеноструктурного анализа (Рис. 1).
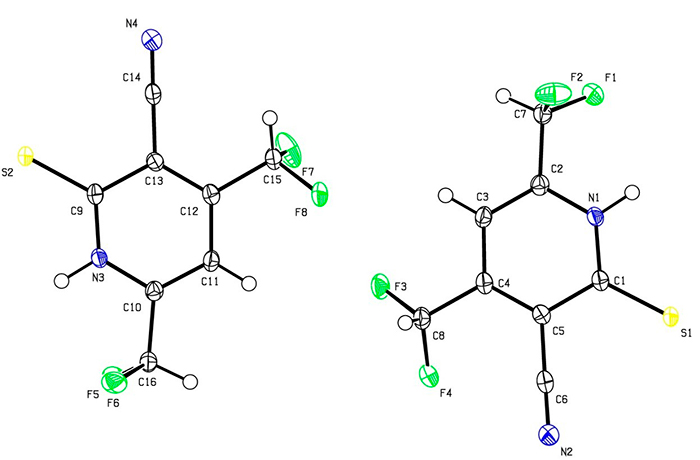
Рисунок 1. Строение 4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила 3 (данные РСА)
Как данные РСА, так и данные ИК-спектроскопии указывают на то, что в твердом состоянии соединение 3 существует в виде тиоксо-таутомера. Так, в ИК-спектре обнаруживаются полосы поглощения при 3175, 3096 см-1 (ν N-H) и 1231 см-1 (C=S), наряду с характерными колебаниями группы C≡N (ν = 2230 см-1) и очень сильными полосами при 1096 и 1045 см-1, соответствующими колебаниям групп CHF2. Однако, ЯМР спектры соединения 3 обнаруживают удвоенный набор сигналов, предположительно вследствие таутомерного равновесия, существующего в растворе между тиоксо-формой 3 и меркапто-формой 3А (Схема 2).
Схема 2
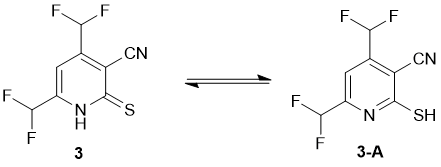
В спектре ЯМР 1H отсутствует сигнал, относящийся к протону NH в ожидаемом интервале δ 12.0-14.0 м.д., вероятно, вследствие дейтерообмена. Вместо этого наблюдаются два сигнала для протона H-5 в виде синглетов при δ 7.81 и δ 8.13 м.д. с отношением интегральных интенсивностей ~ 8: 1. Сигналы групп СHF2 проявляются как две пары триплетов с константами спин-спинового взаимодействия 2JH-F в диапазоне 52.8–53.8 Гц (Рис. 2):
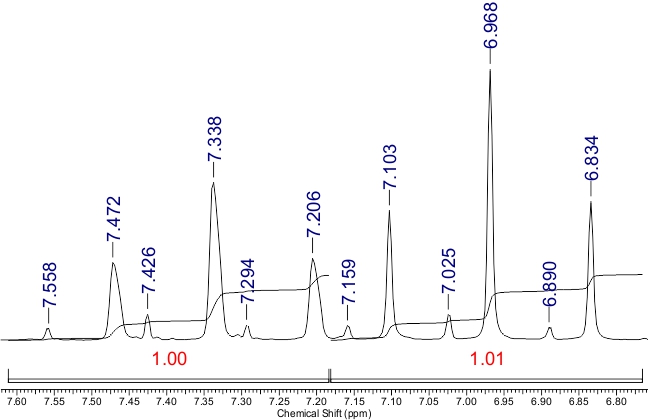
Рисунок 2. Сигналы СHF2-групп в 1H ЯМР спектре соединения 3
В спектре ЯМР 13С DEPTQ обнаруживаются: сигнал цианогруппы при δ 112.6 м.д., частично перекрывающиеся сигналы обеих групп СHF2 в области δ 109-114 м.д. с 1JC-F ~ 241 Гц, уширенные пики углеродов C-5 при δ 115.3 м.д. (основной таутомер) и δ 117.6 м.д. (минорный таутомер). Сигналы С-4 и С-6 проявляются в области слабых полей в виде триплетов с константами спин-спинового взаимодействия 2JC-F ~ 25 Гц. Наиболее дезэкранированный сигнал атома углерода, который может быть явным образом отнесен к сигналам основного таутомера, наблюдается при δ 158.4 м.д. Поскольку атом углерода, соседствующий с меркатогруппой, обычно более экранирован в сравнении с углеродом тиоксогруппы C=S (который, как правило, резонирует в более слабом поле при δ ~ 175 м.д. или более), мы склонны полагать, что пик при δ 158.4 м.д. следует отнести к сигналу атома C-2 основного меркапто-таутомера 3-А. В спектре ЯМР 19F сигналы каждой СHF2 группы как минорного, так и основного таутомеров проявляются как дублеты с константами спин-спинового взаимодействия 2JH-F в диапазоне от 53.2 до 53.8 Гц. Помимо этого, сигналы в спектрах ЯМР были отнесены с помощью ЯМР экспериментов по гетероядерной корреляции 1H-13C HSQC и 1H-13C HMBC (Рис. 3). Полный набор данных по гетероядерным корреляциям приведен в Таблице 1. Химические превращения 4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила 3 в настоящее время изучаются, и будут представлены позже.
Таблица 1. Гетероядерные корреляции в спектре соединения 3
|
Сигналы в 1H ЯМР спектре, δ, м.д. |
Наблюдаемые гетероядерные корреляции |
|
|
1H-13C HSQC |
1H-13C HMBC |
|
|
6.97 (т, 1Н, C(6)-СHF2) |
111.6 |
115.3; 155.7 |
|
7.34 (т, 1Н, C(4)-СHF2) |
111.5 |
111.3; 147.7 |
|
7.81 (уш.с, 1H, H-5) |
115.3 |
111.5; 111.6 |
|
Сигналы минорного таутомера |
||
|
7.03 (т, 1Н, C(6)-СHF2) |
111.64 |
154.8 |
|
7.48 (т, 1Н, C(4)-СHF2) |
111.64 |
111.3; 148.1 |
|
8.13 (уш.с, 1H, H-5) |
117.6 |
148.1; 154.8 |
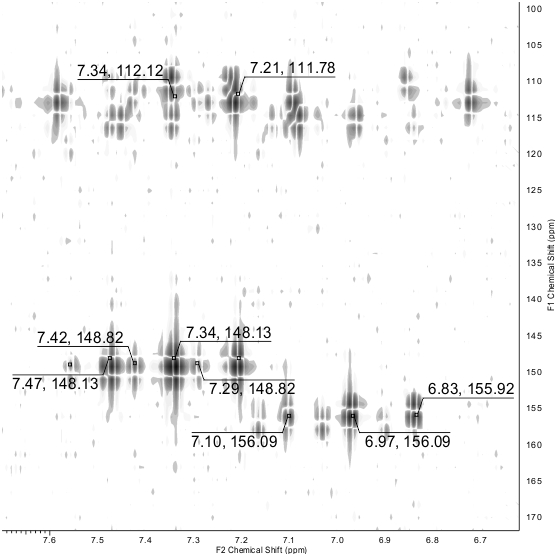
Рисунок 3. Фрагмент 1H-13C HMBC ЯМР спектра соединения 3. Показаны кросс-пики для СHF2-групп.
Экспериментальная часть
Спектры ЯМР 1Н, 13C DEPTQ, 19F регистрировались на приборе Bruker Avance III HD 400 MHz (400.17, 100.63 и 376.5 МГц соответственно). Химсдвиги для 1H и 13C даны относительно остаточного пика ДМСО (δ 2.48 и 39.5 м.д.), для ядер 19F – относительно внешнего стандарта CF3COOH (δ = -76.55 м.д.). ИК-спектр соединения 3 записан на приборе Bruker Vertex 70 с приставкой нарушенного полного внутреннего отражения на кристалле алмаза. Цианотиоацетамид 2 был синтезирован по известной методике [14]. 1,1,5,5-Тетрафторацетилацетон (чистота 98%) 1 был любезно предоставлен компанией "ПиМ-Инвест" (Москва, Россия).
4,6-Бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрил 3. К раствору 1,1,5,5-тетрафторацетилацетона 1 (3.80 г, 22.08 ммоль) в 15 мл EtOH при интенсивном перемешивании добавляют цианотиоацетамид 2 (2.21 г, 22.07 ммоль) и морфолин (0.3 мл). Смесь незамедлительно окрашивается в красный цвет. После того, как тиоамид 2 полностью растворится, раствор красного цвета перемешивают еще 0.5 ч и оставляют на ночь. Через 24 ч кристаллический осадок отфильтровывают, промывают холодным EtOH, получают 0.98 г (19%) продукта 3 в виде оранжево-красных кристаллов.
ИК-спектр, ν, см-1: 3175, 3096 (N–H), 2230 (C≡N), 1626, 1587 (C=C), 1352, 1230 (C=S), 1096, 1045 (C–F). Спектр ЯМР 1Н, δ, м.д.: сигналы основного (меркапто) таутомера: 6.97 (т, 1Н, C(6)-СHF2, 2JH-F 53.8 Гц); 7.34 (т, 1Н, C(4)-СHF2, 2JH-F 52.8 Гц); 7.81 (уш.с, 1H, H-5). Сигналы минорного (тиоксо) таутомера: 7.03 (т, 1Н, C(6)-СHF2, 2JH-F 53.8 Гц); 7.48 (т, 1Н, C(4)-СHF2, 2JH-F 52.8 Гц); 8.13 (уш.с, 1H, H-5). Соотношение таутомеров составляет ~ 8:1. Сигналы протона NH не наблюдаются, вероятно вследствие дейтерообмена. Спектр ЯМР 13C DEPTQ, δ, м.д.: 111.3 (C-3), 111.5* (т, СHF2, 1JC-F 241.3 Гц), 111.6* (т, СHF2, 1JC-F 241.3 Гц), 112.6 (C≡N), 115.3* (C-5), 147.7 (т, C-4, 2JC-F 25.0 Гц), 155.7 (т, C-6, 2JC-F 25.0 Гц), 158.4 (C-2). Наблюдаемые сигналы минорного таутомера: 111.64* (т, СHF2, 1JC-F 240.6 Гц), 117.6* (C-5), 148.1 (т, C–СHF2, 2JC-F 23.5 Гц), 154.8 (уширенный пик, C–СHF2). *Сигналы в противофазе. Спектр ЯМР 19F, δ, м.д.: сигналы минорного таутомера: -118.76 (д, СHF2, 2JH-F 53.8 Гц); -116.46 (д, СHF2, 2JH-F 53.2 Гц). Сигналы основного таутомера: -118.88 (д, СHF2, 2JH-F 53.7 Гц); -116.35 (д, СHF2, 2JH-F 53.2 Гц). Найдено, %: С, 40,57; Н, 1,79; N, 11,80. C8H4F4N2S (M = 236.19). Вычислено, %: C, 40.68; H, 1.71; N, 11.86.
Данные рентгеностуктурного исследования кристалла4,6-бис(дифторметил)-2-тиоксо-1,2-дигидропиридин-3-карбонитрила 3
Кристаллы соединения 3 были получены кристаллизацией из EtOH. Подходящий кристалл был отобран, зафиксирован, и далее исследован на дифрактометре SuperNova Dual Cu at zero, Atlas S2. Температура в ходе сбора данных составляла 100.00(11) К. Структура расшифрована и уточнена методом наименьших квадратов с использованием программных комплексов Olex2 [15], ShelXT и ShelXL [16]. Кристаллы соединения 3 (C8H4F4N2S, M = 236.19 г/моль) триклинные, пространственная группа P-1 (no. 2), параметры кристаллической решетки при 100 K следующие: a = 8.4494(6) Å, b = 8.5120(5) Å, c = 12.7799(4) Å, α = 94.167(4)°, β = 97.675(4)°, γ = 107.002(6)°, V = 865.03(9) Å3, Z = 4, T = 100.00(11) K, μ(CuKα) = 3.713 мм-1, Dвычисл = 1.814 г/см3. В уточнении использовано 10072 отражений (7.028° ≤ 2Θ ≤ 152.524°), 3577 независимых (Rint = 0.0465, Rsigma = 0.0341). Окончательные значения факторов расходимости R1 0.0519 (для отражений с I > 2σ(I)) и wR2 0.1472 по всем отражениям. Полный набор рентгеноструктурных данных для соединения 3 был депонирован в Кембриджский банк структурных данных (CCDC 1852646).
Благодарности
Эта работа была выполнена при поддержке Министерства образования и науки Российской Федерации (проекты № 4.5547.2017/8.9 и 4.1196.2017/4.6).
Список литературы
- Kumar G. S., Poornachandra Y., Reddy K. R., Kumar C. G., Narsaiah, B. Synthesis of novel triazolothione, thiadiazole, triazole-functionalized furo/thieno [2, 3-b] pyridine derivatives and their antimicrobial activity. Synthetic Communications, 2017, 47(20), 1864-1873.
- Ryu H., Seo S., Lee J.Y., Ha T.H., Lee S., Jung A., Ann J., Kim S.E., Yoon S., Hong M., Blumberg P.M., Frank-Foltyn R., Bahrenberg G., Schiene K., Stockhausen H., Christoph T., Frormann S., Lee J. Pyridine C-region analogs of 2-(3-fluoro-4-methylsulfonylamino-phenyl) propanamides as potent TRPV1 antagonists. European journal of medicinal chemistry, 2015, 93, 101-108.
- Dai D., Burgeson J. R., Tyavanagimatt S. R., Byrd C. M., Hruby D. E. Thienopyridine derivatives for the treatment and prevention of dengue virus infections U.S. Patent Application No. 13/708,224, 2013.
- Pevet I., Brulé C., Tizot A., Gohier A., Cruzalegui F., Boutin J. A., Goldstein S.Synthesis and pharmacological evaluation of thieno[2,3-b]pyridine derivatives as novel c-Src inhibitors. Bioorganic & medicinal chemistry, 2011, 19(8), 2517-2528.
- Ho Y. W., Yao W. H. Synthesis and properties of heterocyclic monoazo dyes derived from 3-cyano-4-trifluoromethyl-6-substituted-2 (1H)-pyridinethiones. Dyes and pigments, 2006, 70(1), 60-69.
- Burgart Y. V., Saloutin V. I., Chupakhin O. N. Fluorine-containing 2-functionalized 1, 3-dicarbonyl compounds for heterocyclic synthesis. Heterocycles, 2006, 69, 593-620.
- Furin G. G. Synthesis of heterocycles with polyfluoroalkyl substituents from unsaturated compounds containing polyfluoroalkyl groups. Chemistry of Heterocyclic Compounds, 2006, 42(3), 285-319.
- Rodinovskaya L. A., Sharanin Y. A., Litvinov V. P., Shestopalov A. M., Promonenkov V. K., Zolotarev B. M., Mortikov V. Y. Nitrile cyclization reactions. 8. Synthesis and transformation of 6-aryl-4-trifluoromethyl-3-cyano-2 (1H)-pyridinethiones. Zh. Org. Khim. (J. Org.Chem. USSR), 1985, 21(11), 2439-2444 (in Russian).
- Rodinovskaya L. A., Shestopalov A. M., Gromova A. V., Shestopalov A. A. One-pot synthesis of diverse 4-di (tri) fluoromethyl-3-cyanopyridine-2 (1H)-thiones and their utilities in the cascade synthesis of annulated heterocycles. Journal of combinatorial chemistry, 2008, 10(2), 313-322.
- Rateb N. M. Synthesis and reactions of 4-trifluoromethyl-3-cyano pyridine-2 (1H)-thione/one derivatives. Journal of Sulfur Chemistry, 2011, 32(6), 611-622.
- Dyachenko V. D., Tkachev R. P., Dyachenko A. D. Synthesis of 2-thioxo-6-trifluoromethyl-1, 2-dihydropyridine-3-carbonitrile and ethyl 5-cyano-6-thioxo-1, 6-dihydropyridine-2-carboxylate by the SNVin reaction. Russian Journal of General Chemistry, 2009, 79(1), 121-124.
- Eriksson M. C., Zeng X., Xu J., Reeves D. C., Busacca C. A., Farina V., Senanayake C. H. The Guareschi–Thorpe Cyclization Revisited – An Efficient Synthesis of Substituted 2, 6-Dihydroxypyridines and 2, 6-Dichloropyridines. Synlett, 2018, 29(11), 1455-1460.
- Nikishin K. G., Kislyi V. P., Nesterov V. N., Shestopalov A. M., Struchkov Y. T., Semenov V. V. Regioselective synthesis and properties of 3-cyano-6-methyl-4-trifluoromethylpyridine-2 (1H)-thione. Molecular and crystal structure of 3-cyano-2-ethylthio-6-methyl-4-trifluoromethylpyridine. Russian chemical bulletin, 1998, 47(3), 465-468.
- Dotsenko V. V., Krivokolysko S. G., Polovinko V. V., Litvinov V. P. On the regioselectivity of the reaction of cyanothioacetamide with 2-acetylcyclo-hexanone, 2-acetylcyclopentanone, and 2-acetyl-1-(morpholin-4-yl)-1-cycloalkenes. Chemistry of Heterocyclic Compounds, 2012, 48(2), 309-319.
- Dolomanov O. V., Bourhis L. J., Gildea R. J, Howard J. A. K., Puschmann H. OLEX2: a complete structure solution, refinement and analysis program. J. Appl. Cryst., 2009, 42, 339-341.
- Sheldrick G. M. SHELXT–Integrated space-group and crystal-structure determination. Acta Crystallographica Sec. A, 2015, 71(1), 3-8.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2018, 119, 3-4


