Поступило в редакцию: Июнь 2018
УДК 541.64:547.322:547.422:547.412.92
Fluorine Notes, 2018, 119, 1-2
Cинтез и свойства CF2X-замещенных 4-метил-2-гидрокси(хлор)пиримидинов
В. И. Дяченко
Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.
Н. Несмеянова РАН, РФ
119991, ГСП-1, Москва, В-334, ул. Вавилова, 28
e-mail: vic-d.60@mail.ru
Аннотация: Конденсацией 1,1,1-трифторпентан-2,4-диона (1а) и 1,1-дифторпентан-2,4-диона (1b) с мочевиной (2) при кипячении в CH3CO2H синтезированы соответствующие 4-трифторметил- (3a) и 4-дифторметил-6-метилпиримидин-2-олы (3b) с высоким выходом. Реакцией 3a,b c POCl3 получены соответствующие 2-хлор-4-трифторметил(дифторметил)-6-метилпиримидины (4a,b), востребованные в органическом синтезе.
Ключевые слова: 1,1,1-трифторпентан-2,4-дион, 1,1-дифторпентан-2,4-дион, 4-трифторметил-6-метилпиримидин-2-ол, 4-дифторметил-6-метилпиримидин-2-ол, 2-хлор-4-метил-6-трифторметил-пиримидин, 2-хлор-4-дифторметил-6-метилпиримидин
Наряду с пуриновыми, пиримидиновые основания, входящие в состав ДНК, являются универсальной химической основой для записи, хранения и передачи информации о строении живых организмов [1]. Частично изменяя структуру нуклеотидов без нарушения их комплементарности, ученые смогли влиять на скорость процессов, протекающих в клетках. Наиболее часто используемым для этих целей приемом является «эффект маскировки», связанный с соразмерностью атомов H и F [15]. Подменяя собой природные пиримидиновые нуклеотиды, флоксуридин, 5-фторурацил, тегафур, гемцитабин и капецитабин нашли свое применение в медицинской практике, так как способны встраиваться в структуру ДНК и РНК, замедляя функционирование и деление раковых клеток (Рис.1).
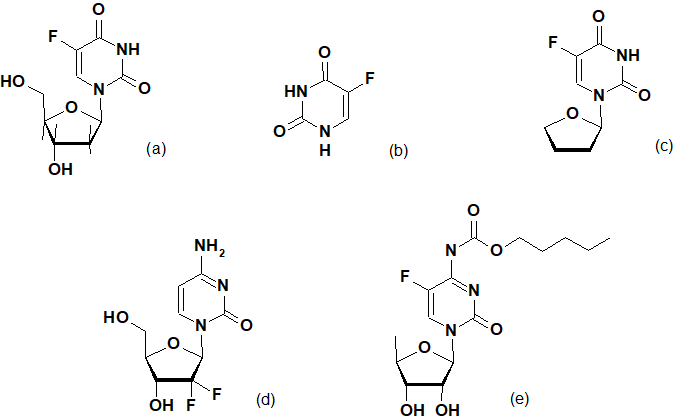
Рис.1. Синтетические фторсодержащие пиримидины: флоксуридин (а), фторурацил (b), тегафур (c), гемцитабин (d) и капецитабин (e).
СF3-Замещенные пиримидины также играют важную роль в клеточном метаболизме. Производные 4-трифторметил-6-метилпиримидин-2-ола 3а являются антагонистами хемокиновых рецепторов [2]. Винилпиримидоны, полученные на его основе, проявляют антивирусную активность [3], хиральные 2-феноксипропионаты 4-трифторметил-6-метилпиримидина предложены в качестве гербицидов [4], другие его аналоги являются эффективными фунгицидами [5]. Замещенные пиперазины, имеющие в своем составе структуру 4-трифторметил-6-метилпиримидина [6], запатентованы в качестве модуляторов Х-рецепторов печени, а производные 1,2,5-оксадиазепама могут быть использованы для лечения депрессии, деменции и болезни Альцгеймера [7]. В связи с этим разработка методов синтеза СF2X-замещенных пиримидинов является важной научной и практической задачей.
Целью настоящей работы является поиск эффективных методов получения 4-три(ди)фторметил-6-метилпиримидин-2-олов 3а,b, а также синтез их 2-хлорсодержащих аналогов 4а,b (Схемa 1). Впервые 4-трифторметил-6-метилпиримидин-2-ол 3а был получен в 1941 году при кипячении 1,1,1-триифторпентан-2,4-диона 1а и мочевины 2 в этаноле в присутствии Н2SO4 на протяжении 24-48 часов с выходом 87% [8, 9].
Схема 1.
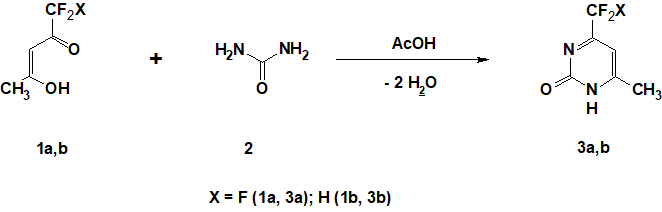
Позже отмечалось, что в этих условиях авторам [2, 3] удалось получить пиримидин 3а лишь с выходом 15 и 20% соответственно. При взаимодействии пентандиона 1а с цианамидом выход пиримидина 3а также не превышал 19% [10]. По литературным данным [11, 13], конденсация мочевины с другими несимметричными 1,3-дикетонами, содержащими один фторированный заместитель, при кипячении 20 часов в этаноле в присутствии концентрированной HCl, приводит к образованию пиримидин-2-олов с выходом лишь 34%.
Нами установлено, что взаимодействие дикетона 1а и мочевины 2 однозначно осуществляется практически в условиях «зеленой химии» – при кипячении в ледяной уксусной кислоте на протяжении 1-1,5 часа. После перекристаллизации из воды спектрально чистый 3а получен с выходом выше 90%. В этих же условиях конденсацией 1,1-дифторпентан-2,4-диона 1b и мочевины нами впервые был получен 4-дифторметил-6-метилпиримидин-2-ол 3b c выходом 83% (Схема 1). Полученные результаты, свидетельствует о том, что низкие выходы пиримидина 3а, опубликованные ранее, по-видимому, связаны с недостаточно высокой температурой реакции. Действительно, в отличие от предложенного нами, кипячения в уксусной кислоте (т. кип. 118°С), во всех предыдущих работах [2, 3, 11-13] конденсация дикетона 1а и мочевины 2 велась в этаноле (т. кип. 78°С).Не уделяя должного внимания влиянию температуры на скорость реакции, авторы сделали акцент на кислотный катализ (H2SO4, HCl, р-СH3-C6H4-SO3H), который, по-видимому, не играет решающей роли в этих превращениях. В подтверждение сказанного мы установили, что при кипячении 1а и 2 в монометиловом эфире этиленгликоля (т. кип. 124°С), имеющим близкую температуру кипения к СН3СО2Н, но при этом вовсе не являющимся кислотой как таковой, образование 3а осуществляется с соизмеримой скоростью и выходом.
Для расширения синтетических возможностей пиримидинов, содержащих СF2X-функцию, мы изучили особенности нуклеофильного замещения ОН-группы в 3а,b на хлор. Ранее отмечалось [2], что при кипячении 3а с РОСl3 максимальный выход хлорпиримидина 4а составил 37%. Такой же результат был получен [14] в реакции 3а с хлорокисью фосфора в присутствии ДМАП при 95°С.
Схема 2.
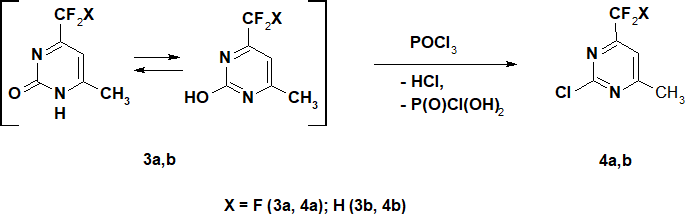
Мы показали, что при кипячении с РОСl3 на протяжении 11 часов 3а претерпевает высокую степень конверсии в соответсвующее 2-хлорпроизводное 4а (Схемa 2). После выделения и перегонки продукта в вакууме, получали 2-хлор-4-метил-6-трифторметилпиримидин 4a с выходом 76,5%. По данным ГЖХ его чистота составляет 99%. Таким же образом из соединения 3b впервые был получен 2-хлор-4-дифторметил-6-метилпиримидин 4b с выходом 74,4%.
По-видимому, низкие выходы хлорпиримидина 4а полученные ранее [2, 14], связаны с высокой реакционной способность хлора в 2-положении, а также особенностями их выделения.
Экспериментальная часть
Спектры ЯМР 1Н и 19F зарегистрированы в DMSO-d6 и CDCl3 на спектрометре «Bruker Avanse 400» с рабочей частотой 400,13 МГц и 376,5 МГц соответственно. Химсдвиги 1Н приведены относительно ТМС (внутренний стандарт), 19F относительно CF3CO2H - внешний стандарт. Константы спин-спинового взаимодействия приведены в МГц. Масс-спектры зарегистрированы на квадрупольном масс-спектрометре Finnigan MAT INCOS 50 (прямой ввод, энергия ионизации 70 эВ).
4-Трифторметил-6-метилпиримидин-2-ол (3а). В стеклянной колбе, снабженной обратным холодильником, капельной воронкой и магнитной мешалкой с нагревом, кипятили 4,8 г (80 ммоль) мочевины 2 и 12,8 г (80 ммоль) 1,1,1-трифторацетилацетона 1а в 48 мл ледяной уксусной кислоты в течение 1 часа. Реакционную массу упаривали на роторном испарителе, сырой продукт 3а кристаллизовали из воды, фильтровали, сушили на воздухе, затем в вакуумном эксикаторе над P2O5. Получали 13 г белого кристаллического пиримидина 3а, т. пл. 181-182°С (вода). Выход 91%. Rf=0,4 (этилацетат). Спектр ЯМР 1Н, (δ, м.д.): 12,76 (уш. с, 1Н, OH); 6,77 (с, 1Н, Het); 2,35 (с, 3Н, СН3). Спектр ЯМР 19F, (δ, м.д.): 7,85 (с, 3F, CF3). Масс-спектр, m/z): 178 [M]+. Найдено, %: С, 40,33; Н, 2,71; F, 31,78. С6H5F3N2O. Вычислено, %: C, 40,46; Н, 2,83; F, 32,00.
4-Дифторметил-6-метилпиримидин-2-ол (3b) получали аналогично 3а из 1,2 г (20 ммоль) мочевины 2 и 3,2 г (20 ммоль) 1,1-дифторацетилацетона 1b, кипятили в течение 1,5 часов в 12 мл ледяной уксусной кислоты. Растворитель удаляли на роторном испарителе, полученное масло при перемешивании обрабатывали эфиром. При охлаждении до -15°С твердеющий остаток измельчали при перемешивании и фильтровали. Продукт промывали эфиром и сушили на фильтре, получили 2,7 г аморфного вещества 3b. Выход 83%, т.пл. 130-131°С (трет-C4H9ОН), Rf=0,5 (aцетон-этилацетат=1:3). Спектр ЯМР 1Н, (δ, м.д., J, МГц): 12,36 (уш. с, 1Н, ОН); 6,60 (т, 1Н, СF2H, 2J=52); 6,53 (с, 1 Н, Het); 2,30 (с, 3Н, СН3). Спектр ЯМР 19F, (δ, м.д., J MHz): 120,00 (д, 2 F, CF2H, 2J=52). Масс-спектр, m/z: 160 [M]+. Найдено, %: С, 45,00; Н, 3,63; F, 23,31. С6H6F2N2O. Вычислено, %: C, 45,01; Н, 3,78; F, 23,73.
2-Хлор-4-метил-6-трифторметилпиримидин (4a). В стеклянной колбе, снабженной обратным холодильником и магнитной мешалкой с нагревом, кипятили 14,2 г (0,08 моль) 3а и 90 г POCl3 в течение11 часов. Обратный холодильник меняли на нисходящий и при обычном давлении отгоняли избыток POCl3. Затем из кубового остатка в вакууме водоструйного насоса (15 мм Hg) отгоняли хлорпиримидин 4a и другие летучие соединения. Для очистки 4a в стакан объемом 1л помещали 200мл холодной воды и при перемешивании по каплям прибавляли в него полученный хлорпиримидин 4a с примесью POCl3. Одновременно в реакционную массу прибавляли концентрированный раствор соды для нейтрализации образующихся неорганических кислот. Из реакционной массы 4a экстрагировали бензолом (3 раза по 50 мл), органический раствор сушили над хлоридом кальция и фильтровали через силикагель. После удаления растворителя получали 14 г подвижного масла. После перегонкой с насадкой Вюрца получали 12 г (76,5%) хлорпиримидина 4a, т. кип. 69-70°С/11мм рт. ст., nD20 1,4450, чистота по данным ГЖХ составляет 99%. Спектр ЯМР 1Н, (δ, м.д.): 7,46 (с, 1Н, Het); 2,67 (с, 3Н, CН3). Спектр ЯМР 19F, (δ, м.д.): 6,78 (с, 3F, CF3). Масс-спектр, m/z : 196 [M]+. Найдено, %: C, 36,38; Н, 2,15; F, 28,69. С6H4СlF3N2. Вычислено, %: C, 36,66; Н, 2,05; F, 29,00.
2-Хлор-4-дифторметил-6-метилпиримидин (4b) получали аналогично 4а из 14,4 г (0,09 моль) 3b и 105 г POCl3 при кипячении на протяжении 12 часов. После перегонки сырого продукта в вакууме с насадкой Вюрца получали 11.9 г 4b в виде прозрачной маслянистой жидкости с т. кип. 84-85°С/11мм рт. ст. Выход 74,4 %. n20D = 1,4800. Спектр ЯМР 1Н, (δ, м.д., J, МГц): 7,42 (с, 1Н, Het); 6,48 (т, 1Н, СF2H, J=52); 2,63 (с, 3Н, СН3). Спектр ЯМР 19F, (δ, м.д.): 120,00 (д, 2F, CF2H, 2J=52). Масс-спектр, m/z: 178 [M]+. Найдено, %: С, 39,99; Н, 3,01; F, 20,98. С6H5СlF2N2. Вычислено, %: C, 40,36; Н, 2,82; F, 21,28.
Выводы
Найден экологически чистый, малоэнергозатратный метод получения 4-CF2X-замещенных 6-метилпиримидин-2-олов 3а,b. С его использованием, впервые получен 4-дифторметил-6-метилпиримидин-2-ол 3b.
Кипячением пиримидин-2-олов 3а,b с хлорокисью фосфора были получены 2-хлор-4-метил-6-трифторметилпиримидин 4a и 2-хлор-4-дифторметил-6-метилпиримидин 4b с выходами свыше 74%.
Благодарности
Авторы благодарят Центр структурных исследований ИНЭОС РАН им. А. Н. Несмеянова, Москва за снятие ЯМР 1Н, 19F и масс-спектров, а также выполнение элементного анализа.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 16-29-05334-офи-м).
Литература
- A. Kornberg, T. A. Baker. Chapter 15: The replication mechanisms and operations // DNA replication. — Sausalito, Calif.: University Science Books, 2005.
- C. G. Kenneth, R. Prakash, S. Francois. Y. Qing, G. Shomir, WO 2006071875, 2006.
- A. Missio, T. Herget, A. Aschenbrenner, B. Kramer, J. Leban, K. Wolf, WO 2004016271, 2004.
- T. Haiyang, H. Tonghui, Z. Aidong, H. Changjian, Patent China № 101613322, 2009.
- L. Long, L. Qiang, T. Qinghong, L. Xinting, D. Ming, L. Shimeng, S. Juan, Patent China № 103965117, 2014.
- D. A. Claremon, C. Dong, Y. Fan, K. Leftheris, S. D. Lotesta, S. B. Singh, C. M. Tice, W. Zhao, Y. Zheng, L. Zhuang, WO 2016022521, 2016.
- T. Kamei, Y. Arikawa, T. Ohashi, T. Imaeda, I. Fujimori, T. Miki, J. Yonemori, Y. Oguro, T. Sugimoto, M. Seto, G. Nishida, M. Kamata, H. Imoto, WO 201617124, 2016.
- J. J. Donleavy, M. A. Kise, Org. Synth. 1, 1941.
- J. C. Sloop, C. L. Bumgardner, W. D. Loehle, J. Fluor. Chem., 2002, 118-135.
- A. Miller, J. Org. Chem., 1984, 49, 21, 4072, DOI:10.1021/jo00195a043.
- A. Kreutzberger, U. H. Tesch, Chem. Ber., 1976, 109, 10, 3255.
- S. Dilli,. K. Robards, Austral. J. Chem., 1978, 31, 8, 1833.
- Ya. V. Burgart, O. S. Kuzueva, M. V. Pryadeina, C. O. Kappe and V. I. Saloutin, Russ. J. Org. Chem., 2001, 37, 6, 869. (Zh. Org. Khim., 2001, 37, 6, 915).
- H. Tu, T. Huang, A. Zhang, C. Hou, Patent China № 101613322, 2009.
- H-J. Böhm, D. Banner, S. Bendels, M. Kansy, B. Kuhn, K. Müller, U. Obst-Sander, M. Stahl, ChemBioChem 2004, 5, 637, DOI: 10.1002/cbic.200301023.
Статья рекомендована к публикации членом редколлегии д.х.н. С. Р. Стерлиным
Fluorine Notes, 2018, 119, 1-2


