Поступило в редакцию: Апрель 2018
УДК 661.185.2
Fluorine Notes, 2018, 118, 3-4
Взаимодействие аллиловых эфиров спиртов-теломеров (n = 1, 2, 3) с малеопимаровой кислотой
Л.М. Попова1, А.С. Цырульникова1, С.В. Вершилов2, И.Ю. Бутко1
1Высшая школа технологии и энергетики Санкт-Петербургского государственного университета промышленных
технологий и дизайна,
ул. Ивана Черных, 4, Санкт-Петербург, 198095 (Россия)
е-mail: lorapopova@mail.ru
2Федеральное государственное унитарное предприятие «Научно-исследовательский институт синтетического
каучука им. акад.С.В. Лебедева»
ул. Гапсальская, 1, Санкт-Петербург,198035 (Россия)
Аннотация:Осуществлен синтез сложных эфиров взаимодействием малеопимаровой кислоты с 6,6,7,7-тетрафтор-4-оксагепт-1-еном, 6,6,7,7,8,8,9,9-октафтор-4-оксанон-1-еном и 6,6,7,7,8,8,9,9-додекафтор-4-оксаундец-1-еном в условиях кислотного катализа.>
Ключевые слова: алкилирование, аллиловые эфиры спиртов-теломеров (п=1, 2, 3), малеопимаровая кислота.
Канифоль и продукты ее химических превращений, такие как производные малеопимаровой кислоты, активно изучаются на протяжении десятилетий и применяются в различных областях [1-4]. Так, составы на основе канифоли используются как адгезивы, в лакокрасочной промышленности, для производства синтетических каучуков, в электротехнике и других сферах.
Известно, что введение в органическую молекулу атомов фтора позволяет существенно влиять на физико-механические свойства веществ: повышает хемо- и термостойкость, стойкость к свету, механическим воздействиям, влияет на электропроводимость, пенообразующую и эмульгирующую способность [5-7].
Данная работа является продолжением исследования по изучению реакции алцилирования аллиловых эфиров спиртов-теломеров производными смоляных кислот [8].
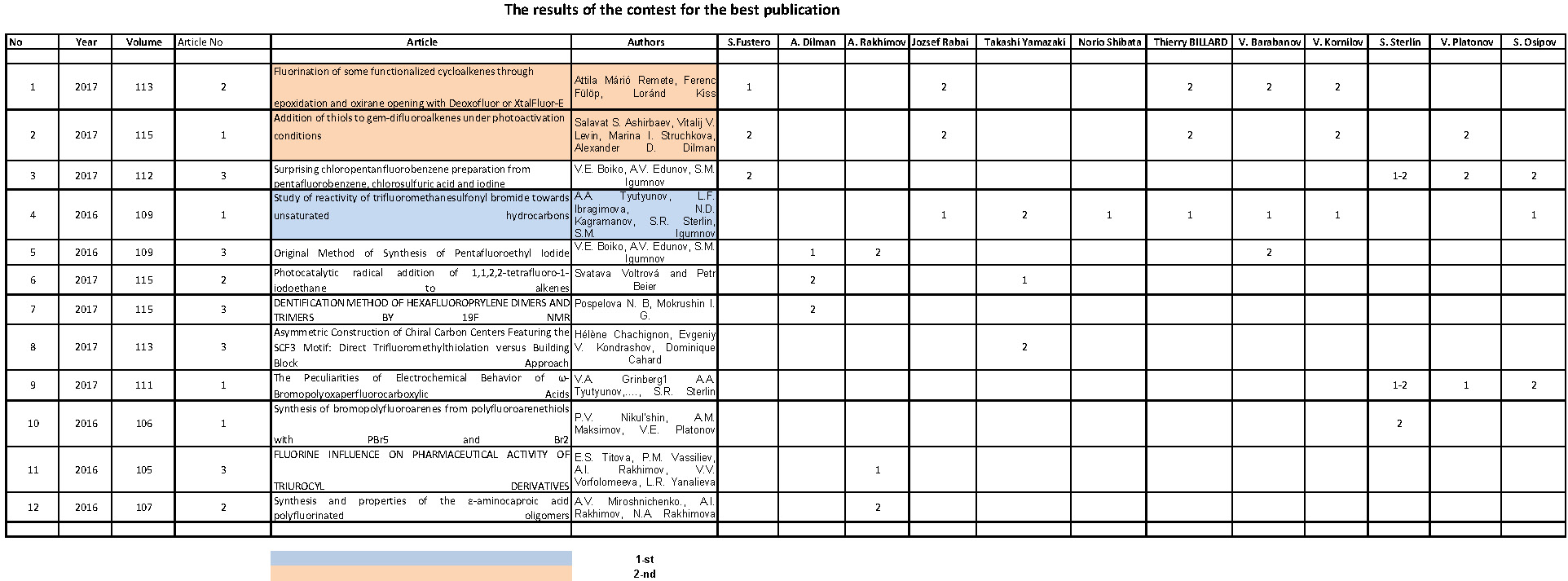
Нами проведено взаимодействие малеопимаровой кислоты с (полифторалкокси)аллиловыми эфирами (а-в) в условиях кислотного катализа без растворителя (II а-в) и в толуоле (II б) при нагревании (104-158°С) в течение 20 ч (см. сх.1). Контроль за ходом реакции осуществляли методом ТСХ. По окончании процесса реакционную массу растворяли в диэтиловом эфире и промывали дистиллированной водой до нейтральной реакции. Сушили прокаленным сульфатом натрия. После удаления растворителя и высушивания в вакууме над P2O5 получены кристаллические вещества (II а-в) светло-коричневого цвета (выходы 40-89%).
Схема 1
В спектрах ЯМР 1Н продуктов (II а-в) присутствуют сигналы протонов группы -CF2H- в виде триплета триплетов с химическим сдвигом 5.96 (для II а), 6.08 (для II б) и 6.09 м.д (3JH-F=52 Гц, 2JH-F=4 Гц) (для II в). О прохождении реакций свидетельствуют сигналы протонов в виде триплета сложноэфирных групп –С1Н2О при 3.83 (для IIа) при 3.94 (для II в), 3.95 м.д. (для II б), также присутствуют резонансные сигналы протонов других (полифторалкокси)-аллильных фрагментов, по своим химическим сдвигам, мультиплетности и интегральным интенсивностям соответствующие структуре эфира. Анализ спектров ЯМР 1Н свидетельствует, что реакция также протекает против правила Марковникова [8].
В спектрах ЯМР 19F продуктов (II а-в) наблюдаются следующие резонансные сигналы атомов фтора дифторметиленовых групп алкильного фрагмента: для продукта (II а) при – 125.40 м.д. и – 140.01 м.д. в виде дублета J=51 Гц); для продукта (II б) – C6F2, C7F2, C8F2 в виде синглетов с химическими сдвигами соответственно – 119.54, – 125.17 и – 129.85 м.д., а C9F2 в виде дублета при – 137.14 м.д. (J=50.8 Гц). для продукта (II в): C6F2 и C7F2 – синглеты с химическими сдвигами – 119.35. и 122.16 м.д., C8F2 и C9F2 – дублет с δF – 123.35 м.д (J=46.9 Гц), C10F2 – синглет с δF – 129.35 м.д и C11F2H в виде дублета с δF – 137.08 м.д. (J=46.98 Гц). По химическим сдвигам и интегральным интенсивностям сигналы соответствуют приписываемым структурам.
В ИК спектре продуктов (II) присутствуют полосы валентных колебаний С-Н связей в области 3028-2872 см-1, полосы валентных колебаний карбонильной группы С=О при 1778 см-1, колебаний двойной связи C=C при 1693 см-1, колебаний эфирной связи С-О-С в области 1250-1249 см-1 и валентных колебаний C-F в интервале 1130-1084 см-1.
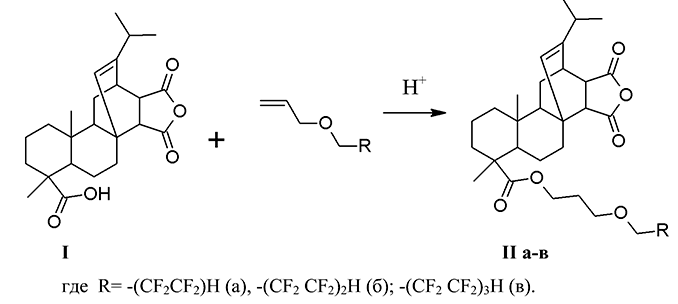
Встречный синтез продукта (II* б) был проведен по реакции диенового синтеза 3-(1,1,2,2,3,3,4,4-октафторпентокси)пропилабиетата (III б) с малеиновым ангидридом без растворителя при температуре 147-152°С в течение 2 ч (см. сх. 2.).
Схема 2
Контроль за ходом реакции проводили методом ТСХ. По окончании процесса реакционную массу растворяли в диэтиловом эфире, промывали дистиллированной водой и сушили прокаленным сульфатом натрия. После удаления растворителя и высушивания в вакууме над P2O5 получен кристаллический продукт темно-коричневого цвета (II*б) (выход по сырцу 89%).
В спектре ЯМР 1Н продуктов (II*б) имеются мультиплетные сигналы полифторалкильного фрагмента в виде триплета триплетов с химическими сдвигами 6.09 м.д., соответствующий протонам группы СF2Н, сигналы протонов сложноэфирных групп -СН2О- наблюдаются при 3.94 м.д. Об образовании продукта диенового синтеза свидетельствует сигнал с химическим сдвигом при 5.56 м.д.
В спектре ЯМР 19F продукта (II*б) имеются резонансные сигналы по химическим сдвигам, мультиплетности и интегральным интенсивностям соответствующие полифторалкильному фрагменту в интервале –137.14 ÷ –119. 54 м.д.
В УФ спектре эфира (II*б) в спиртовом растворе проявляются максимумы поглощения соответствующие π→π*-переходу в интервалах 210 нм (lgε 5.26) и 260 нм (lgε 5.18).
Экспериментальная часть
УФ спектры спиртовых растворов соединений были получены на спектрофотометре СФ-2000 при концентрации соединений 10-4 моль/л, толщина поглощающего слоя 1 см.
Спектр ЯМР 1Н и 19F регистрировали на приборе Bruker 500 с рабочей частотой 500 МГц для 1Н (470 МГц – для 19F), в растворах CDCl3 и DMSO-d6. Внутренний стандарт ТМС, внешний CCl3F.
ИК спектры регистрировали на приборе Shimadzu IRPrestige-2. Измерения проводились на стеклах KBr (растворы в CHCl3 и CCl4 )
Ход реакций и чистоту исходных и полученных соединений осуществляли методом ТСХ на пластинках Сорбфил, элюент: гексан –метиленхлорид – ацетон (1:1:0.5) или гексан - метиленхлорид (1:1).
В работе были использованы свежеперегнанные аллиловые эфиры – 6,6,7,7-тетрафтор-4-оксагепт-1-ен (а) (т.кип. 110-112°С), 6,6,7,7,8,8,9,9-октафтор-4-оксанон-1-ен (б) (т.кип. 141°С) и 6,6,7,7,8,8,9,9,10,10,11,11-додекафтор-4-оксаундек-1-ен (в) (т.кип. 171,8°С), синтезированные по методу [9], а также малеопимаровая кислота (I) (т.пл.. 218°С), полученная аналогично [10], малеиновый ангидрид (т.пл. 52.8°С) и 3-(1,1,2,2,3,3,4,4-октафторпентокси)пропилабиетат (IIIб), синтезированный по методике [8].
6,6,7,7-Тетрафтор-4-оксагептиловый эфир малеопимаровой кислоты (IIа). К 2.0 г (5.0 ммоль) малеопимаровой кислоты (I) добавляли 0.8 г (6.0 ммоль) 6,6,7,7-тетрафтор-4-оксагепт-1-ена (а), 2 капли конц. Н2SO4 и нагревали при 104-110°С в течение 20 ч. По окончании реакционную массу охлаждали, растворяли в диэтиловом эфире, промывали дистиллированной водой до нейтральной реакции. Отделяли органический слой и высушивали прок. Na2SO4. Отгоняли растворитель, остаток сушили в вакууме над Р2О5. Выход продукта (IIа): 2.37 г (89%), кристаллическое вещество светло-коричневого цвета, т.пл. 94-102°С, Rf 0.45 (C6H12-CH2Cl2-CH3COCH3, 1:1:0.5). ИК спектр (CCl4), см-1: 3028–2871(νC-Н).1777 (νC=O, ангидрид); 1730 (νC=O, сл.эф.); 1696 (νC=C); 1204 (νC-O-C); 1126–1016 (νСF). УФ спектр (EtOH), нм (lg ε): 208 (4.71), 235 (4.53), 260 (5.73). Спектр ЯМР 1Н, δ, м.д.: 1.02 (д J=6 Гц); 1.26 (дд J1=19 Гц, J2=8 Гц); 2.20 (c 1H C15H); 2,56 (д J=13 Гц; 2,75 д J=8 Гц;) 3.83 (т 2Н, ОСН2 сл.эф., J1=12 Гц); 4,11 (т 2Н, СН2О, J=6 Гц); 4.12 (т 2Н, СН2О, J=6 Гц ); 5.57 (с 1Н С14Н); 5.96 (тт 1Н, CF2H, J1=53 и J2=6 Гц). Спектр ЯМР 19F, δ, м.д.: – 140.01 (д 2F, C5F2, J=51 Гц) – 125.40 (c 2F, CF2).
6,6,7,7,8,8,9,9-Октафтор-4-оксанониловый эфир малеопимаровой кислоты (IIб). Получали аналогично продукту (IIа) из 3.5 г (8.75 ммоль) (I), 2.86 г (10.5 ммоль) 6,6,7,7,8,8,9,9-октафтор-4-оксанон-1-ена (б), 3-х капель конц. Н2SO4, 20 мл толуола, при 116-118°С в течение 20 ч. Выход (IIб): 2.37 г (40%), кристаллическое вещество темно-коричневого цвета, т.пл. 136-142°С, Rf 0.56 (C6H12-CH2Cl2-CH3COCH3, 1:1:0.5). УФ спектр (EtOH), нм (lg ε): 212 (6.42), 247 (плечо). Спектр ЯМР 1Н, δ, м.д: 0.63 (с 3H C20H3); 1.03 (д 6Н, С16Н3 J=6 Гц); 1.26 (дд J1=20 Гц, J2=7 Гц); 2.20 (c 1H C15H); 3.95 (т 2Н, ОСН2 сл.эф., J=14 Гц); 4.11 (т 2H, OCH2, J=6 Гц); 4.16 (т 2H, OCH2, J=6 Гц); 5.56 (c 1H, C14H), 6.09 (тт 1Н, СF2H, J1=52 Гц; J2=4 Гц). Спектр ЯМР 19F, δ, м.д.: – 137.14 (д 2F, C9F2, J=50.8 Гц); – 129.85 (с 2F, C8F2); – 125.17 (с 2F, C7F2); – 119.54 (с 2F, C6F2).
6,6,7,7,8,8,9,9,10,10,11,11-Додекафтор-4-оксаундеканиловый эфир малеопимаровой кислоты (IIв). Получали аналогично продукту (IIа) из 2.0 г (5.0 ммоль) (I), 2.06 г (5.5 ммоль) 6,6,7,7,8,8,9,9,10,10,11,11-додекафтор-4-оксаундек-1-ена (в), 3-х капель конц. Н2SO4, при 155-158°С в течение 20 ч. Выход (IIв): 1.93 г (50%), кристаллическое вещество темно-коричневого цвета, т.пл. 138-143°С, Rf 0.61 (C6H12-CH2Cl2-CH3COCH3, 1:1:0.5). УФ спектр (EtOH), нм (lg ε): 214 (6.15), 256 (плечо). Спектр ЯМР 1Н, δ, м.д. 0.89 (с 3H C20H3); 2.20 (c 1H C15H); 3.94 (т 2Н, ОСН2 сл.эф., J=14 Гц); 4.15 (т 2H, OCH2, J=6 Гц); 4.16 (т 2H, OCH2, J=6 Гц); 5.57 (c 1H C14H); 6.08 (тт 1Н, CF2H, J1=52 Гц, J2=4 Гц). Спектр ЯМР 19F, δ, м.д.: – 137.08 (д 2F, C11F2H, J=46.98 Гц); – 129.35 (с 2F, C10F2); – 123.35 (с 4F, C8F2C9F2); – 122.16 (с 2F, C7F2); – 119.35 (с 2F, C6F2).
Встречный синтез 6,6,7,7,8,8,9,9-октафтор-4-оксанонилового эфира малеопимаровой кислоты (II*б). К 2.5 г (4.4 ммоль) 3-(1,1,2,2,3,3,4,4-октафторпентокси)пропилабиетата (IIIб) добавляли 0.51 г (5.2 ммоль) малеинового ангидрида, 3 капли конц. Н2SO4 и выдерживали при 147-152°С в течение 2 ч. Реакцию контролировали с помощью ТСХ. По окончании полученный продукт охлаждали, растворяли в толуоле, промывали дистиллированной водой до нейтральной реакции. Отделяли органический слой и высушивали прок. Na2SO4. Отгоняли толуол, остаток сушили в вакууме над Р2О5. Выход (II*б): 2.65 г (90%), кристаллическое вещество песочного цвета, т.пл. 123-127°С, Rf 0.67 (C6H12-CH2Cl2-CH3COCH3, 1:1:0.4). ИК спектр (пленка), см-1: 3027-2651 (νC-Н); 1778 (νC=O, ангидрид); 1735 (νC=O, сл.эф.); 1695 (νC=C); 1229 (νC-O-C); 1204; 1190-948 (νСF). УФ спектр (EtOH), нм (lg ε): 210 (5.26), 260 (5.18). Спектр ЯМР 1Н, δ, м.д.: 0.65 (с 3Н, С20Н3); 1.02 (д 6Н, С16Н3, J=6.88 Гц); 1.19 (с 3Н, С19H3); 1.81 ÷ 1.41 (12Н, CH2); 2.27 (м 1H, C15H); 2.55 (д 2H, C7H2, J=13.6 Гц); 2.76 (д 1H, C21H, J=8.56 Гц); 3.94 (т 2Н, ОСН2 сл.эф., J=14 Гц); 4.11 (т 2H, OCH2, J=6 Гц); 4.16 (т 2H, OCH2, J=6 Гц); 5.56 (с 1H, С14Н); 6.09 (тт 1Н, СF2H, J1=52 Гц; J2=4 Гц). Спектр ЯМР 19F, δ, м.д.: – 137.14 (д 2F, C9F2 J=50.8 Гц); – 129.85 (с 2F, C8F2); – 125.17 (с 2F, C7F2); – 119.54 (с 2F, C6F2).
Выводы
Показано, что алкилирование малеопимаровой кислоты 6,6,7,7-тетрафтор-4-оксагепт-1-еном, 6,6,7,7,8,8,9,9-октафтор-4-оксанон-1-еном и 6,6,7,7,8,8,9,9,10,10,11,11-додекафтор-4-оксаундек-1-еном без растворителя (или в толуоле) в присутствии конц. H2SO4 при 104-158°С в течение 20 ч приводит к образованию соответствующих сложных эфиров.
К аналогичному результату приводит взаимодействие 3-(1,1,2,2,3,3,4,4-октафторпентокси)пропилабиетата (III б) с малеиновым ангидридом без растворителя в присутствии конц. H2SO4 при 147-152°С в течение 2 ч (выход 89%).
Список литературы
- Simonsen J. The terpenes. Volume III. The sesquiterpenes, diterpenes and derivatives. Cambridge: At the University press, 1952. 579 p.
- Зандерманн В. Природные смолы, скипидары, таловое масло (химия и технология) Москва: Лесная промышленность, 1964. 576 с.
- Толстиков Г.А., Толстикова Т.Г., Шульц Э.Э., Толстиков С.Е., Хвостов М.В. Смоляные кислоты хвойных России. Новосибирск: Академ. Изд-во «Гео», .2011. 396 с.
- Rosin – based Chemicals and Polymers / Ed. by Jinwen Zhang. Shawbury, Shewsbury, Shropshire: Smithers Rapra Technology Ltd., 2012. 234 p.
- Исикава Н., Кобаяси Ё. Фтор. Химия и применение. М.: Мир, 1982. 276 с.
- Новое в технологии соединений фтора / Под ред. Н. Исикавы. М.: Мир, 1984. 592 с.
- Соединения фтора: Синтез и применение: пер.с яп. // под ред. Н.Исикавы. М.: Мир, 1990. 407 с.
- Попова Л.М., Вершилов С.В. Ацетоксилирование 6,6,7,7,8,8,9,9-октафторпентоксипропена-1 смоляными кислотами. Fluorine Notes. 2015. N 2.
- Гудлицкий М. Химия органических соединений фтора. М.: Госхимиздат, 1961. 373 с.
- Калниныш А.И., Добелис Ю.Я. Диеновый синтез в области смоляных кислот. Применение катализаторов при получении аддуктов смоляных кислот с диенофилами. Изв. АН Латв.ССР. 1969. №5. С. 54-57.
Статья рекомендована к публикации членом редколлегии В.В. Кориниловым
Fluorine Notes, 2018, 118, 3-4