Поступило в редакцию: Апрель 2018
УДК 543.554.084.873
Fluorine Notes, 2018, 118, 1-2
ПОТЕНЦИОМЕТРИЧЕСКИЙ МИКРОМЕТОД ОПРЕДЕЛЕНИЯ ФТОРИД-ИОНА В ПРИРОДНЫХ ОБЪЕКТАХ
Д.Б. Петренко *,**, В.Ю. Дмитриева*, Р. А. Газаров ***, Н. В. Васильев*
* Московский государственный областной университет, 105005, Российская Федерация, Москва, ул. Радио 10а.
** Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН, 119017, Российская Федерация, Москва, Старомонетный пер. 35. DBPetrenko@yandex.ru
*** Российский государственный университет нефти и газа им. И. М. Губкина (Национальный исследовательский университет), 119991, Российская Федерация, Москва, Ленинский проспект 65. gazarov@gubkin.ru
Аннотация: Описан простой потенциометрический микрометод для определения фторид-иона в природных объектах. Метод позволяет анализировать образцы объемом от 0,05 см3, не требует применения сложного оборудования и удобен для серийного анализа.
Ключевые слова: фторид-ион, потенциометрия, ионоселективные электроды, микроопределение, биообъекты.
Потенциометрия используется для определения фторид-иона в широком круге природных и промышленных объектов благодаря своей простоте и надежности. В настоящее время коммерчески доступные электроды позволяют определять фторид-ион с нижним пределом обнаружения 0,02 мг / дм3 в образцах с объемом 5-50 см3 [1], однако при анализе некоторых природных и биологических объектов возникает необходимость работы с образцами объемом ≤0,5 см3. Известные микрометоды определения фторид-иона представляют собой различные разновидности проточной ионометрии и требуют сравнительно сложного приборного оформления и использования специально сконструированных ячеек [2-3]. Известны также методы, в которых исследуемый раствор наносят на торец перевернутого фторид-селективного электрода и помещают в полученную каплю электрод сравнения [4, 5], либо помещают электроды в исследуемый раствор, находящийся в углублении специально изготовленной тефлоновой пластинки [6]. Недостатком описанных микрометодов определения фторид-иона является необходимость изготовления специальных приспособлений, при использовании некоторых из которых существует значительный риск механического повреждения мембраны электрода, что приводит к его выходу из строя. Не всегда удобна реализация методик, основанных на нанесении пробы на торец перевернутого электрода, что существенно зависит от личных качеств экспериментатора. Существуют промышленно выпускаемые образцы ячеек для ионометрических измерений. Уже несколько десятков лет Гомельским заводом измерительных приборов выпускается ячейка для микроизмерений, представляющая собой стакан с крышкой, в котором имеются отверстия для установки вспомогательного электрода и электролитического ключа [7]. Электролитический ключ имеет форму цилиндра со сферическим дном, в нижней части которого имеется небольшое удлинение с впаянной асбестовой нитью, обеспечивающей связь электролитического ключа со вспомогательным электродом. Анализируемый раствор и рабочая часть измерительного электрода помещаются в полую часть ключа, а вспомогательный электрод погружается в стакан, заполненный электролитом. Серьезным недостатком использования описанной конструкции для определения фторидов является наличие контакта между анализируемым раствором и стеклянной поверхностью электролитического ключа, что делает невозможным определение низких содержаний фторид-иона из-за его взаимодействия со стеклом. Кроме того, следует отметить достаточно значительное время, необходимое для полного смачивания асбестовой нити анализируемым раствором и, как следствие, установление постоянных показаний милливольтметра (по наблюдениям авторов 15-20 минут).
Целью настоящей работы явилась разработка простого, надежного и удобного метода определения фторид - иона в образцах объемом 0,05-0,5 см3, не требующего сложной аппаратуры и пригодного для серийного анализа. В том числе, интерес представляла разработка метода анализа фторид-иона в биологических пробах, имеющих малые объемы и низкие концентрации аналита.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе использовали фторидный электрод ЭЛИТ-221 и хлорид- серебряный электрод сравнения ЭВЛ-1М3. Разность потенциалов между электродами измеряли с точностью ± 0,1 мВ на рН-метре / милливольтметре HANNA-221 при температуре окружающей среды (22-24 ° С). В работе использованы химические реактивы производства ООО «Реахим» (Москва) без дополнительной очистки. Для потенциометрических измерений применяли буферный раствор состава (г/дм3): NaCl - 58,50; тринатрий цитрат пентагидрат Na3C6H5O7 ∙ 5Н2О – (0,36); CH3COONa ∙ 3Н2О – (102,00); CH3COOH – (14,40), который добавляли к образцу в соотношении 1: 1 (по объему) [8]. Исходный раствор фторида натрия с концентрацией фторид-иона 2 мг/см3 готовили растворением 2,210 г NaF (ОСЧ) в бидистиллированной воде в мерной колбе на 0,5 дм3. Растворы с более низкой концентрацией были приготовлены путем разбавления исходного раствора бидистиллированной водой. Между измерениями образца электроды промывали бидистиллированной водой и высушивали фильтровальной бумагой. Градуировочные графики строили по данным измерений потенциалов для концентраций при концентрациях фторид-иона 0,2, 0,4, 0,6, 0,8, 1,0 и 2,0 мг / дм3.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для проведения потенциометрических измерений предлагается использовать устройство, представленное на рис.1, с использованием стандартных виал, объемом 1,5 см3, соединенных солевым мостиком.
Рабочий электрод помещают в виалу, заполненную образцом, разбавленным буферным раствором, электрод сравнения вводят в виалу с буферным раствором, разбавленным бидистиллированной водой с соотношением 1: 1 (по объему). Виалы соединяют солевым мостиком, который представляет собой пористый материал (например, фильтровальную бумагу и т.д.), смоченный буферным раствором, разбавленным водой в соотношении 1: 1 (по объему). Подставки для виал изготавливают из пластмассовых пробирок объемом 15 см3, которые нижними частями крепятся к пластиковому основанию с помощью винтов.
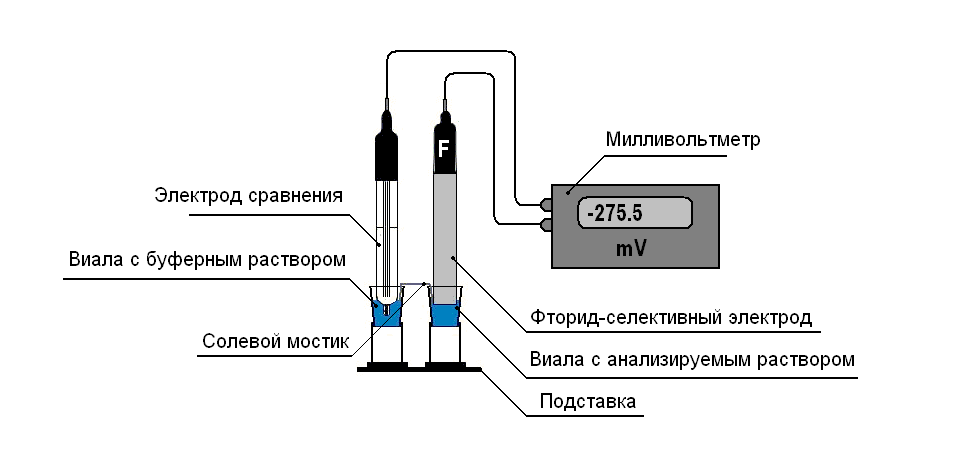
Рис. 1. Установка для потенциометрического микроопределения фторид-иона.
Для оценки достоверности предложенного метода, сравнивались градуировочные графики (зависимость E от обратного отрицательного логарифма концентрации фторид-иона в стандартном растворе (мг/дм3)) (рис.2) и результаты измерений содержания фторида в образцах вод из различных источников (таблица 1), полученные стандартным методом [8] с использованием объемов образцов 20 см3 и микрометодом с использованием объемов образцов 0,5 см3.
Таблица 1. Содержание фторид-иона в образцах вод, мг / дм3 (n = 3, P = 0,95)
|
Образец |
Стандартный метод |
Предложенный микрометод |
|
Родниковая вода |
0.21 ± 0.02 |
0.24 ± 0.02 |
|
Водопроводная вода 1 |
0.59 ± 0.03 |
0.58 ± 0.03 |
|
Водопроводная вода 2 |
1.58 ± 0.15 |
1.65 ± 0.16 |
|
Вода из скважины 1 |
1.74 ± 0.10 |
1.73 ± 0.10 |
|
Вода из скважины 2 |
1.67 ± 0.16 |
1.66 ± 0.16 |
На рис. 2 и табл. 1 продемонстрировано, что градуировочные графики и результаты анализа, полученные стандартным методом и предложенным микрометодом идентичны в пределах погрешности эксперимента. Микрометод позволяет анализировать образцы объемом до 0,050 см3. Его важным преимуществом является экономическая эффективность: достигается по меньшей мере 10-кратное снижение количества необходимых реактивов за счет использования небольших объемов проб, при одинаковой экспрессности анализа (около 3-4 мин).
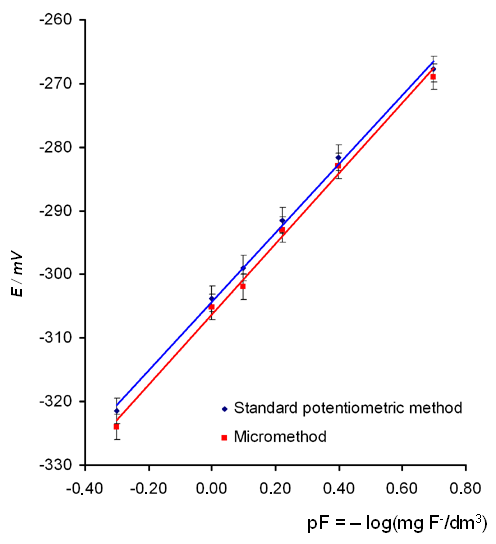
Рис. 2. Градуировочные графики для определения фторид-иона.
Уравнение зависимости:
Стандартный потенциометрический метод: E = 53.9 pF – 304.2, R2 = 0.9976
Микрометод: E = 50.9pF – 306.6, R2 = 0,9925
Разработанный микрометод испытан при определении фторид-иона в биологических объектах на примере экстракта водорастворимых белков гепатопанкреаса моллюска Viviparus viviparus L. (Живородка речная) при изучении накопления фтора в модельных условиях. Объем экстракта, полученного согласно методики [9], составляет не более 0,1-0,2 см3, что делает невозможным использование стандартных потенциометрических методов его анализа. Подготовка образца для устранения эффекта органических компонентов проводилась в соответствии со следующей процедурой: 0,1 см3 экстракта помещали в стекловидный углеродный тигель, добавляли 0,1 см3 50% раствора перекиси водорода, добавляли 0,1 см3 0,1 М раствора гидроксида натрия и выпаривали раствор досуха при нагревании в электрической плитке. Операцию повторяли 5 раз. Полученный осадок растворяли в 0,5 см3 дистиллированной воды, количественно переносили в полипропиленовую пробирку и добавляли 0,5 см3 буфера для регулировки общей ионной силы, затем электроды погружали в анализируемый раствор и измеряли значение ЭДС. Концентрацию фторид-иона определяли по градуировочному графику. Результаты определения фтора в гепатопанкреатических экстрактах моллюсков, находившихся в воде с повышенным и фоновым содержанием фторида, приведены в таблице. 2.
Таблица 2. Содержание фторид-иона в экстрактах гепатопанкреаса моллюсков, мг/дм3 (n = 3; P = 0.95)
|
Образец |
Содержание фторид-иона |
|
1 |
2.4 ± 0.2 |
|
2 |
3.3 ± 0.4 |
|
3 |
6.3 ± 0.5 |
|
4 |
11.0 ± 0.5 |
Из данных табл. 2 видно, что содержание фтора в экстрактах гепатопанкреаса моллюсков, находившихся в воде с высоким содержанием фтора (образцы 3, 4), существенно превышает его содержание в гепатопанкреасе моллюсков в воде с его фоновым содержанием (примеры 1,2).
Область применения модифицированного метода не ограничивается определением фторид-иона, аналогичный подход может быть использован для потенциометрического определения других ионов. Описанный метод может быть удобен для потенциометрического определения хлорида и нитрат-ионов, поскольку позволяет использовать стандартные хлорид-серебряные электроды сравнения вместо более сложных и дорогих электродов с двойным солевым мостиком, при этом одновременно устраняется риск заражения исследуемых растворов с хлоридом калия из электрода сравнения.
ЗАКЛЮЧЕНИЕ
Предложен простой потенциометрический метод определения фторида иона в образцах объемом 0,05-0,5 см3. Показана применимость разработанного метода для анализа реальных объектов на примере экстракта гепатопанкреаса пресноводного моллюска Viviparus viviparus L. Метод удобен для серийного анализа и не требует использования сложного оборудования.
ЛИТЕРАТУРА
- Midgley, D.; Torrance, K. Potentiometric Water Analysis, I ed.; Mir: Moscow, 1980; pp 404 – 415.
- Наrа, Н.; Yabuuchi, К.; Higashida, M.; Ogawa, M. Determination of free and total fluoride in rain water using a continuous-flow system equipped with a fluoride ion-selective electrode detector. Anal. Chim. Acta. 1998, 364, 117 – 123.
- Santos, J.R.; Lapa, R.A.; Lima, J.L. Development of a tubular fluoride potentiometric detector for flow analysis: Evaluation and analytical applications. Anal. Chim. Acta. 2007, 583, 429 – 436.
- Brambilla, E.; Felloni, A.; Fadini, B.L.; Strohmenger, C.L. A simplified micromethod for fluoride analysis. Arch. Oral Biol. 1998, 43, 819 – 823.
- Durst, R.A.; Taylor, K. J. Modification of the fluoride activity electrode for microchemical analysis. Anal. Chem.. 1967, 39, 1483 – 1485.
- Tyler, J.E.; Poole, D.F.G. The rapid measurement of fluoride concentrations in stored human saliva by means of a differential electrode cell. Arch. Oral Biol. 1989, 34, 995 – 998.
- Рачинский Ф.Ю., Рачинская М.Ф. Техника лабораторных работ. Л.: Химия, 1982. - 432 c.
- Руководящий документ № 52.24.360-95. Массовая концентрация фторида в воде. Методика измерения потенциометрического метода с ионоселективным электродом: Ростов-на-Дону, 2008; 11 с.
- Дроганова Т.С., Поликарпова Л.В., Петренко Д.Б., Васильев Н.В. Активность кислой фосфатазы в печени живородки речной (Viviparus Viviparus) при воздействии фторид-иона. Вестник МГОУ. Серия: Естественные науки. 2014 (№5), c. 14 – 19.
Статья рекомендована к публикации членом редколлегии д.х.н. С.Н. Осиповым
Fluorine Notes, 2018, 118, 1-2


