Поступило в редакцию: Март 2018
УДК 547.1
Fluorine Notes, 2018, 117, 1-2
Реакции перфторалифатическихсульфонилгалогенидов с тригалогенидами фосфора
A.A. Тютюновab, Л.Ф. Ибрагимоваa, Н.Д. Каграмановa, С.Р. Стерлинa, С.М. Игумновab
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
bЗАО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
e-mail: tuytuynov@rambler.ru
Аннотация: Показано, что фторалифатические сульфонилгалогениды под действием тригалогенидов фосфора восстанавливаются с образованием соответствующих дисульфидов, в том числе содержащих такие функциональные группы как фторсульфонильную, карбоксиметильную, а также трифторвинилокси-группу. Интермедиатами реакции являются перфторалкансульфинилгалогениды и перфторалкансульфенгалогениды. Образование последних подтверждает получение аддуктов соответствующих сульфенгалогенидов с олефинами углеводородного ряда.
Ключевые слова: трифторметансульфонилбромид, перфторалкансульфонилгалогениды, диперфторалкилдисульфиды, фосфора трихлорид, фосфора трибромид.
Деоксигенирование S-O производных под действием галогенидов фосфора описано в 1871 году Michaelis’ом [1] и позднее исследовано рядом авторов [2-4]. Впоследствии было показано, что эта реакция имеет общий характер и с ее помощью можно осуществлять восстановление алифатических и ароматических сульфонилгалогенидов, сульфи- и сульфокислот, а также их солей до соответствующих дисульфидов [5-9], причем было установлено, что восстановительный потенциал PBr3 существенно превышает восстановительный потенциал PCl3. В свою очередь сульфонилбромиды подвергаются восстановлению намного легче сульфонилхлоридов. В то же время показано, что реакция бензолсульфонилхлорида с PBr3 при t>150°С приводит к образованию PhSO2Br с выходом >90%, а не продуктов его восстановления [10].
Целью настоящей работы является выяснение особенностей взаимодействия перфторалифатических производных сульфи- и сульфокислот с тригалогенидами фосфора.
Нами найдено, что взаимодействие трифторметансульфонилбромида (1) с треххлористым фосфором (мольное соотношение 1 : PCl3 = 1:1) уже при комнатной температуре приводит к образованию трифторметансульфинилхлорида (2), который можно выделить из реакционной смеси с выходом 40% [11].
Схема 1
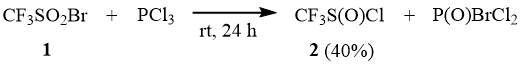
При этом в процессе реакции образуется также P(O)Cl3, бром и продукты более глубокого восстановления 1.
Взаимодействие 1 с двумя эквивалентами PCl3 при комнатной температуре в присутствии каталитических количеств DMF приводит к образованию дисульфида 3 и брома. Аналогично осуществляется реакция CF3SO2Br с PBr3. В этом случае реакция не требует катализа DMF, однако в процессе ее образуется обильный осадок P(O)Br3 (т.пл. 50°С), поэтому ее более удобно осуществлять в среде ацетонитрила, в присутствии которого она ускоряется, и осаждения оксибромида фосфора не происходит. Причем при соотношении реагентов CF3SO2Br : PBr3 = 1:1 конверсия 1 составляет 50% и наблюдается образование дисульфида 3, что вероятно связано с нестабильностью первоначально образующегося CF3S(O)Br, который, как было показано ранее, легко диспропорционирует на CF3SO2Br и CF3SBr [12], и низкой устойчивостью трифторметансульфенбромида. В случае же соотношения CF3SO2Br : PBr3 = 1:2 весь взятый в реакцию сульфонилбромид 1 восстанавливается до дисульфида 3.
Схема 2
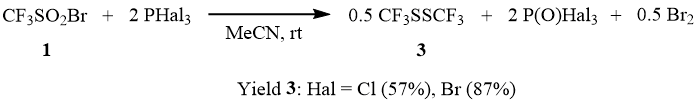
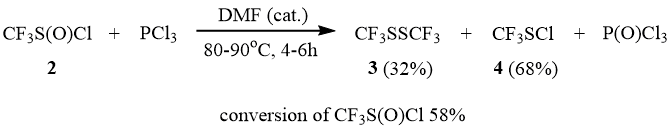
Нами установлено, что трифторметансульфинилхлорид (2) не реагирует с PCl3 даже при нагревании до 90÷100°С. В присутствии каталитических количеств DMF 2 начинает медленно реагировать с PCl3 уже при комнатной температуре. Однако даже после нагревания реакционной смеси в запаянной ампуле при 90÷100°С в течение 5-6 часов конверсия 2 составляет только 58%, при этом образуется смесь дисульфида 3 и сульфенхлорида 4.
Схема 3
В отличие от 1 сульфинилхлорид 2 с PBr3 начинает медленно реагировать только при 90÷100°С. Однако в присутствии каталитических количеств DMF реакция медленно осуществляется уже при комнатной температуре. Причем в ходе реакции помимо основного продукта – дисульфида 3 – в качестве побочного продукта образуется сульфонилхлорид 5, что скорее всего связано с диспропорционированием промежуточно образующегося трифторметансульфинилбромида. Последующий обмен сульфонильного атома брома на хлор приводит к образованию 5, который в данных условиях PBr3 не восстанавливается.
Схема 4
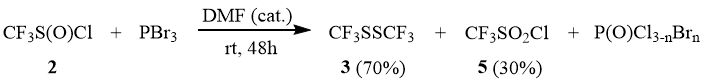
Взаимодействие трифторметансульфонилхлорида (5) c PBr3 в среде ацетонитрила осуществляется при температуре 100°С в запаянной ампуле в течение 3-х часов с образованием дисульфида 3. С менее реакционноспособным PCl3 сульфонилхлорид 5 в этих условиях не реагирует.
Схема 5
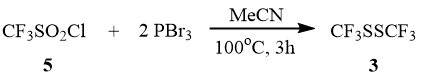
В отличие от трифторметансульфонилбромида (1) и хлорида 5 трифторметансульфонилфторид не реагирует с PBr3 в среде ацетонитрила в запаянной ампуле при 100°С, что, скорее всего, определяется большей прочностью S-F-связи (~343 кДж/моль) по сравнению с S-Cl и S-Br-связями (~241 и ~218 кДж/моль соответственно) [13]. Полученный результат в определенной степени согласуется с сообщением об устойчивости фтористого тионила к действию PCl3 [14].
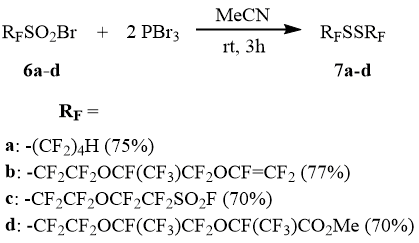
Высшие перфторалкансульфонилбромиды при действии PBr3 в среде ацетонитрила так же гладко превращаются в соответствующие дисульфиды, в том числе и содержащие такие функциональные группы как фторсульфонильную, карбоксиметильную, а также трифторвинилокси-группу.
Схема 6
В отличие от 6b винилоксисульфонилбромид 8 в ходе реакции c PBr3 образует циклический оксатиолан 9, который, вероятно, получается в результате внутримолекулярного присоединения промежуточно образующегося сульфенбромида к трифторвинилокси-группе. Следует отметить, что использование в этой реакции PCl3 приводит к образованию смеси BrCF2-оксатиолана 9 и ClCF2-оксатиолана 9’ в соотношении 3:1.
Схема 7
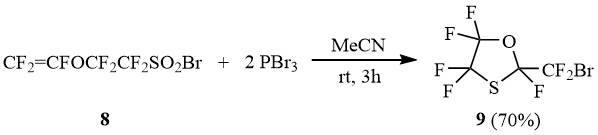
Подобные циклизации, приводящие к пятичленным циклам, вообще типичны для перфторалифатических соединений. В литературе представлены примеры нуклеофильного и свободно-радикального образования перфторированных 1,3-оксатиолан-3,3-диоксидов [15-16], а так же ряд других реакций приводящих к пятичленным циклическим продуктам [17-18].
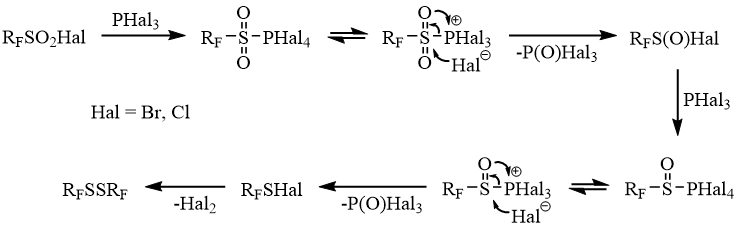
По всей вероятности восстановление сульфонил- и сульфинилгалогенидов осуществляется постадийно с участием сульфонил- и сульфинилтетрагалогенфосфоранов в качестве первичных интермедиатов реакции.
Схема 8
Генерация фторалифатических сульфенгалогенидов при восстановлении фторалкансульфонилгалогенидов тригалогенидами фосфора позволила предположить, что проведение этой реакции в присутствии непредельных углеводородов может приводить к образованию вицинальных фторалкилтиогалогенидов (электрофильное присоединение CF3SCl к циклическим и терминальным олефинам описано ранее [19]).
Действительно, реакция 1 с PCl3 в присутствии циклогексена приводит к образованию β-галогентрифторметилтиоциклогексанов 10-11, содержащих атомы как хлора, так и брома.
Схема 9
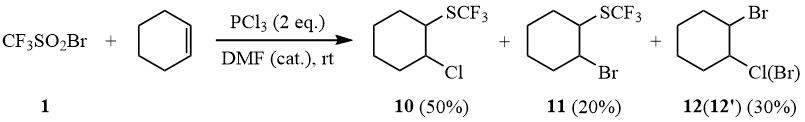
В свою очередь при восстановлении сульфонилбромида 1 PBr3 в присутствии циклогексена в растворе ацетонитрила образуется смесь продуктов 11 (84%), 12’ (16%).
Аналогично реакция этилциклопент-3-енилкарбоксилата с 1 и PCl3 приводит к образованию смеси стереоизомеров трифторметилтиохлоридов и бромидов.
С менее активными, чем циклоалкены, терминальными олефинами эта реакция осуществляется с образованием либо главным образом смеси марковниковского (M) и анти-марковниковского (a-M) продуктов присоединения сульфенгалогенидов к олефину, либо дисульфида 3 и дибромида алкена.
Так, реакция 1 с PCl3 в присутствии аллилтрифторацетамида приводит к образованию смеси региоизомеров 13-14 и незначительного количества дисульфида 3 и N-(2,3-дибромпропил)трифторацетамида.
Схема 10
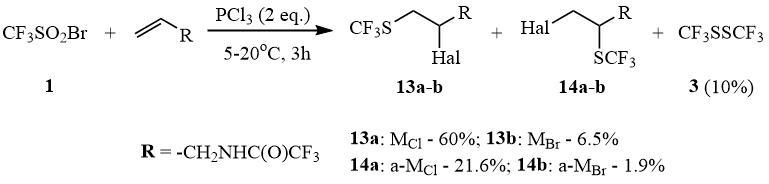
Аналогичная реакция с PBr3 приводит исключительно к дисульфиду 3 и дибромиду аллилтрифторацетамида, что можно объяснить относительно низкой стабильностью трифторметансульфенбромида.
В свою очередь, проведение реакции CF3SO2Br с PCl3 в присутствии аллилбромида приводит к образованию дисульфида 3 в качестве единственного фторорганического продукта.
Схема 11
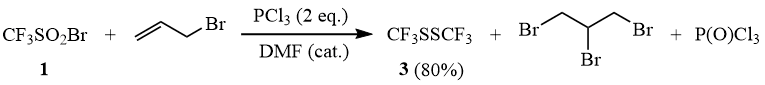
При действии PCl3 на сульфонилбромид 1 в присутствии аллилацетата и каталитических количеств DMF реализуются оба варианта реакции: наблюдается образование как продуктов сопряженного галогентрифторметилтиилирования аллилацетата в виде смеси региоизомеров, так и дисульфида 3 и 2,3-дибромпропилацетата в соизмеримых количествах (3 – 28%, MCl – 42%, a-MCl – 11%, MBr – 12%, a-MBr – 7%).
Трифторметансульфинат натрия (15) реагирует с PBr3 с образованием дисульфида 3 (подобно образованию дифенилдисульфида при действии PCl3 на PhSO2Na [5]). Скорее всего, восстановлению 15 предшествует образование трифторметансульфинилбромида (см. [20]), превращающегося далее в 3.
Схема 12
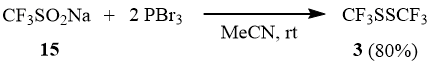
Регистрация продуктов постадийного восстановления фторалкансульфонилгалогенидов тригалогенидами фосфора – RFSO2Hal→RFSOHal→RFSHal→RFSSRF – позволяет считать, что цепь превращений, представленная на схеме 8, носит унитарный характер. В этой связи следует отметить, что получение продуктов трифторметилтиилирования электронодонорных гетероароматических соединений при действии на них смеси CF3SO2Na и PCl3 можно объяснить не только восстановлением соответствующих трифторметилсульфоксидов [21], но и действием на них промежуточно образующегося трифторметансульфенхлорида 4 (см. [22]).
Таким образом, показано, что восстановление перфторалкансульфонилбромидов тригалогенидами фосфора может использоваться для синтеза фторалифатических дисульфидов, в том числе и функционализованных, и, в ряде случаев, продуктов перфторалкилтиилирования непредельных соединений.
Экспериментальная часть
ЯМР 1H, 19F и 31P спектры записаны на спектрометре “Bruker AVANCE-300” при 300, 282 и 121 MHz, соответственно, внешний стандарт CDCl3. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7,26) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение. Химические сдвиги 31P спектров приведены относительно 85% H3PO4. Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra). Элементный анализ выполнен в Лаборатории микроанализа ИНЭОС РАН. Метод синтеза сульфонилбромидов 1, 6с-d и 8 описан ранее [16, 23-24]. Сульфонилбромид 6a получен аналогично. Сульфонилбромид 6b получен из соответствующего сульфонилфторида его восстановлением в сульфинат натрия под действием Na2SO3 с последующим бромированием (выход 60%).
Реакция CF3SO2Br с одним эквивалентом PCl3.
Смесь 102,76 г (0,482 моль) трифторметансульфонилбромида (1) и 66,25 г (0,482 моль) треххлористого фосфора выдерживают в течение 20-24 часов при температуре 20÷25°С, далее нагревают до кипения, отгоняя на колонке Вигре продукты с температурой кипения 25÷60°С используя для их конденсации холодильник со смесью лед-вода. Получают 62,4 г дистиллята, содержащего по данным ЯМР 19F-спектроскопии 5,8% CF3SSCF3 (δ: -47); 5,8% CF3SCl (δ: -51); 15% CF3SO2Br (δ: -78) и 73% CF3S(O)Cl (δ: -79). Анализ кубового остатка методом ЯМР 31P-спектроскопии показывает, что он представляет собой смесь: P(O)BrCl2 (δ: -29) и P(O)Cl3 (δ: 2) соотношением 1:1.
К полученному дистилляту при 0÷5°С добавляют 5 г циклогексена и ректификацией выделяют 30 г (40%) сульфинилхлорида 2, т.кип. 42-44oC, спектр ЯМР 19F δ: -77 (с, CF3).
Полученный продукт использовался в дальнейших синтезах без дополнительной очистки.
Восстановление сульфонилбромидов 1, 6a-d, 8 трехбромистым фосфором (общая методика).
К смеси 54,14 г (0,2 моль) трехбромистого фосфора и 30 мл ацетонитрила при перемешивании и температуре 5÷10°С прибавляют по каплям (0,1 моль) сульфонилбромида 1, 6a-d, 8. Смесь перемешивают при 20÷25°С в течение 3-х часов. Затем реакционную смесь порциями выливают на смесь льда с водой, нижний органический слой отделяют, промывают его несколько раз водой и перегоняют над P2O5. Полученный продукт дополнительно очищают ректификацией.
Гексафтордиметилдисульфид (3).
Выход 87%, т.кип. 33÷34°С. ЯМР 19F δ: -48 (с, SCF3) (перед перегонкой следы Br2 удаляют промыванием продукта водн. Na2SO3).
Дисульфид 3 может быть также получен реакцией сульфонилбромида 1 с PCl3, выход 57%.
Ди-4-гидроперфторбутилдисульфид (7a).
Выход 75%, т.кип. 189°С. Найдено (%): C, 19,28; H, 0,44; F, 64,77; S, 13,64. C8H2F16S2. Вычислено (%): C, 20,61; H, 0,43; F, 65,20; S, 13,75. ЯМР 1H δ: 5,87 (тт, 1H, 2JHF = 52 Гц, 3JHF = 4,8 Гц, HCF2); ЯМР 19F δ: -139,1 (д, 4F, 2JFH = 52 Гц, HCF2), -130,6 (c, 4F, CF2), -122,4 (c, 4F, CF2), -91,1 (c, 4F, CF2S).
Ди(перфтор-3,6-диокса-4-метилоктен-7-ил)дисульфид (7b).
Выход 77%, т.кип. 71÷73°С/0,5 Торр. Найдено (%): C, 21,30; F, 62,58; S, 8,04. C14F26O4S2. Вычислено (%): C, 21,28; F, 62,51; S, 8,11. ЯМР 19F δ: -147,3 (т, 1F, 3JFF = 21 Гц, CFCF3), -138,7 (дд, 1F, 3JFF-trans = 113 Гц, 3JFF-cis = 68 Гц, OCF=CF2), -125,2 (дд, 1F, 2JFF = 85 Гц, OCF=CF2-trans), -117,6 (дд, 1F, 2JFF = 85 Гц, OCF=CF2-cis), -96,8 (с, 2F, CF2S), -87,3 (уш.с, 2F, CF2O), -84,5 (м, 2F, CF2O), -82,7 (д, 3F, 3JFF = 6 Гц, CF3).
Ди-(5-фторсульфонилперфтор-3-оксаамил)дисульфид (7c).
Выход 70%, т.кип. 54÷55°С/0,3 Торр. Найдено (%): C, 14,29; F, 51,51; S, 19,38. C8F18O6S4. Вычислено (%): C, 14,51; F, 51,63; S, 19,36. ЯМР 19F δ: -114 (с, 4F, CF2SO2F), -96 (c, 4F, CF2S), -85,8 + -83,6 (два c, 8F, CF2OCF2), 43,9 (c, 2F, SO2F).
Ди-(7-метоксикарбонилперфтор-3,6-диокса-4,7-диметилгептил)дисульфид (7d).
Смесь стереоизомеров. Выход 70%, т.кип. 112÷122°С/0,3 Торр. Найдено (%): C, 22,75; H, 0,65; F, 56,35; S, 6,59. C18H6F28O8S2. Вычислено (%): C, 22,85; H, 0,64; F, 56,21; S, 6,78. ЯМР 1H δ: 3,97 (c, 3H, CH3); ЯМР 19F δ: -146,5 (дд, 2F, CF2OCFCF2O), -133,8 (дд, 2F, OCFCO2Me), -98,5 (уш.c, 4F, CF2S), -90,6÷-89,5+-84,3÷-83,2 (м, 4F, OCFCF2O), -87,7 (c, 6F, CF3), -87,5÷-86,5 (м, 4F, SCF2CF2O), -85,2 (c, 6F, CF3).
2-(Бромдифторметил)-2,4,4,5,5-пентафтор-1,3-оксатиолан (9).
Выход 70% (смесь энантиомеров), т.кип. 94÷95°С. Найдено (%): C, 15.50; Br, 26.10; F, 42.91; S, 10.05. C4BrF7OS. Вычислено (%): C, 15.55; Br, 25.86; F, 43.04; S, 10.38. ЯМР 19F δ: -93,4, -87,2 (АВкв, 2F, 2JFF = 209 Гц, CF2S), -92,8, -83,3 (АВкв, 2F, 2JFF = 131 Гц, CF2O), -86,6 (c, 1F, CF), -67,3 (c, 2F, CF2Br). Масс-спектр (M/Z, отнесение): 308[M]+, 289[M-F]+, 261[M-COF]+, 229[M-Br]+, 201[M-Br-C-O]+, 179[M-CF2Br]+(100%), 129[CF2Br]+, 119[C2F5]+, 113[C2F3S]+, 100[C2F4]+, 82[CF2S]+, 69[CF3]+, 63[CFS]+, 47[COF]+.
2-(Хлордифторметил)-2,4,4,5,5-пентафтор-1,3-оксатиолан (9’).
Получен в смеси с бромидом 9 в соотношении 9/9’=3/1 по реакции 8 с двумя эквивалентами PCl3.
Масс-спектр (M/Z, отнесение): 245[M-F]+, 229[M-Cl]+, 217[M-COF]+, 201[M-Cl-C-O]+, 179[M-CF2Cl]+(100%), 163[C2F4SCF]+, 135[C2F4Cl]+, 119[C2F5]+, 113[C2F3S]+, 100[C2F4]+, 85[CF2Cl]+, 82[CF2S]+, 69[CF3]+, 63[CFS]+, 47[COF]+.
Реакция трифторметансульфонилбромида 1 с PCl3 (2 экв.) в присутствии олефинов (общая методика).
К смеси 27,5 г (0,2 моль) треххлористого фосфора и (0,1 моль) олефина добавляют 1 каплю диметилформамида и при перемешивании и температуре 5÷10°С прибавляют по каплям 21,3 г (0,1 моль) сульфонилбромида 1. Смесь выдерживают при 20÷25°С в течение 3-20 час., контролируя реакцию методом ЯМР 19F.
Затем отгоняют в вакууме (10 торр) в охлаждаемую ловушку (-70°С) низкокипящие компоненты смеси и дальнейшей перегонкой кубового остатка в вакууме выделяют смесь продуктов галотрифторметилтиилирования олефина, которую анализируют методом ЯМР 19F и хромато-масс-спектрометрии.
Реакция в присутствии циклогексена.
В результате реакции с циклогексеном получена смесь продуктов (ЯМР 19F): 50% 10 (δ: -40,2); 20% 11 (δ: -40,4); 30% 12+12’.
(β-Хлорциклогексил)трифторметилсульфид (10).
ЯМР 1H δ: 1,3-1,6 (м, 3H, cyclohexyl), 1,6-1,85 (м, 3H, cyclohexyl), 2,15 (м, 1H, cyclohexyl), 2,35 (м, 1H, cyclohexyl), 3,4 (м, 1H, CHSCF3), 4,05 (м, 1H, CHCl); ЯМР 19F δ: -40,2 (c, SCF3). Масс-спектр (M/Z, отнесение): 218[M]+, 199[M-F]+, 183[M-Cl]+, 149[M-CF3]+, 141[C3H4SCF3]+, 128[C2H3SCF3]+, 117[C6H10Cl]+, 81[C6H9]+(100%), 79[C6H7]+, 77[C6H5]+, 67[C5H7]+, 59[C2H3S]+, 53[C4H5]+, 45[CHS]+, 39[C3H3]+.
Аналогично, с использованием 2-х эквивалентов PBr3 в ацетонитриле, получена смесь продуктов (ЯМР 19F): 84% 11 (δ: -40,4); 16% 12’.
(β-Бромциклогексил)трифторметилсульфид (11).
Масс-спектр (M/Z, отнесение): 262[M]+, 183[M-Br]+, 161[C6H10Br]+, 141[C3H4SCF3]+, 128[C2H3SCF3]+, 81[C6H9]+(100%), 79[C6H7]+, 77[C6H5]+, 67[C5H7]+, 59[C2H3S]+, 53[C4H5]+, 45[CHS]+, 39[C3H3]+.
Реакция в присутствии аллилтрифторацетамида.
В этом случае реакция не требует катализа DMF. Получена смесь продуктов (ЯМР 19F): 10% CF3SSCF3 (δ: -47); 60% MCl 13a (δ: -40,93); 21,6% a-MCl 14a (δ: -42,34); 6,5% MBr 13b (δ: -40,84); 1,9% a-MBr 14b (δ: -42,27).
N-(3-трифторметилтио-2-хлорпропил)трифторацетамид (13a).
Масс-спектр (M/Z, отнесение): 290[M+H]+, 270[M-F]+, 254[M-Cl]+, 234[M-Cl-HF]+, 188[M-CF3S]+, 184[M-HCl-CF3]+, 177[M-NHCOCF3]+, 168[C5H5F3NS]+, 152[C5H5F3NO]+(100%), 128[C3H3F3S]+, 126[C3H3F3NO]+, 115[C2H2F3S]+, 78[COCF2]+, 69[CF3]+, 59[COCF]+, 45[CHS]+, 39[C3H3]+.
N-(3-хлор-2-трифторметилтиопропил)трифторацетамид (14a).
Масс-спектр (M/Z, отнесение): 290[M+H]+, 270[M-F]+, 254[M-Cl]+, 200[M-HF-CF3]+, 188[M-CF3S]+, 184[M-HCl-CF3]+, 168[C5H5F3NS]+, 152[C5H5F3NO]+(100%), 141[M-HCl-NHCOCF3]+, 126[C3H3F3NO]+, 115[C2H2F3S]+, 78[COCF2]+, 69[CF3]+, 45[CHS]+, 39[C3H3]+.
N-(3-трифторметилтио-2-бромпропил)трифторацетамид (13b).
Масс-спектр (M/Z, отнесение): 334[M+H]+, 314[M-F]+, 254[M-Br]+, 234[M-Br-HF]+, 221[M-NHCOCF3]+, 184[M-HBr-CF3]+, 168[C5H5F3NS]+(100%), 152[C5H5F3NO]+, 141[M-HBr-NHCOCF3]+, 128[C3H3F3S]+, 126[C3H3F3NO]+, 115[C2H2F3S]+, 78[COCF2]+, 69[CF3]+, 59[COCF]+, 45[CHS]+, 39[C3H3]+.
N-(3-бром-2-трифторметилтиопропил)трифторацетамид (14b).
Масс-спектр (M/Z, отнесение): 334[M+H]+, 314[M-F]+, 254[M-Br]+, 234[M-Br-HF]+, 221[M-NHCOCF3]+, 184[M-HBr-CF3]+, 168[C5H5F3NS]+, 152[C5H5F3NO]+(100%), 141[M-HBr-NHCOCF3]+, 128[C3H3F3S]+, 126[C3H3F3NO]+, 115[C2H2F3S]+, 78[COCF2]+, 69[CF3]+, 59[COCF]+, 45[CHS]+, 39[C3H3]+.
Реакция в присутствии аллилацетата.
В результате реакции с аллилацетатом получена смесь продуктов (ЯМР 19F): 28% CF3SSCF3 (δ: -47); 42% MCl (δ: -41,05); 11% a-MCl (δ: -42,3); 12% MBr (δ: -40,98); 7% a-MBr (δ: -42,22).
Реакция CF3SO2Br с двумя эквивалентами PCl3 в присутствии аллилбромида.
К смеси 27,4 г (0,2 моль) треххлористого фосфора и 6,05 г (0,05 моль) аллилбромида добавляют 1 каплю диметилформамида и при перемешивании и температуре 10÷15°С прибавляют по каплям 21,3 г (0,1 моль) трифторметансульфонилбромида (1). Смесь выдерживают при 20÷25°С в течение 3 часов и перегонкой на колонке Вигре выделяют 8 г (80%) CF3SSCF3 (3).
Реакция CF3SO2Na с двумя эквивалентами PBr3 в ацетонитриле.
К суспензии 10 г (64 ммоль) трифторметансульфината натрия (15) в 10 мл ацетонитрила добавляют по каплям при перемешивании и температуре 5÷10°С 34,65 г (0,128 моль) трехбромистого фосфора. Смесь перемешивают при 20÷25°С в течение 3 часов и оставляют на ночь, далее нагревают до кипения, отгоняя продукты с температурой кипения до 80°С, используя для их конденсации холодильник со смесью лед-вода. Полученный дистиллят промывают ледяной 5% соляной кислотой и перегонкой над P2O5 получают 5,2 г (80%) CF3SSCF3 (3).
Литература
- Michaelis, Bull.Soc.Chim., 1871, 15, 185.
- H.B. North, J.C. Thomson, JACS, 1918, 40, 774-777.
- E. Krumbiegel, Pat. DE415312C (1925).
- Handbook of Preparative Inorganic Chemistry V.1, 2nd Ed., G. Brauer, Acad. Press Inc., N.Y., London, Trans. from the Germ., 1963, p. 387.
- R. Otto, A. Rossing, Ber., 1891, 24, 3874-3883.
- A.H. Kohlhase, JACS, 1932, 54, 2441-2448.
- W.H. Hunter, B.E. Sorenson, JACS, 1932, 54, 3364-3367.
- W.H. Hunter, B.E. Sorenson, JACS, 1932, 54, 3368-3374.
- A.H. Kohlhase, JACS, 1933, 55, 1291-1292.
- L.I. Zakharkin, G.G. Zhigareva, Zh.Org.Khim., 1973, 9, 891-895.
- A.A. Tyutyunov, L.F. Ibragimova, N.D. Kagramanov, S.R. Sterlin, S.M. Igumnov, XI All-Russian Conference “FLUORINE CHEMISTRY” (devoted to the 110th anniversary of academician I.L. Knunyants), June 26-30, 2016, Moscow Russia, O-43.
- C.T. Ratcliffe, J.M. Shreeve, JACS, 1968, 90, 5403-5408.
- Comprehensive Handbook of Chemical Bond Energies, Yu-Ran Luo, CRC Press, Taylor & Francis Group, Boca Raton, London, New York, 2007.
- T. Mahmood, J.M. Shreeve, Inorg.Chem., 1985, 24, 1395-1398.
- P.R. Resnick, US Pat. №3,560,568 (1971).
- A.A. Tyutyunov, L.F. Ibragimova, N.D. Kagramanov, N.I. Delyagina, V.F. Cherstkov, S.R. Sterlin, S.M. Igumnov, Fluorine notes, 2015, 5(102).
- S.D. Chepik, V.F. Cherstkov, S.R. Sterlin, L.S. German, Bull.Acad.Sci. USSR, div.chem.sci., 1990, 39, 1992-1992.
- S.D. Chepik, V.F. Cherstkov, E.I. Mysov, A.F. Aerov, M.V. Galakhov, S.R. Sterlin, L.S. German, Bull.Acad.Sci. USSR, div.chem.sci., 1991, 40, 2285-2291.
- A. Haas, M. Lieb, Y. Zhang, JFC, 1985, 30, 203-210.
- H.W. Roesky, S. Tutkunkardes, Chem.Ber., 1974, 107, 508-517.
- X. Zhao, A. Wei, B. Yang, T. Li, Q. Li, D. Qiu, K. Lu, JOC, 2017, 82, 9175-9181.
- D.-W. Sun, X. Jiang, M. Jiang, Y. Lin, J.-T. Liu, Eur. JOC, 2017, 24, 3505-3511.
- W.-Y. Huang, L. Lu, Chin.J.Chem., 1992, 10, 268-273.
- A.A. Tyutyunov, L.F. Ibragimova, N.D. Kagramanov, S.R. Sterlin, S.M. Igumnov, Fluorine notes, 2016, 6(109).
Статья рекомендована к публикации членом редколлегии д.х.н. С.Р. Стерлиным
Fluorine Notes, 2018, 117, 1-2


