Поступило в редакцию: Февраль 2018
Fluorine Notes, 2018, 116, 9-10
Синтез 5-нитро-пиразол трифлонов через [3+2] циклоприсоединение и их применение для потенциальных инсектицидов
Pulakesh Das,1 Hiroto Uno, 1 Etsuko Tokunaga, 1 Yuji Sumii 1 и Norio Shibata1,2*
1Department of Nanopharmaceutical Sciences, and Department of Life Science and Applied Chemistry, Nagoya Institute of Technology, Gokiso, Showa-ku, Нагоя 466-8555, Япония
E-mail: nozshiba@nitech.ac.jp; TEL; +81-52-735-7543
2Institute of Advanced Fluorine-Containing Materials, Zhejiang Normal University, 688 Yingbin Avenue, 321004 Jinhua, China
Аннотация: Синтез 5-нитро-пиразол трифлонов 6 был осуществлен с помощью реакции [3+2] циклоприсоединения 2-диазо-1-фенил-2-((трифторметил)сульфонил)этан-1-она (3) и производных α-бромнитростирола 7 в основных условиях со средними и хорошими выходами. 5-Амино-N-пиримидинил-пиразол трифлон 2a, представляющий интерес для агрохимии, был успешно получен в две стадии из 5-нитро-пиразол трифлона 6c.
Ключевые слова: 5-нитро-пиразол трифлоны, α-бромнитростирол, [3+2] циклоприсоединение
Введение: Пиразол-содержащие фрагменты часто встречаются в качестве составных частей биологически активных молекул [1]. В частности, пиразолы с арильными или гетероарильными заместителями в положении N-1 и свободной NH2 группой в положении С-5 привлекли большое внимание ввиду их активности, необходимой для производства фармацевтических [2] и агрохимических [3] продуктов. Точнее, 1-арилпиразолы имеющие такие заместители как алкил, тио-алкил, ацил или циано-групу в положении С-3 или С-4, проявляют потенциальные инсектицидные свойства [4]. Один из пиразолсодержащих пестицидов Фипронил® (5-амино1-(2,6-дихлоро-4-трифторметилфенил)- 4-трифлюорометансульфинил-1H-пиразол-3-карбонитрил) - является высокоэффективным широко применяемым инсектицидом, а также ветеринарным средством против блох и клещей [5] (Рисунок 1). Однако использование Фипронила® является предметом обсуждения из-за недавнего инцидента, связанного с безопасностью пищевых продуктов [6]. Таким образом, разработка более безопасных производных Фипронила® имеет большое значение. Компанией Bayer CropScience AG были получены патенты на серу содержащие производные пиримидинил-пиразол-5-аминов 1, которые проявили сильные инсектицидные и/или антипаразитные свойства [3a,7]. Вдохновившись патентами Bayer CropScience AG, мы заинтересовались трифлил (трифторметансульфонил, SO2CF3) производными (трифлонами) 2 в качестве потенциальных пестицидов.
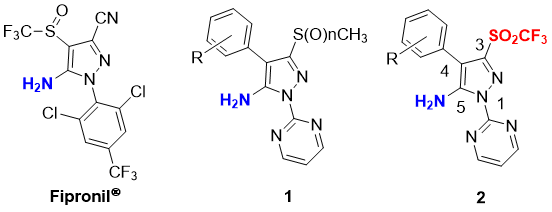
Рисунок 1. Фипронил® и его представляющие интерес с точки зрения биологической активности производные, содержащие арильный или гетероарильный заместитель в положении N-1 и свободную NH2 - группу в положении C-5.
Введение одного или нескольких атомов фтора или фторированных функциональных групп в органические соединения является одним из эффективных способов улучшения/изменения биологической активности, а также повышает устойчивость исходных молекул к инактивации в процессе метаболизма [8]. В случае целевых продуктов 5-амино-пиразол трифлонов 2 введение липофильной трифлильной группы (π = 0.55) в C-3 положение соединения 2 может изменить химические, физические и биологические свойства исходных гетероциклических 5-амино-пиразолов. Кроме того, предполагается, что разновидности трифлонов 2 также имеют пониженную основность аминогруппы ввиду сильного электроноакцепторного влияния трифлильной группы (σm = 0.79, σp = 0.93) [9]. На протяжении длительного времени наша научная группа занималась разработкой новых, имеющих длительный срок хранения реагентов для реакций фтор-функционализации [10,11]. Одно из таких уникальных соединений — 2-диазо-1-фенил-2-((трифторметил)-сульфонил)этан-1-он (3) [12]. Соединение 3 изначально было нами разработано в качестве реагента для реакций электрофильного трифторметилирования. Многие нуклеофиолы, такие как енамины, индолы, β-кетоэфиры и пирролы хорошо трифторметилируются в мягких условиях соединением 3 в присутствии медного катализатора [12a]. С использованием соединения 3 также возможно проведение трифторметилирования ароматических соединений. С другой стороны, соединение 3 также может быть эффективным строительным блоком для получения множества трифлонов, например, β-лактам трифлонов [12c]. Недавно нами был описан синтез пиразол трифлонов 4 через [3+2] циклоприсоединение 3 к нитростиролам 5 (Схема 1a) [12d]. В присутствии NaOMe реагент 3 in situ генерирует реакционноспособные трифлил-диазометановые анионы A, реагирующие с нитростиролами 5. Для расширения нашей научной работы по гетероцикличным трифлонам [12], мы описали новый метод получения 5-амино-N-пиримидинил-пиразол трифлонов 2. Важными прекурсорами для получения соединений 2 являются 5-нитро-пиразол трифлоны 6, которые могут быть синтезированы реакцией диазосоединения 3 с α-бромнитростиролами 7 в основных условиях (Схема 1b). Селективное элиминирование брома вместо нитро-группы в 7 на стадии реакции замыкания цикла блокирует образование 5-бром-пиразол трифлонов 8 и является ключом к успеху [13]. Был исследован ряд α-бромнитростиролов 7 в реакциях получения соединений типа 6. В дальнейшем 5-нитро-пиразол трифлон 6c в две стадии был успешно превращен в желаемый 5-амино-N-пиримидинил-пиразол трифлон 2a с хорошим выходом (Схема 1b).
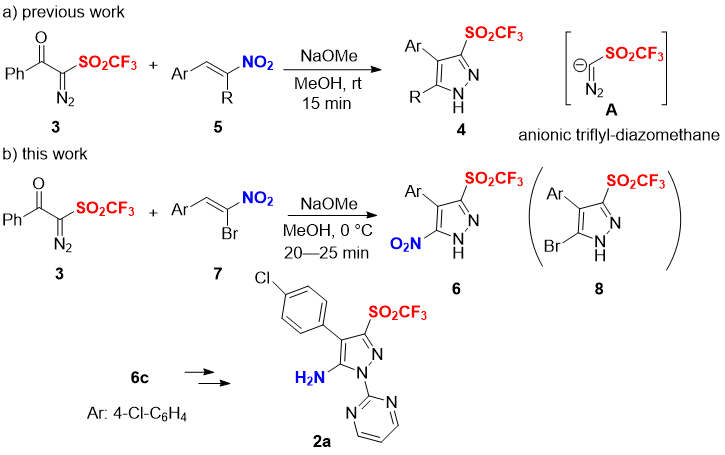
Схема 1. a) Синтез пиразол трифлонов 4 реакцией [3+2] циклоприсодинения 3 с нитростиролами 5 (предыдущая работа); b) Селективный синтез 5-нитро-пиразол трифлонов 6 и превращение 6c в 5-амино-N-пиримидинил-пиразол трифлон 2a (настоящая статья).
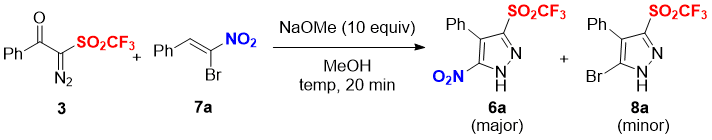
Основываясь на нашей предыдущей работе [12d], мы постарались оптимизировать температуру для реакций 3 с α-бромнитростиролом 7a в присутствии 10 эквивалентов NaOMe в MeOH (Таблица 1). Требуемый 5-нитро-пиразол трифлон 6a был получен с 62% выходом наряду с 5-бром-пиразол трифлоном 8a с 17% выходом при температуре 0 °C в течение 20 минут (entry 1). Понижение температуры реакции до –10 °C не повлияло на выход и распределение продуктов (entry 2). При увеличении количества вещества 3 с 1.2 до 1.5 эквивалентов наблюдалось увеличение выхода 6a до 64%, а 8a – до 19% (entry 3), в то время как понижение температуры с 1.5 эквивалентами вещества 3 не оказало влияния на получение нитро продукта 6a при наличии небольшого увеличения - до 21% выхода бромпроизводного 8a (entry 4). Таким образом, оптимальным было признано проведение реакции вещества 3 (1.5 эквивалентов) и α-бромнитростиролов 7 (1.0 эквивалентов) в присутствии NaOMe (10.0 эквивалентов) в MeOH при температуре 0 °C в течение 20 минут (entry 3).
Таблица 1. Оптимизация реакции циклоприсоединения [3+2]a
|
No |
3 (эквив) |
7a (эквив) |
температура (°C) |
выход (%) |
|
|
6a |
8a |
||||
|
1 |
1.2 |
1.0 |
0 |
62 |
17 |
|
2 |
1.2 |
1.0 |
–10 |
63 |
20 |
|
3 |
1.5 |
1.0 |
0 |
64 |
19 |
|
4 |
1.5 |
1.0 |
–10 |
64 |
21 |
aУсловия реакции: Исследования проводились с веществами 3 (1.2 или 1.5 эквивалента), 7a (1.0 эквивалент), NaOMe (10 эквивалентов), MeOH (1.0 мл) при указанной температуре в течение 20 минут.
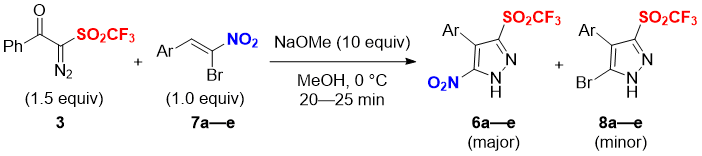
Оптимизировав условия реакции, мы исследовали ряд субстратов в реакциях [3+2] циклоприсоединения, как показано в Таблице 2. Все реакции прошли гладко и в качестве основных продуктов были получены желаемые 5-нитро-пиразол трифлоны 6b-e с хорошими выходами и с селективностью, похожей на результаты реакции с веществом 7a. Использование субстрата 7b с электронодонорным заместителем 4-Me-C6H4 приводит к получению продуктов с похожим выходом и избирательностью (6b: 67%, 8b: 23%). Реакция галогензамещённых α-бромнитростиролов (7c: 4-Cl-C6H4; 7d: 3-Br-C6H4; 7e: 4-F-C6H4) привели к получению 5-нитро-пиразол трифлонов 6 с более высокими выходами (6c: 77%; 6d: 76%; 6e: 69%) наряду с соответствующими побочными бром-содержащими продуктами 8 (8c: 15%; 8d: 18%; 8e: 17%) (Таблица 2).
Далее нами был проанализирован синтез 5-амино-N-пиримидинил-пиразол трифлона 2a. Восстановление нитро-группы в 6c путем гидрогенизации в присутствии Pd-C в MeOH позволило получить 5-амино-пиразол трифлон 9, последующее нуклеофильное присоединение к 2-хлорпиримидину в присутствии NaH при нагревании приводит к получению потенциально биологически активного 5-амино-N-пиримидинил-пиразол трифлона 2a с выходом 35% (Схема 2).
Таблица 2. Реакции диазотрифлона 3 с α-бромнитроалкенами 7a-ea
|
entry |
7 |
Ar |
Выход (%) |
|
|
6 |
8 |
|||
|
1 |
7a |
Ph |
6a: 64 |
8a: 19 |
|
2 |
7b |
4-Me-C6H4 |
6b: 67 |
8b: 23 |
|
3 |
7c |
4-Cl-C6H4 |
6c: 77 |
8c: 15 |
|
4 |
7d |
3-Br-C6H4 |
6d: 76 |
8d: 18 |
|
5 |
7e |
4-F-C6H4 |
6e: 69 |
8e: 17 |
aИсследования проводились с веществами 3 (1.5 эквивалента), 7a-e (1.0 эквивалент) и NaOMe (10 эквивалентов) в сухом MeOH при температуре 0 °C в течение 20–25 минут.
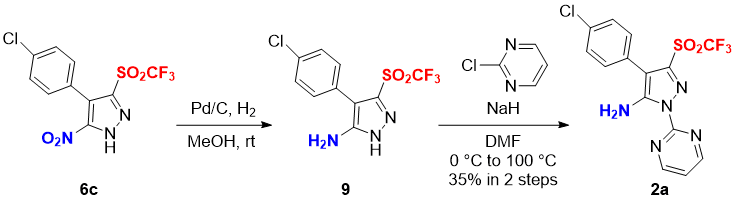
Схема 2. Синтез 5-амино-N-пиримидинил-пиразол трифлона 2a.
Таким образом, нами был описан синтез 5-нитро-пиразол трифлонов 6 через [3+2] циклоприсоединение 2-диазо-1-фенил-2-((трифторметил)сульфонил)этан-1-она 3 и производных α-бромнитростирола 7 в основных условиях с хорошими выходами. Было продемонстрировано успешное превращение в две стадии 5-нитро-пиразол трифлона 6 в представляющий интерес для агрохимии 5-амино-N-пиримидинил-пиразол трифлон 2a. Синтез ряда 5-амино-N-пиримидинил-пиразол трифлонов и исследование их инсектицидных свойств находятся в процессе разработки.
Экспериментальная часть
Все реакции проводились в высушенной в печи стеклянной посуде при избыточном давлении азота или аргона (кроме случаев, когда указано иное). Растворители подавались при помощи шприца и вводились в реактор через силиконовую прокладку. Все реакции контролировались с помощью тонкослойной хроматографии (ТСХ), использовали силикагель (Merck) 0,25мм (60-F254). Пластины ТСХ проявляли УФ-светом и KMnO4 в воде/при нагревании. Хроматографическая колонка была наполнена силикагелем (60N размер частиц 40-50 µm) для колоночной хроматографии. 1H ЯМР (300 МГц), 19F ЯМР (282 МГц), и 13C ЯМР (126 МГц) спектры в растворе CDCl3 и CD3OD записывались на ЯМР спектрометрах Varian Mercury 300 и Bruker Avance 500. Химические сдвиги (δ) выражены в ppm, с использованием ТМС (δ = 0.00) или C6F6 [δ = −162.2 (CDCl3)] в качестве внутреннего стандарта. Масс-спектры записывались на SHIMAZU LCMS-2020 (ESI-MS). Масс-спектрометрические измерения с высоким разрешением записывались на Waters Synapt G2 HDMS (ESI-MS), Waters GCT premier (EI-MS). Растворители CH3CN, CH2Cl2, ДМФА перед использованием сушили и перегоняли. 2-Диазо-1-фенил-2-((трифторметил)-сульфонил)этан-1-он (3) [12c] и (Z)- α-бромнитростиролы 7a—e [14] получены по литературным методикам.
Общая методика для синтеза 5-нитро-4-арил-пиразол трифлонов (6) и 5-бром-4-арил-пиразол трифлонов (8) из 3 и (Z)-1-(2-бром-2-нитровинил)бензолов (7) (Способ A)
В раствор (Z)-α-бромнитростирола 7 (0.1 моль, 1.0 эквив) и 2-диазо-1-фенил-2-((трифторметил)-сульфонил)этан-1-она (3) (0.15 моль, 1.5 эквив) в сухом MeOH (1.0 мл) при перемешивании и температуре 0 °C добавляли NaOMe (10.0 эквив), затем полученную смесь перемешивали в течение 20-25 минут в атмосфере аргона при той же температуре (процесс реакции контролировался с помощью ТСХ). По окончании реакционную смесь концентрировали при пониженном давлении. Добавляли воду и нейтрализовали 5%-ным раствором HCl, экстрагировали этил ацетатом. Органический слой промывали раствором NaCl и сушили над Na2SO4, смесь упаривали в вакууме. Полученный продукт очищали колоночной хроматографией (CH2Cl2/MeOH = 10:1) до получения желаемого замещенного 5-нитро-4-арил-3-((трифторметил)сульфонил)-1H-пиразола 6 и 5-бром-4-арил-3-((трифторметил)сульфонил)-1H-пиразола 8.
5-нитро-4-фенил-3-((трифторметил)сульфонил)-1H-пиразол (6a) и 5-бром-4-фенил-3-((трифторметил)сульфонил)-1H-пиразол (8a):
Смесь (Z)-(2-бром-2-нитровинил) бензола 7a (0.1 моль, 0.023 г, 1.0 эквив), 3 (0.15 моль, 0.042 г, 1.5 эквив) и NaOMe (1.0 моль, 0.054 г, 10.0 эквив) в сухом MeOH (1.0 мл) перемешивают в течение 20 минут при температуре 0 °C и получают продукты 6a (0.0205 г, 64 %) в виде твердого вещества бледно-желтого цвета и 8a (0.0068 g, 19 %) в виде твердого вещества коричневого цвета.
6a: Mp: 313–315 °C (метанол); 1H NMR (CDCl3, 300 MHz) δ: 7.56–7.44 (m, 3H), 7.40–7.31 (m, 2H); 19F NMR (CDCl3, 282 MHz) δ: –77.96 (s, 3F); 13C NMR (CD3OD, 126 MHz) δ: 151.51, 138.17, 131.37, 130.22, 128.86, 127.58, 125.48, 120.81 (q, J = 324.8 Hz); IR (KBr): 3581, 3334, 3066, 1963, 1673, 1560, 1506, 1378, 1232, 1110, 921 cm-1; HRMS (ESI–TOF): вычислено для C10H5F3N3O4S [M–H]– 319.9953; найдено 319.9981.
8a: Mp: 152–155 °C (CH2Cl2); 1H NMR (CDCl3, 300 MHz) δ: 7.49–7.43 (m, 3H), 7.41–7.36 (m, 2H); 19F NMR (CDCl3, 282 MHz) δ: –78.30 (s, 3F); 13C NMR (CDCl3, 126 MHz) δ: 130.49, 129.92, 129.55, 129.28, 128.49, 127.82, 126.77, 119.51 (q, J = 326.0 Hz); IR (KBr): 3642, 3210, 3116, 2672, 1959, 1654, 1533, 1386, 1114, 987, 717 cm-1; HRMS (ESI–TOF): вычислено для C10H6F3N2O2SBrNa [M+Na]+ 376.9183; найдено 376.9177.
5-нитро-4-(п-толил)-3-((трифторметил)сульфонил)-1H-пиразол (6b) и 5-бром-4-(п-толил)-3-((трифторметил)сульфонил)-1H-пиразол (8b):
Смесь (Z)-1-(2-бром-2-нитровинил)-4-метилбензола 7b (0.3 моль, 0.0726 г, 1.0 эквив), 3 (0.45 моль, 0.125 г, 1.5 эквив) и NaOMe (3.0 моль, 0.162 г, 10.0 эквив) в сухом MeOH (3.0 мл) перемешивают в течение 20 минут при температуре 0 °C и получают продукты 6b (0.0677 г, 67%) в виде твердого вещества бледно-желтого цвета и 8b (0.0251 g, 23%) в виде твердого вещества коричневого цвета.
6b: Mp: 305–308 °C (метанол); 1H NMR (CDCl3, 300 MHz) δ: 7.34–7.15 (m, 4H), 2.43 (s, 3H); 19F NMR (CDCl3, 282 MHz) δ: –78.12 (s, 3F); 13C NMR (CD3OD, 126 MHz) δ: 155.17, 139.39, 139.21, 131.23, 129.18, 126.95, 125.27, 121.20 (q, J = 325.0 Hz), 21.37; IR (KBr): 3596, 3210, 3035, 1720, 1670, 1529, 1371, 1224, 1110, 995 cm-1; HRMS (ESI–TOF): calcd for C11H7F3N3O4S [M–H]– 334.0109, обнаружено 334.0108.
8b: Mp: 133–134 °C (CH2Cl2); 1H NMR (CDCl3, 300 MHz) δ: 7.29–7.25 (m, 4H), 2.41 (s, 3H); 19F NMR (CDCl3, 282 MHz) δ: –78.33 (s, 3F); 13C NMR (CDCl3, 126 MHz) δ: 139.55, 130.33, 129.72, 129.23, 127.77, 125.33, 123.79, 119.53 (q, J = 325.7 Hz), 21.56; IR (KBr): 3612, 3237, 3097, 2350, 1901, 1662, 1498, 1382, 1106, 975, 717 cm-1; HRMS (ESI–TOF): calcd for C11H8F3N2O2SBrNa [M+Na]+ 390.9340, обнаружено 390.9333.
4-(4-хлорфенил)-5-нитро-3-((трифторметил)сульфонил)-1H-пиразол (6c) и 5-бром-4-(4-хлорфенил)-3-((трифторметил)сульфонил)-1H-пиразол (8c):
Смесь (Z)-1-(2-бром-2-нитровинил)-4-хлорбензола 7c (0.3 моль, 0.0787 г, 1.0 эквив), 3 (0.45 моль, 0.125 г, 1.5 эквив) и NaOMe (3.0 моль, 0.162 г, 10.0 эквив) в сухом MeOH (3.0 мл) перемешивают в течение 20 минут при температуре 0 °C и получают продукты 6c (0.0825 г, 77 %) в виде твердого вещества коричневато-желтого цвета и 8c (0.0177 г, 15 %) в виде твердого вещества коричневого цвета.
6c: Mp: 271–273 °C (метанол); 1H NMR (CDCl3, 300 MHz) δ: 7.38 (d, J = 8.1 Hz, 2H), 7.16 (d, J = 8.2 Hz, 2H), 3.04 (br s, 1H); 19F NMR (CDCl3, 282 MHz) δ: –78.47 (s, 3F); 13C NMR (CD3OD, 126 MHz) δ: 156.09, 139.82, 135.04, 132.99, 129.66, 128.60, 123.65, 121.26 (q, J = 325.2 Hz); IR (KBr): 3507, 3241, 3073, 2609, 1897, 1635, 1529, 1367, 1220, 1106, 848 cm-1; HRMS (ESI–TOF): вычислено для C10H4F3N3O4SCl [M–H]– 353.9563; найдено 353.9581.
8c: Mp: 136–138 °C (CH2Cl2); 1H NMR (CDCl3, 300 MHz) δ: 7.45 (d, J = 8.4 Hz, 2H), 7.33 (d, J = 8.4 Hz, 2H); 19F NMR (CDCl3, 282 MHz) δ: –78.32 (s, 3F); 13C NMR (CDCl3, 126 MHz) δ: 135.73, 133.76, 131.71, 130.22, 128.75, 126.43, 125.12, 119.34 (q, J = 325.9 Hz); IR (KBr): 3619, 3131, 2923, 2327, 1540, 1459, 1390, 1110, 987, 829, 717 cm-1; HRMS (ESI–TOF): вычислено для C10H4F3N2O2SClBr [M–H]– 386.8817; найдено 386.8824.
4-(3-Бромфенил)-5-нитро-3-((трифторметил)сульфонил)-1H-пиразол (6d) и 5-Бром-4-(3-бромфенил)-3-(( трифторметил)сульфонил)-1H-пиразол (8d):
Смесь (Z)-1-бром-3-(2-бром-2-нитровинил)бензола 7d (0.3 моль, 0.092 г, 1.0 эквив), 3 (0.45 моль, 0.125 г, 1.5 эквив) и NaOMe (3.0 моль, 0.162 г, 10.0 эквив) в сухом MeOH (3.0 mL) перемешивают в течение 20 минут при температуре 0 °C и получают продукты 6d (0.0917 г, 76 %) в виде твердого вещества коричневато-желтого цвета и 8d (0.024 g, 18%) в виде твердого вещества коричневого цвета.
6d: Mp: 266–268 °C (метанол); 1H NMR (CDCl3, 300 MHz) δ: 7.59 (d, J = 7.5 Hz, 1H), 7.43 (s, 1H), 7.36–7.26 (m, 1H), 7.20 (d, J = 7.4 Hz, 1H); 19F NMR (CDCl3, 282 MHz) δ: –78.54 (s, 3F); 13C NMR (CD3OD, 126 MHz) δ: 156.12, 139.87, 134.13, 133.27, 131.95, 130.31, 130.17, 123.17, 122.15, 121.26 (q, J = 325.3 Hz); IR (KBr): 3569, 3226, 3085, 2613, 1743, 1552, 1521, 1378, 1205, 1106, 840, 624 cm-1. HRMS (ESI–TOF): вычислено для C10H4F3N3O4SBr [M–H]– 397.9058; найдено 397.9055.
8d: Mp: 115–116 °C (CH2Cl2); 1H NMR (CDCl3, 300 MHz) δ: 7.61 (d, J = 5.9 Hz, 1H), 7.54 (s, 1H), 7.40–7.31 (m, 2H); 19F NMR (CDCl3, 282 MHz) δ: –78.27 (s, 3F); 13C NMR (CD3OD, 126 MHz) δ: 134.51, 134.04, 133.04, 131.41, 130.96, 130.67, 129.47, 126.43, 122.86, 120.90 (q, J = 325.3 Hz); IR (KBr): 3667, 3139, 2938, 2373, 1556, 1459, 1375, 1106, 987, 871, 790, 655 cm-1; HRMS (ESI–TOF): вычислено для C10H4F3N2O2SBr2 [M–H]– 430.8312; найдено 430.8305.
4-(4-фторфенил)-5-нитро-3-((трифторметил)сульфонил)-1H-пиразол (6e) и 5-бром-4-(4-фторфенил)-3-((трифторметил)сульфонил)-1H-пиразол (8e):
Смесь (Z)-1-(2-бром-2-нитровинил)-4-фторбензол 7e (0.3 моль, 0.0738 г, 1.0 эквив), 3 (0.45 моль, 0.125 г, 1.5 эквив) и NaOMe (3.0 моль, 0.162 г, 10.0 эквив) в сухом MeOH (3.0 мл) перемешивают в течение 20 минут при температуре 0 °C и получают продукты 6e (0.0706 г, 69 %) в виде твердого вещества коричневато-желтого цвета и 8e (0.0188 г, 17 %) в виде твердого вещества коричневого цвета.
6e: Mp: 352–354 °C (метанол); 1H NMR (CDCl3, 300 MHz) δ: 7.26–7.23 (m, 2H), 7.18–7.07 (m, 2H), 2.20 (br s, 1H); 19F NMR (CDCl3, 282 MHz) δ: –78.65 (s, 3F), –111.50 (s, 1F); 13C NMR (CD3OD, 126 MHz) δ: 162.65 (d, J = 245.3 Hz), 155.03, 138.54, 131.98 (d, J = 8.6 Hz), 125.71 (d, J = 3.8 Hz), 122.47, 119.91 (q, J = 325.2 Hz), 113.82 (d, J = 22.0 Hz); IR (KBr): 3519, 3318, 3097, 2562, 1654, 1521, 1375, 1224, 1106, 991 cm-1; HRMS (ESI–TOF): вычислено для C10H4F4N3O4S [M–H]– 337.9859; найдено 337.9861.
8e: Mp: 116–118 °C (CH2Cl2); 1H NMR (CDCl3, 300 MHz) δ: 7.40–7.33 (m, 2H), 7.19–7.12 (m, 2H); 19F NMR (CDCl3, 282 MHz) δ: –78.35 (s, 3F), –111.67– –111.86 (m, 1F); 13C NMR (CD3OD, 126 MHz) δ: 164.57 (d, J = 247.0 Hz), 133.89 (d, J = 8.7 Hz), 130.72, 129.47, 127.02, 125.31 (d, J = 3.6 Hz), 120.92 (q, J = 325.1 Hz), 116.10 (d, J = 22.1 Hz); IR (KBr): 3679, 3127, 2931, 2377, 1548, 1475, 1382, 1228, 1114, 983, 755, 640 cm-1; HRMS (ESI–TOF): вычислено для C10H4F4N2O2SBr [M–H]– 370.9113; найдено 370.9113.
Синтез 4-(4-хлорфенил)-1-(пиримидин-2-ил)-3-((трифторметил)сульфонил)-1H-пиразол-5-амина (2a)
В раствор 4-(4-хлорфенил)-5-нитро-3-((трифторметил)сульфонило)-1H-пиразол 6c (0.0355 г, 0.1 моль) в MeOH добавляли Pd/C (0.006 г), смесь перемешивали при комнатной температуре в атмосфере водорода (баллон) в течение 2.5 часов. Смесь фильтровали через Celite® для получения амина 9. Полученный сырой продукт использовался для следующей реакции без последующей очистки.
Неочищенный амин 9 растворяли в ДМФА (1.0 мл), добавляли при температуре 0 °C NaH (60% w/w в минеральном масле, 0.0024 г, 0.1 моль), смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли 2-хлорпиримидин (0.0115 г, 0.1 моль) и перемешивали реакционную массу при температуре 100 °C в течение 12 часов. В полученную смесь добавляли воду и экстрагировали EtOAc. Органический слой промывали раствором NaCl и сушили Na2SO4, смесь упаривали в вакууме. Полученный продукт очищали колоночной хроматографией (элюент:MeOH = 20:1, перед использованием силикагель нейтрализовали 1%-ным раствором аммония в CH2Cl2), получали 5-амино-N-пиримидинил-пиразол трифлон 2a (0.014 г, 35% выход), в виде твердого вещества белого цвета.
Mp (CH2Cl2): 150–151 °C; 1H NMR (300 MHz, CDCl3) δ: 8.90 (d, J = 4.9 Hz, 2H), 7.48–7.41 (m, 3H), 7.40–7.34 (m, 2H), 6.09 (br s, 2H); 19F NMR (282 MHz, CDCl3) δ: –78.18 (s, 3F).; 13C NMR (126 MHz, CDCl3) δ: 158.96, 157.28, 148.99, 143.03, 130.72, 129.02, 128.75, 128.20, 119.74, 119.68 (q, J = 326.3 Hz), 106.98; IR (KBr): 3411, 3255, 3060, 1600, 1567, 1511, 1428, 1376, 1297, 1213, 1120, 979, 838, 794, 701, 657 cm–1; HRMS (ESI–TOF): вычислено для C14H8F3N5O2SCl [M–H]– 402.0039; найдено 402.0029.
Благодарности
Данное исследование выполнено при поддержке JSPS KAKENHI grants JP 16H01142 (Middle Molecular Strategy) и JP16H01017 (Precisely Designed Catalysts with Customized Scaffolding), и ACT-C из JST (JPMJCR12Z7). ET благодарит the Pesticide Science Society of Japan за поддержку.
Литература
- (a) Lee, K. Y.; Kim, J. M.; Kim, J. N. Tetrahedron Lett. 2003, 44, 6737–6740. (b) Elgemeie, G. H.; Zaghary, W. A.; Amin, K. M.; Nasr, T. M. Nucleosides, Nucleotides Nucleic Acids 2005, 24, 1227–1247. (c) McDonald, E.; Jones, K.; Brough, P. A.; Drysdale, M. J.; Workman, P. Curr. Top. Med. Chem. 2006, 6, 1193–2003. (d) Lamberth, C. Heterocycles 2007, 71, 1467–1502. (e) Dolzhenko, A. V.; Dolzhenko, A. V.; Chui, W. K. Heterocycles 2008, 75, 1575–1622. (f) Fustero, S.; Román, R.; Sanz-Cervera, J.-F.; Simón-Fuentes, A.; Cunãt, A. C.; Villanova, S.; Murguía, M. J. Org. Chem. 2008, 73, 3523–3529. (g) Fustero, S.; Sanz-Cervera, J. F.; Simón-Fuentes, A.; Román, R.; Catalán, S.; Murguía, M. ACS Symp. Ser. 2009, 1003, 182–209.
- (a) Kane, J. L.; Hirth, B. H.; Liang, B.; Gourlie, B. B.; Nahill, S.; Barsomian, G. Bioorg. Med. Chem. Lett. 2003, 13, 4463–4466. (b) Kumar, V.; Aggarwal, R.; Tyagi, P.; Singh, S. P. Europ. J. Med. Chem. 2005, 40, 922–927. (c) Aggarwal, R.; Kumar, V.; Tyagi, P.; Singh, S. P. Bioorg. Med. Chem. 2006, 14, 1785–1791.
- (a) Frackenpohl, J.; Gebauer, O.; Cerezo-Galvez, S.; Es-Sayed, M.; Gorgens, U.; Franken, E.-M.; Malsam, O.; Schnatterer, S.; Arnold, C.; Lummen, P.; Schwarz, H.-G.; Hense, S.; Werner, S. PCT Int. Appl. WO 2008077483 A1, 2008. (b) Kudo, N.; Furuta, S.; Taniguchi, M.; Endo, T.; Sato, K. Chem. Pharm. Bull. 1999, 47, 857–868.
- (a) Banks, B. J. Eur. Pat. Appl. EP 846686 A1, 1998. (b) Banks, B. J. U.S. Patent 6,069,157A, 2000.
- Meegalla, S. K.; Doller, D.; Sha, D.-Y.; Soll, R.; Wisnewski, N.; Silver, G. M.; Dhanoa, D. Bioorg. Med. Chem. Lett. 2004, 14, 4949–4953.
- (a) Food Standards Agency: Update on Fipronil in eggs, https://www.food.gov.uk/news-updates/news/2017/16427/update-on-fipronil-in-eggs-10-august; (b) Health assessment of individual measurements of Fipronil levels detected in foods of animal origin in Belgium, DOI 10.17590/20170802-140011
- Schwarz, H.-G.; Schenke, T.; Hense, A.; Velten, R.; Maechling, S.; Werner, S.; Franken, E.-M.; Gorgens, U.; Lummen, P.; E.-Kiintscher, U.; Voerste, A. PCT Int. Appl. WO 2009156090 A2, 2009.
- (a) Filler, R.; Kobayashi, Y. Biomedical Aspects of Fluorine Chemistry; Elsevier Biomedical Press and Kodansha Ltd.: Amsterdam, Tokyo, 1982. (b) Filler, R.; Kobayashi, Y.; Yagupolskii, L. M. (Ed) Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications; Elsevier: Amsterdam, New York, 1993.
- Xu, X.-H.; Shibata, N. J. Synth. Org. Chem. Jpn. 2013, 71, 1195–1201.
- (a) Xu, X.-H.; Taniguchi, M.; Azuma, A.; Liu, G.; Tokunaga, E.; Shibata, N. Org. Lett. 2013, 15, 686–689. (b) Xu, X.-H.; Taniguchi, M.; Wang, X.; Tokunaga, E.; Ozawa, T.; Masuda, H.; Shibata, N. Angew. Chem., Int. Ed. 2013, 52, 12628–12631. (c) Kawai, H.; Sugita, Y.; Tokunaga, E.; Sato, H.; Shiro, M.; Shibata, N. ChemistryOpen 2014, 3, 14–18. (d) Das, P.; Shibata, N. J. Org. Chem. 2017, 82, 11915–11924.
- (a) Shibata, N.; Ishimaru, T.; Nakamura, S.; Toru, T. J. Fluorine Chem. 2007, 128, 469–483. (b) Shibata, N.; Mizuta, S.; Kawai, H. Tetrahedron: Asymmetry 2008, 19, 2633–2644. (c) Shibata, N.; Matsnev, A.; Cahard, D. Beilstein J. Org. Chem. 2010, 6, No. 65. (d) Kawai, H.; Shibata, N. Chem. Rec. 2014, 14, 1024–1040. (e) Shibata, N. Bull. Chem. Soc. Jpn. 2016, 89, 1307–1320.
- (a) Huang, Z.; Okuyama, K.; Wang, C.; Tokunaga, E.; Li, X.; Shibata, N. ChemistryOpen 2016, 5, 188–191. (b) Huang, Z.; Jia, S.; Wang, C.; Tokunaga, E.; Sumii, Y.; Shibata, N. J. Fluorine Chem. 2017, 198, 61–66. (c) Huang, Z.; Wang, C.; Tokunaga, E.; Sumii, Y.; Shibata, N. Org. Lett. 2015, 17, 5610–5613. (d) Das, P.; Gondo, S.; Tokunaga, E.; Sumi, Y.; Shibata, N. Org. Lett. 2018, 20, 558–561.
- (a) Muruganantham, R.; Mobin, S. M.; Namboothiri, I. N. N. Org. Lett. 2007, 9, 1125–1128. (b) Xie, J.-W.; Wang, Z.; Yang, W.-J.; Konga, L.-C.; Xu, D.-C. Org. Biomol. Chem. 2009, 7, 4352–4354. (c) Muruganantham, R.; Namboothiri, I. J. Org. Chem. 2010, 75, 2197–2205.
- Huang, K.; Ma, Q.; Shen, X.; Gong, L.; Meggers, E. Asian J. Org. Chem. 2016, 5, 1198–1203.
Информацию по спектрам (1H, 19F, 13C ЯМР спектры) синтезированных соединений см. английскую версию статьи
Статья рекомендована к публикации членом редколлегии Проф. Norio Shibata
Fluorine Notes, 2018, 116, 9-10


