Поступило в редакцию: Ноябрь 2017
УДК 542.91:541.49+541.64:66.095.264.3-036.742
Fluorine Notes, 2018, 116, 5-6
Комплексы Ti (+4) с фторсодержащими лигандами ON- и ONNO2-- типов как катализаторы реакции полимеризации этилена
В.А.Тускаев а,б), С. Ч. Гагиева а), К.А. Лысенкоб), Б. М. Булычев а)
а Московский государственный университет им. М.В. Ломоносова, Химический факультет, 19992, Москва, Ленинские горы, Российская Федерация, Факс: 932 8846. E-mail: B.Bulychev@highp.chem.msu.ru
б Институт элементоорганических соединений им. А.Н. Несмеянова, 119992, Российская федерация, Москва, ул. Вавилова 28
Аннотация Исходя из природной аминокислоты – пролина получена серия би- и тетрадентатных хиральных лигандов – производных дифенилпролинола, в том числе и с перфторфенильными заместителями. Взаимодействием депротонированных бутиллитием лигандов с тетрахлоридом титана(+4) синтезирован ряд координационных соединений, способных в присутствии метилалюмоксана (МАО) катализировать полимеризацию этилена с активностью до 370 кг/моль Ti ч атм. Введение перфторфенильных заместителей, помимо увеличения активности, приводит к росту молекулярной массы полиэтилена вплоть до образования сверхвысокомолекулярного полимера (2,7-4,2 млн Да) с температурой плавления 142-145оС.
Ключевые слова: титан(+4), фторсодержащие лиганды, гомогенный катализ, этилен, полимеризация, СВМПЭ.
В настоящее время наблюдается заметный рост интереса к получению нового поколения катализаторов полимеризации олефинов на базе координационных соединений переходных металлов (пост-металлоценовый катализ [1-7]). Среди них наибольшее развитие получили пост-металлоценовые катализаторы на основе металлов 4 группы с фенольными лигандами NO- и ONNO-типов, такими как феноксиимины [8], бис(иминопиролы) [9], а также комплексы с салановыми [10], салофановыми [11] и аминофенольными лигандами [12]. В то же время комплексы этих металлов, образованные с участием лигандов с аминогруппами и спиртовыми гидрокси-группами изучены в гораздо меньшей степени. Немногочисленные примеры подобных структур приведены на рисунке 1.
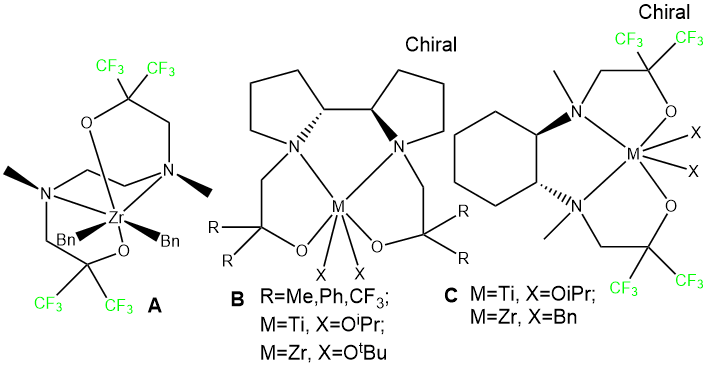
Рисунок 1. Примеры аминоалкоксидных комплексов, активных в полимеризации этилена и других олефинов [13-14].
В настоящей работе описан синтез и свойства новых типов хиральных би- и тетрадентатных лигандов NO- ONNO-типов - производных бис-диарилпролинола - и ряда комплексов титана(+4), полученных с их участием, а также результаты изучения каталитических свойств этих соединений в гомогенной реакции полимеризации этилена.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее нами было показано, что титановые комплексы, стабилизированные производными тетраарилдиоксоландиметанола (ТАДДОЛа) и фенолоспиртов, являются эффективными катализаторами получения сверхвысокомолекулярного полиэтилена (СВМПЭ) [15-17]. Для выяснения влияния на активность координационных соединений, содержащих в лигандах наряду с двумя атомами кислорода дополнительные донорные атомы азота, нами были получены производные бис-диарилпролинола. Новые лигандные системы являются би– (ON) или тетрадентатными (ONNO); а арильные заместители способны создать оптимальную стерическую нагрузку вокруг металлического центра (схема 1). Наличие двух атомов азота, способных к координации, может дополнительно стабилизировать комплексы, тем самым снизить вероятность образования набора активных центров и привести к получению высокомолекулярных полимеров с узким молекулярно-массовым распределением. Все эти соединения хиральны, поскольку получены на основе природного L–пролина 1, следовательно, они могут найти применение не только в полимеризации олефинов, но и в асимметрическом катализе.
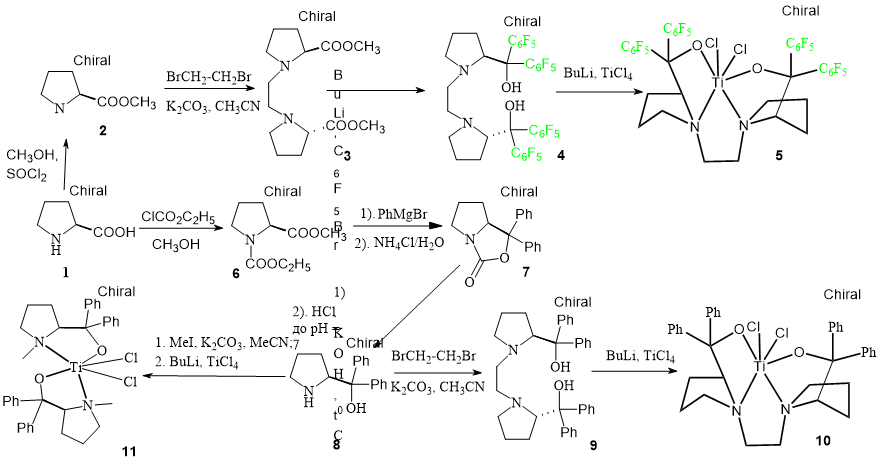
Схема 1. Синтез производных пролина и титановых комплексов с их участием.
По литературным данным для большинства пост-металлоценов наиболее активные в реакции полимеризации соединения содержат в составе лиганда перфторароматические заместители [6,8,13-14]. Для синтеза бис(перфторфенил)пролинольного производного, из пролина был получен 1,2-бис[2(S)-2-карбметокси-1-пирролидинил]этан [18] (соединение 3), обработка которого перфторфениллитием привела к лиганду 4. Его структура была подтверждена данными ЯМР, ИК, масс-спектроскопией. Для однозначного подтверждения строения 4 проведено его рентгенодифракционное исследование (Рис. 2). Несмотря на кажущиеся стерические препятствия в кристалле 4 фторированные фенильные заместители и гидрокси-группы расположены по одну сторону от средней плоскости пирролидиновых циклов.
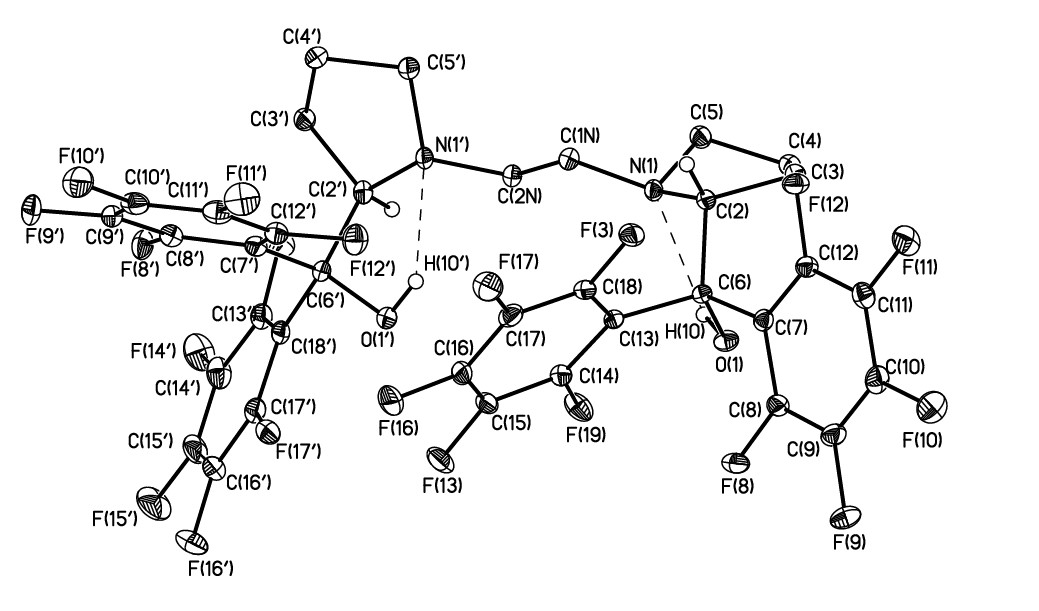
Рисунок 2. Общий вид соединения 4 в представлении атомов тепловыми эллипсоидами (p=50%). Основные длины связей (A°) и углов (рад): O(1)-C(6) 1.417(2), N(1')-C(2N) 1.470(2), N(1)-C(1N) 1.467(2), N(1')-C(5') 1.470(2), N(1)-C(5) 1.478(2), N(1')-C(2') 1.485(2), N(1)-C(2) 1.482(2), O(1')-C(6') 1.420(2); C(6)-O(1)-H(1O) 102.9(16), C(2N)-N(1')-C(5') 112.29(14), C(1N)-N(1)-C(5) 112.40(15), C(2N)-N(1')-C(2') 114.50(14), C(1N)-N(1)-C(2) 114.90(14), C(5')-N(1')-C(2') 108.85(14), C(5)-N(1)-C(2) 107.08(14), C(6')-O(1')-H(1O') 104.4(17).
Атомы азота расположены антиперипланарно с торсионным углом N(1’)-C(2N)-C(1N)-N(1) равным 170.1. Конформация пирролидиновых циклов - конверт с выходами атомов С(5) и С(4’) из плоскости на 0.56 и 0.60Å. Атомы азота N(1) и N(1’) характеризуются пирамидальным окружением с суммой валентных углов 334.4(1) и 335.7(1).
Обе гидроксигруппы в молекуле вовлечены в образование Н-связей с замыканием 5-членного Н-связанного цикла. Геометрические параметры Н-связей несколько различаются. В частности, расстояние между донором и акцептором протона N(1)…O(1) и N(1’)…O(1’) равны 2.721(1) и 2.650(1)Å, соответственно. Наблюдаемые различия в прочности Н-связей, по-видимому, приводят к указанной выше вариации геометрических параметров пирролидиновых циклов. Укорочения Н-связи O(1’)-H(1O’)...N(1’), по-видимому, обусловлено внутримолекулярными факторами, поскольку перфторированные циклы фактически полностью экранируют Н-связанный цикл. Среди наиболее вероятных причин может выступать наличие укороченного O(1')...С(15) контакта (3.165(1)Å), который с учетом его направленности (O(1’)C(15)C(14) 89.5(1)) можно интерпретировать как О... взаимодействие.
Дифенилпролинол 8 получен по известной методике [19], его строение было подтверждено методами ЯМР спектроскопии и измерением угла оптического вращения. Алкилированием дифенилпролинола дибромэтаном синтезирован тетрадентатный лиганд 9 [20] (Схема 1). Его структура была подтверждена данными ЯМР, ИК, масс-спектроскопией.
Для проверки влияния С2 линкера, связывающего пирролидиновые кольца в лиганде, на каталитическую активность системы представлялось целесообразным получить бидентатный лиганд, в котором отсутствует такая жесткая связь. Для этого дифенилпролинол 8 был проалкилирован йодистым метилом по методике [21] и полученный таким образом N–метилдифенилпролинол был использован в качестве лиганда для синтеза титандихлоридного комплекса 11.
Все полученные в данной работе титандихлоридные комплексы (5, 10 и 11) синтезированы взаимодействием литиевых производных соответствующих лигандов и тетрахлорида титана (Схема 1) и использованы в реакции полимеризации этилена in-situ, т.е. без их выделения в индивидуальном состоянии (Таблица 1).
Таблица 1. Полимеризация этилена на системах с пре-катализаторами 5, 10 и 11/МАО и некоторые свойства получаемого полиэтилена а
|
№№ |
Комплекс |
[Al]/[Ti] |
Масса полимера, г |
A б |
Степень криств % |
Tплг |
Mw, 106 |
| 1 |
5 |
500 |
0.52 |
347 |
71 |
145 |
4.21 |
| 2 |
5 |
1000 |
0.56 |
370 |
59 |
142 |
2.69 |
| 3 |
10 |
500 |
0.17 |
113 |
62 |
143 |
2.98 |
| 4 |
10 |
1000 |
0.19 |
127 |
58 |
142 |
2.45 |
| 5 |
11 |
500 |
0.08 |
53 |
62 |
144 |
3.05 |
a Полимеризация выполнена в 10 мл толуола, С(Ti) 3 10-6 моль, давление 1 атм, время полимеризации 30 мин, температура полимеризации 25 C, катализатор готовили в режиме in situ. б кг ПЭ (моль Ti атм)-1 ч-1. в Температура плавления определена из ДСК (второе плавление образца полиэтилена). г Степень кристалличности рассчитана по данным ДСК (с использованием формулы Hm100% = 288 J/g ) [18].д Mw определен визкозиметрически.
Как видно из таблицы 1, наивысшую каталитическую активность проявил фторсодержащий комплекс 5 (до 370 кг ПЭ моль Ti-1 атм-1 ч-1). Его нефторированный аналог 10 в три раза менее активен (активность - 120 кг ПЭ моль Ti-1 атм-1 ч-1). Титандихлоридный комплекс 11 с двумя ON лигандами проявил наименьшую каталитическую активность - 53 кг ПЭ моль Ti-1 атм-1 ч-1. Отсюда можно сделать вывод о существенном влиянии электронных и геометрических параметров лиганда на каталитические свойства координационного соединения.
Для всех каталитических систем, сформированных на базе комплексов 5, 10 и 11, характерна стабильная кинетика полимеризации. Для примера, на рисунке 3 приведена кинетика полимеризации на системе с комплексом 10.
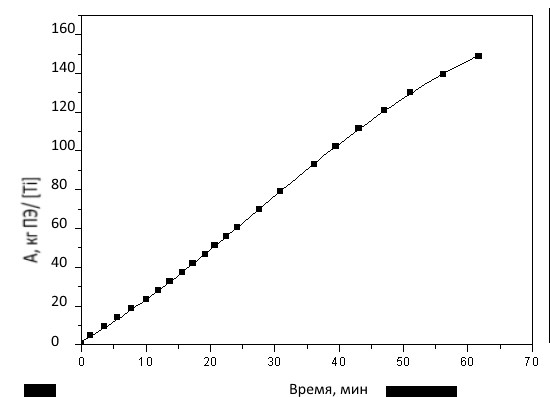
Рис. 3. Кинетика полимеризации этилена на титандихлоридном катализаторе на базе комплекса 10 ([Ti]:[МАО] = 1:500).
Таким образом, анализ полученных экспериментальных данных позволил нам выявить следующие закономерности взаимосвязи структуры комплекса (пре-катализатора) – каталитическая активность:
- комплексы Ti(+4) с лигандами ONNO2-- типа превосходят по каталитической активности комплекс с лигандом ON –типа того же суммарного состава более чем в 2 раза;
- введение в структуру катализатора перфторфенильных заместителей увеличивают каталитическую активность в 3 раза по сравнению с активностью нефторированного аналога.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры 1Н и 13С ЯМР регистрировали на приборе Bruker AVANCE 400 (рабочая частота 400 МГц, 100 МГц) и Bruker AVANCE 600 (рабочая частота 600 МГц, 150 МГц) и указаны в м.д., используя остаточный сигнал недейтерированного растворителя как внутренний стандарт. Данные представлены в следующем виде: хим. сдвиг в м.д. (мультиплетность, интеграл, константа спин-спинового взаимодействия в Гц). Оптическое вращение измеряли на поляриметре Perkin-Elmer 241 в 5 см термостатируемой кювете при 25 °С. Для всех соединений приведены растворитель и концентрация в грамм/100 мл растворителя. Элементный анализ полученных соединений был выполнен в лаборатории Элементного Анализа ИНЭОС РАН. Все реагенты приобретены у фирм Aldrich или Acros и использовались без дополнительной очистки. ИК спектры сняты на спектрофотометре “Magna-IR 750”. Соединения 2-3 [18], 6-8 [19], 9 [20] были получены по известным методикам. Синтезы комплексов проводили в атмосфере аргона в безводных условиях. Дихлорметан, толуол, тетрагидрофуран, диэтиловый эфир, гексан и этилацетат марок «х.ч.» дополнительно очищали согласно [22]. TiCl4 и бутиллитий фирмы Fluka. Кристаллы 4 (C36H20F20N2O2, M= 892.54) при 100К триклинные: а = 11.0812(12), b = 12.1050(18), c = 13.692(2) Å, 69.925(3), β = 81.771(4), = 73.776(3), V = 1654.1(4) Å3, dвыч. = 1.792 г.cм-1, пространственная группа P-1, Z = 2. Интенсивности 19736 отражений измерены на автоматическом дифрактометре Bruker Smart APEX II CCD при 100 К (МоКα-излучение, графитовый монохроматор, -сканирование, 2θmax = 58º) и 8716 наблюдаемых отражений использованы в дальнейших расчетах. Структура расшифрована прямым методом и уточнена полноматричным МНК в анизотропно-изотропном приближении по F2. Атомы водорода локализованы в разностных синтезах электронной плотности и уточнены по модели “наездника”. Окончательные факторы расходимости: wR2= 0.1155, GOF= 1.018 по отражениям (R1= 0.0452 рассчитан по 5841 отражениям с I>2σ(I)) по комплексу программ SHELXTL PLUS [23].
Синтез N,N-1,2-этан-бис-((S)-2-(1-гидрокси-1,1-ди(перфторфенил)метил)-пирролидина (Соединение 4).
В заполненную аргоном колбу и охлажденную до -78 С последовательно добавили 1.12 мл (4.5 ммоль) C6F5Br, диэтилового эфира 30 мл, 6.19 мл (5.0 ммоль) BuLi при интенсивном охлаждении и перемешивании. После двух часов перемешивания по каплям прибавили 1 г (1.0 ммоль) соединения 3. Перемешивали 2 часа, довели реакционную смесь до комнатной температуры, добавили насыщенный водный раствор хлорида аммония. Органическую фазу промыли водой, водную фазу дважды экстрагировали метил-трет-бутиловым эфиром. Органическую фазу сушили над безводным сульфатом натрия, упарили раствор на роторном испарителе. Полученный продукт кристаллизовали из гексана, температура плавления 1940-1960C (с разложением). Выход 0.8 г (89.5%). Найдено (%): C, 48.39; H, 2.24; N 3.07. Для C36H20F20N2O2. Вычислено (%): C, 48.45; H, 2.26; N, 3.14. 1Н ЯМР (400 МГц, CDCl3, δ, м.д.) 6.57 (c, 2H), 4.50 (c, 2H), 3.11 (м, 2H), 2.46 (м, 2H), 2.40 (м, 4H), 2.26 (м, 4H), 1.54 (c, 2H), 1.41 (м 4H).
Синтез N,N-1,2-этан-бис-((S)-2-(1-гидрокси-1,1-дифенил-метил)-пирролидина (Соединение 9).
В колбу заполненную аргоном внесли 1.78 г (12.8 ммоль) карбоната калия, суспендировали его в 17 мл сухого ацетонитрила. Затем добавили 3 г (11.85 ммоль) 1.1-дифенилпролинола и 0.35 мл (3.95 ммоль) 1.1-дибромэтана. Полученную смесь кипятили при перемешивании в атмосфере аргона два дня. По окончании реакции (определили методом ТСХ) реакционную смесь охладили до комнатной температуры, осадок отфильтровали, промыли его ацетонитрилом. Фильтрат упарили на роторном испарителе. Сухой остаток перекристаллизовывали из смеси гексан : хлористый метилен. Продукт получен в виде белых кристаллов с выходом 2,2 г (40 %) и температурой плавления 1500C. Найдено (%): C, 81.13; H, 7.54; N 5,20.Для C36H40N2O2. Вычислено (%): C, 81.17; H, 7.57; N 5,26. 1Н ЯМР (400 МГц, CDCl3, δ, м.д.) 7.29-7.23 (м, 20 H), 4.5 (с, 2Н), 3.32 (с, 2 Н), 2.40 (м, 4 Н), 2.35 (м, 4Н), 1.65 (м, 4 Н). 13C ЯМР δ 146.12, 128.26, 127.78, 127.75, 76.76, 75.86, 56.86, 56.63, 28.32, 24.18.
Синтез комплексов осуществляли по методике:
К раствору лиганда 4, 8а, 9 (0.20 ммоль) в толуоле при температуре -78оС добавляли 2,5 М раствор бутиллития в гептане (0.42 ммоль) по каплям. Температуру реакционной смеси доводили до комнатной, и через 4 часа вновь охлаждали до 0оС и добавляли раствор TiCl4 (0.20 ммоль). Через 3 часа перемешивания растворитель упаривали, комплекс перекристаллизовывали из смеси толуол: гексан 1:1.
Благодарности:
Работа выполнена при финансовой поддержке Российского Научного Фонда (грант РНФ №16-13-10502).
Список цитированной литературы
- Park S., Han Y., Kim S. K., Lee J., Kim H. K., Do Y., J. Organomet. Chem. 2004, 689, 4263–4276.
- Busico V., Dalton Trans., 2009, 41, 8794–8802.
- Takeuchi D., Dalton Trans., 2010, 39, 311–328.
- Budagumpi S., Kim K.-H., Kim I. Coord. Chem. Rev., 2011, 255 2785– 2809.
- Delferro M. and Marks T. J., Chem. Rev. 2011, 111, 2450–2485.
- Bryliakov K. P., Talsi E. P., Coord. Chem. Rev. 2012, 256, 2994– 3007.
- Baier M. C., Zuideveld M. A., and Mecking S., Angew. Chem. Int. Ed. 2014, 53, 9722 – 9744.
- Makio H., Terao H., Iwashita A., and Fujita T., Chem. Rev., 2011, 111, 2363–2449.
- Mashima K., Tsurugi H., J. Organomet. Chem. 2005, 690, 4414–4423.
- Cohen A., Kopilov J., Lamberti M., Venditto V. and Kol M., Macromolecules, 2010, 43, 1689–1691.
- Gendler S., Zelikoff A. L., Kopilov J., Goldberg I. and Kol M., J. Am. Chem. Soc., 2008, 130, 2144–2145.
- Groysman S., Sergeeva E., Goldberg I., and Kol M., Inorg. Chem., 2005, 44, 8188–8190.
- Kirillov E., Lavanant L., Thomas C., Roisnel T., Chi Y., and Carpentier J.-F., Chem. Eur. J. 2007, 13, 923 – 935.
- Sergeeva E., Kopilov J., Goldberg I. and Kol M., Inorg. Chem., 2009, 48, 8075–8077.
- Tuskaev V. A., Gagieva S. Ch., Maleev V. I., Borissova A. O., Solov’ev M. V., Starikova Z. A., Bulychev B. M., Polymer 2013, 54, 4455-4462.
- Gagieva S. Ch, Tuskaev V. A., Fedyanin I. V., Buzin M. I., Vasil'ev V. G., Nikiforova G. G., Afanas'ev E. S., Zubkevich S. V., Kurmaev D. A., Kolosov N. A., Mikhaylik E. S., Golubev E. K., Sizov A. I., Bulychev B. M., J. Organomet Chem 2017, 828, 89-95, http://dx.doi.org/10.1016/j.jorganchem.2016.11.026.
- Gagieva S. Ch., Tuskaev V. A., Fedyanin I. V., Sizov A. I., Mikhaylik E. S., Golubev E. K., Bulychev B M., Polyhedron 2017, 122, 179–183, http://dx.doi.org/10.1016/j.poly.2016.11.007.
- Yang X., Li B. and Fu E. Synthetic Communications, 35, (2005) 271–278, DOI: 10.1081/SCC-200048458.
- Mathre D. J., Jones T. K., Xavier L. C., Blacklock T. J., Reamer R. A., Mohan J. J., Jones E. T. T., Hoogsteen K., Baum M. W., and Grabowski E. J. J., J. Org. Chem., 1991, 56, 751-762.
- Xu Q., Zhu G., Pan X., Chan Han A. S.C. Chirality, 2002, 14, 716–723.
- Braga A. L., Paixao M. W., Westermann B., Schneiderc P. H. and Wessjohann L. A. J. Org. Chem. 73, (2008), 2879–2882, DOI: 10.1021/jo702413n
- Organikum. Organischchemisches Grundpraktikum, VEB Deutscher Verlag der Wissenschaften, Berlin, 1990.
- Sheldrick GM. Acta Cryst 2008; A64:112.
- The UHMWPE handbook: ultra-high molecular weight polyethylene in total joint replacement / Steven M. Kurtz., 2004, Elsevier Academic Press.
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2018, 116, 5-6


