Поступило в редакцию: Декабрь 2017
УДК [547.569.1:546.16]: 546.226'131-31
Fluorine Notes, 2018, 116, 3-4
ПОЛУЧЕНИЕ ПОЛИФТОРХЛОРАРЕНОВ ИЗ ПОЛИФТОРАРЕНТИОЛОВ, SOCl2 И SO2Cl2
П.В.Никульшин, А.М.Максимов, Р.А.Бредихин, В.Е.Платонов@
Федеральное государственное бюджетное учреждение науки Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, просп. Академика Лаврентьева, д. 9, г. Новосибирск, 630090, Российская Федерация.
E-mail: platonov@nioch.nsc.ru
Abstract: Осуществлена замена тиольной группы в полифторарентиолах на атом хлора с использованием в качестве хлорирующих реагентов SOCl2 и SO2Cl2. Нагреванием полифтор- и полифторхлорарентиолов с SO2Cl2 при 200-220°C в ампулах синтезированы полифторхлор- и полифтордихлорарены, а также 1,2,4-трифтортрихлорбензол. Полифтордихлорарены содержат атомы хлора в орто- и пара-положенииях.
Ключевые слова: хлористый тионил, хлористый сульфурил, тиольная группа, полифторарентиолы, полифторхлорарены.
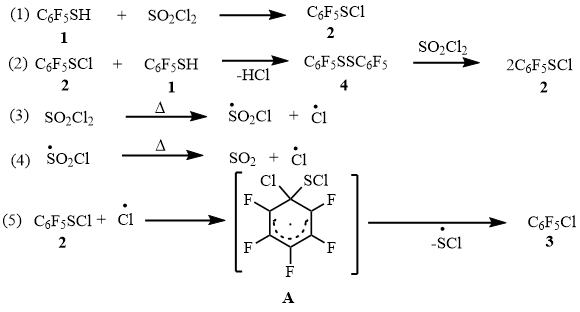
Полифторхлорарены является важными продуктами для синтеза полифторароматических соединений с различными функциональными группами. Одним из направлений синтеза является избирательное участие в реакциях металлирования связи CAr-Cl. Образование реактивов Гриньяра [1], литийорганических соединений [1], цинкорганических соединений [2] из полифторхлораренов позволило осуществить синтез большого числа функциональных производных полифторароматических соединений. В этой связи нами в последние годы разрабатывался метод получения полифторхлораренов, заключающийся в замене на атомы хлора тиольной группы в полифторарентиолах. Этим методом ряд полифторхлорароматических соединений был синтезирован с высокими выходами [3,4]. Реакция проводилась при сопиролизе полифторарентиолов с хлором, его источниками (SOCl2 и SO2Cl2) в проточной системе при ~400°C [3]. Кроме реакций в проточной системе, нами изучено превращение полифторарентиолов с PCl5 в ампулах при ~200°C, приведшее также к получению полифторхлораренов [4]. На примере реакции пентафторбензолтиола 1 с Cl2 и PCl5, проведенных в различных условиях, предложена схема механизма замены тиольной группы на атом хлора, включающая промежуточное образование пентафторбензолсульфенилхлорида 2 и его превращение под действием Cl2 и PCl5 в пентафторхлорбензол 3 с участием промежуточного радикального σ-комплекса [3, 4].
Использование в газофазном процессе, наряду с Cl2, хлористого тионила и хлористого сульфурила как источников хлора характеризует реакции замены тиольной группы в полифторарентиолах на атом хлора в методическом и практическом отношении как достаточно общий путь синтеза полифторхлораренов. Дополнительным свидетельством в пользу такого вывода являются также реакции полифторарентиолов с PCl5, осуществленные в ампулах при более низкой температуре (~200°C) [4]. С целью расширения возможностей реакций в этих условиях нами в настоящей работе также исследованы превращения полифторарентиолов с SOCl2 и SO2Cl2 в ампулах.
Нами показано, что при нагревании тиола 1 с SOCl2 или SO2Cl2 в ампулах при (~200°C) получен арен 3 с высокими выходами. При этом оказалось, что реакция тиола 1 с SOCl2 требует большего времени для достижения хорошего выхода арена 3, чем в случае использования SO2Cl2 при одинаковой температуре процессов (схема 1).
Схема 1

При уменьшении времени реакции тиола 1 с SOCl2 с 24 часов до 5 часов при ~200°C, реакционная смесь содержала арен 3, предполагаемые декафтордифенилполисульфаны и сульфенилхлорид 2 в соотношении ~55 : 34 : 11 соответственно (по данным ЯМР 19F).
В реакции тиола 1 с SO2Cl2 при ~200°C в течение 2.5 часов полученная реакционная смесь содержала арен 3 в большем количестве, чем в случае реакции тиола 1 с SOCl2, проведенной в течение 5 часов. Кроме арена 3, в смеси находились также предполагаемые декафтордифенилполисульфаны и сульфенилхлорид 2. Соотношение этих продуктов составило ~79 : 18 : 3 соответственно (по данным ЯМР 19F). Однако, сопоставление результатов реакций тиола 1 с SOCl2 (5 часов) и SO2Cl2 (2.5 часа) имеет относительный характер, поскольку не была проведена оценка массовых выходов реакционных смесей.
Представленные выше результаты реакций тиола 1 с SOCl2 и SO2Cl2 могут свидетельствовать о том, что процесс с участием SO2Cl2 требует меньшего времени, чем при использовании SOCl2. Поэтому в дальнейшем нами проводились реакции полифторарентиолов с SO2Cl2.
Образующийся в реакции тиола 1 с SO2Cl2 при ~200°C в течение 2.5 часов сульфенилхлорид 2 и декафтордифенилполисульфаны могут представить интерес для получения из них под действием SO2Cl2 арена 3. В этой связи была осуществлена реакция сульфенилхлорида 2 с SO2Cl2 (~200°C, 5 часов). В качестве представителя указанных полисульфанов казалось целесообразным провести реакцию декафтордифенилдисульфана 4 с SO2Cl2 в условиях реакции тиола 1 с SO2Cl2 (~200°C, 5 часов).
Как оказалось, при нагревании сульфенилхлорида 2 и дисульфана 4 с SO2Cl2 также получается соединение 3 с высокими выходами (схема 2).
Схема 2
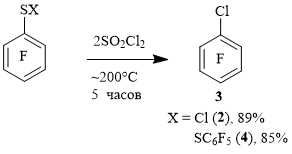
Аналогичный процесс протекает и в случае пара-замещенных производных тиола 1. Так, при нагревании 2,3,5,6-тетрафторбензолтиола 5 с SO2Cl2, был получен 1,2,4,5-тетрафтор-6-хлорбензол 6, а из 2,3,5,6-тетрафтор-4-хлорбензолтиола 7 - 1,2,4,5-тетрафтор-3,6-дихлорбензол 8. 4-Трифторметил-2,3,5,6-тетрафторбензолтиол 9 в реакции с SO2Cl2 дает с высоким выходом гептафтор-4-хлортолуол 10 (схема 3).
Схема 3
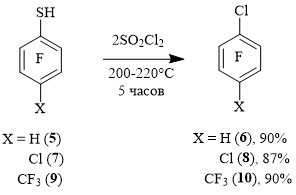
В то же время, попытка получения 1-бром-2,3,5,6-тетрафтор-4-хлорбензола 11 хлорированием 4-бром-2,3,5,6-тетрафторбензолтиола 12 при ~180°C показала, что в этой реакции происходит в значительной степени также и замена атома брома на хлор. При увеличении температуры реакции до ~240°C было получено соединение 8 с небольшой примесью арена 11 (схема 4). Ранее нами было показано, что аналогичный процесс происходил в близких условиях и в реакции тиола 12 с PCl5 [4].
Схема 4
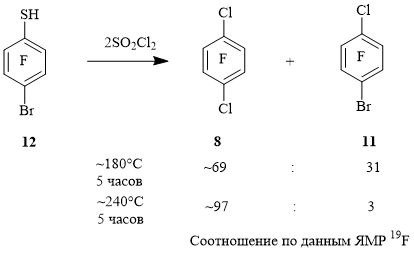
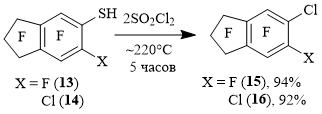
Из 5-нонафториндантиола 13 и октафтор-6-хлориндан-5-тиола 14 были получены нонафтор-5-хлориндан 15 и октафтор-5,6-дихлориндан 16 соответственно (схема 5).
Схема 5
Нагреванием смеси трифтордихлорбензолтиолов с SO2Cl2 в ампуле был синтезирован практически индивидуальный 1,2,4-трифтортрихлорбензол 17 (схема 6).
Схема 6
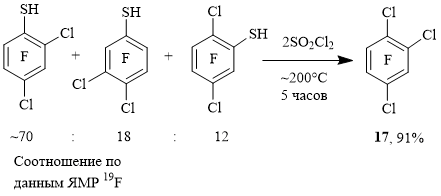
Изомерная смесь трифтордихлорбензолтиолов приготовлена из технической смеси о-, м-, п-C6Cl2F4 и KSH (выход 90%) [5].
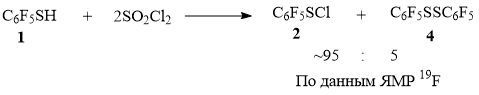
При смешивании при комнатной температуре тиола 1 с SO2Cl2 образуется в основном сульфенилхлорид 2, наряду с небольшим количеством дисульфана 4 (по данным ЯМР 19F, схема 7).
Схема 7
Возможно, что соединение 4 в реакции с SO2Cl2 превращается в сульфенилхлорид 2 [6]. Последний под действием атома хлора, образующегося из SO2Cl2 [7-9] (уравнение 3 и 4, схема 8) превращается в арен 3, включая промежуточное образование радикального σ-комплекса А [4]. Вероятно, аналогичным образом происходит реакция тиола 1 с SO2Cl2 в проточной системе при ~400°C, описанная нами ранее [3].
Схема 8
Экспериментальная часть
Авторы выражают благодарность Химическому сервисному центру коллективного пользования СО РАН за проведение спектральных и аналитических измерений.
Спектры ЯМР 19F и 1H записаны на приборе Bruker AV-300 (282.4 МГц для 19F, 300 МГц для 1H) в CCl4 c добавкой (CD3)2СO, внутренние стандарты - С6F6 и ГМДС (0.04 м.д. от ТМС). Положительные значения химических сдвигов соответствуют смещению сигнала в слабое поле. ГХ анализ проводили на газовом хроматографе ЛХМ-72 с детектором по теплопроводности (ДТП) и насадочными (набивными) колонками длиной 2 м и внутренним диаметром 4 мм (заполнены твердым инертным носителем Chromosorb W-AW-DMCS, пропитанным жидкой неподвижной фазой (диметилполисилоксан ВС-1 либо диметилтрифторпропилполисилоксан СКТФТ-50) в количестве 15% от массы носителя). Расход гелия - 60 мл/мин. Температура испарителя 280ºC, начальная температура колонки 50ºC - 1 мин, 10 град/мин до 280ºC, изотерма при 280ºC до выхода всех компонентов пробы, температура ДТП 280ºC.
Исходные полифторарентиолы были получены по методу [10].
Образование соединений 2 и 4 и конечных продуктов реакций хлорирования полифторарентиолов подтверждено сравнением химических сдвигов и констант спин-спинового взаимодействия спектров ЯМР 19F и 1H этих соединений с литературными данными [3, 5, 11].
Метод 1. В ампулу помещали полифторарентиол и порциями добавляли SOCl2 или SO2Cl2. По окончании видимого выделения газа, ампулу запаивали и помещали в металлический кожух, затем нагревали. По окончании реакции ампулу охлаждали, вскрывали, содержимое переносили в колбу под слой воды со льдом (80-100 г) и перегоняли с паром. Продукт отделяли, сушили CaCl2 и анализировали методами ГХ, ЯМР 19F и 1H. Аналогично осуществляли реакции сульфенилхлорида 2 и дисульфана 4 с SO2Cl2. При этом ампулу запаивали сразу после помещения в нее реагентов.
Реакция пентафторбензолтиола 1 с SOCl2. Из 2.77 г (13.84 ммоль) соединения 1 и 3.30 г (27.74 ммоль) SOCl2 (200-202ºC, 24 часа) получили 2.52 г соединения 3 (содержание по данным ГХ - 97.3%), выход 88%.
В таблице 1 даны результаты реакций полифторарентиолов (1, 5, 7, 9, 13, 14, смеси C6Cl2F3SH, а также соединений 2 и 4 с SO2Cl2).
Таблица 1. Получение полифторхлораренов.
|
№ опыта |
Соединение, г (ммоль) |
SO2Cl2, г (ммоль) |
Мольное соотношение соединения к SO2Cl2 |
Температура, °С |
Время, часы |
Выход смеси, г |
Содержание (выход) продукта по ГХ, % |
|
1 |
1, 2.76 (13.79) |
4.01 (29.95) |
2.17 |
203-205 |
5 |
2.55 |
3, 98.3 (90) |
|
2 |
2, 3.01 (12.83) |
3.76 (21.21) |
2.19 |
200-202 |
5 |
2.37 |
3, 98.0 (89) |
|
3 |
4, 3.05 (7.66) |
2.08 (15.53) |
2.03 |
203-205 |
5 |
2.67 |
3, 91.2 (85) |
|
4 |
5, 2.24 (12.30) |
3.40 (25.39) |
2.06 |
200-202 |
5 |
2.07 |
6, 99.0 (90) |
|
5 |
7, 3.29 (15.19) |
4.21 (31.41) |
2.07 |
203-205 |
5 |
2.91 |
8, 99.1 (87) |
|
6 |
9, 2.39 (9.55) |
2.88 (21.51) |
2.25 |
218-220 |
5 |
2.17 |
10, ~100 (90) |
|
7 |
13, 1.98 (6.34) |
1.79 (13.37) |
2.11 |
220-222 |
5 |
1.89 |
15, 99.4 (94) |
|
8 |
14, 3.00 (9.13) |
2.54 (18.97) |
2.08 |
218-220 |
5 |
2.80 |
16, 99.3 (92) |
|
9 |
Смесь C6Cl2F3SH, 3.04 (13.37) |
3.87 (28.90) |
2.22 |
203-205 |
5 |
2.82 |
17, 99.4 (91) |
0.15 г (0.75 ммоль) соединения 1 смешали в колбе с 0.21 г (1.57 ммоль) SO2Cl2 при комнатной температуре. По окончании видимого выделения газа, полученную смесь растворили в ~2 мл CCl4 и анализировали с помощью ЯМР 19F. Получили смесь, содержащую соединение 2 и 4 в соотношении ~95 : 5 соответственно (данные ЯМР 19F).
Метод 2. В ампулу помещали соединение 1 и порциями добавляли SOCl2 или SO2Cl2. По окончании видимого выделения газа, ампулу запаивали и помещали в металлический кожух, затем нагревали. По окончании реакции ампулу охлаждали, вскрывали, содержимое ампулы растворяли в ~2 мл хлористого метилена и анализировали с помощью ЯМР 19F.
Нагреванием 0.12 г (0.60 ммоль) соединения 1 с 0.16 г (1.35 ммоль) SOCl2 при 202-204ºC в течение 5 часов получили содержащую в растворе хлористого метилена смесь соединений 2, 3, 4 (данные ЯМР 19F), а также, вероятно, смесь декафтордифенилтрисульфана (δ, м.д.: 13.4 (F-4 и F-4') [12]) и декафтордифенилтетрасульфана (δ, м.д.: 13.5 (F-4 и F-4') [12]). В этих двух полисульфанах химические сдвиги мета-атомов фтора находятся в области 2.1÷2.6 м.д. [12], орто-атомов фтора -- в области 31÷32 м.д. [12]. Соотношение соединений 2, 3, 4 и смеси декафтордифенилтри- и -тетрасульфана составило ~11 : 55 : 10 : 24 соответственно (данные ЯМР 19F).
Аналогично из 0.20 г (1.00 ммоль) тиола 1 и 0.27 г (2.02 ммоль) SO2Cl2 нагреванием при 200-202ºC в течение 2.5 часов получили соединения 2, 3, 4 и смесь декафтордифенилтри- и -тетрасульфана в соотношении ~3 : 79 : 3 : 15 соответственно (данные ЯМР 19F).
Реакции 4-бром-2,3,5,6-тетрафторбензолтиола (12) с SO2Cl2.
Из 0.32 г (1.23 ммоль) соединения 12 и 0.34 г (2.54 ммоль) SO2Cl2 (180-182ºC, 5 часов) получили смесь, содержащую соединения 8 и 11 в соотношении ~69 : 31 соответственно (данные ЯМР 19F). При увеличении температуры реакции до 238-240ºC (5 часов) из 0.27 г (1.03 ммоль) соединения 12 и 0.30 г (2.24 ммоль) SO2Cl2 получили смесь, содержащую соединения 8 и 11 в соотношении ~97 : 3 соответственно (данные ЯМР 19F).
Работа выполнена при финансовой поддержке РФФИ (проект № 15-03-08869а).
Список литературы
- Chambers R.D. Fluorine in Organic Chemistry. Wiley, New York, 1973.
- Виноградов А.С., Краснов В.И., Платонов В.Е. Цинкорганические реагенты из полифтораренов и цинка: получение и реакции с аллилгалогенидами. Синтез аллилполифтораренов. ЖОрХ. 2008. Т. 44. Вып. 1. С. 101-107 [Vinogradov A.S., Krasnov V.I., Platonov V.E. Organozinc reagents from polyfluoroarenes: Preparation and reactions with allyl halides. Synthesis of allylpolyfluoroarenes. Russ J. Org. Chem. 2008. V. 44. № 1. P. 95-102].
- Платонов В.Е., Максимов А.М., Дворникова К.В., Никульшин П.В. Фторорганические серосодержащие соединения. V. Сопиролиз полифторарентиолов, -гетарентиолов и их производных с хлором и бромом. ЖОрХ. 2005. Т. 41. Вып. 11. С. 1681–1687. [Platonov V.E., Maksimov A.M., Dvornikova K.V., Nikul’shin P.V. Organofluorine sulfur-containing compounds: V. Joint pyrolysis with chlorine or bromine of polyfluoroarenethioles, polyfluorohetarenethioles, and their derivatives. Russ J. Org. Chem. 2005. V. 41. № 11. P. 1647-1653].
- Никульшин П.В., Максимов А.М., Платонов В.Е., Получение хлорполифтораренов из полифторарентиолов и PCl5. ЖОрХ. 2016. Т. 52. Вып. 2. С. 217–221. [Nikul’shin P.V., Maksimov A.M., Platonov V.E. Synthesis of Chloropolyfluoroarenes from Polyfluoroarenethiols and PCl5. Russ J. Org. Chem. 2016. V. 52. № 2. P. 200-205].
- Никульшин П.В., Максимов А.М., Платонов В.Е. Синтез 1,2-дихлортетрафтор- и 1,2,4-трифтортрихлорбензолов. ЖОрХ. 2012. Т. 48. Вып. 4. С. 538-535 [Nikul’shin P.V., Maksimov A.M., Platonov V.E. Synthesis of 1,2-dichlorotetrafluoro- and 1,2,4-trichlorotrifluorobenzenes. Russ J. Org. Chem. 2012. V. 48. № 4. P. 536-543].
- Still I.W.J.; Kutney G.W.; McLean D., Convenient Method for the Conversion of Thiols and Disulfides to the Corresponding Chlorides. J. Org. Chem. 1982. V. 47. № 1. P. 560-561.
- Нонхибел Д., Уолтон Дж. Химия свободных радикалов. Структура и механизм реакций. М.: Мир, 1977. С. 207. [Nonhebel D.C., Walton J.C. Free-Radical Chemistry. Structure and Mechanism. Cambridge: At the University Press, 1974].
- Poutsma M.L. Methods in Free Radical Chemistry. New York: Marcel Dekker, 1969. V. 1. P. 111-115.
- Матье Ж., Панико Р. Курс теоретических основ органической химии М.: Мир. 1975. С. 423.[ Mathieu J., Panico R. Mecanismes Reactionnels en Chimie Organique. Paris: Hermann, 1972].
- Maksimov A.M., Platonov V.E. Reactions of some polyfluoroaromatic compounds with potassium hydrosulfide. Fluorine Notes. 1999. Vol. 4. http://notes.fluorine1.ru/contents/history/1999/4_1999/letters/index.html.
- Никульшин П.В., Максимов А.М., Платонов В.Е. Синтез хлор- и о-дихлорполифтораренов пиролизом полифторарентиолов в присутствии хлора. ЖПХ. 2010. Т. 83. Вып. 7. С. 1148-1152. [Nikul’shin P.V., Maksimov A.M., Platonov V.E. Synthesis of chloro- and ortho-dichloropolyfluoroarenes by pyrolysis of polyfluoroarenes in the presence of chlorine. Rus. J. Appl. Chem. 2010. V. 83. № 7. P. 1254-1258].
- Peach M. E. Pentafluorophenyl polysulfides. Intern. J. Sulfur Chem. 1973. V. 8. P. 27 – 29; Gmelin Handbook: F: PerFHalOrg.S., Springer-Verlag, Berlin-Heidelberg-New York-Tokyo, 1986, V. 2. P. 194.
Статья рекомендована к публикации членом редколлегии Проф. д.х.н. В. Е. Платоновым
Fluorine Notes, 2018, 116, 3-4