Поступило в редакцию: Декабрь 2017
Fluorine Notes, 2018, 116, 1-2
Исследования влияния субстрата на фторирование с помощью Deoxofluor некоторых высокофункциональных соединений с алициклическим каркасом
Melinda Nonn,1 Ferenc Fülöp,1,2 Loránd Kiss,2*
1MTA-SZTE Stereochemistry Research Group, Hungarian Academy of Sciences, H-6720 Szeged, Eötvös u. 6, Hungary
2Institute of Pharmaceutical Chemistry, University of Szeged, H-6720 Szeged, Eötvös u. 6, Hungary
Email: kiss.lorand00@gmail.com
kiss.lorand@pharm.u-szeged.hu
Графическая аннотация:
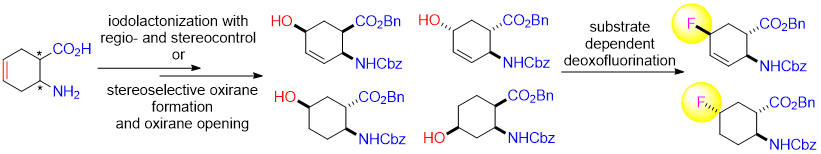
Аннотация: Было исследовано влияние субстрата на фторирование с помощью Deoxofluor ряда высокофункциональных соединений с алициклическим каркасом. Выбранная серия соединений: гидроксилированные, насыщенные и ненасыщенные шестичленные циклические β-амино эфиры были синтезированы из ненасыщенных стереоизомеров циклогексан β-аминокислот через иодолактонизацию с стерео- и регио-контролируемым или стереоселективным окислением двойной связи кольца с последующим региоселективным раскрытием оксирана. В зависимости от стереоструктуры гидроксилированного аминоэфира, нуклеофильное фторирование при различных условиях приводило либо к соответствующему фторсодержащему замещению или к продуктам отщепления.
Keywords: β-амино кислоты, региоконтроль, стереоконтроль, фторирование, функционализация.
Введение
По причине увеличения важности фторированных соединений в медицине [1], развитие селективных и контролируемых эффективных методов фторирования является важной задачей синтетической органической химии в последние годы. Этот интерес хорошо иллюстрируется все возрастающим числом различных публикаций по синтезам в этой области и сопутствующими недавними обзорами [2].
Среди различных методов фторирования, нуклеофильное фторирование путем деоксофторирования органических субстратов с помощью промышленно доступных фторирующих агентов (т.е. DAST, Deoxofluor, Fluolead, XtalFluor) занимает важный сегмент. В соответствии с широко принятым подходом, замещение гидроксигруппы фтором имеет место обычно через инверсию [3]. Деоксофторирование, включающее замену гидроксила на фтор, опредленно является простым и эффективным методом введения фтора в органическую молекулу.
Однако, регио- и стереоконтроль, так же как и наводящий эффект субстрата, остается сложной проблемой при работе с высоко функционализированным каркасом (скелетом). В процессе наших ранних экспериментальных исследований на различных алициклических молекулах с функциональными группами, мы установили, что их трансформации сильно зависят от субстрата.
В дополнение, нами было показано, что стереохимия субстратов, так же как и природа защитных групп должны играть решающую роль на результаты фторирования [4].
Результаты и обсуждение
Целью нашей работы являлось продолжение и расширение наших более ранних исследований фторирования различных циклических насыщенных или ненасыщенных β-аминоэфиров. Учитывая важность этих соединений для фармацевтики [5], мы выбрали некоторые модельные образцы β-амино кислот и планировали собрать полезную информацию об их реакционной способности и поведении в химических реакциях. Особенно мы хотели раскрыть регио- и стереохимию их трансформаций и влияние карбоксильной и амино защитных групп (к примеру бензил и бензилоксикарбонил).
В первую очередь, гидроксилирование кольца олефиновой связи в циклогексен β-амино кислоте (±)-1 было выполнено через регио- и стереоселективную иодолактонизацию.
Получающийся лактон (±)-2 [6] давал, после отщепления HI с диазабициклоандеценом (DBU), ненасыщенный бициклический лактон (±)-3. Раскрытие лактона в (±)-3 с бензил алкоголятом натрия (BnONa) при 50 °C приводило к полностью cis (all-cis) гидроксилированному амино эфиру (±)-4, содержащему гидрокси группу у С-5 (Схема 1).
С целью иметь коммерчески доступный нуклеофильный фторирующий агент, этот all-cis продукт в серии экспериментов, различающихся температурой реакции и растворителем, подвергался фторированию через гидрокси-фторный обмен. Однако, в противоположность нашим ожиданиям [6c], реакция давала только неидентифицируемую смесь соединений с большим количеством полимерного материала (Схема 1).
Неудачное фторирование (±)-4 могло бы быть объяснено стереохимическими факторами. То есть, предполагается, что фторирующий агент не способен трансформировать гидроксигруппу в соответствующую хорошо отщепляемую группу вследствие стерических затруднений из-за громоздких бензил эфирных и карбаматных фрагментов.
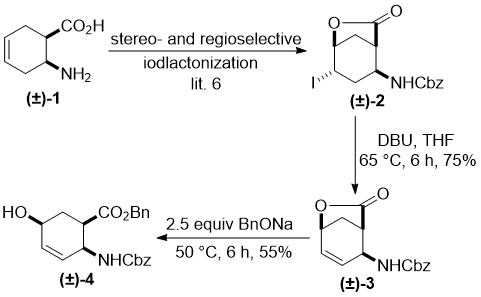
Схема 1
Эта неудача не остановила нас в продолжении наших экспериментов с другими бензил/бензилоксикарбонил защищенными изомерами циклогексен аминокислот.
Была видна очевидная необходимость изменить стереохимическое расположение функциональных групп в исходных соединениях. Так, циклогексен транс аминокислота (±)-5 была превращена с помощью селективной и стереоконтролируемой иодолактонизации в соотвествующий лактон (±)-6 [6]. Аналогично, его цис изомер после отщепления HI с помощью DBU давал ненасыщенный лактон (±)-7, и дальнейшее раскрытие гетерокольца с помощью BnONa приводило к гидроксилированному эфиру (±)-8. Вновь гидроксильная группа была присоединена к углероду С-5 кольца с помощью эфирных и карбаматных фрагментов в положении транс. После нескольких экспериментальных попыток, было проведено успешное фторирование (±)-8 с тремя эквивалентами Deooxfluor. Наиболее высокий выход (65%) был достигнут в CH2Cl2 при комнатной температуре, когда фторированный продукт (±)-9, образованный через взаимную перестановку, был выделен колоночной хроматографией (Схема 2).
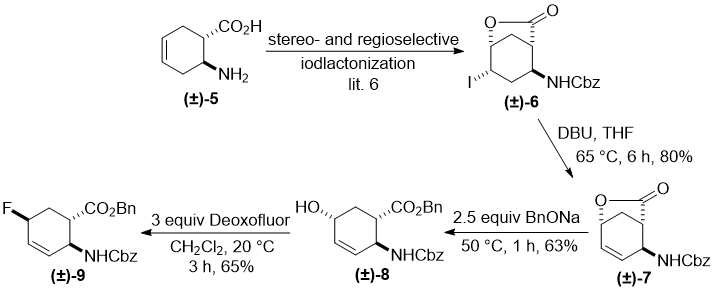
Схема 2
Далее, мы расширили наши исследования изменением позиции гидроксильной группы в бензил/бензилоксикарбонил защищенных аминокислотах. Соответственно, Cbz-защищенная аминокислота (±)-10 (полученная из (±)-1) [6] сперва была превращена в соответствующий бензиловый эфир (±)-11, который, в свою очередь, приводил к all-cis эпоксиду (±)-12 путем получения стереоселективного оксирана взаимодействием с m-хлорпербензойной кислотой (m-chloroperbenzoic acid (MCPBA)), которая включала направляющий эффект водородных связей.
Аналогично нашим более ранним полученным результатам [7], раскрытие оксиранового кольца при применении несколько модифицированного метода раскрытия восстановлением давало региоселективный all-cis гидроксилированный аминоэфир (±)-13, который содержал гидроксил у атома С-4 кольца.
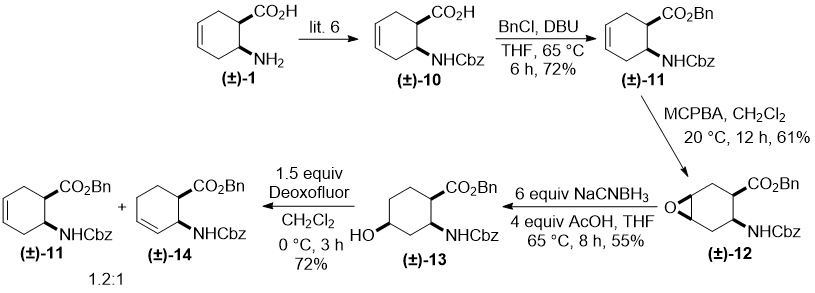
Схема 3
Гидроксилированный циклогексан аминоэфир (±)-13 подвергался фторированию в различных экспериментальных условиях (температура, растворитель, количество фторирующего агента). К сожалению, во всех случаях можно было выделить только смесь неразделяемых продуктов отщепления (±)-11 и (±)-14 в примерном соотношении 1,2:1 (Схема 3). Следует отметить, что продукты отщепления наравне с производными замещения часто образуются в нуклеофильных реакциях фторирования.
Далее мы хотели оценить закономерности при фторировании trans циклогексан аминоэфира. Аминокислота (±)-15 (полученная из (±)-5) [6] превращалась в соответствующий аминоэфир (±)-16 с помощью бензилирования при базовых условиях. С помощью MCPBA было достигнуто стереоселективное эпоксидирование этого продукта с получением производного оксирана (±)-17. Trans эпоксид (±)-17 в противоположность его cis аналогу (±)-12 при модифицированных условиях восстановительного раскрытия гетерокольца давал региоселективный гидроксилированный аминоэфир (±)-18, с гидрокси группой у атома С5 ( для более ранних аналогичных трансформаций см. [7]). Соединение (±)-18 фторировали при различных условиях. Когда реакцию проводили с Deoxofluor при 20 °C, получали только продукт (±)-16 как результат элиминирования. В противоположность, аналогичное фторирование при 0 °C давало фторированное производное (±)-19, которое получалось через замещение с перестановкой (Схема 4), как единственный продукт с умеренным выходом.
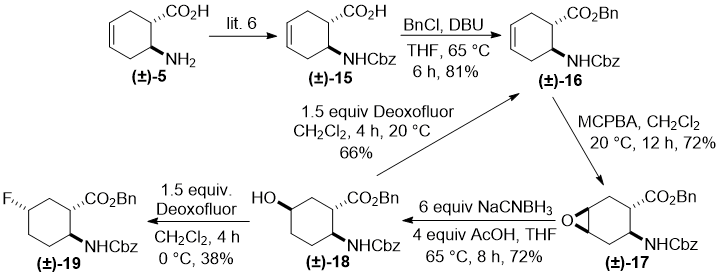
Схема 4
В заключение, были проведены исследования фторирования различных гидроксилированных циклогексен или циклогексан β-защищенных регио- и стереоизомеров аминоэфиров при различных экспериментальных условиях. Было установлено, что как стереохимия исходных соединений, так и позиция гидроксильной группы, имеют существенное влияние на результаты фторирования. В нашей лаборатории также будут проводится дальнейшие исследования с другими новыми субстратами.
Экспериментальная часть
Benzyl ((1R*,2S*,5S*)-7-oxo-6-oxabicyclo[3.2.1]oct-3-en-2-yl)carbamate, (±)-3
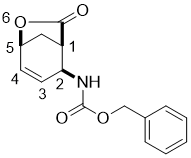
К раствору иодолактона (±)-2 (20.5 mmol) в THF (50 mL) был добавлен DBU (45.1
mmol), и реакционную смесь перемешивали с обратным холодильником в течении 6 часов. Затем реакционную
массу разбавляли EtOAc (50 mL), промывали H2O (3 × 30 mL), сушили
(Na2SO4) и концентрировали при пониженном давлении. Сырец очищали колоночной
хроматографией на силикагеле (n-гексан/EtOAc).
Получен белый твердый продукт; выход: 75%; Rf = 0.3 (n-гексан/EtOAc
2:1); Mp 102-104 °C; 1H NMR (400 MHz, CDCl3): δ = 2.17-2.24 (m, 1H,
CH2), 2.56-2.65 (m, 1H, CH2), 3.04-3.09 (m, 1H, H-1), 4.77 (brs, 1H, N-H),
4.87-4.91 (m, 1H, H-2), 5.06-5.23 (m, 3H, H-5, OCH2), 5.77-5.84 (m, 1H, H-3), 6.33-6.40
(m, 1H, H-4), 7.32-7.41 (m, 5H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 36.6, 43.6, 49.0, 67.1, 73.0, 128.1. 128.3, 128.5, 131.1, 131.2, 133.8, 155.4, 176.1; MS (ESI,
pos) m/z = 547 [2M+1]; Вычислено для C15H15NO4: C, 65.92; H, 5.53;
N, 5.13. Найдено: C, 65.59; H, 5.16; N, 4.79.
Benzyl (1R*,2S*,5S*)-2-(((benzyloxy)carbonyl)amino)-5-hydroxycyclohex-3-enecarboxylate, (±)-4
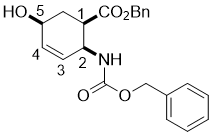
К ненасыщенному лактону (±)-3 (14.6 mmol) добавляли BnONa (35.1 mmol) реакционную смесь перемешивали 6 часов при 50 °C. Затем реакционную массу разбавляли EtOAc (75 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Сырец очищали колоночной хроматографией на силикагеле (n-гексан /EtOAc).
Получен белый твердый продукт; выход: 55%; Rf = 0.5 (n-гексан/EtOAc 1:1); Mp 48-50 °C; 1H NMR (400 MHz, CDCl3): δ = 2.00-2.08 (m, 2H, CH2), 2.89-3.00 (m, 1H, H-1), 4.22 (brs, 1H, N-H), 4.43 (m, 1H, H-2), 4.90-5.16 (m, 5H, H-5 and OCH2), 5.70-5.79 (m, 1H, H-3), 5.84-5.95 (m, 1H, H-4), 7.27-7.37 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 14.1, 32.3, 42.9, 49.8, 61.5, 62.1, 66,4, 127.5, 127.8, 128.6, 129.1, 131.0, 131.2, 132.3, 136.2, 137.0, 155.6, 173.4; MS (ESI, pos) m/z=404 [M+Na]; Вычислено для C22H23NO5: C, 69.28; H, 6.08; N, 3.67. Найдено: C, 69.55; H, 5.76; N, 3.32.
Benzyl ((1S*,2S*,5R*)-7-oxo-6-oxabicyclo[3.2.1]oct-3-en-2-yl)carbamate, (±)-7
К раствору иодолактона (±)-6 (20.51 mmol) в THF (50 mL) ) был добавлен DBU (45.1 mmol), и реакционную
смесь перемешивали с обратным холодильником в течении 6 часов. Затем реакционную
массу разбавляли EtOAc (75 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4)
и концентрировали при пониженном давлении. Сырец очищали колоночной хроматографией на силикагеле
(n-hexane/EtOAc).
Получен белый твердый продукт; выход: 80%; Rf = 0.3 (n-hexane/EtOAc2:1 ); Mp 125-127 °C;
1H NMR (400 MHz, CDCl3): δ = 1.59-1.92 (m, 1H, CH2), 2.11-2.44
(m, 2H, H-1 and CH2), 3.02-3.22 (m, 1H, H-2), 4.53 (brs, 1H, N-H), 4.79 (m, 1H, H-5),
4.94-5.21 (m, 2H, OCH2), 5.70-5.76 (m, 1H, H-3), 6.36-6.43 (m, 1H, H-4), 7.26-7.39 (m,
5H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 31.5, 43.4, 47.3, 67.2,
72.9, 128.3, 128.4, 128.6, 133.2, 133.3, 135.6, 155.2, 176.6; MS (ESI, pos) m/z = 547 [2M+1]; Вычислено
для C15H15NO4: C, 65.92; H, 5.53; N, 5.13. Найдено: C, 65.60; H,
5.18; N, 5.46.
Benzyl (1S*,2S*,5R*)-2-(((benzyloxy)carbonyl)amino)-5-hydroxycyclohex-3-enecarboxylate, (±)-8
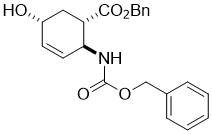
К ненасыщенному лактону (±)-7 (14.6 mmol) добавляли BnONa (35.1 mmol) и реакционную смесь перемешивали
6 часов при 50 °C. Затем реакционную массу разбавляли EtOAc (75 mL), промывали H2O (3
× 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении.
Получен белый твердый продукт; выход: 63%; Rf = 0.3 (n-hexane/EtOAc 1:1); Mp 138-140 °C;
1H NMR (400 MHz, CDCl3): δ = 1.86-1.98 (m, 1H, CH2), 2.02-2.11
(m, 1H, CH2), 2.27-2.36 (m, 1H, H-1), 2.74-2.85 (m, 1H, H-2), 4.32 (brs, 1H, N-H), 4.51-4.63
(m, 1H, H-5), 4.82 (brs, 1H, O-H), 5.02-5.21 (m, 4H, OCH2), 5.67-5.75 (m, 1H, H-3), 5.85-5.92
(m, 1H, H-4), 7.32-7.41 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 33.8, 45.6, 49.5, 54.3, 60.6, 65.6, 77.1, 77.7, 128.5, 128.6, 128.7, 128.9, 129.1, 133.5, 136.6,
155.9, 173.4; MS (ESI, pos) m/z = 382 [M+1]; Вычислено для C22H23NO5:
C, 69.28; H, 6.08; N, 3.67. Найдено: C, 67.89; H, 5.77; N, 3.99.
Benzyl (1S*,2S*,5S*)-2-(((benzyloxy)carbonyl)amino)-5-fluorocyclohex-3-enecarboxylate, (±)-9
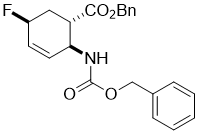
К раствору гидроксилированного эфира (±)-8 (0.52 mmol) в сухом CH2Cl2 (5 mL) был добавлен раствор Deoxofluor (50% в толуоле, 1.56 mmol) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течении 3 часов, и затем разбавляли CH2Cl2 (20 mL), промывали насыщенным NaHCO3 (3x 10 mL) и H2O (2 × 10 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток сырца очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 65%; Rf = 0.3 (n-hexane/EtOAc 3:1); Mp 63-65 °C ; 1H NMR (400 MHz, CDCl3): δ = 2.01-2.22 (m, 1H, CH2), 2.27-2.39 (m, 1H, CH2), 2.81-2.90 (m, 1H, H-1), 4.48-4.62 (m, 1H, H-2), 4.82-4.98 (m, 1H, H-5), 5.01-5.21 (m, 4H, OCH2), 5.22-5.36 (brs, 1H, N-H), 5.95-5.99 (m, 2H, H-3 and H-4), 7.32-7.42 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 30.6 (d, J = 26.8), 41.3, 42.2, 50.0, 67.3, 81.5 (d, J = 170.8), 125.9, 126.0, 128.5, 128.9, 135.3, 135.4, 136.6, 156.0, 173.0; 19F NMR (100 MHz, CDCl3): δ = -165.7; MS (ESI, pos) m/z = 406 [M+Na]; Вычислено для C22H22FNO4: C, 68.92; H, 5.78; N, 3.65. Найдено: C, 68.62; H, 5.41; N, 3.92.
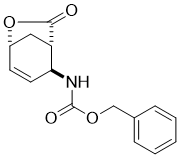
Benzyl (1R*,6S*)-6-(((benzyloxy)carbonyl)amino)cyclohex-3-enecarboxylate, (±)-11
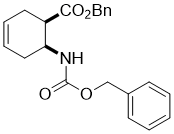
К раствору аминокислоты (±)-10 (28.4 mmol) в THF (75 mL), добавляли DBU (42.6 mmol) и BnBr (39.8 mmol), и реакционную смесь перемешивали с обратным холодильником в течении 6 часов. Затем реакционную массу разбавляли EtOAc (50 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении.
Получен белый твердый продукт; выход: 72%; Rf = 0.6 (n-hexane/EtOAc 3:1); Mp 42-43 °C; 1H NMR (400 MHz, CDCl3): δ = 2.12-2.46 (m, 4H, CH2), 2.49-2.61 (m, 1H, H-1), 2.84-2.91 (m, 1H, H-2), 4.29 (brs, 1H, N-H), 5.02-5.16 (m, 4H, OCH2), 5.57-5.70 (m, 2H, H-4, H-5), 7.26-7.39 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 24.9, 31.0, 42.1, 46.8, 66.6. 66.7. 124.1, 124.7, 124.9, 128.1, 128.2, 128.4, 128.5, 136.4, 136.5, 155.5, 173.2; MS (ESI, pos) m/z = 366 [M+1]; Вычислено для C22H23NO4: C, 72.31; H, 6.34; N, 3.83. Найдено: C, 72.66; H, 6.01; N, 3.50.
Benzyl (1S*,3R*,4S*,6R*)-4-(((benzyloxy)carbonyl)amino)-7-oxabicyclo[4.1.0]heptane-3-carboxylate, (±)-12
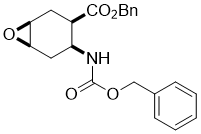
К раствору аминоэфира (±)-11 (13.3 mmol) в CH2Cl2 (60 mL) добавляли MCPBA (13.3 mmol) при температуре 0 °C. Реакционную смесь перемешивали при комнатной температуре в течении 12 часов, затем разбавляли CH2Cl2 (50 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток сырца очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 61%; Rf = 0.5 (n-hexane/EtOAc 2:1); Mp 53-56 °C; 1H NMR (400 MHz, CDCl3): δ = 2.06-2.32 (m, 3H, CH2), 2.54-2.61 (m, 1H, CH2), 2.64-2.73 (m, 1H, H-3), 3.20-3.26 (m, 2H, H-1 and H-6), 4.12-4.24 (m, 1H, H-4), 5.04-5.19 (m, 4H, OCH2), 5.77-5.85 (brs, 1H, N-H), 7.31-7.44 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 24.4, 29.4, 40.7, 46.0, 50.9, 51.6, 66.8, 66.9, 127.1, 128.0, 128.2, 128.5, 128.6, 135.7, 136.5, 155.7, 172.6; MS (ESI, pos) m/z = 382 [M+1]; Вычислено для C22H23NO5: C, 69.28; H, 6.08; N, 3.67. Найдено: C, 68.87; H, 5.80; N, 3.40.
Benzyl (1R*,2S*,4S*)-2-(((benzyloxy)carbonyl)amino)-4-hydroxycyclohexanecarboxylate, (±)-13
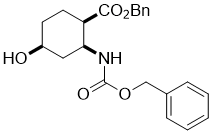
К раствору эпокси аминоэфира (±)-12 (7.8 mmol) в THF, добавляли NaCNBH3 (62.9 mmol) и CH3COOH (47.2 mmol). Реакционную смесь перемешивали с обратным холодильником в течении 8 часов, затем разбавляли EtOAc, промывали H2O, осушали (Na2SO4) и концентрировали при пониженном давлении. Сырец очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 55%; Rf = 0.3 (n-hexane/EtOAc 1:1); Mp 70-72 °C ; 1H NMR (400 MHz, CDCl3): δ = 1.73-2.00 (m, 6H, CH2), 2.10-2.22 (m, 1H, H-1), 2.68-2.76 (m, 1H, H-2), 4.07 (brs, 1H, H-4), 4.33 (m, 1H, O-H), 5.00-5.14 (m, 4H, OCH2), 6.40-6.52 (brs, 1H, N-H), 7.30-7.40 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 31.3, 37.4, 44.4, 48.2, 66.5, 65.6, 66.7, 128. 0, 128.2, 128.3, 128.5, 135.6, 136.4, 155.7, 173.1; MS (ESI, pos) m/z = 382 [M+1]; Вычислено для C22H25NO5: C, 68.91; H, 6.57; N, 3.65. Найдено: C, 68.56; H, 6.19; N, 3.31.
Benzyl (1S*,6S*)-6-(((benzyloxy)carbonyl)amino)cyclohex-3-enecarboxylate, (±)-16
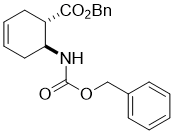
К раствору аминокислоты (±)-15 (29.0 mmol) в THF (75 mL) добавляли DBU (43.6 mmol), BnBr (40.7 mmol) и реакционную смесь перемешивали с обратным холодильником в течении 6 часов. Затем реакционную массу разбавляли EtOAc (50 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 81%; Rf = 0.5 (n-hexane/EtOAc 3:1); Mp 45-46 °C ; 1H NMR (400 MHz, CDCl3): δ = 1.95-2.06 (m, 1H, CH2), 2.30-2.40 (m, 1H CH2), 2.47-2.62 (m, 2H, CH2), 2.76-2.85 (m, 1H, H-1), 4.11-4.22 (m, 1H, H-2), 4.88 (brs, 1H, N-H), 5.04-5.17 (m, 4H, OCH2), 5.59-5.73 (m, 2H, H-4, H-5), 7.30-7.42 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 26.7, 31.1, 44.5, 47.9, 66.5, 66.6, 124.2, 124.9, 128.4, 128.5, 135.8, 136.4, 155.5, 172.3; MS (ESI, pos) m/z = 366 [M+1]; Вычислено для C22H23NO4: C, 72.31; H, 6.34; N, 3.83. Найдено: C, 72.68; H, 6.70; N, 3.51.
Benzyl (1S*,3S*,4S*,6R*)-4-(((benzyloxy)carbonyl)amino)-7-oxabicyclo[4.1.0]heptane-3-carboxylate, (±)-17
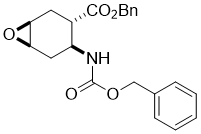
К раствору аминоэфира (±)-16 (17.0 mmol) в CH2Cl2 (60 mL) добавляли MCPBA (17.0 mmol) при 0 °C. Реакционную смесь перемешивали при комнатной температуре в течении 12 часов, затем разбавляли CH2Cl2 (50 mL), промывали H2O (3 × 30 mL), сушили (Na2SO4 и концентрировали при пониженном давлении. Остаток сырца очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 72%; Rf = 0.5 (n-hexane/EtOAc 2:1); Mp 89-91°C ; 1H NMR (400 MHz, CDCl3): δ = 1.90-1.98 (m, 1H, CH2), 2.14-2.31 (m, 2H, CH2), 2.35-2.45 (m, 1H, CH2), 2.73-2.81 (m, 1H, H-3), 3.16-3.21 (m, 1H, H-4), 3.27-3.32 (m, 1H, H-1), 4.07-4.20 (m, 1H, H-6), 5.03-5.20 (m, 4H, OCH2), 5.36-5.44 (m, 1H, N-H), 7.30-7.42 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 23.8, 28.4, 41.1, 46.5, 51.6, 52.4, 66.7, 66.8, 128.5, 128.6, 128.7, 128.8, 135.6, 136.4, 155.4, 172.8;
MS (ESI, pos) m/z = 382 [M+1]; Вычислено для C22H23NO5: C, 69.28; H, 6.08; N, 3.67. Найдено: C, 68.88; H, 5.79; N, 3.38.
Benzyl (1S*,2S*,5R*)-2-(((benzyloxy)carbonyl)amino)-5-hydroxycyclohexanecarboxylate, (±)-18
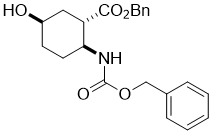
К раствору (±)-17 эпокси аминоэфира (10.4 mmol) в THF добавляли NaCNBH3 (31.4 mmol) и CH3COOH (10.4 mmol). Реакционную массу перемешивали с обратным холодильником в течении 8 часов, затем разбавляли EtOAc, промывали H2O (3 × 30 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Сырец очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Получен белый твердый продукт; выход: 72%; Rf = 0.6 (n-hexane/EtOAc 1:1); Mp 58-60 °C; 1H NMR (400 MHz, CDCl3): δ = 1.52-2.13 (m, 7H, CH2, H-1), 2.76-2.86 (m, 1H, H-2), 3.77-3.88 (m, 1H, H-5), 4.08 (brs, 1H, N-H), 4.78 (brs, 1H, O-H), 4.98-5.10 (m, 4H, OCH2), 7.26-7.37 (m, 10H, CH-Ar); 13C NMR (100 MHz, CDCl3): δ = 26.6, 29.7, 34.7, 43.9, 51.1, 64.4, 66.6, 66.7, 128.0, 128.1, 128.4, 128.5, 135.8, 136.5, 155.5, 173.8; MS (ESI, pos) m/z = 384 [M+1]; Вычислено для C22H25NO5: C, 68.91; H, 6.57; N, 3.65. Найдено: C, 68.56; H, 6.21; N, 3.99.
Benzyl (1S*,2S*,5S*)-2-(((benzyloxy)carbonyl)amino)-5-fluorocyclohexanecarboxylate, (±)-19
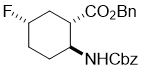
К раствору гидроксилированного эфира (±)-18 (0.52 mmol) в сухом CH2Cl2 (5 mL) был добавлен в атмосфере аргона раствор Deoxofluor (50% в толуоле, 1.56 mmol). Реакционную смесь перемешивали при 0 °C в течении 4 h, затем разбавляли CH2Cl2 (20 mL), промывали насыщенным NaHCO3 (3x 15 mL) и потом H2O (2 × 10 mL), сушили (Na2SO4) и концентрировали при пониженном давлении. Сырец очищали колоночной хроматографией на силикагеле (n-hexane/EtOAc).
Белый твердый продукт; выход: 38%; Rf = 0.6 (n-hexane/EtOAc 3:1); Mp 77-79 °C; 1H NMR (400 MHz, CDCl3): δ = 1.41-1.49 (m, 1H, CH2), 1.62-1.71 (m, 1H, CH2), 1.87-1.96 (m, 1H, CH2), 2.03-2.10 (m, 2H, CH2), 1.28-1.35 (m, 1H, CH2), 2.44-2.52 (m, 1H, H-1), 3.60-3.67 (m, 1H, H-2), 4.41-4.60 (m, 1H, H-5), 4.78 (brs, 1H, N-H), 5.03-5.12 (m, 4H, OCH2), 7.41-7.55 (m, 10H, Ar-H); 13C NMR (100 MHz, CDCl3): δ = 26.6, 30.1 (d, J = 26.1), 33.7 (d, J = 27.0), 46.7, 50.9, 66.8, 66.9, 89.5 (d, J = 170.2 Hz), 128.2, 128.3, 128.4, 128.5, 135.5, 136.3, 155.4, 171.9. 19F NMR (100 MHz, CDCl3): δ = -174.5; MS (ESI, pos) m/z = 386 [M+1]; Вычислено для C22H24FNO4: C, 68.56; H, 6.28; N, 3.63. Найдено: C, 68.15; H, 5.95; N, 3.28.
Благодарности
Мы признательны Hungarian Research Foundation (NKFIH Nos. K 115731 и K 119282) за фининсовую поддержку. Мы также благодарны за финансовую поддержку проекта GINOP-2.3.2-15-2016-00038. Это исследование также было поддержано грантом Евросоюза EFOP-3.6.1-16-2016-00008.
Литература
- a) Wang, J.; Sánchez-Roselló, M.; Aceña, J. L.; del Pozo, C.; Sorochinsky, A. E.; Fustero, S.; Soloshonok, V. A.; Liu, H. Chem. Rev. 2014, 114, 2432; b) Zhou, Y.; Wang, Y.; Gu, Z.; Wang, S.; Zhu, W.; Acena, J. L.; Soloshonok, V. A.; Izawa, K.; Liu, H. Chem. Rev. 2016, 116, 442; c) Fluorine in Pharmaceutical and Medicinal Chemistry: From Biophysical Aspects to Clinical Applications, Imperial College Press, London 2012. Edited by Gouverneur, V. and Müller, K.
- a) Liang, T.; Neumann, C. N.; Ritter, T. Angew. Chem. Int. Ed. 2013, 52, 8214; b) Campbell, M. G.; Ritter, T. Chem. Rev. 2015, 115, 612; c) Charpentier, J.; Früh, N.; Togni, A. Chem. Rev. 2015, 115, 650; d) Yang, X.; Wu, T.; Phipps, R. J.; Toste, F. D. Chem. Rev. 2015, 115, 826; e) Cresswell, A. J.; Davies, S. G.; Roberts, P. M.; Thomson, J. E. Chem. Rev. 2015, 115, 566; f) O’Hagan, D.; Deng, H. Chem. Rev. 2015, 115, 634; g) Liu, X.; Xu, C.; Wang, M.; Liu, Q. Chem. Rev. 2015, 115, 683; h) Champagne, P. A.; Desroches, J.; Hamel, J. D.; Vandamme, M.; Paquin, J. F. Chem. Rev. 2015, 115, 9073.
- a) Kiss, L.; Fülöp, F. The Chem. Rec. 2017, doi: 10.1002/tcr201700038; b) Kiss, L.; Nonn, M.; Sillanpää, R.; Fustero, S.; Fülöp, F. Beilstein J. Org. Chem. 2013, 9, 1164; c) Kiss, L.; Nonn, M.; Forró, E.; Sillanpää, R.; Fustero, S.; Fülöp, F. Eur. J. Org. Chem. 2014, 4070.
- for some relevant references see: a) Nonn, M.; Kiss, L.; Haukka, M.; Fustero, S.; Fülöp, F. Org. Lett. 2015, 17, 1074; b) Kiss, L.; Nonn, M.; Sillanpää, R.; Haukka, M.; Fustero, S.; Fülöp, F. Chem. Asian J. 2016, 11, 3376; c) Remete, A. M.; Nonn, M.; Fustero, S.; Fülöp, F.; Kiss, L: Molecules 2016, 21, 1943.
- a) Kiss, L.; Fülöp, F. Chem. Rev. 2014, 114, 1116; b) Kiss, L.; Mándity, I. M.; Fülöp, F. Amino Acids 2017, 49, 1441.
- a) Kiss, L.; Szatmári, I.; Fülöp, F. Lett. Org. Chem. 2006, 3, 463; b) Kiss, L.; Forró, E.; Fustero, S.; Fülöp, F. Org. Biomol. Chem. 2011, 9, 6528; c) Kiss, L.; Forró, E.; Fustero, S.; Fülöp, F. Eur. J. Org. Chem. 2011, 4993.
- a) Kiss, L.; Forró, E.; Fülöp, F. Tetrahedron 2012, 68, 4438; b) Kiss, L.; Forró, E.; Martinek, T. A.; Bernáth, G.; De Kimpe, N.; Fülöp, F. Tetrahedron 2008, 64, 5036.
Информацию по спектрам синтезированных соединений см. английскую версию статьи
Статья рекомендована к публикации членом редколлегии Prof. József Rábai
Fluorine Notes, 2018, 116, 1-2


