Поступило в редакцию: Ноябрь 2017
УДК 542.91:541.49+541.64:66.095.264.3-036.742
Fluorine Notes, 2017, 115, 9-10
Биядерные комплексы хлорида титана(IV) с хиральными фторсодержащими тетраарил-1,3-диоксолан-4,5-диметанольными лигандами – новый тип катализаторов полимеризации этилена и пропилена
С. Ч. Гагиева а), В.А.Тускаева, в), Л.А. Ришинаб), А.Г. Буяновскаяв), Б. М. Булычева)
а Московский государственный университет им. М.В. Ломоносова, Химический факультет, 19992, Москва, Ленинские горы, Российская Федерация, Факс: 932 8846. E-mail: B.Bulychev@highp.chem.msu.ru
б Институт химической физики им. Н.Н. Семенова РАН, 11797, Москва, ул. Косыгина, 4, Россия
в Институт элементоорганических соединений им. А.Н. Несмеянова, 119992, Российская федерация, Москва, ул. Вавилова 28
Аннотация: Получены моно- и биядерные координационные соединения титана (IV), стабилизированные новыми би- и тетрадентантными хиральными лигандами (L) - производными (4R,5R)-2,2-диметил-,,','-тетрафенил-1,3-диоксолан-4,5-диметанола. Комплексы, после активации метилалюмоксаном, катализируют реакцию полимеризации этилена с активностями от 50 до 1000 кг ПЭ(моль Ti ч. атм)-1 и пропилена от 50 до 200 кг ПП(моль Ti ч атм)-1). Замена фенильных радикалов в лигандах на перфторфенильные приводит к значительному увеличению каталитической активности систем в реакциях полимеризации этилена и пропилена. Показано, что системы с участием биядерных комплексов и системы с комплексами, содержащими в лигандах перфторфенильные фрагменты, продуцируют образование полиэтиленов со значительно большими значениями молекулярных масс, в сравнении с моноядерными и нефторированными аналогами.
Ключевые слова: титан(IV), ТАДДОЛ, фторсодержащие лиганды, гомогенный катализ, полимеризация, СВМПЭ, полипропилен.
В последние два десятилетия отмечается интенсивный рост исследований в области синтеза координационных соединений переходных металлов 4-6 и 8-10 групп, многие из которых оказались эффективными компонентами каталитических систем полимеризации олефинов, получивших название постметалоценовые системы [1-6]. Эти катализаторы характеризуются высокой активностью и возможностью получения с их помощью различных типов полиолефинов: сверхвысокомолекулярного линейного полиэтилена (СВМПЭ), низкомолекулярного ПЭ с концевыми винильными группами, высокорегулярного изотактического и синдиотактического ПП, высокомолекулярного атактического полипропилена, сверхвысокомолекулярных статистических и блок-сополимеров этилена с пропиленом, сополимеров этилена с норборненом и ряда других полиолефинов [7-9]. Одним из наиболее интересных свойств некоторых катализаторов этого класса является способность обеспечивать “живую” полимеризацию этилена и пропилена даже при высоких температурах реакции, что позволяет получать ПЭ и ПП с очень узким молекулярно-массовым распределением (Mw/Mn~1).
В то же время систематические исследования комплексов с хиральными лигандами, содержащими перфторированные заместители, в полимеризации олефинов крайне редки. Данные системы интересны с двух точек зрения: 1 - выяснения влияния электроакцепторных функциональных групп на каталитические свойства получаемых комплексных соединений и отсюда на все свойства полимеров, включая МW, молекулярно-массовое распределение, кристалличность и т.п., 2- возможностью синтеза моно-, би- и полиядерных комплексов и исследования эффекта нуклеарности пре-катализатора на активность системы и свойства полимера.
Би- и полиядерные комплексы переходных металлов являются эффективными катализаторами разнообразных химических реакций, включая и полимеризацию олефинов [10]. В структурах подобных соединений возможно (хотя и не всегда регистрируется и не всегда доказывается их полиядерная природа) кооперативное взаимодействие близко расположенных металлических центров, обеспечивающее уровень активности и селективности каталитических систем, недостижимый для систем с моноядерными аналогами. Помимо этого, кооперативный эффект в катализе полимеризации олефинов может влиять на степень разветвлений полимерной цепи и кинетические параметры переноса цепи, что, в конечном итоге, сказывается на молекулярном весе полимера и его морфологии [11].
Ранее нами было показано, что комплексные соединения титана с диольными лигандами являются эффективными компонентами постметаллоценовых каталитических систем полимеризации этилена [12-15]. В настоящей работе описан синтез и свойства новых типов хиральных полидентатных лигандов - производных тетраарил-1,3-диоксолан-4,5-диметанола (ТАДДОЛа)- и ряда комплексов титана(IV), полученных с их участием, а также результаты изучения каталитических свойств этих комплексов в гомогенных реакциях полимеризации этилена и пропилена.
Хиральные лиганды (1-17) получены путем взаимодействия арилмагнийбромидов с соответствующими
ацеталями эфиров винной кислоты [16,17] (Схема 1). Введение в структуру лиганда стерически затрудненных
ароматических заместителей, функционализированных различными группами, позволяет изменять как геометрию
молекулы комплекса, т.е. направленно регулировать стерическую нагруженность металлического центра,
так и его электронные характеристики. В этом отношении достаточно удобными заместителями являются
атомы фтора и трифторметильные группы.
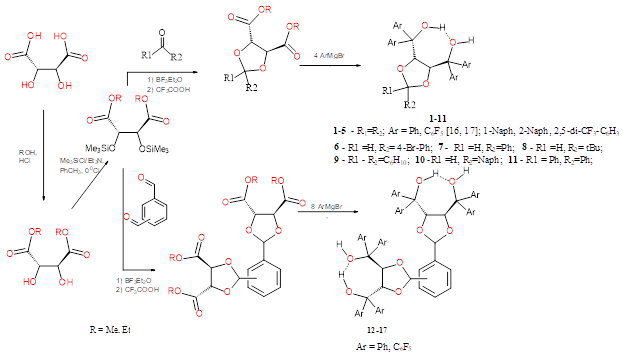
Схема 1
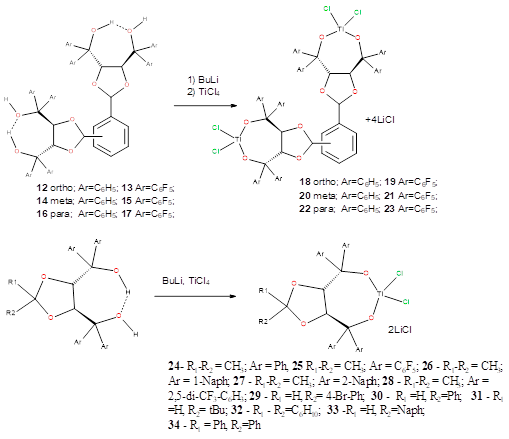
Схема 2.
Состав соединений и их строение подтверждены данными элементного анализа, спектрами ЯМР и масс-спектроскопии. В ИК-спектрах комплексов наблюдалось появление полос валентных колебаний Ti–O, Ti–Cl в области 520-600 см–1.
Для изучения каталитических свойств комплексы состава LTiCl2 или LTi2Cl4 не отделяли от побочного продукта реакции – LiCl, а сразу активировали их полиметилалюмоксаном (МАО) и использовали в реакции полимеризации этилена in situ. Наиболее значимые результаты этого исследования приведены в таблице 1.
Таблица 1.
Полимеризация этилена на системах с пре-катализаторами 18-23 и 24-34/МАО и некоторые свойства получаемого полиэтилена а
|
№№ |
Комплекс |
[Al]/ [Ti] |
Масса полимера, г |
A б |
Степень криств % |
Tплг |
Mw, 106 |
Mw/ Mn |
| 1 |
18 |
1000 |
0.29 |
192 |
47 |
138 |
1.50 |
2.7 |
| 2 |
18 |
500 |
0.20 |
132 |
48 |
139 |
1.98 |
3.5 |
| 3 |
18 |
3000 |
0.50 |
501 |
52 |
137 |
1.50 |
2.7 |
| 4 |
19 |
500 |
0.35 |
240 |
58 |
142 |
3.7ж |
|
| 5 |
19 |
1000 |
0.70 |
463 |
69 |
143 |
5.64ж |
|
| 6 |
20 |
3000 |
0.12 |
212 |
52 |
138 |
1.45 |
|
| 7 |
20 |
1000 |
0.37 |
232 |
50 |
137 |
||
| 8 |
21 |
3000 |
0.36 |
230 |
73 |
140 |
4.68 ж |
|
| 9 |
21 |
1000 |
0.79 |
510 |
70 |
142 |
||
| 10 |
22 |
1000 |
0.85 |
550 |
52 |
139 |
||
| 11 |
22 |
500 |
0.57 |
368 |
60 |
137 |
||
| 12 |
23 |
1000 |
1.50 |
968 |
77 |
143 |
4.25ж |
|
| 13 |
23 |
500 |
1.05 |
678 |
72 |
140 |
5.04ж |
|
| 14 |
24е |
3000 |
0.62 |
805 |
73 |
140 |
0.50 |
2.12 |
| 15 |
24 |
1050 |
0.41 |
480 |
68 |
141 |
0.48 |
2.32 |
| 16 |
24 |
200 |
0.12 |
21 |
54 |
142 |
||
| 17 |
25 |
1000 |
0.30 |
600 |
76 |
144 |
1.45 |
2.76 |
| 18 |
25 |
500 |
0.24 |
480 |
79 |
143 |
1.68 |
2.67 |
| 19 |
25е |
1000 |
0.49 |
850 |
71 |
141 |
||
| 20 |
26 |
500 |
0.05 |
48 |
58 |
142 |
||
| 21 |
27 |
500 |
0.05 |
69 |
60 |
143 |
1.21 |
2.78 |
| 22 |
28 |
500 |
0.10 |
120 |
62 |
139 |
||
| 23 |
29 |
500 |
0.12 |
150 |
68 |
138 |
1.05 |
3.93 |
| 24 |
30 |
500 |
0.29 |
520 |
50 |
140 |
||
| 25 |
31 |
500 |
0.10 |
120 |
56 |
141 |
||
| 26 |
32 |
500 |
0.18 |
120 |
47 |
139 |
||
| 27 |
33 |
500 |
0.32 |
150 |
49 |
137 |
||
| 28 |
34 |
500 |
0.40 |
520 |
66 |
139 |
a Полимеризация выполнена в 10 мл толуола, С(Ti) 1.7 10-6 моль, давление 1 атм, время полимеризации 30 мин, температура полимеризации 25 C, катализатор готовили в режиме in situ. б кг ПЭ (моль Ti атм)-1 ч-1. в Температура плавления определена из ДСК (второе плавление образца полиэтилена). г Степень кристалличности рассчитана по данным ДСК (с использованием формулы Hm100% = 288 J/g ) [18]. д Mw определен ГПХ; е реакция проведена в гептане; ж Mw определен визкозиметрически.
Как видно из таблицы 1, все прекатализаторы 18-34 в той или иной степени эффективны в реакции полимеризации этилена: каталитическая активность систем варьирует в диапазоне от 21 до 968 кг ПЭ/(моль Ti ч атм).
Наиболее эффективными являются каталитические системы на основе фторсодержащого биядерного комплекса 23 (каталитическая активность достигает 968 кг ПЭ (моль Ti атм)-1 ч-1). Увеличение мольного отношения AlMAO/Ti от 500 до 3000 моль/моль (на примере прекатализатора 18) сопровождается постепенным ростом активности каталитической системы от 132 до 500 кг ПЭ/моль Ti·ч·атм.
Полимеризация этилена на фторсодержащих биядерных ТАДДОЛьных комплексах 19, 21 и 23, в отличие от фенильных аналогов, приводит к заметному повышению каталитической активности (в 2-3
раза). Как видно из рисунка 2, полимеризация этилена на моно- и биядерных фторсодержащих комплексах
характеризуется относительно стабильной кинетикой.
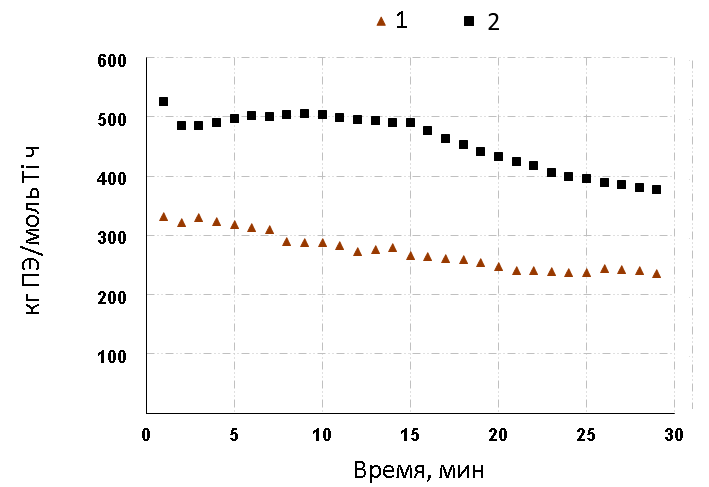
Рисунок 2. Кинетика полимеризации этилена на прекатализаторах 23 (кривая 2, опыт12, таблица 1) и 25 (кривая 1, опыт 17, таблица 1).
В ряду моноядерных комплексов 24-34 наиболее эффективным является прекатализатор 25. Как видно из таблицы 1, замена перфторфенильных фрагментов на объемные 1-нафтильный, 2-нафтильный и 2,5-ди-CF3-фенильный не приводит к увеличению каталитической активности системы. Изменение природы радикала в диоксолановом фрагменте на трет-бутильный, нафтильный, 4-бромфенильный также не приводит к увеличению каталитической активности 29, 31, 33. Введение одного или двух фенильных радикалов в диоксолановый цикл (комплексы 30, 34) сопровождается ростом активности до 520 кг ПЭ/ (моль Ti ч атм) и только при наличии двух метильных радикалов в диоксолановом цикле (комплексы 24, 25) каталитическая активность возрастает до 850 кг ПЭ/(моль Ti ч атм).
ИК-спектры полиэтиленов, образующихся на всех катализаторах c ТАДДОЛ’ьными лигандами характеризуются наличием полос при 908 и 995 см-1, которые можно отнести к концевым винильным группам. Это свидетельствует о передаче цепи путем -Н элиминирования и переходе водорода на атом Ti или мономер [19]. О том, что полимеры имеют преимущественно линейное строение и являются сверхвысокомолекулярными полиэтиленами, свидетельствуют данные ИК-спектроскопии, ТГА, ДСК и вискозиметрии (молекулярная масса до 5 106 Да).
Сравнительно высокая стабильность моноядерного фторсодержащего комплекса 25 и биядерных комплексов 19, 21 и 23 в условиях полимеризации, в особенности термостабильность 25 при температурах до 50 °C, позволила провести полимеризацию пропилена и блок-сополимеризацию пропилена с этиленом.
На моноядерном перфторфенильном 25 титановом катализаторе образуется полипропилен, обладающий эластичными свойствами, с изотактическими включениями (Тпл = 150-156оС, Тс = 4-5 оС и степень кристалличности 9%) [15].
На биядерных катализаторах 19, 23 выход полипропилена не увеличивается по сравнению с моноядерным аналогом (таблица 2), но в ЯМР спектре наблюдается увеличение доли изотактических последовательностей (mmmm) 31.32, 27.75 (соответственно).
Таблица 2. Полимеризация пропилена на каталитических системах 22,23,25/МАО (t = 50С, жидкий пропилен, продолжительность полимеризации 60 мин).
|
№ |
Прекатализатор |
Ti 105, |
Al/Ti моль/ моль |
Выход Полимера |
|
|---|---|---|---|---|---|
|
г |
кг/моль Ti |
||||
|
1 |
22 |
1.5 |
135 |
1 |
67 |
|
2 |
23 |
1.07 |
189 |
1 |
100 |
|
3 |
25 |
5.37 |
120 |
5 |
93.1 |
Таблица 3
Структурные характеристики ПП, полученного на системах с моно- и биядерными комплексами 22, 23 и 25
|
№№ |
Прекатализатор |
D998/D973 |
D840/D973 |
D865/D1160 |
Т пл, С |
Hпл, Дж/г |
Ткр, С |
Hкр, Дж/г |
K, % |
|---|---|---|---|---|---|---|---|---|---|
|
1 |
22 |
0.445 |
0.30 |
0.0555 |
151.8 |
10.08 |
111.4 |
12.93 |
10.7 |
|
2 |
23 |
0.45 |
0.26 |
0.045 |
154.9/149.7 |
23.94/ 9.277 |
100.9 |
14.9 |
Аморф- ный |
|
3 |
25 моно F |
0.47 |
0.27 |
0.0455 |
156.1/152.8 |
19.63/ 15.15 |
114.4 |
17.89 |
9 |
Т пл –первое и второе плавление
Таблица 4. Распределение стерических пентад в образцах ПП, полученного с моно- и биядерными комплексами 22, 23 и 25 (жидкий пропилен)
|
№ |
Прекатализатор |
Содержание стерических пентад, % |
||||||||
|
mmmm |
mmmr |
rmmr |
mmrr |
mrmm+ rmrr |
rmrm |
rrrr |
rrrm |
mrrm |
||
|
1 |
22 |
31.32 |
9.93 |
1.91 |
8.57 |
12.48 |
5.37 |
11.07 |
11.19 |
8.16 |
|
2 |
23 |
27.75 |
8.94 |
2.52 |
9.42 |
13.58 |
6.40 |
8.58 |
16.93 |
5.88 |
|
3 |
25 |
27.2 |
9.15 |
2.65 |
9.29 |
14.99 |
5.99 |
13.11 |
10.37 |
7.23 |
Таким образом, все полученные нами моно- и биядерные титансодержащие комплексы с производными тетраарилдиоксоландиметанола, после их активации полиметилалюмоксаном способны катализировать реакции полимеризации этилена и пропилена. Введение в структуру лиганда перфторфенильных фрагментов приводит к существенному увеличению каталитической активности систем, как при полимеризации этилена, так и пропилена. Этот факт не может быть объяснен исключительно стерическими факторами. Очевидно, что большое значение играют электронные эффекты, а также так называемый «фторный эффект», заключающийся в формировании слабых нековалентных взаимодействий между атомами фтора в лиганде и водородными атомами растущей полимерной цепи [9].
Активность биядерных комплексов в полимеризации этилена, вне зависимости от структуры линкера (о-, м- и п-ксилиденового фрагмента), либо не превосходит, либо существенно уступает моноядерным аналогам. Однако, полиэтилен, полученный на биядерных пре-катализаторах, характеризуется значительно более высокими значениями молекулярной массы (до 5.64 106 Да для комплекса 12), что, с нашей точки зрения, позволяет предположить наличие кооперативного эффекта двух металлических центров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы комплексов проводили в атмосфере аргона. Тетрагидрофуран, дихлорметан, толуол, изопропанол, гексан марок “х.ч.” дополнительно перегоняли над кетил натрием [20] TiCl4 фирмы Fluka дополнительно перегоняли в атмосфере аргона. Метилалюмоксан (MMAO-12; Aldrich) использовали в виде 7% раствора в толуоле. Диизопропиловый эфир L-винной кислоты получали по описанной ранее методике [16]. 1,2-, 1,3- и 1,4-ди-[(4R,5R)-4,5-бис-(карбоксиэтил)-1,3-диоксолан-2-ил]-бензолов получены по методике [21].
Спектры ЯМР лигандов записывали на приборе “Bruker АМХ-400”, ИК спектры - на спектрофотометре “Magna-IR 750”. Оптическое вращение измеряли на поляриметре “Perkin-Elmer 241”. Элементный анализ проводился на приборах “Carlo Erba-1106” и “Carlo Erba-1108”.
Соединения 1-11 были получены реакцией Гриньяра по общей методике, приведенной в [22].
Для [(4R,5R)-2,2-диметил-α,α,α’,α'-тетрафенил-1,3-диоксалан-4,5-диметанола] (1) Т. пл. 193 0С. Выход 86%. Найдено (%): C, 79.74; H, 6.40. C31H30O4. Вычислено (%): C, 79.80; H, 6.48. 1H ЯМР (400 MГц, CDCl3) δ: 1.56 (с, 6H, CH3), 3.85 (с, 2H, OH), 4.67 (с, 2H, CH), 7.22-7.34 (м, 10Н, Ph).
Для [(4R,5R)-2,2-диметил- α,α,α’,α'-тетрафтортетрафенил-1,3-диоксалан-4,5-диметанола] (2) Т. пл. 106 0С. Выход 76%. Найдено (%): C, 45.00; H, 1.18. C31H10F20O4. Вычислено (%): C, 45.06; H, 1.22. 1H ЯМР (400 MГц, CDCl3) δ: 1.37 (с, 6H, CH3), 4.67 (с, 2H, OH), 4.89 (с, 2H, CH).
Для [(4R,5R)-2-циклогексил-α,α,α’,α'-тетра-1-нафтил-1,3-диоксалан-4,5-диметанола] (3) осуществляли согласно методике приведенной в работе [22]. Т. пл. 186 0С.
Синтез [(4R,5R)-2,2-диметил-α,α,α’,α'-тетра-2-нафтил-1,3-диоксалан-4,5-диметанола] (4) осуществляли согласно методике приведенной в работе [22]. Т. пл. 193 0С.
Синтез [(4R,5R)-2,2-диметил- α,α,α’,α'-тетра(2,5-дитрифторметилфенил)-1,3-диоксалан-4,5-диметанола] (5) осуществляли согласно методике приведенной в [21]. Т. пл. 106 0С.
Синтез [(4R,5R)-2-ди-4-бромфенил-α,α,α’,α'-тетрафенил-1,3-диоксалан-4,5-диметанола] (6) осуществляли согласно методике приведенной в работе [21]. Т. пл. 193 0С.
Синтез [(4R,5R)-2,2-диметил- α,α,α’,α'-тетрафтортетрафенил-1,3-диоксалан-4,5-диметанола] (2) осуществляли согласно методике приведенной в [17]. Т. пл. 106 0С.
Синтез 1,2-бис(4,5-бис(дифенил)гидроксиметил-1,3-диоксолан-2-ил)-бензола (12). В атмосфере аргона к реактиву Гриньяра, полученному из металлического магния (0.94 г) и C6H5Br (6.0 г; 10 ммоль) в 20 мл тетрагидрофурана, охлажденному до 0°С, был добавлен раствор 1,2-ди-[(4R,5R)-4,5-бис-(карбоксиэтил)- 1,3-диоксолан-2-ил]бензола (2 г; 3.9 ммоль). После окончания прибавления реакционную смесь нагревали до кипения и кипятили с обратным холодильником в течение 2 часов. Затем реакционную смесь разлагали 50 мл насыщенного раствора NH4Cl, отделяли органический слой, сушили над Na2SO4, и удаляли растворитель в вакууме. Полученное масло перекристаллизовывали из толуола. Получено 0.50 г. (90%). Т. пл. 118°С; [α]D25 +1000 (с 1, CHC13). Спектр 1H ЯМР (CDCl3, δ, м.д.) 7.54-7.11 (м, 44Н, аром.), 6.18 (с, 2Н, СН), 5.34 (д, 2Н, СН, J=4.0 Гц), 5.28 (д, 2Н, СН, J=4.0 Гц), 3.25 (с, 2Н, ОН), 1,90 (с, 2Н,ОН). УФ-спектр (СН2Cl2), λmax, нм (lg ε): 245.2 (4.35), 253.6 (4.46), 259.4 (4.51). Найдено: С 80.67%; Н 5.65%. Вычислено для С64Н54О8: С 80.82%; Н 5.72%.
Синтез 13-17 проводили аналогично 12.
Синтез комплексов 18-34 проводили по общей методике:
К раствору лиганда 1-17 (0.20 ммоль) в толуоле при температуре -78оС добавляли 2,5 М раствор бутиллития в гептане (0.42 ммоль) по каплям. Температуру реакционной смеси доводили до комнатной, и через 4 часа вновь охлаждали до 0оС и добавляли раствор TiCl4 (0.20 ммоль) в 5 мл толуола. Через 3 часа перемешивания растворитель упаривали. Аналитические образцы комплексов получены кристаллизацией из смеси толуол: гексан 1:1.
Посвящается памяти Суховой Т.
Работа выполнена при финансовой поддержке Российского Научного Фонда (грант РНФ №16-13-10502).
Список цитированной литературы:
- B.M. Trost, L.C. Czabaniuk. Angew. Chem. Int. Ed., 2014, 53, 2826 – 2851.
- M. C. Baier, M.A. Zuideveld, S. Mecking. Angew. Chem. Int. Ed., 2014, 53, 9722 – 9744.
- S. Wang, W.-H. Sun, C. Redshaw. J. Organomet. Chem., 2014, 751, 717-741.
- M.S. Khan, A. Haque, M. K. Al-Suti, P. R. Raithby. J. Organomet. Chem., 2015, 793, 114-133, DOI 10.1016/j.jorganchem.2015.03.023.
- L.C. So, S. Faucher, S. Zhu. Progress in Polymer Science, 2014, 39, 1196–1234.
- Y.-Y. Grace Luk, D.A. Foucher, R.A. Gossage. C. R. Chimie, 2013, 16, 573–579.
- Y.V. Kissin. J. Res.Updates Polym. Sci., 2013, 2, 8-24.
- Y.V. Kissin. Alkene Polymerization Reactions with Transition Metal Catalysts. Amsterdam: Elsevier 2008 [chapter 5].
- H. Makio, T. Fujita, Bull. Chem. Soc. Jpn. 2005, 78, 52–66.
- M. Delferro, T. J. Marks, Chem Rev., 2011, 111, 2450–2485.
- Ainooson M., Meyer F., in Comprehensive Inorganic Chemistry II (Second Edition), Volume 8: Coordination and Organometallic Chemistry, 2013, 433–458.
- M.V. Solov’ev, S.Ch. Gagieva, V.A. Tuskaev, N.M. Bravaya, O.E. Gadalova, V.N. Khrustalev, A.O. Borissova, B.M. Bulychev, Russ. Chem. Bull., 2011, 60, 2227-2235.
- L.А. Rishina, S.S. Lalayan, S.Ch. Gagieva, V.А. Тuskaev, A.N. Shchegolikhin, D.P. Shashkin, Y.V. Kissin, J. Res. Updates. Polym. Sci., 2015, 3, 216-226.
- Y.V. Kissin, L.A. Rishina, N.M. Galashina, S.Ch Gagieva, V.А. Tuskaev, Eur. Polym. J., 2009, 45, 2951-2961.
- L.A. Rishina, N.M. Galashina, S.Ch. Gagieva, V.A. Tuskaev, B.M. Bulychev, Yu N. Belokon, Polymer Science - Series A, 2008, 50, 110-118.
- Y. N. Belokon', S. C. Gagieva, T. A. Sukhova, Russ. Chem. Bull., 2005, 54, 2348–2353.
- V.A. Tuskaev, S.C. Gagieva, V.I. Maleev, M.V. Solov'ev, A.O. Borissova, Z.A. Starikova, B.M. Bulychev, Polymer, 2013, 54, 4455-4462.
- B. Wunderlich, C.M. Cormier, J. Polym. Sci Part A 2 Polym.Phys., 1967, 5, 987-988.
- L.K. Johnson, C.M. Killian, M.S. Brookhart, J. Am. Chem. Soc., 1995, 117, 6414.
- Organikum. Organischchemisches Grundpraktikum, VEB Deutscher Verlag der Wissenschaften, Berlin, 1990.
- D. Seebach, A. K. Beck, R. Imwinkelried, S. Roggo, A. Wonnacott, Helv. Chim. Acta, 1987, 70, 954.
- A. K. Beck, B. Bastani, D. A. Plattner, W. Petter, D. Seebach, H. Braunshweiger, P. Gysi, and L. LaVeccia, Chimia, 1991, 45, 238;
- D. Seebach, A. K. Beck, R. Imwinkelried, S. Roggo, and A. Wonnacott, Helv. Chim.Acta, 1987, 70, 954.
Статью рекомендовал к публикации член редколлегии С. М. Игумнов
Fluorine Notes, 2017, 115, 9-10


