Поступило в редакцию: Ноябрь 2017
УДК 544.144:547.412
Fluorine Notes, 2017, 115, 7-8
Сравнительная оценка электроноакцепторного влияния полифторированных заместителей на поляризацию связи O-NO2 в нитроэфирах перфторкарбоновых кислот
Виктор П. Зеленов1, Александр Н. Субботин1, Иван А. Троян2
1 Институт органической химии им Н.Д. Зелинского Российской академии наук, Российская Федерация, 119991, Москва, Ленинский пр., 47,
e-mail: zelenov@ioc.ac.ru
2 ФНИЦ «Кристаллография и фотоника» Российской академии наук,
Российская Федерация, 119333, Москва, Ленинский пр., 59
Аннотация: Спектральными (КР и 14N ЯМР) и квантово-химическими методами выполнена сравнительная оценка электроноакцепторного влияния фторсодержащего заместителя на поляризацию нитроэфирной связи в нитроэфирах перфторкарбоновых кислот. Показано, что в сравнении с атомом фтора трифторметильная группа обладает несколько большим электроноакцепторным действием.
Ключевые слова: нитроэфиры перфторкарбоновых кислот, электроноацепторная группа, поляризация связи
Известно, что катион нитрония NO2+ является наиболее эффективной нитрующей частицей [1]. Ковалентные нитроэфиры карбоновых кислот также обладают нитрующим действием [2,3]. Очевидно, что поляризация O2N-O-связи нитроэфира электроноакцепторными заместителями (EWG), находящимися у β-атома углерода, приводит к перераспределению зарядов на атомах кислорода и азота (схема 1) и должна способствовать электрофильному замещению протона нитрогруппой. Увеличение количества EWG-групп в молекуле нитроэфира удлиняет O2N-O-связь. Предельным случаем такой поляризации можно считать разделение зарядов, приводящее к образованию катиона нитрония, т.е. ионизацию. В рамках последовательного изучения закономерности «структура—свойство» в ряду O-нитросоединений нами ранее был получен трифторацетилнитрат (TFAN) и исследовано его поведение в растворах кислот [3,4,5,6]. В данной работе спектральными и квантово-химическими методами изучены структура и свойства нитроэфира 2,2,3,3,3-пентафторпропионовой кислоты (пентафторпропионилнитрат, PFPN).

Схема 1
Одной из основных целей исследования являлось желание выяснить, каким образом замена атома фтора в молекуле трифторацетилнитрата на трифторметильный фрагмент (TFAN → PFPN) будет влиять на изменение свойств нитроэфира перфторкарбоновой кислоты. Данное сравнение удобно выполнять квантово-химическими расчётами, а также физико-химическими методами, например, оценивая изменение частот симметричных колебаний нитрогруппы νsNO2 в спектрах комбинационного рассеивания и изменение сдвига δ сигнала азота в спектрах 14N ЯМР (см. лит. [3]).
Следует отметить, что исследования электроноакцепторного эффекта CF3- и C2F5-групп с помощью эффекта Мёссбауэра в ряду соединений олова (CH3)3SnCF [7], а также методами колебательной спектроскопии соответствующих перфторокислот [8], ранее проводились, однако привели к диаметрально противоположным выводам.
Катион NO2+, в том числе монодентатно связанный с атомом кислорода аниона, представляет собой практически линейную структуру, и частота νsNO2 в КР спектрах солей нитрония является характеристической [9]. Однако, симметричное колебание нитрофрагмента ковалентных нитроэфиров не является характеристичным, поскольку в нём участвует вся молекула, причём в большей степени на него оказывает влияние сопряжение с карбонильной группой. Ранее нами было показано, что экспериментальный КР спектр TFAN хорошо согласуется с расчётным спектром syn-конформера нитроэфира, нитрогруппа которого развёрнута на 90° относительно плоскости С-С(O)-OОшибка! Закладка не определена.. В данной работе мы исходили из предположения, что при сохранении syn-конформации молекулы замена атома фтора в трифторметильной группе TFAN более тяжёлым CF3-заместителем будет оказывать через 3 связи на симметричное NO2-колебание меньшее влияние, чем аддитивное электроноакцепторное действие C2F5-заместителя. Таким образом, частота симметричного колебания нитрогруппы νsNO2 в КР спектрах соединений могла бы служить одним из ориентиров для оценки электроноакцепторного действия заместителя.
Эффект электроноакцепторного влияния заместителей на смещение сдвига (ΔδN) ONO2-фрагмента в 14N ЯМР спектрах нитроэфиров кислот (в одном и том же растворителе) был обнаружен нами ранее [3] и в данной работе использован в качестве второго исследуемого параметра сравнения.
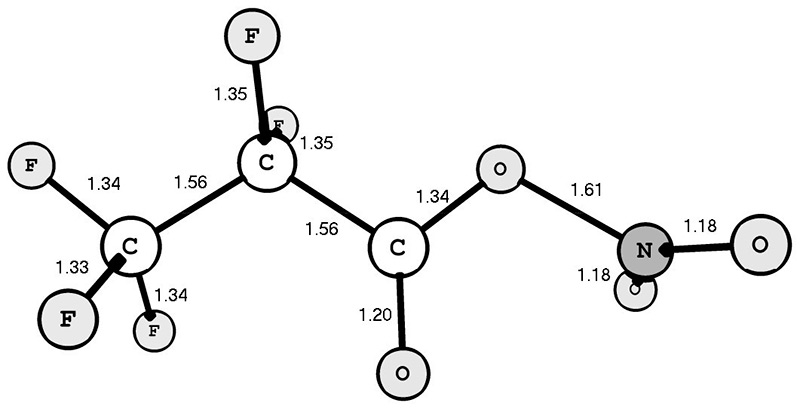
Согласно полученным расчётным данным syn-конформация PFPN (рис. 1) на 6.17 ккал/моль выгоднее его anti-конформации. Важно отметить, что связь O-NO2 syn-конформера PFPN (1.61 Å) оказалась значительно длиннее аналогичной связи syn-конформера TFAN (1.56 Å) [3].
Рис. 1 Структура syn-конформера нитроэфира 2,2,3,3,3-пентафторпропионовой кислоты. Длины связей указаны в Å.
При экспериментальном получении пентафторпропионилнитрата было необходимо учитывать особенности синтеза нитроэфиров, содержащих электроноацепторный заместитель. Так, реакция N2O5 c трифторуксусным ангидридом протекает длительное время (до 7 сут), в отличие от его реакции с уксусным ангидридом (0.5 ч)[3]. Реакция синтеза TFAN – равновесная, но смещена вправо: из эквимолярной смеси трифторуксусного и азотного ангидридов получили TFAN, содержащий менее 10 мольных % исходного трифторуксусного ангидрида. В газовой фазе TFAN склонен к гомолитическому распаду на ангидриды, их содержание может достигать 15 мольных % [3] (схема 2). Видимо, по этой причине концентрированный TFAN при механическом воздействии легко взрывается даже в охлаждённом льдом виде. Однако, в реакциях HNO3 как с уксусным ангидридом, так и с трифторуксусным, время синтеза нитроэфиров практически не отличается (~10 мин при 10 °С) [3].
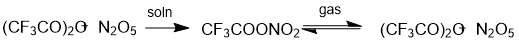
Схема 2
Таблица 1. Спектральные характеристики нитроэфиров кислот
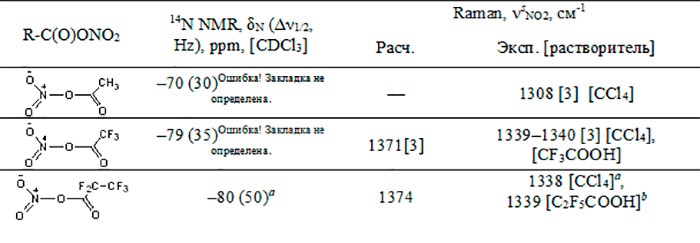
а PFPN получен из эквимолярной смеси ангидрида пентафторпропионовой кислоты и N2O5 (5 °С, 5 сут.).
b PFPN получен из эквимолярной смеси ангидрида пентафторпропионовой кислоты и HNO3 (0–5 °С, 2 ч).
PFPN был получен двумя альтернативными способами: реакциями ангидрида 2,2,3,3,3-пентафторпропионовой кислоты как с N2O5, так и с HNO3 (схема 3). Спектральные характеристики полученных растворов приведены в Таблице 1 и на рис. 2,3. КР спектры 2,2,3,3,3-пентафторпропионовой кислоты и её ангидрида представлены на рис. 4,5.
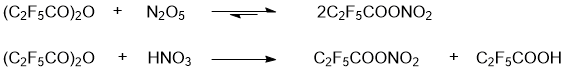
Схема 3
Полученные экспериментальные значения КР частот νsNO2 TFAN и PFPN близки, их различия находятся в пределах погрешности прибора. Тем не менее, квантово-химические расчётные данные КР спектра PFPN для газовой фазы дают чуть большее значение частот νsNO2 (на ~3 см-1), в сравнении с расчётным спектром TFAN, а в 14N ЯМР спектрах сравниваемых соединений сигнал азота PFPN сдвинут на ~1 м.д. в область сильного поля, относительно TFAN (табл. 1). Указанные факты, а также увеличенная длина нитроэфирной связи PFPN (1.61 Å), позволяют считать электроноакцепторное действие трифторметильного заместителя, в сравнении с атомом фтора, чуть более сильным. Следует отметить, что электроноакцепторное влияние CF3-заместителя на нитроэфирную связь PFPN ослаблено его действием через 3 связи.
Электроноакцепторное действие F- и CF3-заместителей можно также сравнить сопоставлением характеристических частот νsNO2 соответствующих сульфатов нитрония и сравнением сдвигов сигнала 14N катиона нитрония этих солей. В солях нитрония NO2+[FSO3]- и NO2+[CF3SO3]- эти заместители влияют на катион нитрония через две связи, поэтому электроноакцепторный эффект CF3-заместителя, в сравнении с атомом фтора, выражен отчётливее, чем в нитроэфирах перфторкарбоновых кислот. Линия νsNO2 1410 см-1 NO2+[CF3SO3]- ощутимо сдвинута относительно аналогичной частоты NO2+[FSO3]- (1404 см-1) в коротковолновую область [9]. В 14N ЯМР спектрах этих солей (в сульфолане) различие в сдвигах ΔδN достигает 2 м.д.: δN –131 м.д. (NO2+[FSO3]-), –133 м.д (NO2+[CF3SO3]-) [9].
Таким образом, выполнена сравнительная оценка влияния полифторированных заместителей на степень поляризации нитроэфирных связей в нитроэфирах перфторкарбоновых кислот. Показано, что нитроэфир 2,2,3,3,3-пентафторпропионовой кислоты существует в syn-конформации, а электроноакцепторное влияние через 3 связи трифторметильного заместителя на нитроэфирный фрагмент близко к электроноакцепторному действию атома фтора и слегка превышает его.
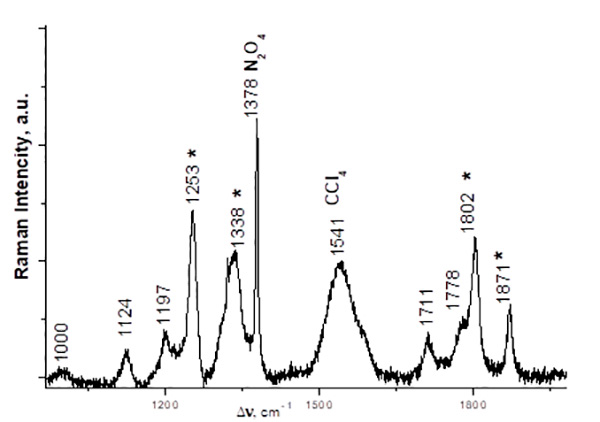
Рис. 2 КР спектр раствора в CCl4 C2F5COONO2, полученного из эквимолярной смеси (C2F5CO)2O и N2O5, 5 °С, 5 сут. (диапазон 900–1900 см-1). Звёздочками отмечены частоты C2F5COONO2. N2O4 образовался вследствие самопроизвольного распада N2O5.
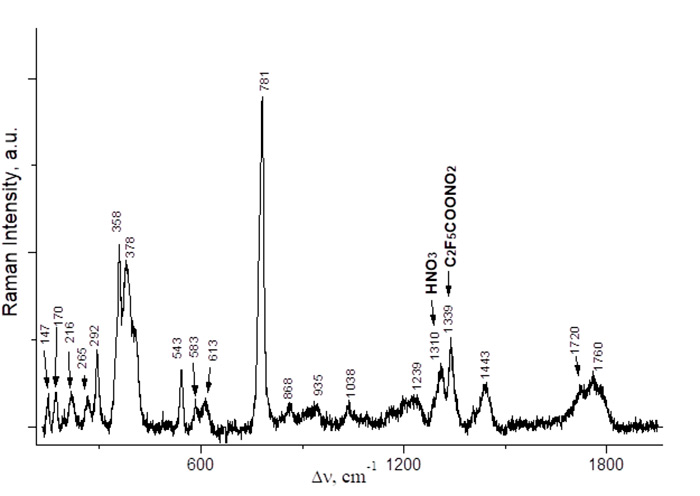
Рис. 3 КР спектр смеси C2F5COONO2 и C2F5COOH (≈ 1 : 1), полученной из эквимолярной смеси (C2F5CO)2O и HNO3 (0–5 °С, 2 ч).
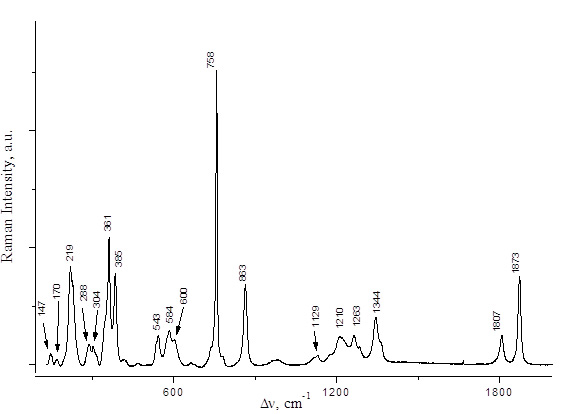
Рис. 4 КР спектр (C2F5CO)2O.
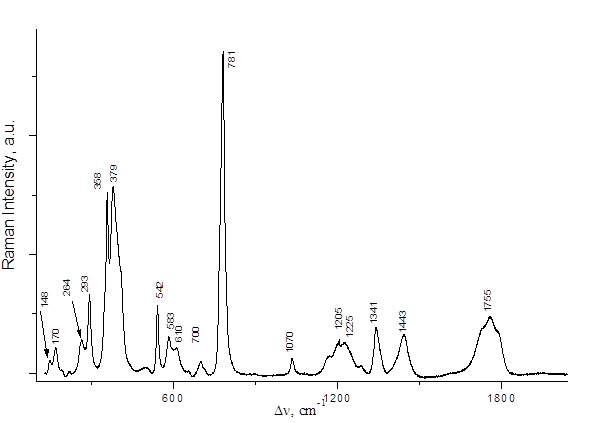
Рис. 5 КР спектр C2F5COOH.
Экспериментальная часть
Азотную кислоту предварительно очищали перегонкой в вакууме кислоты плотностью d20 = 1.5 г·cм-1, в синтезах использовали бесцветную фракцию. Азотный ангидрид получали известным методом из HNO3 и P2O5 [3].
Спектры комбинационного рассеяния света регистрировались с помощью спектрометра Acton Research с фокусным расстоянием 500 мм на решётке 1200 шт/мм. В качестве фотоприёмника оптичекого сигнала использовалась CCD Princeton Instruments с охлаждением жидким азотом. Спектры измерялись на линии криптонового лазера 641.7 нм с мощностью до 100 мВт в конфигурации 180° комбинационного рассеяния света (рассеяние назад). Спектральное разрешение составляло 1.5 см-1. Оптический тракт установки выполнен по схеме конфокального микроскопа с пространственным разрешением 2 микрона. Для записи спектров индивидуальные соединения помещали в стеклянные ампулы и плотно закупоривали, реакционные смеси готовили смешиванием компонентов непосредственно в ампулах. Ампулы с растворами, содержащими C2F5COONO2, до выполнения КР спектроскопии хранили во льду, при записи их спектров мощность излучения не превышала 10 мВт. Спектр 14N ЯМР (21.69 MHz) зарегистрирован на приборе Brucker AM300 с использованием CH3NO2 (10 мг) в качестве внутреннего стандарта, сильнопольные сдвиги отрицательны. Квантово-химические расчёты проведены комплексом программ Gaussian 09 Revision D.01 DFT B3LYP/6-311++g(d,p) [10].
Данная работа выполнена при финансовой поддержке Российского Фонда фундаментальных исследований, проект № 16-03-00713_а. Авторы выражают благодарность ЗАО «ПиМ-Инвест» за предоставленный образец ангидрида 2,2,3,3,3-пентафторпропионовой кислоты и к.х.н. М. И. Стручковой – за выполнение 14N ЯМР спектроскопии.
Литература
- G. A. Olah, G. K. Surya Prakash, Á. Molnár and J. Sommer, Heterocations in Superacid Systems, in Superacid Chemistry, Second Ed., John Wiley & Sons, Hoboken, NJ, USA, 2009, ch. 4.
- J. Hoare, R. Duddu, R. Damavarapu, Org. Process Res. Dev., 2016, 20 (3), 683–686. DOI: 10.1021/acs.oprd.6b00010
- V. P. Zelenov, S. S. Bukalov, L. A. Leites, R. R. Aysin, A. N. Subbotin, М. I. Struchkova, I. V. Fedyanin, Mendeleev Commun., 2017, 27, 31–34; doi: 10.1016/j.mencom.2017.01.009.
- В. П. Зеленов, С. С. Букалов, М. И. Стручкова, А. Н. Субботин, Fluorine Notes, 2016, 4 (107), 179 (Р-88). http://notes.fluorine1.ru/public/2016/4_2016/conference/Program_Thesis_RUS_opt.pdf
- В. П. Зеленов, С. С. Букалов, А. О. Дмитриенко, И. В. Федянин, FluorineNotes, 2016, 4 (107), 90 (O-46). http://notes.fluorine1.ru/public/2016/4_2016/conference/Program_Thesis_RUS_opt.pdf
- V. P. Zelenov, S. S. Bukalov, A. N. Subbotin, Mendeleev Commun., 2017, 27, 355–356; doi: 10.1016/j.mencom.2017.07.011.
- W. R. Cullen, J. R. Sams M. C. Waldman, Inorg. Chem.. 1970, 9, 1682–1686.
- G. A. Crowder, J. Fluorine Chem., 1971/72, 1, 385–389.
- V. P. Zelenov, S.S. Bukalov, I. S. Bushmarinov, L.A. Leites, М. I. Struchkova, A. O. Dmitrienko, V. А. Tartakovsky, Syntheses of nitronium salts. 1. A new strategy towards solid nitronium monosulfates, ChemistrySelect, 2017 (впечати).
- M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, G. Scalmani, V. Barone, B. Mennucci, G. A. Petersson, H. Nakatsuji, M. Caricato, X. Li, H. P. Hratchian, A. F. Izmaylov, J. Bloino, G. Zheng, J. L. Sonnenberg, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, T. Vreven, J. A. Montgomery, Jr., J. E. Peralta, F. Ogliaro, M. Bearpark, J. J. Heyd, E. Brothers, K. N. Kudin, V. N. Staroverov, T. Keith, R. Kobayashi, J. Normand, K. Raghavachari, A. Rendell, J. C. Burant, S. S. Iyengar, J. Tomasi, M. Cossi, N. Rega, J. M. Millam, M. Klene, J. E. Knox, J. B. Cross, V. Bakken, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, R. L. Martin, K. Morokuma, V. G. Zakrzewski, G. A. Voth, P. Salvador, J. J. Dannenberg, S. Dapprich, A. D. Daniels, Ö. Farkas, J. B. Foresman, J. V. Ortiz, J. Cioslowski, and D. J. Fox, Gaussian, Inc., Wallingford CT, 2013.
Статью рекомендовал к публикации член редколлегии С. М. Игумнов
Fluorine Notes, 2017, 115, 7-8


