Поступило в редакцию: Октябрь 2017
УДК 543.429.23: 661.489: 543.051: 54.[061+062]
Fluorine Notes, 2017, 115, 5-6
СПОСОБ ИДЕНТИФИКАЦИИ ДИМЕРОВ И ТРИМЕРОВ ГЕКСАФТОРПРОПИЛЕНА МЕТОДОМ ЯМР 19F
Поспелова Н. Б.1, Мокрушин И. Г2
1ФГУП "РНЦ "Прикладная химия", Пермский филиал,
2Пермский государственный национальный исследовательский университет, Пермь, Россия
Аннотация: Детально описаны и уточнены спектральные характеристики олигомеров гексафторпропилена. Отмечено несоответствие химсдвигов атомов фтора литературным данным, уточнение проведено с помощью синтеза модельных соединений. Проанализированы смеси тримеров в различных соотношениях. Существенного концентрационного влияния на химические сдвиги не обнаружено. Предложен способ идентификации олигомеров в смеси и методика определения изомерного состава методом ЯМР.
Ключевые слова: ядерный магнитный резонанс, ЯМР фтор-19, перфторированные соединения, гексафторпропилен.
Введение
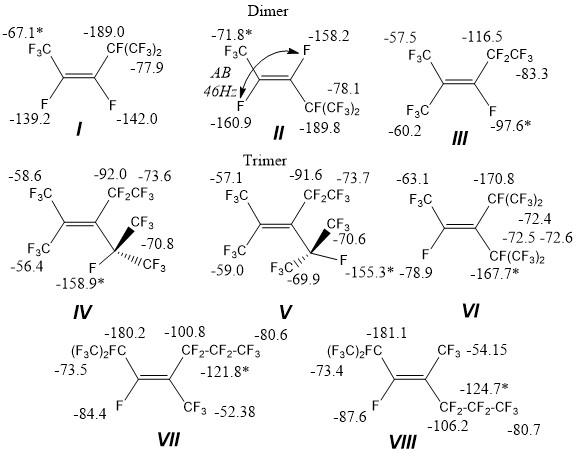
Олигомеры перфторпропена используются в качестве термостойких растворителей, хладагентов, инертных жидкостей, диэлектриков, в производстве ПАВ. Известно, что для полифторированных молекул характерно дальнее спин-спиновое взаимодействие атомов фтора, имеющее пространственную природу. [1] В этом аспекте представляет интерес исследование химсдвигов атома 19F в смесях близких по строению молекул, например, продуктов димеризации и тримеризации гексафторпропилена I-VIII.
Особенности проведения количественного ЯМР анализа описаны в руководстве [2]. При выполнении условий качественной записи спектра, погрешность определения мольной доли может быть менее 1%. Методика расчета массовой доли методом ЯМР заключается в определении интегральной интенсивности всех резонансных линий исследуемой молекулы и отнесение к суммарной площади всех линий спектра по формуле 1. Для облегчения расчета выделяются «аналитические» линии каждого изомера (отмечены «*»), рассчитывают мольное содержание по формуле 2.
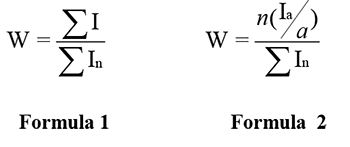
где ΣI интегральная площадь всех резонансных линий исследуемой молекулы, Ia – площадь только аналитической линии, a количество атомов фтора ее давших, n общее количество атомов в определяемой молекуле, ΣIn суммарная интегральная площадь всех резонансных линий. [3]
Изучение концентрационного влияния на положение сигнала резонанса фтора
Нами рассмотрены спектры ЯМР 19F смесей тримеров гексафторпропилена IV, V, VI при различных их соотношениях. Найденные химические сдвиги и состав смесей приведены в таблице 1.
Таблица 1. Состав смесей тримеров ГФП и положение сигналов ЯМР 19F (75.4 MHz)
|
Изомер |
Соотношение |
Химические сдвиги фтора, м.д. |
|||||
|
изомеров, |
|||||||
|
% мольн. |
δ 1 |
δ 2 |
δ 3 |
δ 4 |
δ 5 |
δ 6 |
|
|
IV |
- |
159,8 |
87,7 |
71,2 |
70,3 |
59,1 |
56,1 |
|
62 |
158,3 |
86,7 |
70,5 |
70,2 |
58,6 |
55,6 |
|
|
44 |
158,4 |
87 |
69,9 |
* |
59,7 |
56,8 |
|
|
27 |
157,6 |
87,1 |
69 |
* |
59,3 |
56,9 |
|
|
V |
- |
156,1 |
91,5 |
74,1 |
70,3 |
52,1 |
56,4 |
|
23 |
154,6 |
91,6 |
70,5 |
70,2 |
58,6 |
57 |
|
|
28 |
154,2 |
91,9 |
69,9 |
* |
59,7 |
58,3 |
|
|
24 |
154,3 |
91,7 |
69 |
* |
59,3 |
57,2 |
|
|
VI |
100[3] |
180,8 |
180,2 |
78,9 |
73,2 |
72,9 |
13,3 |
|
15 |
* |
* |
* |
73,6 |
72,4 |
62,7 |
|
|
28 |
169,6 |
167,1 |
77,3 |
72,5 |
71,7 |
62,8 |
|
|
49 |
169,7 |
166,9 |
76,2 |
71,3 |
70,4 |
62,4 |
|
|
95 |
170,6 |
167,7 |
76,3 |
72,1 |
71,3 |
61,7 |
|
|
* - точного отнесения линий не проводилось |
|||||||
Из таблицы следует, что измеренные химические сдвиги находятся в хорошем соответствии с литературными [4] практически для всех атомов фтора, не испытывают существенного концентрационного влияния и могут быть проанализированы в смеси без разделения. Исключение составляют химические сдвиги атомов фтора в положениях 1 и 2 изомера VI, которые смещены в слабое поле на 10-14 м.д., относительно данных [5]. Стандартное отклонение от среднего составило 0.2-0.9 м.д для значений химисдвигов ЯМР фтора, т.е. до 0,2% диапазона и является несущественным.
Для уточнения химсдвигов атомов фтора С4F и С3-СF изомера VI нами был использован тот факт, что взаимодействие смесей изомеров тримера с фенолом или резорцином однозначно приводит к замещению фтора C2F изомера VI на фенилоксигруппу [6] с образованием модельных соединений 2-арилоксиперфтор(3-изопропил-4-метилпентена-1) VIa и VIб:
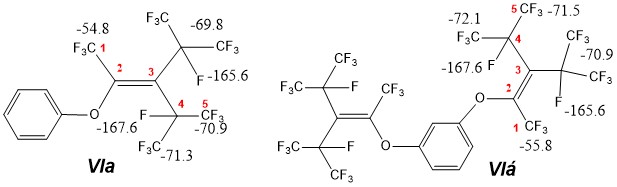
В спектре ЯМР 19F VIa,б наблюдается общая тенденция к смещению всех линий поглощения в слабое, относительно аналогичных линий VI, поле, что может быть объяснено индуктивным эффектом арилоксигруппы. Кроме того, введение объемного арилоксизаместителя привело к увеличению неэквивалентности CF3-групп в цис-положении изомера VI вследствие заторможенности ее вращения, что подтверждается наличием в спектре двух линии C5F и C4СF (VIa, б).
Неразрешенный мультиплет фтора 1 (в VI) объясняется [5] наличием сложных эффектов многих взаимодействий и обменных уширений, вызванных вращением трансизопропильной, относительно метильной, группы. В VIa структура соответствующей линии несколько упростилась вследствие исключения взаимодействия J1-3, но форма линии указывает на наличие обменных процессов между различными ротамерными положениями, верхний температурный предел которых выше температуры съемки спектров.
Экспериментальная часть
Смеси изомеров суммарной чистотой ~ 95% проанализированы на спектрометрах: Bruker WP80SY 80 MHz, с «капилляром» с ацетоном-d6, внутренний эталон – гексафторбензол добавлялся непосредственно в образец, температура съемки 35°С; Bruker Avance III HD 400 MHz, с «капилляром» с ДМСО-d6 + бензотрифторид в качестве внешнего эталона, температура съемки 40°С. Эталон в спектрах 19F (м.д., отн. CFCl3). гексафторбензол -162.90 м.д. либо бензотрифторид -63.90 м.д. [3]
Состав смесей в табл. 1, приведенный по данным ЯМР, контролировался хроматографически. Изомер VI выделен с помощью препаративного хроматографа ВАХВ-С8. Условия разделения: колонка длиной 4 м, диаметр – 8 мм, сорбент – 20% 4Ф на силанизирвоанном силохроме С-80, фракция 0,315 – 0,5, температура колонок 85°С, скорость газа-носителя (гелий) 280 мл/мин.
Олигомеры (I-VIII) получены по известной методике [2], «активный» димер ГФП (III) получен изомеризацией смеси в присутствии катализатора. Химические сдвиги димеров гексафторпропилена I и II измерены для смеси ~ 1:1.
Соединения VIa и VIб получены по известной методике взаимодействием тримера гексафторпропилена III соответственно с фенолом и резорцином в присутствии триэтиламина и очищены ректификацией. [4]
Димеры.
(Z)-1,1,1,2,3,4,5,5,5-нонафтор-4-(трифторметил)пент-2-ен (I).
19F NMR (376 MHz, DMSO-d6) δ -67.10 (dddhept, J = 36.0, 8.9, 8,3, 2.4 Hz), -77.85 (ddqd, J = 9.9, 7.6, 2.4, 0.8, Hz), -139.24 (qddhept, J = 8.3, 7.2, 4.4, 0.8 Hz), -141.98 (heptdqd, J = 9.9, 9.8, 8.9, 7.2 Hz), -189.04 (qdheptd, J =36.0, 9.8, 7.6, 4.6 Hz).
(E)-1,1,1,2,3,4,5,5,5-нонафтор-4-(трифторметил)пент-2-ен (II).
19F NMR (376 MHz, DMSO-d6) δ -71.84 (ddd, J = 23.0, 8.7, 0.7 Hz), -78.12 (ddd, J = 8.8, 7.8, 5.1 Hz), -158.18 (dqdhept, J = 139.5, 23.7, 9.8, 8.8 Hz), -160.89 (ddqhept, J = 139.5, 46.5, 8.5, 5.1 Hz), -189.76 (ddheptq, J = 46.5, 9.8, 7.8, 0.7 Hz).
1,1,1,3,4,4,5,5,5-нонафтор-2-(трифторметил)пент-2-ен (III).
19F NMR (377 MHz, DMSO-d6) δ -57.49 (dtqq, J = 24.1, 20.1, 9.6, 4.7 Hz), -60.16 (dq, J = 30.4, 9.7 Hz), -83.33 (dq, J = 10.5, 4.7 Hz), -97.6 (qqqt, J = 30.4, 24.2, 10.5, 6.3 Hz), -116.45 (qd, J = 20.1, 6.3 Hz).
Тримеры.
Ротамер A - 1,1,1,4,4,5,5,5-октафтор-3-(перфторпропан-2-ил)-2-(трифторметил)пент-2-ен (IV). 19F NMR (376 MHz, DMSO-d6) δ -56.40 (dd, J = 52.5, 13.1 Hz), -58.63 (dh, J = 26.0, 13.1 Hz), -70.83 (qp, J = 13.5, 6.5 Hz), -72.48 (d, J = 1.0 Hz), -87.62 (dddt, J = 51.3, 41.2, 31.1, 10.6 Hz), -158.94 (dddt, J = 54.9, 51.8, 48.7, 3.0 Hz).
Ротамер B - 1,1,1,4,4,5,5,5-октафтор-3-(перфторпропан-2-ил)-2-(трифторметил)пент-2-ен (V). 19F NMR (376 MHz, DMSO-d6) δ -57.11 (qddd, J = 19.7, 11.6, 8.0, 3.7 Hz), -58.98 (dpdd, J = 26.6, 15.0, 11.4, 3.5 Hz), -72.56 (dm, J = 27.5 Hz), -73.60 (ddq, J = 12.5, 6.3, 3.3 Hz), -73.69 (dddq, J = 9.8, 7.8, 5.7, 2.0 Hz), -91.65, -155.33 (tq, J = 39.2, 24.0 Hz).
1,1,1,2,4,5,5,5-октафтор-3-(перфторпропан-2-ил)-4-(трифторметил)пент-2-ен (VI).
19F NMR (376 MHz, DMSO-d6) δ -63.05 (dhept, J = 52.8, 2.3 Hz), -72.40 (heptm, J = 4.3), -72.48 (d, J = 33.2 Hz), -72.56 (heptq, J = 4.3, 2.3 Hz), -78.09 (heptdd, J = 33.5, 9.2, 8.9 Hz), -167.7 (qdhept, J = 52.8, 9.2, 3.1 Hz), -170.78 (heptd, J = 30.9, 8.9 Hz).
((1,1,1,4,5,5,5-гепатфтор-3-(перфторпропан-2-ил)-4-(трифторметил)пент-2-ен-2-ил)окси)бензол (VIa). ЯМР 19F (pure), δ, м.д.: -54.8 (3F, C1F3, д, J= 58 Гц), -69.8 (6F, CF3, i-Pr, м), -70.9 (3F, C5F3, м), -71.3 (3F, C4-CF3, м), -165.6 (1F, CF, i-Pr, кварт, J= 58 Гц), -167.6 (1F, C4F, гепт, J= 35 Гц).
1,3-бис((1,1,1,4,5,5,5-гептафтор-3-(перфторпропан-2-ил)-4-(трифторметил)-пент-2-ен-2-ил)окси)бензол (VIб). ЯМР 19F (pure), δ, м.д.: -55.8 (3F, C1F3, д, J= 58 Гц), -70.9 (6F, CF3, i-Pr, м), -71.5 (3F, C5F3, м), -72.1 (3F, C4-CF3, м), -165.6 (1F, CF, i-Pr, кварт, J= 58 Гц), -167.6 (1F, C4F, гепт, J= 35 Гц).
(Z)-1,1,1,2,3,5,5,6,6,7,7,7-додекафтор-2,4-бис(трифторметил)гепта-3-ен (VII).
19F NMR (376 MHz, DMSO-d6) δ -52.38 (dd, J = 45.3, 10.7 Hz), -80.63 (td, J = 10.5, 3.7 Hz), --84.46 (tdtd, J = 34.7, 12.9, 7.3, 3.7 Hz), -106.17 (dqqtheptd, J = 49.1, 24.7, 9.9, 6.0, 4.1, 2.0, Hz), -124.74 (dqd, J = 17.4, 8.1, 2.0 Hz), -181.13 (dp, J = 18.8, 6.3 Hz).
(E)-1,1,1,2,3,5,5,6,6,7,7,7-додекафтор-2,4-бис(трифторметил)гепта-3-ен (VIII).
19F NMR (376 MHz, DMSO-d6) δ -54.15 (dt, J = 48.4, 11.5 Hz), 80.74 (td, J = 10.2, 1.6 Hz), -87.62 (tdt, J = 40.4, 16.8, 11.3 Hz), -100.82 (dqqtheptd, J = 69.0, 24.7, 10.2, 6.0, 4.1, 2.0 Hz), -121.79 (dqd, J = 33.3, 9.0, 3.8 Hz), -180.01 (dddd, J = 34.7, 22.5, 12.1, 6.1 Hz).
Список литературы
- Спектроскопия ядерного магнитного резонанса высокого разрешения: в 2х т. Т. 1 / Дж. Эмсли ; ред.: В. Ф. Быстров, Ю. Н. Шейнкер; пер. с англ. Б. А. Квасов. М.: Мир, 1968. 630 с.
- Practical guide for quantitative 1D NMR integration. Eugenio Alvarado, University of Michigan, 2010. http://umich.edu/~chemnmr/docs/Quantitative_NMR.pdf
- Особенности ЯМР-анализа перфторированных соединений. Н.Б. Поспелова, И.Г. Мокрушин // Вестник Пермского университета, №3, 2016. DOI: 10.17072/2223-1838-2016-3-85-91
- Anionic oligomerisation of hexafluoropropene: fission of a carbon–carbon bond by fluoride ion // J. Chem. Soc. D, 1970, 1444-1446, DOI:10.1039/C29700001444
- Schumann C., Cavagna F., Non-bond F-F nuclear spin couplings II. Hexafluoropropene trimers. // J. Magn Reson., 1976; 22: 333-344.
- А.С. 570591 (СССР). Способ получения полифторированных простых эфиров. Институт элементоорганических соединений АН СССР, Кнунянц И. Л., Чебурков Ю. А., Макаров К. Н. и Гервиц Л. Л., заявл. 15.05.75, от 30.08.77. Бюл. №32 1977.
- R. R. Gupta, M. D. Lechner; Nuclear Magnetic Resonance (NMR) Data: Chemical Shifts and Coupling Constants for Fluorine-19 and Nitrogen-15 / Landolt-Börnstein - Group III Condensed Matter, Volume 35B, 1998. DOI: 10.1007/b55685
- Ishikawa, Nobuo; Nippon Kagaku Kaishi 1977, (10), P1411-15 CAPLUS
Статью рекомендовал к публикации член редколлегии С. М. Игумнов
Fluorine Notes, 2017, 115, 5-6


