Поступило в редакцию: Октябрь 2017
УДК 547.024, 547-305.1
Fluorine Notes, 2017, 115, 1-2
Присоединение тиолов к гем-дифторалкенам в условиях фотоактивации
С.С. Аширбаев,1,2 В.В. Левин,1 М.И. Стручкова,1 А.Д. Дильман*,1
1Институт Органической Химии им. Н.Д. Зелинского Российской академии наук, Российская Федерация, 119991 Москва, Ленинский просп., 47.
dilman@ioc.ac.ru
2Химический факультет МГУ им. М.В. Ломоносова, Российская Федерация, 119991 Москва, Ленинские горы 1-3
Аннотация гем-Дифторалкены взаимодействуют с тиолами а присутствии каталитических количеств дисульфидов с образованием α,α-дифторзамещенных сульфидов. Реакция проводится при комнатной температуре при активации светом с длиной волны 400 нм.
Ключевые слова гем-дифторалкены, тиолы, фотоктализ
гем-Дифторалкены представляют собой важный класс фторорганических соединений. С одной стороны, они востребованы в медицинской химии, и известно несколько примеров биологически активных молекул с дифторвинильным фрагментом [1]. А с другой стороны, дифторалкены могут выступать в качестве предшественников в синтезе широкого круга монофтор- [2], дифтор- [3], а также трифтор-замещенных соединений [4]. При этом, дифторолефины могут быть легко получены из карбонильных соединений [5], диазоалканов [6], а также другими методами [2,7].
Недавно была описана реакция присоединения тиолов к дифторалекенам, катализируемая основанием 1,1,3,3-тетраметилгуанидином [8]. Эта реакция включает нуклеофильную атаку тиолят-аниона по электронодефицитной двойной связи с последующим протонированием и проходит при повышенной температуре. Ранее отмечалось, что присоединение тиолов к дифторалкенам может быть проведено в присутствии бензоилпероксида, однако также требовалось нагревание, а продукты получались с невысокими выходами [9]. В настоящей работе мы сообщаем, что реакция присоединения может быть эффективно осуществлена в мягких нейтральных условиях при облучении светом.
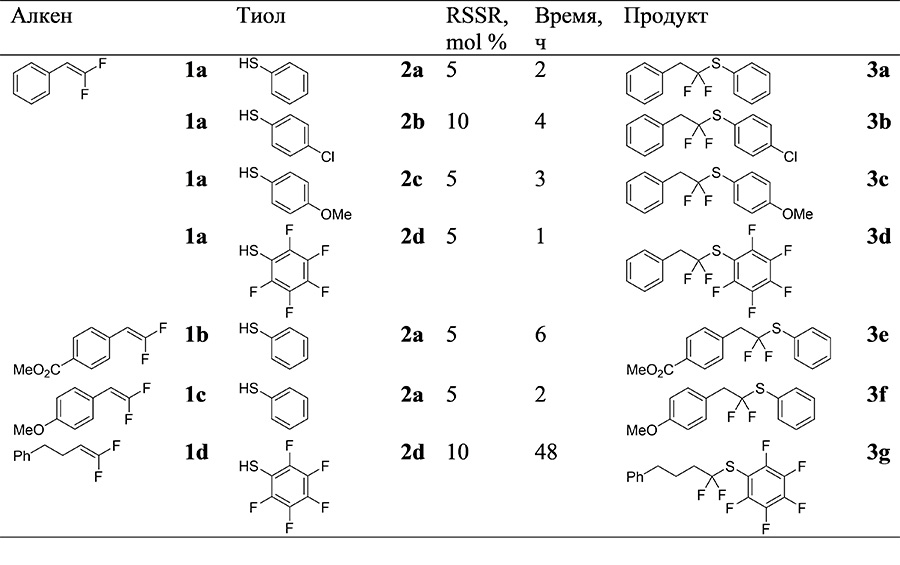
Реакцию дифторалкенов 1 с тиолами 2 проводили в хлористом метилене при комнатной температуре при облучении светодиодной лентой с длиной волны излучения 400 нм (Таблица 1). В качестве катализатора применялись соответствующие дисульфиды в количестве 5-10 мольных %. Реакции с дифторалкенами, содержащими ароматический заместитель, проходили с выходами более 90%, причем наиболее быстрая реакция наблюдалась с участием перфтортиофенола 2d. В тоже время, взаимодействие алкил-замещенного субстрата 1d с перфтортиофенолом происходит очень медленно, и даже через два дня выход целевого продукта 3g составил всего 45%.
Таблица 1. Реакция дифторалкенов с тиолами.
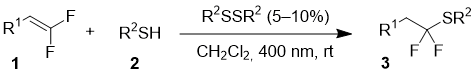
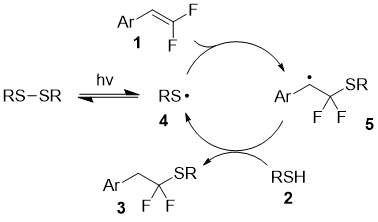
Предполагаемый механизм реакции включает генерацию S-центрированного радикала 4 из дисульфида при воздействии света (Схема 1). Последующее присоединение этого радикала по двойной связи дифторалкена приводит к интермедиату 5, который отрывает атом водорода от исходного тиола с образованием продукта и регенерацией радикала 4.
Схема 1. Предполагаемый механизм реакции.
Таким образом, мы показали, что присоединение тиолов к гем-дифторалкенам может быть реализовано при воздействии света. Мягкие условия и простота проведения эксперимента делают этот метод привлекательным для получения α,α-дифторзамещенных сульфидов.
Экспериментальная часть
Получение дисульфидов 3 (общая методика). В атмосфере аргона раствор дифтороралкена 1 (0.75 ммоль), тиола 2 (0.94 ммоль) и дисульфида (для 3a,c-f, 0.038 ммоль; для 3b,g, 0.075 ммоль) в хлористом метилене (2 мл) перемешивали при облучении светодиодами (2x smd 3528, Arlight RT 2-5000 12V UV400 2X), охлаждая реакционный сосуд водой комнатной температуры. Время реакции приведено в Таблице 1. Затем реакционную смесь упаривали в вакууме, остаток очищали методом колоночной хроматографии на силикагеле.
[(1,1-Дифторо-2-фенилэтил)тио]бензол (3a) [10].
Выход 190 мг (99%), бесцветное масло, Rf 0.30 (EtOAc/гексан, 1/30). 1H ЯМР (300 МГц, CDCl3) δ: 3.52 (т, 2H, J = 14.8 Гц) 7.36–7.50 (м, 8H), 7.68 (дд, 2H, J = 7.8, 1.4 Гц). 13C ЯМР (75 МГц, CDCl3) δ: 45.3 (т, J = 24.3 Гц), 127.1 (т, J = 2.2 Гц), 127.8, 128.5, 128.8 (т, J = 280.0 Гц), 129.1, 129.8, 130.6, 132.1 (т, J = 3.3 Гц), 136.2. 19F ЯМР (282 МГц, CDCl3) δ: –72.5 (т, J = 14.8 Гц).
1-Хлоро-4-[(1,1-дифторо-2-фенилэтил)тио]бензол (3b).
Выход 215 мг (99%), белые кристаллы, Тпл 63–64 °C, Rf 0.40 (EtOAc/гексан, 1/25). 1H ЯМР (300 МГц, CDCl3) δ: 3.49 (т, 2H, J = 14.8 Гц), 7.30–7.45 (m, 7H), 7.55 (д, 2H, J = 8.5 Гц). 13C ЯМР (75 МГц, CDCl3) δ: 45.3 (т, J = 24.2 Гц), 125.5 (т, J = 2.1), 128.0, 128.6, 128.6 (т, J = 280.6), 129.4, 130.6, 131.9 (т, J = 3.4 Гц), 136.4, 137.5. 19F ЯМР (282 МГц, CDCl3) δ: –72.1 (т, J = 14.8 Гц). Вычислено C14H11ClF2S (284.02): C 59.05, H 3.89. Найдено: C 59.07, H 3.80.
1-[(1,1-Дифторо-2-фенилэтил)тио]-4-метоксибензол (3c).
Выход 190 мг (90%), бесцветное масло, Rf 0.39 (EtOAc/гексан, 1/10). 1H ЯМР (300 МГц, CDCl3) δ: 3.51 (т, 2H, J = 14.9 Гц), 3.85 (с, 3H), 6.97 (д, 2H, J = 8.8 Гц), 7.37–7.47 (м, 5H), 7.61 (д, 2H, J = 8.8 Гц). 13C ЯМР (75 МГц, CDCl3) δ: 45.0 (т, J = 24.5), 55.3, 114.7, 117.5 (т, J = 2.4), 127.7, 128.5, 128.7 (т, J = 279.3 Гц), 130.6, 132.3 (т, J = 3.2 Гц), 138.2, 161.2. 19F ЯМР (282 МГц, CDCl3) δ: –73.2 (т, J = 14.9 Гц). HRMS (ESI): вычислено C15H14F2OSNa [M+Na] 303.0626; найдено 303.0638.
[(1,1-Дифторо-2-фенилэтил)тио]-пентафторбензол (3d).
Выход 244 мг (95%), белые кристаллы, Тпл 49–51 °C, Rf 0.36 (EtOAc/гексан, 1/25). 1H ЯМР (300 МГц, CDCl3) δ: 3.57 (т, 2H, J = 14.7 Гц), 7.38–7.48 (m, 5H). 13C ЯМР (75 МГц, CDCl3) δ: 45.2 (т, J = 23.2 Гц), 101.2 (тм, J = 21.7 Гц), 128.3, 128.4 (т, J = 285.5 Гц), 128.8, 130.6, 131.1 (т, J = 3.5 Гц), 137.9 (дм, J = 256.2 Гц), 143.5 (дтт, J = 258.7, 13.4, 5.0 Гц), 148.9 (дм, J = 249.6 Гц). 19F ЯМР (282 МГц, CDCl3) δ: –161.2 (м, 2F), –148.7 (тт, 1F, J = 20.8, 4.5 Гц), –129.9 (м, 2F), –70.1 (тт, 2F, J = 14.7, 5.8 Гц). Вычислено C14H7F7S (340.02): C 49.42, H 2.07. Найдено: C 49.28, H 2.01.
Метил 4-[(2,2-дифторо-2-(фенилэтил)тио]-бензоат (3e).
Выход 234 мг (99%), белые кристаллы, Тпл 70–71 °C, Rf 0.32 (EtOAc/гексан, 1/8). 1H ЯМР (300 МГц, CDCl3) δ: 3.49 (т, 2H, J = 14.8 Гц), 3.93 (с, 3H), 7.34–7.49 (м, 5H), 7.60 (д, 2H, J = 7.4 Гц), 8.04 (д, 2H, J = 8.3 Гц). 13C ЯМР (75 МГц, CDCl3) δ: 45.0 (т, J = 24.6 Гц), 52.1, 126.7 (т, J = 2.2 Гц), 128.3 (т, J = 280.0 Гц), 129.1, 129.7, 129.9, 130.6, 136.2, 137.2 (т, J = 3.0 Гц), 166.8. 19F ЯМР (282 МГц, CDCl3) δ: –72.3 (т, J = 14.8 Гц). HRMS (ESI): вычислено C16H14F2O2SNa [M+Na] 331.0575; найдено 331.0575.
1-[(2,2-Дифторо-2-(фенилтио)этил)]-4-метоксибензол (3f) [5].
Исходный тиофенол не отделяется от конечного вещества при помощи колоночной хроматографии. Для выделения соединения 3f, сырой продукт растворили в этаноле (5 мл), добавили Н2О2 (25 мкл 30% водного раствора, 0.3 ммоль), кристаллик йода и перемешивали в течение 30 минут. Далее йод нейтрализовали водным раствором Na2S2O3, смесь экстрагировали метил трет-бутиловым эфиром (35 мл). Объединенный органический слой сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали хроматографически. Выход 204 мг (97%), бесцветная жидкость, Rf 0.32 (EtOAc/гексан, 1/10). 1H ЯМР (300 МГц, CDCl3) δ: 3.45 (т, 2H, J = 14.7 Гц), 3.85 (с, 3H), 6.96 (д, 2H, J = 8.5 Гц), 7.29 (д, 2H, J = 8.5 Гц), 7.38–7.49 (м, 3H), 7.67 (д, 2H, J = 7.0 Гц). 13C ЯМР (75 МГц, CDCl3) δ: 44.4 (т, J = 24.3 Гц), 55.2, 114.0, 124.1 (т, J = 3.5 Гц), 127.2 (т, J = 2.1 Гц), 129.0 (т, J = 279.6 Гц), 129.1, 129.7, 131.7, 136.2, 159.4. 19F ЯМР (282 МГц, CDCl3) δ: –72.4 (т, J = 14.7 Гц).
1,1-Дифторо-4-фенилбутилпентафторфенилсульфид (3g).
Выход 125 мг (45%), бесцветное масло, Rf 0.35 (EtOAc/гексан, 1/25). 1H ЯМР (300 МГц, CDCl3) δ: 1.97–2.11 (м, 2H), 2.18–2.37 (м, 2H), 2.77 (т, 2H, J = 7.5 Гц), 7.20–7.31 (м, 6H), 7.31–7.41(м, 4H). 13C ЯМР (75 МГц, CDCl3) δ: 24.8 (т, J = 3.3 Гц), 35.0, 38.1 (т, J = 22.4 Гц), 101.3 (тм, J = 18.8 Гц), 126.4, 128.5, 128.7, 129.5 (т, J = 283.5 Гц), 137.9 (дм, J = 256.5 Гц), 140.9, 143.5 (дтт, J = 258.7, 13.7, 5.0 Гц), 148.9 (дм, J = 250.4 Гц). 19F ЯМР (282 МГц, CDCl3) δ: –161.1 (м, 2F), –148.7 (тт, 1F, J = 21.2, 4.2 Гц), –120.0 (м, 2F), –70.9 (тт, 2F, J = 14.6, 6.3 Гц). MS (EI), m/z: 368.08 [M+], 198.94, 169.08, 149.03, 129.02, 127.00, 105.00, 90.99.
Работа выполнена при поддержке грантов MK-6724.2016.3 и РФФИ 16-29-10661.
Литература
- (a) Magueur, G.; Crousse, B.; Ourevitch, M.; Bonnet-Delpon, D.; Begue, J.-P. J. Fluorine Chem. 2006, 127, 637–642. (b) Leriche, C.; He, X.; Chang, C. T.; Liu, H. J. Am. Chem. Soc. 2003, 125, 6348–6349. (c) Pitterna, T.; Böger, M.; Maienfisch, P. Chimia 2004, 58, 108–116.
- Zhang, X.; Cao, S. Tetrahedron Lett. 2017, 58, 375–392.
- (a) McAlpine, I.; Tran-Dube, M.; Wang, F.; Scales, S.; Matthews, J.; Collins, M. R.; Nair, S. K.; Nguyen, M.; Bian, J.; Alsina, L. M.; Sun, J.; Zhong, J.; Warmus, J. S.; O'Neill, B. T. J. Org. Chem. 2015, 80, 7266–7274. (b) Sasada, Y.; Shimada, T.; Ushioda, M.; Matsui, S. Liq. Cryst. 2007, 34, 569–576. (c) Lin, S.-T.; Chen, L.-C.; Lee, C.-J. J. Chem. Res. 2004, 2004, 353–355. (d) Saito, A.; Okada, M.; Nakamura, Y.; Kitagawa, O.; Horikawa, H.; Taguchi, T. J. Fluorine Chem. 2003, 123, 75–80. (e) Lee, C.-C.; Lin, S.-T. Synthesis 2000, 496–498.
- (a) Gao, B.; Zhao, Y.; Ni, C.; Hu, J. Org. Lett. 2013, 16, 102–105. (b) Qiao, Y.; Si, T.; Yang, M.-H.; Altman, R. A. J. Org. Chem. 2014, 79, 7122–7131. (c) Tian, P.; Wang, C.-Q.; Cai, S.-H.; Song, S.; Ye, L.; Feng, C.; Loh, T.-P. J. Am. Chem. Soc. 2016, 138, 15869–15872. (d) Tang, H.-J.; Lin, L.-Z.; Feng, C.; Loh, T.-P. Angew. Chem. Int. Ed. 2017, 56, 9872–9876.
- (a) Zheng, J.; Cai, J.; Lin, J.-H.; Guo, Y.; Xiao, J.-C. Chem. Commun. 2013, 49, 7513–7515. (b) Burton, D. J.; Yang, Z.-Y.; Qiu, W. Chem. Rev. 1996, 96, 1641–1716.
- (a) Hu, M.; Ni, C.; Li, L.; Han, Y.; Hu, J. J. Am. Chem. Soc. 2015, 137, 14496–14501. (b) Zheng, J.; Lin, J.-H.; Yu, L.-Y.; Wei, Y.; Zheng, X.; Xiao, J.-C. Org. Lett. 2015, 17, 6150–6153. (c) Zhang, Z.; Yu, W.; Wu, C.; Wang, C.; Zhang, Y.; Wang, J. Angew. Chem. Int. Ed. 2016, 55, 273–277.
- Ichikawa, J. J. Fluorine Chem. 2000, 105, 257–263.
- Orsi, D. L.; Easley, B. J.; Lick, A. M.; Altman, R. A. Org. Lett. 2017, 19, 1570–1573.
- Suda, M. Tetrahedron Lett. 1981, 22, 2395–2396.
- Ashirbaev, S. S.; Levin, V. V.; Struchkova, M. I.; Dilman, A. D. J. Fluorine Chem. 2016, 191, 143–148.
Статью рекомендовал к публикации член редколлегии А.Д. Дильман
Fluorine Notes, 2017, 115, 1-2


