Поступило в редакцию: Август 2017
УДК 10.17677/fn20714807.2017.05.01
Fluorine Notes, 2017, 114, 1-2
Синтезы стерически затруднённых фторсодержащих арил перфторалкил сульфидов
Antal Harsányi, Gitta Schlosser and József Rábai*
Institute of Chemistry, Eötvös Loránd University, Pázmány Péter sétány 1-A, Budapest, H-1117, Hungary
e-mail: rabai@elte.hu
Аннотация: Натриевая соль 2,6-диметил-4-трет-бутилбензотиола реагировала в ДМФ с рядом перфторалкилиодидов и 1,8-дииодоперфтороктаном давая соответствующие перфторалкил сульфиды и бис-арилтио-перфтороктан с хорошими выходами.
Ключевые слова: фтосодержащие сульфиды, перфторалкилиодиды, перфторалкилирование.
Вдохновленные работами Umemoto с сотр. [1] по введению FluoleadTM как нового фторирующего реагента и в соответствии с ранними публикациями Ягупольского с сотр. [2] по получению некоторых арил(трифторметил)дифторсульфуранов наша цель была синтезировать сульфураны (4) типа ArSF2Rfn (Схема 1).
Ожидается, что такие перфторалкил замещенные реагенты должны иметь уникальные физико-химические свойства схожие с теми, которыми обладают фторуглероды, и позволяющие легкое выделение использованных реагентов из продуктов [3].
В этой статье мы раскрываем оптимизированный синтез прекурсоров арил перфторалкиловых сульфидов (3a-e), основанный на самопроизвольном перфторалкилировании тиолов в отсутствии инициаторов в условиях подобных тем о которых сообщалось для простых тиолов Feiring и Бойко [4] (Схема 1).
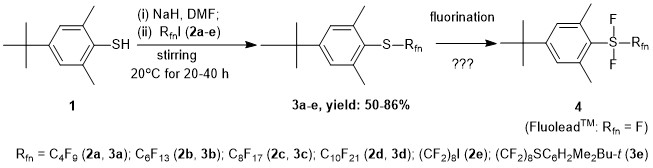
Схема 1. Предполагаемый синтез новых фторсодержащих арил перфторалкил дифторсульфуранов 4.
Стерически затруднённые арил перфторалкилсульфиды 3a-e были получены с очень хорошими выделенными выходами, используя реакцию натриевой соли 1 с небольшим избытком 1-иодперфторалканов (RfnI, 2a-d) или с 1,8-дииодоперфтороктаном (2e) в абсолютном ДМФА при комнатной температуре в течении 20-40 часов. Очищенные новые фторсодержащие сульфиды 3a-e были должным образом охарактеризованы. Целесообразно упомянуть, что масс спектрометрические измерения с помощью ионизации при атмосферном давлении (APCI) были облегчены использованием смеси (1:1 об.) растворителей CH3CN и CF3CH2OH для приготовления образцов. О синтезе аналогичного трифторметилсульфида (Rfn = CF3), который был проведен с использованием как перфторалкилирующего реагента растворенного CF3I в ДМФА, было сообщено нами ранее [5].
Наши попытки окислительного фторирования 3 в 4 (Rfn = CF3) с применением Br2/KF/CH2Cl2 и некоторых других реагентов, однако, были пока безуспешными [6].
Экспериментальная часть
1H-, 13C- и 19F-ЯМР спектры были получены на приборе Bruker Avance 250 с использованием инверсионной 1H/13C/31P/19F измерительной головки при комнатной температуре. Химические сдвиги (δ) даны в м.д. относительно остаточных пиков растворителя (CDCl3) (δ=7.26 дляr 1H, δ=77.0 для 13C) и к CFCl3 как внешнему стандарту (δ=0.00 для 19F). Определение молекулярной массы проводили масс-спектрометрией с использованием химической ионизации при атмосферном давлении (APCI-MS) на масс-спектрометре Bruker Daltonics Esquire 3000 plus (Германия). Образцы растворяли в смеси растворителей ацетонитрил-трифторэтанол (50:50 об.). Масс спектры были получены в диапазоне 50-1500 m/z давая одинарно заряженные (CDCl3) радикал-катионы (M•+). Давление газа в капилляре было 25 psi (фунтов на квадратный дюйм), расход сушильного газа – 5 л в мин., температура капилляра 250 oC, температура испарителя 450 oC. Образцы вводили в источник иона в потоке 10 μL/мин. используя поршневой насос. Температуры плавления определялис помощью аппарата Боеция для микро-определения точки плавления и не корректировали. ГЖХ анализ летучих продуктов определяли на приборе Hewlett-Packard 5890 Series II с PONA [сшитая метилсиликоновая смола] 50 m x 0.2mm x 0.5 mm колонкой, H2 газ-носитель, детектор ДИП; Программа: 120 °C, 5 мин., 10 °C/мин., 250 °C, 5 мин., Температура испарителя: 250°C, Детектора: 280°C.
Общая методика для синтеза Арил перфторалкилсульфидов [7]
4-(трет-Бутил)-2,6-диметилбензотиол [8] (1.93 g, 10 mmol) был суспендирован в абсолютном ДМФА (15 mL) и реагировал с гидридом натрия (11 mmol) в небольших порциях, приготовленных промывкой водой в атмосфере аргона дисперсии 57% (вес.) гидрида натрия – вазелинового (светлого) масла с пентаном (3 x 5 mL). Когда выделение водорода прекращалось добавляли префторалкил иодид 2a-d, CnF2n+1I, [n=4,6,8,10], 11.0 mmol) или 1,8-диодоперфтороктан (2e, I(CF2)8I, 5.50 mmol) и смесь перемашивали при комнатной температуре в течении 20 (3a-c) или 40 часов (3d-e) в атмосфере N2. Затем реакционную массу вливали в воду (100 mL) и экстрагировали диэтиловым эфиром (3 x 20 mL); объединенный органический экстракт промывали водой (3 x 20 mL) и насыщенным водным раствором NaCl (20 mL). Эфирную фазу отделяли и осушали (Na2SO4), после чего эфир удаляли дистилляцией, продукт очищали вакуумной дистилляцией или кристаллизацией.
(4-(трет-Бутил)-2,6-диметилфенил)(перфторбутил)сульфид (3a)
Выход: 2.90 g (71 %) бесцветная жидкость, полученная молекулярной перегонкой; 20 мм. рт. ст. при 160°C
бани. Загустевает в холодильнике. GC образец: 98%+, время удерживания: 14.47 min. 1H NMR
(250 MHz, CDCl3): δ 1.33 (s, 9H, C(CH3)3), 2.57 (s, 6H, CH3),
7.22 (s, 2H, Ar CH). 13C NMR (62.5 MHz, CDCl3): δ 22.88, 31.43, 34.97, 118.81,
126.34, 145.98, 154.82. 19F NMR (243 MHz, CDCl3): δ -81,50 (m, 3F, CF3),
-85,96 (m, 2F, CF2), -121,29 (m, 2F, CF2), -126,01 (m, 2F, CF2).
MS (APCI, M•+): вычислено C16H17F9S = 412.1; получено:
412.0.
(4-(трет-Бутил)-2,6-диметилфенил)(перфторгексил)сульфид (3b)
Выход: 3.50 g (68 %) белое воскообразное вещество с Тпл = 32-34 oC, полученное молекулярной перегонкой; 20 мм. рт. ст. при 170°C бани. GC образец: 98%, время удерживания: 15.90 мин. 1H NMR (250 MHz, CDCl3): δ 1.32 (s, 9H, C(CH3)3), 2.56 (s, 6H, CH3), 7.21 (s, 2H, Ar CH). 13C NMR (62.5 MHz, CDCl3): δ 22.89, 31.44, 34.97, 118.81, 126.34, 145.99, 154.82. 19F NMR (243 MHz, CDCl3): δ -81.33 (m, 3F, CF3), -85.74 (m, 2F, CF2), -120.38 (m, 2F, CF2), -121.85 (m, 2F, CF2), -123.28 (m, 2F, CF2), -126.63 (m, 2F, CF2). MS (APCI, M•+): Вычислено C18H17F13S = 512.1; получено: 511.9.
(4-(трет-Бутил)-2,6-диметилфенил)(перфтороктил)сульфид (3c)
Выход: 5.30 g (86 %) белые кристаллы с Тпл. = 53-54 oC, полученные молекулярной перегонкой; 0.5 мм. рт. ст. при 120°C бани. GC выход: 98%, время удерживания: 17.31 мин. 1H NMR (250 MHz, CDCl3): δ 1.31 (s, 9H, C(CH3)3), 2.55 (s, 6H, CH3), 7.20 (s, 2H, Ar CH). 13C NMR (62.5 MHz, CDCl3): δ 22.90, 31.45, 34.98, 118.82, 126.34, 145.98, 154.81. 19F NMR (243 MHz, CDCl3): δ -81.28 (m, 3F, CF3), -85.72 (m, 2F, CF2), -120.33 (m, 2F, CF2), -121.65 (m, 2F, CF2), -122.35 (m, 4F, CF2), -123.24 (m, 2F, CF2), -126.62 (m, 2F, CF2). MS (APCI, M•+): Вычислено C20H17F17S = 612.1; получено: 611.8.
(4-(терт-Бутил)-2,6-диметилфенил)(перфтордецил)сульфид (3d)
Выход: 5.70 g (76 %) белые кристаллы с Тпл. = 72-75 oC, полученные молекулярной перегонкой; 0.5 мм. рт. ст. при 140°C бани. 1H NMR (250 MHz, CDCl3): δ 1.31 (s, 9H, C(CH3)3), 2.55 (s, 6H, CH3), 7.20 (s, 2H, Ar CH). 13C NMR (62,5 MHz, CDCl3): δ 22.90, 31.46, 34.98, 118.82, 126.33, 145.97, 154.81. 19F NMR (243 MHz, CDCl3): δ -81.26 (m, 3F, CF3), -85.72 (m, 2F, CF2), -120.33 (m, 2F, CF2), -121.64 (m, 2F, CF2), -122.24 (m, 8F, CF2), -123.20 (m, 2F, CF2), -126.58 (m, 2F, CF2). MS (APCI, M•+): Вычислено C22H17F21S = 712.1; получено: 711.8.
(Перфтороктан-1,8-диил)бис((4-(терт-бутил)-2,6-диметил) сульфид (3e)
Сырец был перекристаллизован из ацетона (15 mL). Выход: 2.80 g (50 %) белые кристаллы с Тпл. = 100-101 oC. 1H NMR (250 MHz, CDCl3): δ = 1.32 (s, 9H, C(CH3)3), 2.56 (s, 6H, CH3), 7.21 (s, 2H, Ar CH). 13C NMR (62.5 MHz, CDCl3): δ = 22.90; 31.45; 34.98; 118.82; 126.34; 145.98; 154.81. 19F NMR (243 MHz, CDCl3): δ = -85.67 (m, 4F, CF2), 120.31 (m, 4F, CF2), -121.62 (m, 4F, CF2), -122.22 (m, 4F, CF2). MS (APCI, M•+): Вычислено C32H34F16S2 = 786.2; получено: 786.0.
Благодарности
Мы благодарим National Research, Development and Innovation Office за финансовую поддержкуe M-ERA.Net COR_ID программы (NKFIH NN117633). G. S. благодарит за поддержку MTA János Bolyai Research Scholarship и MTA Premium Post-Doctorate Research Program Венгерской Академии наук (HAS, MTA).
Литература
- Umemoto, T.; Singh, R. P.; Xu, Y.; Saito, N. Discovery of 4-tert-Butyl-2,6-dimethyl phenylsulfur Trifluoride as a Deoxofluorinating Agent with High Thermal Stability as Well as Unusual Resistance to Aqueous Hydrolysis, and Its Diverse Fluorination Capabilities Including Deoxofluoro-Arylsulfinylation with High Stereoselectivity. J. Am. Chem. Soc., 2010, 132, 18199–18205. DOI: 10.1021/ja106343h
- (a) Yagupolskii, L. M. Aromatic and Heterocyclic Compounds with Fluorine-Containing Substituents; Naukova Dumka: Kiev, USSR, 1988; (b) Yagupolskii, L. M.; Matsnev, A. V.; Orlova, R. K.; Deryabkin, B. G.; Yagupolskii, Y. L. A new method for the synthesis of trifluoromethylating agents—Diaryltrifluoromethylsulfonium salts J. Fluorine Chem. 2008, 129, 131–136. doi: 10.1016/j.jfluchem.2007.10.001
- (a) Horváth, I. T., Rábai, J. Facile Catalyst Separation without Water: Fluorous Biphase Hydroformylation of Olefins. Science 1994, 266, 72-75; DOI:10.1126/science.266.5182.72 (b) Handbook of Fluorous Chemistry, Gladysz, J.A.; Curran, D. P.; Horváth, I. T., Eds.; Wiley/VCH: Weinheim, 2004; DOI: 10.1002/3527603905 (c) Fluorous Chemistry, Volume Editor: Horváth, I.T.; Topics in Currant Chemistry, Springer, Vol. 308, 2012; Heidelberg. DOI 10.1007/978-3-642-25234-1.
- (a) Feiring, A. E. Perfluoroalkylation of Thiols . Evidence for a Radical Chain Process J. Fluorine Chem. 1984, 24, 191–203. doi:10.1016/S0022-1139(00)85203-3; (b) Feiring, A. E.; Wonchoba, E. R.; Arthur, S. D. J. Polym. Sci. Polym. Chem. Fluorinated Poly (ether Sulfone)s1990, 28, 2809–2819. doi:10.1002/pola.1990.080281018; (c) Boiko, V. N. Aromatic and heterocyclic perfluoroalkyl sulfides. Methods of preparation Beilstein J. Org. Chem. 2010, 6, 880–921. doi:10.3762/bjoc.6.88
- Harsányi, A.; Dorkó, É.; Csapó, Á.; Bakó, T.; Peltz, Cs.; Rábai, J. Convenient synthesis and isolation of trifluoromethylthio-substituted building blocks. J. Fluorine Chem. 2011, 132, 1241–1246. doi:10.1016/j.jfluchem.2011.07.008
- Unpublished results of PhD student Mr. Bálint Menczinger, Institute of Chemistry, Eötvös Loránd University, Budapest.
- Cf. Harsányi, A. Synthesis and Characterization of Aryl Perfluoroalkyl Sulfides, B.Sc. Thesis, 2010, Institute of Chemistry, Eötvös Loránd University, Budapest.
- Sviridova, A. V.; Laba, V. I.; Vasil’ev, S. V.; Litvinov, V. P. Efficient method for the synthesis of [2-(alkylarylthio)ethyl]pyridines. Russ. Chem. Bull. Int. Ed. 2001, 50, 563-565.
Статья рекомендована к публикации членом редколлегии József Rábai
Fluorine Notes, 2017, 114, 1-2


