Поступило в редакцию: апрель 2017
УДК 543.429.23: 543.051: 54.[061+062]
Fluorine Notes, 2017, 111, 3-4
ЯМР ХАРАКТЕРИСТИКИ ФТОРСОДЕРЖАЩИХ ПИРИДИНОВ
Поспелова Н. Б.1, Мокрушин И. Г2
1ФГУП "РНЦ "Прикладная химия", Пермский филиал,
2Пермский государственный национальный
исследовательский университет, Пермь, Россия
Аннотация: Спектроскопия ЯМР фторпроизводных пиридина – удобный метод идентификации и анализа. В статье собрана как уже известная, так и впервые полученная информация о химических сдвигах и константах сигналов ядер водорода, углерода-13, азота-15, фтора-19, сделаны выводы о зависимости положения сигнала от условий эксперимента и структуры замещенных пиридинов.
Ключевые слова: ядерный магнитный резонанс, ЯМР фтор-19, перфторированные соединения, фторпиридины.
Введение
С начала 1960-х гг. с возрастающей интенсивностью ведется разработка методов синтеза фторсодержащих препаратов, обладающих фармакологическими и медико-биологическими свойствами. На современном уровне потенциально возможно получение любого, даже полностью фторированного алкалоида. Примеры фторсодержащих препаратов с потрясающей активностью включают соединение I (дифлюкан, флюконазол), применяемое для лечения микозов и кандидоза, соединения II и III, обладающие антибактериальными свойствами, даже если сформировалась устойчивость к другим лекарственным средствам, соединения IV и V, инсектициды, ингибиторы синтеза хинина, применяемые в сельском хозяйстве.
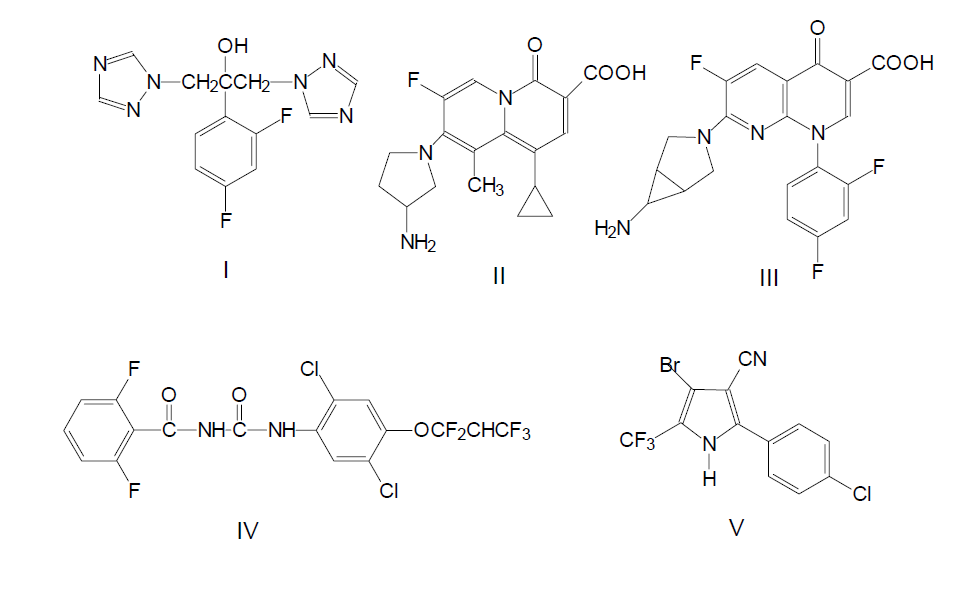
Пиридин и его производные являются основой большого числа алкалоидов. Модификация природных систем и введение атомов фтора в их состав может привести к повышению биологической активности таких соединений, серьезному уменьшению вовлечения в метаболизм, повышению специфичности и связываемости сайтами рецепторов.
Нами описаны спектральные характеристики ЯМР ряда фторсодержащих пиридинов синтезированных на базе ФГУП РНЦ «Прикладная Химия» и ООО «Пермская химическая компания». Были получены протонные, фторные, углеродные и азотные спектры ядерного магнитного резонанса. В публикацию также включены некоторые литературные данные для замещенных пиридинов.
Факторы, влияющие на химические сдвиги
Основные факторы, определяющие положение сигнала в спектре: локальные диамагнитное и парамагнитное экранирования, обусловленные движением собственных орбитальных электронов атома, межъядерное квадрупольное (как системы диполей) и спин-спиновое взаимодействие (между спиновыми магнитными моментами), влияние соседних атомов и электрических полей от заряженных или полярных групп (например, при образовании водородных связей или сольватации).
Молекула пиридина поляризована и отрицательный центр поляризации сосредоточен на атоме азота. Наибольшее влияние на химический сдвиг протонов оказывают атомы, имеющие большую электронную плотность вблизи ядра (диамагнитная составляющая) и низкие энергии возбуждения внешних орбиталей (парамагнитная составляющая). Парамагнетизм Ван Флека – деформация приложенным магнитным полем электронной оболочки с появлением дополнительного магнитного момента.
Величина диамагнитного экранирования существенно зависит от электронной плотности вблизи ядра: чем больше плотность, тем больше экранирование и тем меньше химический сдвиг. Опираясь на данные по электроотрицательности заместителей, возможно предсказание области нахождения соответствующего сигнала в спектре. Описан ряд примеров хорошей корреляции между химическим сдвигом протона и электроотрицательностью заместителя в метане. Отмечено, что магнитная анизотропия связи C-Hal дополнительно уменьшает экранирование протонов, по сравнению с аналогичными по электроотрицательности негалогенами (например, халькогенами). [1], [2].
Влияние растворителя на химический сдвиг и вид спектра
«Истинное» значение химического сдвига может быть получено записью бесконечно разбавленного раствора. На практике, чтобы снять обменные взаимодействия используется 5-10% (вес.) концентрация образца.
Актуальным является вопрос выбора растворителя для получения ЯМР спектров фторорганических соединений. Ряд исследователей, например Никульшин П. В., приводит химические сдвиги замещенных пиридинов растворенных в CCl4 с добавкой ДАЦ (Дейтерированный ацетон), либо CDCl3. С целью изучения влияния растворителя на химический сдвиг сигналов были записаны спектры монофтор-, дифтор- и тетрафторпиридина в чистом виде с капилляром и в виде растворов в хлороформе и ацетоне. Калибровать спектр чистого жидкого образца можно по эталону в дейтерированном растворителе, помещенному в стеклянный капилляр. Данный экономичный метод упрощает получение спектра и не загрязняет образец.
Согласно литературным данным, прямые константы 1J (C, F) лежат в диапазоне -150÷-300 Гц и на них во многих случаях оказывает воздействие используемый растворитель. [3]. Геминальные константы 2J (C, F) всегда положительны. Обычно их значения лежат в диапазоне 10÷30 Гц. Далее приведены абсолютные значения констант.
Обнаружено, что растворение образца в хлороформе сдвигает сигналы (относительно чистого образца, записанного с внешним капилляром с ДМСО-d6/бензотрифторидом) в более слабое поле: протонный – на 5-9% (0,4-0,7 м.д.), фторный – на 1,5-6,5% (1-6 м.д.), углеродный – на 1-2% (1-3 м.д.).
Растворение того же образца в ацетоне, в большинстве случаев, двухкратно увеличивает разницу в химический сдвиге (отн. ΔCDCl3-pure) – 13С на 1,8-3% (2-4 м.д.) и 1H на 3-12% (0,3-1 м.д.), в слабое поле, однако в гораздо меньшей степени влияет на положении линий 19F Δ = 0,1-4,5% (1-4 м.д.).
Константы спин-спинового взаимодействия J (C, F) и J (F, F) незначительно зависят от условий съемки спектра. Растворитель и концентрация образца не влияет на форму линий всех исследованных ядер. Разброс значений, обусловленный в большей степени случайными факторами, составляет 1-5% (до 4 Гц). Наличие растворителя также не влияет на обратный «эффект крыши» (“inverse roof effect”), т.е. изменение относительной интенсивности линий в мультиплете из-за взаимного влияния энергетических состояний взаимодействующих ядер – результат диполь-дипольного взаимодействия, в ряде случаев проявляющийся на спектрах 13С замещенных пиридинов.
Результаты
В таблицах приводятся данные для растворов пиридинов в хлороформе-d, литературные данные приводятся «как есть», со ссылкой на источник. Отсутствие значения химического сдвига в соответствующей ячейке говорит о том, что спектр записан не был по разным причинам. Значения химический сдвигов δ ЯМР азота 15N водородсодержащих пиридинов получены из 2D 1H-15N HMBC (Heteronuclear Multiple Bond Correlation) экспериментов.
КССВ JFF замещенных пиридинов уменьшаются по мере увеличения расстояния между ними. По мере фторирования пиридина и удалению по цепи от атома азота константы JCF растут, так JC2F = 236 Гц, а JC4F = 265 Гц.
Таблица 1. Найденные диапазоны констант спин-спинового взаимодействия, J, Гц:
|
F2-F3, F5-F6 |
F2-F4, F4-F6 |
F2-F5, F3-F6 |
F2-F6 |
F3-F4, F4-F5 |
C-F |
C-CF |
C-С-CF |
C6-C2F |
C5-C2F |
|
20-32 |
18-20 |
20-24 |
12-13 |
17-18 |
230-270 |
20-40 |
6-9 |
13-15 |
3-5 |
1.Перфторпиридин и тетрафторпиридины
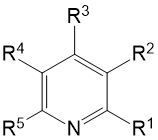
Химический сдвиг фтора в α, β и γ положениях значительно различается. Фтор в α-положении наиболее дезэкранирован, а в β-положении наиболее экранирован.
Величина электроотрицательности пара-заместителя тетрафторпиридина влияет на химический сдвиг фторов в орто-положении. Сигнал F2,6 дезэкранируется и смещается в более слабое поле по мере роста электроотрицательности в ряду H<CH2COOH<Br<Cl<CN<F. В то время как на сигнал F3,5 влияет в большей степени межъядерное квадрупольное и спин-спиновое взаимодействие с пара-заместителем, например в 4-бром и 4-цианотетрафторпиридине
|
Брутто-формула |
α-F |
β-F |
γ-R |
Р-ль |
Прим. |
|
C5F5N |
-87.8 |
-161.2 |
-133.5 |
ДАЦ |
- |
|
C5F5N |
-87.4 |
-161.6 |
-133.6 |
CDCl3 |
- |
|
C5F4NH |
-94.0 |
-142.1 |
7.17 |
CDCl3 |
15N: -126 |
|
C5F4NBr |
-88.5 |
-135.3 |
Br |
CCl4 |
[4] |
|
C5F4NCl* |
-89.5 |
-142.1 |
Cl |
ДАЦ |
- |
|
C6F4N2* |
-87.7 |
-134.3 |
CN |
ДАЦ |
- |
|
C7F4NH3* |
-92.5 |
-143.6 |
CH2COOH |
ДАЦ |
- |
|
Брутто-формула |
R1 |
R2 |
R3 |
R4 |
R5 |
Р-ль |
Прим. |
|
C5F4NH |
-90.3 |
-164.5 |
-150.7 |
-155.8 |
7,17 |
ДАЦ |
[6] |
|
C5F4NCl |
-85.6 |
-163.6 |
-113.9 |
Cl |
-72.2 |
CDCl3 |
15N: -136 |
*Спектр записан Поспеловой Н. Б. на приборе Bruker WP80SY
2. Трифторпиридины
|
Брутто-формула |
R1 |
R2 |
R3 |
R4 |
R5 |
Р-ль |
Прим. |
|
C5F3NCl2 |
-87.5 |
-141.6 |
Cl |
Cl |
-71.3 |
CCl4 |
[4] |
|
C5F3NH2 |
-90.8 |
-135.4 |
7.37 |
-128.6 |
7.82 |
CDCl3 |
15N: -95 |
|
C5F3NH2 |
-88.6 |
-147.6 |
7.69 |
6.80 |
-74.7 |
CDCl3 |
15N: -95 |
|
C5F3NH2 |
-83 |
-165 |
-123 |
H |
H |
- |
[5] |
|
C5F3NH2 |
-91 |
-136 |
7.6 |
-129 |
7.92 |
- |
[5] |
|
C5F3NH2 |
-86 |
-147 |
7.63 |
6. 75 |
-73 |
- |
[5] |
|
C5F3NH2 |
-65 |
6.54 |
-95 |
6.54 |
-65 |
- |
[5] |
|
C5F3NH2 |
H |
-146 |
-148 |
-146 |
H |
- |
[5] |
|
C5F3NHCl |
-89.4 |
-143.01 |
Cl |
7.79 |
-76.4 |
CDCl3 |
15N: -75 |
|
C5F3NHClS |
-90.1 |
-139.6 |
SH |
Cl |
-73.9 |
CCl4 |
[4] |
|
C6F3NH2O2* |
COOH |
-140.97 |
7.75 |
-140.3 |
-94.64 |
ДАЦ |
COOH: 10.40 |
|
C5F3NHCl |
-85.1 |
-149 |
Cl |
H |
-72.1 |
pure |
[6] |
|
C5F3N2H2Cl* |
NH2 |
-159.6 |
Cl |
-144.07 |
-91.75 |
ДАЦ |
NH2: 5.96 |
|
C5F3N2H3 |
-95 |
-173.7 |
NH2 |
H |
-76.4 |
ДАЦ |
[6] |
|
C5F3N2H3 |
NH2 |
-124 |
-172.6 |
H |
-70.9 |
ДАЦ |
[6] |
3. Дифторпиридины
|
R1 |
R2 |
R3 |
R4 |
R5 |
Р-ль |
Прим. |
|
|
C5F2NCl3 |
-68.94 |
Cl |
Cl |
Cl |
-68.94 |
pure |
- |
|
C5F2NH3 |
8.37 |
-124 |
7.2 |
-124 |
8.37 |
- |
[5] |
|
C5F2NH3 |
-87 |
-140 |
7.75 |
7.16 |
7.91 |
- |
[5] |
|
C5F2NH3 |
-63 |
6.64 |
-99 |
6.95 |
8.2 |
- |
[5] |
|
C5F2NH3 |
-73 |
6.86 |
7.48 |
-134 |
7.98 |
- |
[5] |
|
C5F2NH3 |
-70 |
6.73 |
7.8 |
6.73 |
-70 |
- |
[5] |
|
C5F2NH3 |
H |
-153 |
-130 |
H |
H |
- |
[5] |
|
C5F2NH3 |
-69.5 |
6.68 |
7.79 |
6.68 |
-69.5 |
CDCl3 |
15N: -133 |
|
C5F2NHCl2 |
-73.04 |
Cl |
7.95 |
Cl |
-73.04 |
CDCl3 |
15N: -131 |
|
C5F2N2H3Cl |
NH2 |
-150.7 |
Cl |
H |
-74.6 |
ДАЦ |
[6] |
|
C5F2N2H4 |
-68.7 |
H |
NH2 |
H |
-68.7 |
ДАЦ |
[7] |
*Спектр записан Поспеловой Н. Б. на приборе Bruker WP80SY
4. Монофторпиридины
|
R1 |
R2 |
R3 |
R4 |
R5 |
Р-ль |
Прим. |
|
|
C5FN2H3Cl2* |
NH2 |
Cl |
7.66 |
Cl |
-75.87 |
ДАЦ |
NH2: 5.33 |
|
C5FNH4 |
-68 |
6.9 |
7.8 |
7.2 |
8.2 |
- |
[5] |
|
C5FNH4 |
-68.35 |
6.79 |
7.66 |
7.05 |
8.09 |
CDCl3 |
15N: -103 |
|
C5FNH5 |
H |
-126 |
H |
H |
H |
- |
[5] |
|
C5FNH6 |
H |
H |
-103 |
H |
H |
- |
[5] |
|
C5FNH7+HCl |
-79 |
H |
H |
H |
H |
- |
[5] |
|
C5FNH8+HCl |
H |
-114 |
H |
H |
H |
- |
[5] |
|
C6FNH5OCl* |
7.44 |
Cl |
7.44 |
-136.23 |
OCH3 |
ДАЦ |
OCH3: 3.96 |
*Спектр записан Поспеловой Н. Б. на приборе Bruker WP80SY
Экспериментальная часть.
Авторы благодарят к. х. н. Подсевалова П. В. за любезно предоставленные образцы.
Спектры ЯМР замещенных пиридинов зарегистрированы на приборах Bruker WP80SY 80 MHz и Avance III HD 400 MHz. Химические сдвиги приведены в миллионных долях (ppm). За эталон в ПМР спектрах принят сигнал растворителя (δ, м.д., отн. TMS): 2.05 - acetone-D6; 2.50 - DMSO-D6, 7.26 - CDCl3; в спектрах 13C (м.д., отн. TMS): 29.84 - acetone-D6; 39.52 - DMSO-D6, 77.16 - CDCl3; в спектрах 19F сигнал бензотрифторида -63.70 м.д., отн. CFCl3; в спектрах 15N (1H-15N HMBC) сигнал нитрометана 0.0 м.д.;
Пиридин. 1H (pure liquid) δ 8.23 – 8.08 (m, 2H, С2,4H), 7.04 (tt, J = 7.7, 1.9 Hz, 1H, С4H), 6.72 – 6.58 (m, 2H, С3,5H). 13C (pure liquid) δ 148.89, 134.72, 122.72. 1H (CDCl3) δ 7.98 (dt, J = 3.7, 1.7 Hz, 2H, С2,4H), 6.95 (tt, J = 7.6, 1.8 Hz, 1H, С4H), 6.57 (ddd, J = 7.7, 4.3, 1.6 Hz, 2H, С3,5H). 13C (CDCl3) δ 148.62, 134.63, 122.52. 15N (CDCl3) δ -63 (s).
Пентафторпиридин. 19F (pure liquid) δ -93.19 (dm, J = 14.3 Hz), -139.42 (tt, J = 16.6, 14.0 Hz), -167.40 (m). 13C (pure liquid) δ 148.02 (dtt, J = 267.7, 12.3, 6.2 Hz), 142.31 (ddddd, J = 244.1, 16.4, 13,4, 5.6, 2.8 Hz), 131.97 (dm, J = 209.7 Hz). 13C (CDCl3) δ 149.68 (dtt, J = 268.1, 12.2, 6.1 Hz), 144.13 (dm, J = 244.9 Hz), 133.71 (dm, J = 291.2 Hz). 19F (CDCl3) δ -87.37 (d, J = 12.8 Hz), -133.56 (tt, J = 17.6, 13.8 Hz), -161.62 (m). 13C (Ac-d6) δ 150.97 (dtt, J = 266.0, 12.4, 6.3 Hz), 145.20 (d, J = 242.2 Hz), 135.09 (d, J = 259.8 Hz). 19F (Ac-d6) δ -89.28 (dm, J = 12.1 Hz), -135.08 (tt, J = 17.4, 13.9 Hz), -162.9 (m).
2,3,5,6-тетрафторпиридин. 1H (pure liquid) δ 7.23 – 7.11 (7.17) (m, 1H). 19F (pure liquid) δ -93.69 (dt, J = 28.3, 12.8 Hz), -141.84 – -142.10 (-142.27) (m). 13C (pure liquid) δ 142.00 (dddd, J = 16.3, 15.1, 12.3, 2.3 Hz), 142.1-139.0 (140.54) (dm, J = 265.1 Hz), 117.56 (tt, J = 21.1, 3.1 Hz). 1H (CDCl3) δ 7.63 – 7.55 (7.59) (m, 1H). 19F (CDCl3) δ -91.96 (dt, J = 27.5, 13.3 Hz), -140.65 – -140.87 (-140.06) (m). 13C (CDCl3) δ 143.24 (dddd, J = 17.0, 15.6, 12.1, 2.2 Hz), 142.9-139.8 (141.35) (dm, J = 264 Hz), 121.26 (tt, J = 21.2, 3.0 Hz). 15N (CDCl3) δ -126 (s). 1H (Ac-d6) δ 8.18 (tt, J = 8.1, 7.1 Hz, 1H). 19F (Ac-d6) δ -94.00 (td, J = 28.8, 13.6 Hz), -141.91 – -142.11 (-142.31) (m). 13C (Ac-d6) δ 144.56 (dddd, J = 16.8, 15.5, 12.0, 2.2 Hz), 144.7-141.6 (143.17) (dm, J = 263.3 Hz), 121.09 (tt, J = 21.3, 3.0 Hz).
2-фторпиридин. 1H (pure liquid) δ 7.66-7.57 (7.62) (dm, J = 4.9 Hz, 1H), 7.19 (tdd, J = 8.3, 7.2, 2.1 Hz, 1H), 6.57 (dddd, J = 7.3, 4.9, 2.5, 0.9 Hz, 1H), 6.35 (ddt, J = 8.3, 2.7, 0.8 Hz, 1H). 13C (pure liquid) δ 162.56 (d, J = 236.6 Hz), 146.46 (d, J = 14.8 Hz), 140.05 (d, J = 7.8 Hz), 120.22 (d, J = 4.1 Hz), 108.22 (d, J = 37.5 Hz). 19F (pure liquid) δ -71.32 (s). 1H (CDCl3) δ 8.12-8.06 (8.09) (dm, J = 4.9 Hz, 1H), 7.66 (tdd, J = 8.2, 7.2, 2.1 Hz, 1H), 7.05 (dddd, J = 7.3, 4.9, 2.4, 0.9 Hz, 1H), 6.79 (ddt, J = 8.3, 2.7, 0.7 Hz, 1H). 13C (CDCl3) δ 163.57 (d, J = 238.4 Hz), 147.61 (d, J = 14.5 Hz), 140.96 (d, J = 7.8 Hz), 121.10 (d, J = 4.2 Hz), 109.46 (d, J = 37.0 Hz). 19F (CDCl3) δ -68.35 (s). 15N (CDCl3) δ -103 (s). 1H (Ac-d6) δ 8.57-8.21 (8.24) (dm, J = 4.7 Hz, 1H), 7.94 (tdd, J = 8.3, 7.2, 2.1 Hz, 1H), 7.30 (dddd, J = 7.4, 4.9, 2.6, 0.8 Hz, 1H), 7.05 (ddt, J = 8.3, 2.7, 0.8 Hz, 1H). 13C (Ac-d6) δ 164.63 (d, J = 235.9 Hz), 148.69 (d, J = 15.0 Hz), 142.42 (d, J = 7.8 Hz), 122.45 (d, J = 4.2 Hz), 110.30 (d, J = 37.6 Hz). 19F (Ac-d6) δ -69.56 (s).
2,3,5-трифторпиридин. 1H (pure liquid) δ 7.26 (t, J = 2.5 Hz, 1H), 6.99 (dtd, J = 9.0, 7.3, 2.6 Hz, 1H). 13C (pure liquid) δ 155.70 (ddd, J = 255.7, 4.0, 2.7 Hz), 146.79 (ddd, J = 234.2, 14.3, 2.0 Hz), 143.61 (ddd, J = 265.5, 32.2, 7.6 Hz), 126.98 (ddd, J = 27.0, 14.2, 5.8 Hz), 113.84 (ddd, J = 24.8, 18.3, 3.6 Hz). 19F (pure liquid) δ -91.14 (t, J = 27.1 Hz), -128.48 (dd, J = 29.2, 3.2 Hz), -135.60 (dd, J = 25.7, 3.3 Hz). 1H (CDCl3) δ 7.77 (t, J = 2.5 Hz, C6H), 7.37 (dtd, J = 8.7, 7.2, 2.6 Hz, C4H). 13C NMR (CDCl3) δ 156.85 (ddd, J = 256.4, 4.0, 2.7 Hz), 148.16 (ddd, J = 235.1, 14.2, 1.7 Hz), 144.93 (ddd, J = 266.1, 32.0, 7.4 Hz), 128.56 (ddd, J = 26.9, 13.9, 5.8 Hz), 115.38 (ddd, J = 24.5, 18.1, 3.6 Hz). 19F (CDCl3) δ -90.81 (t, J = 26.9 Hz), -128.55 (dd, J = 29.1, 3.2 Hz), -135.39 (dd, J = 25.6, 3.2 Hz). 15N (CDCl3) δ -95 (s).
2,3,6-трифторпиридин. 1H (CDCl3) δ 7.69 (dddd, J = 9.1, 8.6, 8.1, 6.0 Hz, 1H), 6.80 (ddd, J = 8.6, 3.3, 2.2 Hz, 1H). 13C (CDCl3) δ 155.61 (dd, J = 244.1, 11.3 Hz), 151.12 – 147.06 (m), 142.99 (ddd, J = 253.7, 25.1, 6.4 Hz), 131.33 (ddd, J = 18.4, 8.5, 2.9 Hz), 106.89 (ddd, J = 38.5, 6.2, 2.9 Hz). 19F (CDCl3) δ -74.66 (dd, J = 24.5, 10.3 Hz), -88.61 (dd, J = 17.0, 12.5 Hz), -147.58 (dd, J = 26.9, 21.8 Hz). 15N (CDCl3) δ -95 (s).
2,6-дифтор-3,5-дихлорпиридин. 1H (Ac-d6) δ 8.42 (t, J = 7.7 Hz, 1H). 13C (Ac-d6) δ 155.48 (dd, J = 244.5, 13.4 Hz), 145.75 (t, J = 1.8 Hz), 114.57 (dd, J = 22.2, 13.4 Hz), 114.57 (d, J = 40.2 Hz). 19F (Ac-d6) δ -75.49 (s). 1H (CDCl3) δ 7.95 (t, J = 7.5 Hz, 1H). 13C (CDCl3) δ 154.81 (dd, J = 247.7, 13.0 Hz), 143.99 (t, J = 1.8 Hz), 113.95 (dd, J = 22.1, 13.0 Hz), 113.95 (d, J = 40.2 Hz). 19F (CDCl3) δ -73.04 (s). 15N (CDCl3) δ -131 (s).
2,6-дифторпиридин. 1H (pure liquid) δ 7.90 (p, J = 8.0 Hz, 1H), 6.80 (d, J = 8.0 Hz, 2H). 13C (pure liquid) δ 160.38 (dd, J = 245.3, 14.9 Hz), 144.23 (t, J = 7.8 Hz), 106.38 – 103.15 (m). 19F (pure liquid) δ -72.94 (s). 1H (Ac-d6) δ 8.14 (p, J = 8.1 Hz, 1H), 7.02 (d, J = 8.0 Hz, 2H). 13C (Ac-d6) δ 162.54 (dd, J = 244.6, 15.0 Hz), 147.12 (t, J = 7.8 Hz), 107.34 – 106.64 (m).19F (Ac-d6) δ -70.63 (s). 1H (CDCl3) δ 7.79 (p, J = 8.0 Hz, 1H), 6.68 (d, J = 8.0 Hz, 2H). 13C (CDCl3) δ 161.52 (dd, J = 246.1, 14.8 Hz), 145.20 (t, J = 7.7 Hz), 109.14 – 101.15 (m). 19F (CDCl3) δ -69.48 (s). 15N (CDCl3) δ -133 (s).
3-хлор-2,5,6-трифторпиридин. 1H (pure liquid) δ 7.13 (td, J = 7.6, 6.8 Hz, 1H). 13C (pure liquid) δ 149.35 (ddd, J = 243.2, 11.5, 2.4 Hz), 145.63 (ddd, J = 247.0, 16.8, 12.5 Hz), 140.96 (ddd, J = 259.9, 27.1, 6.3 Hz), 129.69 (ddd, J = 20.3, 3.0, 2.0 Hz), 111.52 (ddd, J = 35.3, 6.6, 3.1 Hz). 19F (pure liquid) δ -80.36 (dd, J = 28.0, 11.4 Hz), -93.39 (dd, J = 20.1, 12.0 Hz), -146.69 (dd, J = 28.2, 20.9 Hz). 1H (CDCl3) δ 7.80 (td, J = 7.6, 6.8 Hz, 1H). 13C (CDCl3) δ 151.08 (ddd, J = 243.7, 11.4, 2.4 Hz), 147.32 (ddd, J = 247.4, 16.7, 12.4 Hz), 142.57 (ddd, J = 260.1, 27.0, 6.2 Hz), 131.36 (ddd, J = 20.0, 3.1, 2.0 Hz), 113.22 (ddd, J = 35.3, 6.6, 3.0 Hz). 19F (CDCl3) δ -76.44 (dd, J = 27.7, 10.9 Hz), -89.41 (dd, J = 19.5, 11.8 Hz), -142.99 (dd, J = 28.1, 21.1 Hz). 15N (CDCl3) δ -75.5 (s).
5-хлор-2,3,4,6-тетрафторпиридин. 13C (pure liquid) δ 155.11 (ddt, J = 266.2, 11.5, 5.8 Hz), 149.52 (dddd, J = 243.0, 15.0, 5.8, 3.4 Hz), 146.07 (dddd, J = 245.5, 16.1, 13.4, 6.7 Hz), 131.81 (dddd, J = 263.1, 30.0, 14.3, 8.1 Hz), 102.29 (dddd, J = 38.5, 17.7, 8.0, 2.9 Hz). 19F (pure liquid) δ -76.90 (dt, J = 23.2, 11.8 Hz), -90.45 (dd, J = 33.9, 17.4 Hz), -118.88 (td, J = 17.6, 10.6 Hz), -168.48 (ddd, J = 24.7, 20.3, 17.5 Hz). 13C (CDCl3) δ 156.96 (ddt, J = 266.4, 11.5, 5.8 Hz), 151.49 (dddd, J = 243.5, 14.9, 5.6, 3.3 Hz), 147.99 (dddd, J = 246.0, 16.0, 13.3, 6.6 Hz), 133.70 (dddd, J = 263.4, 29.9, 14.3, 8.1 Hz), 104.33 (dddd, J = 38.3, 17.7, 8.0, 2.8 Hz). 19F (CDCl3) δ -71.97 – -72.20 (m), -85.60 (dd, J = 32.8, 16.4 Hz), -113.93 (td, J = 17.9, 10.5 Hz), -163.61 (ddd, J = 24.7, 20.6, 18.1 Hz).
2,3,4,6-тетрафторпиридин. 1H (pure liquid) δ 6.27 (dm, J = 8.5 Hz, 1H). 13C (pure liquid) δ 159.03 (dddd, J = 265.2, 13.2, 10.4, 5.7 Hz), 153.97 (dtd, J = 243.2, 15.7, 3.7 Hz), 148.80 (dddd, J = 243.1, 18.8, 13.1, 6.8 Hz), 131.78 (dddd, J = 257.2, 28.5, 14.0, 8.6 Hz), 95.31 (dddd, J = 42.9, 21.0, 6.8, 2.4 Hz). 19F (pure liquid) δ -75.02 (dd, J = 31.5, 13.3 Hz), -91.54 (dd, J = 33.6, 17.4 Hz), -120.79 (ddd, J = 18.9, 17.7, 15.1 Hz), -175.67 (ddd, J = 22.4, 20.9, 17.8 Hz). 1H (CDCl3) δ 6.73 (dddd, J = 8.3, 3.7, 2.8, 1.6 Hz, 1H). 13C (CDCl3) δ 160.54 (dddd, J = 265.6, 13.1, 10.4, 5.7 Hz), 155.51 (dtd, J = 243.7, 15.6, 3.7 Hz), 133.40 (dddd, J = 257.6, 28.2, 14.0, 8.5 Hz), 97.11 (dddd, J = 42.5, 20.7, 6.8, 2.4 Hz). 19F (CDCl3) δ -69.38 (dd, J = 29.4, 15.6 Hz), -85.58 (dd, J = 32.5, 16.4 Hz), -115.04 (td, J = 18.7, 15.2 Hz), -169.82 (ddd, J = 22.7, 21.0, 18.3 Hz). 15N (CDCl3) δ -136 (s).
Дифтортрихлорпиридин. 13C (pure liquid) δ 152.90 (dd, J = 247.5, 15.7 Hz), 145.20 (t, J = 3.0 Hz), 112.76 – 111.85 (m). 19F (pure liquid) δ -68.94 (s).
Тетрафторпиридин. 1H (CDCl3) δ 7.87 (s, J = 1.2 Hz, 1H). 13C (CDCl3) δ 146.17 (s), 140.30 (s), 129.82 (s). 15N (CDCl3) δ -50.5 (s).
Литература
- Основы ядерного магнитного резонанса: Учебное пособие / М.П. Евстигнеев, А.О. Лантушенко, В. В. Костюков. и др. - М.: Вузовский учебник, НИЦ ИНФРА-М, 2015. – 247 с.
- Днепровский А.С., Темникова Т.И. Теоретические основы органической химии, Л: Химия, 1991. – 558 с.
- Воловенко Ю.М., Карцев В.Г., Комаров И.В., Туров А.В., Хиля В.П., Спектроскопия ядерногомагнитного резонанса для химиков, М.: МБФНП, 2011. – 694 с.
- Никульшин П. В. Изучение термических реакций полифторарентиолов с хлором, бромом и их источниками. Дисс. канд. хим. наук: 02.00.03: 07.10.2016 / Никульшин Павел Викторович. – Новосибирск, 2016. – 151 с.
- Dolbier, William R. Guide to Fluorine NMR for Organic Chemists. John Wiley & Sons, 2006. – 235 p.
- Richard D. Chambers, John S. Waterhouse, and D. Lyn H. Williams. Mechanisms for Reactions of Halogenated Compounds. Part 1. Activating Effects of Fluorine in Polyfluoropyridines in Reactions with Ammonia // J. Chem. Soc., Perkin Trans. 2, 1977, 585-588.
- Chambers RD, Seabury MJ, Williams D, Hughes N. Mechanisms for reactions of halogenated compounds. Part 6. Investigations into the activating effect of ortho-fluorine in nucleophilic aromatic substitution // J Chem Soc Perkin Trans. 1, 1988: 255–258.
- J.-E. Backvall, J.E. Baldwin, R.M. Williams. High-Resolution NMR Techniques in Organic Chemistry, Elsevier, 2009.
- Gerig, J. T., Fluorine, N. M. R., Chapter in On-line Textbook, Biophysical Society, 2001 (www.biophysics.org/img/jtg2001-2.pdf).
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2017, 111, 3-4


