Поступило в редакцию: апрель 2017
УДК 544.653.2:547
Fluorine Notes, 2017, 111, 1-2
ОСОБЕННОСТИ ЭЛЕКТРОХИМИЧЕСКОГО ПОВЕДЕНИЯ ω-БРОМПОЛИОКСАПЕРФТОРКАРБОНОВЫХ КИСЛОТ
В.А. Гринберг1, А.А. Тютюнов2, 3, Н.Д. Каграманов2, Н.А. Майорова1, Е.И. Маевский4, С.Р. Стерлин2
1Федеральное Государственное Бюджетное Учреждение Науки Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, Ленинский пр-т 31, 119071 г. Москва, Россия
2Федеральное Государственное Бюджетное Учреждение Науки Институт элементоорганических соединений им. Н.А.Несмеянова РАН, ул. Вавилова 28, В-334, ГСП-1, 119991, г. Москва, Россия
3НПО «ПиМ-Инвест», ул. Вавидова 28, В-334, ГСП-1, 119991, г. Москва, Россия
4Федеральное Государственное Бюджетное Учреждение Науки Институт теоретической и экспериментальной биофизики РАН, Пущино, Московская область, Институтская ул. 3, 142290 Пущино, Московская область, Россия
Аннотация: Установлено, что электрохимическое поведение ω-бромполиоксафторкарбоновых кислот общей формулы BrCF2CF2O[CF(CF3)CF2O]nCF(CF3)CO2H (n = 0÷3) в условиях анодного окисления (электросинтеза Кольбе) радикально отличается в зависимости от длины их основной цепи.
Ключевые слова: ω-бромполиоксафторкарбоновые кислоты; электросинтез Кольбе; α ,ω-дибромполиоксаперфторалканы.
Электросинтез Кольбе является одним из наиболее востребованных препаративных методов электрохимии. Эта реакция используется для получения продуктов димеризации алифатических радикалов, генерируемых в ходе электроокисления карбоксилат-анионов, в первую очередь перфторированных, стабильных в условиях электросинтеза, в том числе и функционализированных (например, получение , ω-бис(фторсульфонил)оксаперфторалканов при электроокислении карбоксилатов -фторсульфонилоксаперфторкарбоновых кислот [1]).
Еще в 1956 г было показано, что при электролизе ω-галогенкарбоновых кислот общей формулы Hal(CH2)nCO2H (Hal = F, Cl, Br, J) соответствующие Кольбе-димеры начинают образовываться лишь при достижении алифатической цепью определенной длины (так, в случае Hal = F, n = 4; Hal = Cl, n = 2; Hal = Br, n = 10) [2]. Авторы отмечали, что с увеличением значения n до 10 выход Кольбе-димеров монотонно возрастает от 39 до 82% для разных галогенкарбоновых кислот. При этом все ω-йодкарбоновые кислоты (с числом углеродных атомов в молекуле от 2 до 11) в процессе электролиза разлагались с выделением иода, не давая димерных продуктов.
Целью настоящей работы является синтез дибромполиоксаперфторалканов, обладающих, подобно другим фторуглеродам, высокой растворяющей способностью по отношению к кислороду и характеризующихся пониженной летучестью, повышенной по сравнению с перфторалканами липофильностью, и образующих эмульсии, устойчивые как при длительном хранении при плюсовых температурах, так и при стерилизации в автоклаве при 120оС. Подобные соединения могут служить исходными веществами для получения оксигенирующих эмульсий, используемых как терапевтические средства наружного применения (кремы, мази, линименты), а также как оксигенирующие компоненты культуральных сред в биотехнологических процессах.
Для решения этой важной задачи было изучено электрохимическое поведение ω-бромполиоксаперфторкарбоновых кислот общей формулы BrCF2CF2O[CF(CF3)CF2O]nCF(CF3)CO2H (n = 0÷3) (1a-d) и показано, что оно радикально меняется в зависимости от длины фторуглеродной цепи. Как показали проведенные нами исследования, при анодном окислении карбоксилат-анионов кислот 1a-b происходит образование многокомпонентной смеси продуктов, в которой, однако, согласно данным хромато-масс-спектрометрии, отсутствуют ожидаемые Кольбе-димеры.
В то же время электролизом частично нейтрализованной кислоты 1b в присутствии трифторуксусной кислоты был получен кросс-димер Кольбе 3 (см. Схему 1) с 50%-ным выходом по отношению к теоретическому, что однозначно указывает на генерацию радикала 2 в результате декарбоксилирования ω-бромполиоксаперфторацилоксильного радикала – первичного интермедиата электроокисления карбоксилат-аниона 1b:
Схема 1
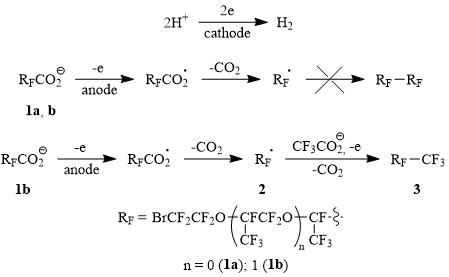
При электролизе частично нейтрализованных кислот 1c-d, в отличие от их низших гомологов, образуются как гомо-, так и кросс-димеры Кольбе (4-6) с препаративными выходами (Схема 2; здесь 1с’ и 1d’ – карбоксилат-анионы соответствующих кислот). Образование Кольбе-димеров 4-6 легко контролируется методом ЯМР 19F-спектроскопии: в ходе электролиза сигнал атома фтора во фрагменте CF(CF3), прилежащем к карбонильной группе (δ: -132, м), исчезает, и появляются сигналы атомов фтора продукта димеризации CF(CF3)-CF(CF3) (δ : -143, м). При этом выход по току этих димеров возрастает с увеличением температуры электролита до 50-55оС, что, скорее всего, связано с деглобулизацией исходных кислот:
Схема 2
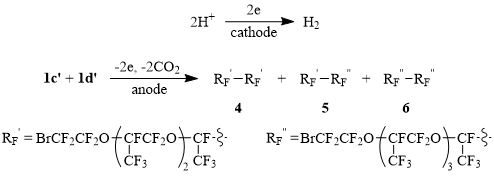
Катодная реакция на Схемах 1 и 2 – выделение водорода при восстановлении протона кислот и воды.
Таким образом установлено, что кислоты 1a-b, подобно линейным ω-галогенкарбоновым кислотам [2], характеризуются аномальным электрохимическим поведением, не образуя продуктов димеризации соответствующих алкильных радикалов в условиях электросинтеза Кольбе.
Следует принять во внимание, что разветвленные полиоксаперфторкарбоновые кислоты общей формулы RCF2CF2O[CF(CF3)CF2O]nCF(CF3)CO2H (где R = CF3, FSO2; n = 1-3) – близкие структурные аналоги кислот 1a-b – гладко димеризуются при их анодном окислении [3-5]. Следует также отметить, что энергия адсорбции 3-окса-2-трифторметилперфторкапроноат-аниона на аноде выше энергии адсорбции близкого по молекулярной массе перфторвалерат-аниона: так, при анодном окислении эквимолярной смеси C3F7OCF(CF3)CO2H (7) и C4F9CO2H в присутствии бутадиена после пропускания 0,5 F электричества была получена смесь гомо- и кросс-димеров Кольбе R’-R’ : R’-R’’: R’’-R’’ [R’ = C3F7OCF(CF3); R’’ = C4F9] в соотношении 2,2 : 3,3 : 1, что указывает на преимущественное вытеснение бутадиена с анода 3-окса-2-трифторметилперфторкапроноат-анионом [6]. Высказанное авторами предположение, что повышенная адсорбция карбоксилат-аниона кислоты 7 связана с наличием в основной цепи молекулы атома кислорода, играющего роль дополнительного нуклеофильного центра, согласуется с полученными ранее данными о повышенной устойчивости и, соответственно, пониженной реакционной способности перфторированных α-алкоксиалкильных радикалов по сравнению с их перфторалкильными аналогами [7]. Последнее, в свою очередь, объясняется стабилизацией радикалов за счет образования мезомерных форм благодаря электронодонорной способности неподеленной электронной пары на атоме кислорода в α-положении к парамагнитному центру (по аналогии со схемой, предложенной в [8]):
Схема 3
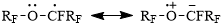
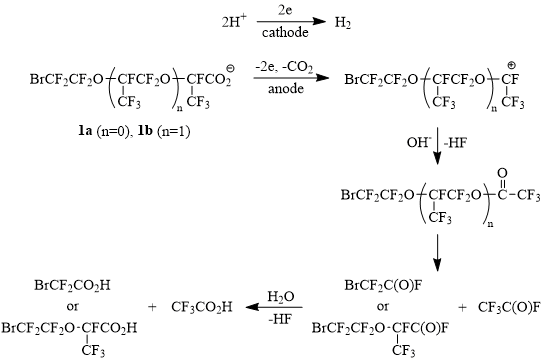
Изложенное выше в равной степени относится и к кислотам 1. Но кислоты 1, помимо эфирных атомов кислорода, содержат в ω-положении ещё и атом брома, ковалентный радиус которого существенно больше ковалентного радиуса кислорода (1,14 и 0,66Å соответственно [9]). Можно предположить, что в условиях электролиза (потенциал анода > 2,1 В отн. н.к.э.) происходит поляризация атома брома, приводящая к образованию еще одной донорно-акцепторной связи, что повышает энергию адсорбции как карбоксилат-анионов, так и генерируемых в ходе электроокисления радикалов на аноде. Иммобилизация радикалов способствует их дальнейшему окислению до карбокатиона (реакция Гофера-Мёста), что в среде водного MeCN должно приводить к образованию нестабильных перфторированных эфиров трифторуксусной кислоты и, после их распада, к смеси либо трифторуксусной и бромдифторуксусной кислот (в случае кислоты 1а), либо трифторуксусной кислоты и кислоты 1а (в случае 1b) (Схема 4):
Схема 4
При переходе от кислот 1a-b к их высшим гомологам – кислотам 1c-d – донорно-акцепторное взаимодействие атомов кислорода и брома с материалом анода уменьшается под влиянием стерических затруднений, возрастающих симбатно с увеличением числа боковых трифторметильных групп. Скорее всего, конкурентному преимуществу стерических факторов способствует глобулизация радикалов (благодаря наличию «шарнирных» атомов кислорода), в результате чего промежуточно образующиеся бромполиоксаперфторалкильные радикалы способны уходить в объем раствора с образованием продуктов димеризации (ср. с данными [10]).
Таким образом, показано, что анодное окисление кислот 1c-d является удобным препаративным методом получения низколетучих и химически инертных фторорганических жидкостей, которые могут быть использованы в качестве оксигенирующих добавок к терапевтическим препаратам наружного применения и компонентов культуральных сред в микробиологии.
Экспериментальная часть
ЯМР 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 282 MHz с внешним стандартом CDCl3. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение. Масс-спектры сняты на хромато-масс-спектрометрах VG FYFLITICAL 7070E (70 eV) и Finnigan Polaris/GCQ Plus (70 eV). Кислоты 1a-b получены омылением фторангидридов BrCF2CF2O[CF(CF3)CF2O]nCF(CF3)COF, n = 0, 1 [11].
Метод получения кислот 1c-d.
К смеси 30 г (44 ммоль) BrCF2CF2O[CF(CF3)CF2O]2CF(CF3)COF (2c) и 10 мл гептана прибавили 5 мл (280 ммоль) воды, интенсивно перемешивали 30 мин, прибавили 5 мл H2SO4, нижний слой отделили, перегнали в вакууме, собирая фракцию, кипящую в интервале 90÷150о/1 Torr. Повторной перегонкой получили 24,7 г (82,6%) 11-бром-3,6,9-триоксаперфтор-2,5,8-триметилундекановой кислоты (1c) (смесь диастереомеров), т.кип. 133÷135о/17 Torr. Вычислено для C11BrHF20O5, %: С, 19,61; H, 0,15; F, 56,43; Br, 11,89. Найдено, %: С, 20,00; H, 0,20; F, 56,37; Br, 11,36.
Аналогичным образом из BrCF2CF2O[CF(CF3)CF2O]3CF(CF3)COF (2d) получена 14-бром-3,6,9,12-тетраоксаперфтор-2,5,8,11-тетраметилтетрадекановая кислота (1d) (смесь диастереомеров), выход 84%, т.кип. 118÷122оС/0,1 Тоrr. Вычислено для C14BrHF26O6, %: С, 20,02; H, 0,12; F, 58,87; Br, 9,53. Найдено, %: С, 20,31; H, 0,15; F, 59,02; Br, 8,49.
Спектр ЯМР 19F кислоты 1d
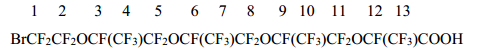
-70,97 (2F1); -79,2÷-85,35 (20F2+4+5+7+8+10+11+13); -132,14 (1F12); -146,12÷-146,67(3F3+6+9).
Спектр ЯМР 19F кислоты 1с отличается лишь интенсивностью сигналов в областях -79,2÷-85,35 м.д. и -146,12÷-146,67 м.д.
Получение кросс-димера 3 на основе кислоты 1b и CF3CO2H.
В электролизер, снабженный водяной рубашкой, магнитной мешалкой и обратным холодильником, загружено 10 г кислоты 1b (19,7 ммоль), 3,42 г (30 ммоль) CF3CO2H и 0,224 г (4 ммол) КОН. Анод – сплав платина-(10%)иридий (15 см2). Катод – нержавеющая сталь (2 см2). Плотность тока 64,4 мА.см-2. Ток 1,0 А. Температура электролиза 20оС. Теоретическое количество электричества на израсходование 49,7 ммол кислот составляет 1,33 А.ч. Всего пропущено 1,99 А.ч электричества. Исходное напряжение на электролизере – 24 В. Конечное напряжение после 80 минут электролиза составило 18 В. По окончании электролиза электролит промыли водой и водным раствором K2CO3, органический слой отделили, перегнали и получили 5,1 г (выход 49,0% по веществу и 26,5 % по току) кросс-димера 3 [BrCF2CF2OCF(CF3)CF2OCF(CF3)2], т.кип. 129÷131оС. Вычислено для C8BrF17O2, %: С, 18,08; F, 60,83. Найдено, %: С, 17,98; F, 60,74.
Масс-спектр 3 (M/Z, отнесение): 511[M-F]+; 451[M-Br]+; 395[C6F12BrO]+; 335[C6F13O]+; 179[C2F4Br]+; 147[C3F5O]+; 100[C2F4]; 69[CF3]+(100%); 47[CFO]+; 31[CF]+.
Получение дибромида 4.
В электролизер, снабженный водяной рубашкой, магнитной мешалкой и обратным холодильником, загружено 9,8 г (14 ммоль) кислоты 1c, 0,122 г (2,2 ммоль) КОН, 1 мл Н2О и 29 мл СН3СN. Анод – сплав платина-(10%)иридий (15 см2). Катод – нержавеющая сталь (2 см2). Плотность тока 51,6 мА.см-2. Ток 0,8 А. Температура электролиза 40÷50оС. Теоретическое количество электричества в расчете на израсходование 11,8 ммол кислоты 1c составляет 0,32 А.ч. Всего пропущено 0,37 А.ч электричества. Исходное напряжение на электролизере 24 В. Конечное напряжение на электролизере после 28 минут электролиза составило 40 В. По окончании электролиза электролит промыли водой, водным раствором K2CO3, органический слой отделили, перегнали и получили 7,1 г (80% по веществу и 72% по току) 1,20-дибром-3,6,9,12,15,18-гексаоксаперфтор-4,7,10,11,14,17-гексаметилэйкозана (4) (смесь диастереомеров), т.кип. 117÷119оC/1 Torr. Вычислено для C20Br2F40O6, %: С, 19,11; F, 60,51; Br, 12,74. Найдено, %: С, 19,09; F, 60,43; Br, 12,38.
Спектр ЯМР 19F дибромида 4
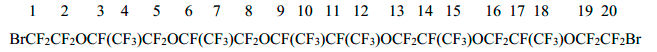
-71,1+-72,0 (2F1+2F20); -80,45÷-86,14 (группа сигналов 30F2+4+5+7+8+10+12+13+15+16+18+19); -143,2 (1F9+1F11); -147÷-147,5 (4F3+6+14+17).
Масс-спектр 4 (M/Z, отнесение): 727[C12BrF24O3]+; 705[C12BrF22O4]+; 667[C12F25O3]+; 611[C12BrF22O3]+; 551[C10F21O2]+; 529[C10F19O3]+; 511[C8BrF16O2]+; 395[C6BrF12O2]+; 385[C8BrF16O2]+; 345[C5BrF10O]+; 335[C6F13O]+; 313[C6F11O2]+; 285[C5F11O]+; 229[C3BrF6]+; 219[C4F9]+; 179[C2BrF4]+; 147[C3F5O]+; 131[C3F5]+; 100[C2F4]+; 69[CF3]+(100%).
Получение дибромида 6.
В электролизер, снабженный водяной рубашкой, магнитной мешалкой и обратным холодильником, загружено 10,0 г (11,9 ммоль) кислоты 1d, 0,1 г (1,7 ммоль) КОН, 1 мл Н2О и 29 мл СН3СN. Анод – сплав платина-(10%)иридий (15 см2). Катод – нержавеющая сталь (2 см2). Плотность тока 51,6 мА.см-2. Ток 0,8 А. Температура электролиза 50оС. Теоретическое количество электричества в расчете на израсходование 10,2 ммол кислоты 1d составляет 0,27 А.ч. Всего пропущено 0,35 А.ч электричества. Исходное напряжение на электролизере 32 В. Конечное напряжение на электролизере после 21 минуты электролиза составило 60 В.
Ректификацией органического слоя, выделенного из электролита (см. выше), получено 6,8 г (72% по веществу и 56% по току) 1,26-дибром-3,6,9,12,15,18,21,24-октаоксаперфтор-4,7,10,13,14,17,20,23-октаметилгексакозана (6) (смесь диастереомеров), т.кип. 183÷187оC/1 Torr. Вычислено для C26Br2F52O8, %: C, 19,66; F, 62,21. Найдено, %: С, 19,91; F, 62,37.
Спектр ЯМР 19F дибромида 6
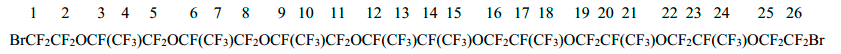
-71,85 (2F1+2F26); -80,66÷-86,32 (группа сигналов 46F2+4+5+7+8+10+11+13+15+16+18+19+21+22+24+25); -143,0 (2F12+14); -146,50÷-147,59 (6F3+6+9+17+20+23).
Масс-спектр 6 (M/Z, отнесение): 961[C18F35O5]+; 912[C15BrF31O4]+; 871[C14BrF30O4]+; 843[C14BrF28O4]+; 811[C15F29O5]+; 679[C13F25O3]+; 645[C12F23O4]+; 607[C12F21O4]+; 501[C9F19O2]+; 451[C8F17O2]+; 420[C7F16O2]+; 385[C7F15O]+; 335[C6F13O]+; 313[C6F11O2]+; 285[C5F11O]+; 219[C4F9]+; 179[C2BrF4]+; 147[C3F5O]+; 131[C3F5]+; 97[C2F3O]+; 69[CF3]+(100%).
Получение дибромидов 4, 5, 6.
В электролизер, снабженный водяной рубашкой, магнитной мешалкой и обратным холодильником, загружено 4,9 г (7 ммоль) кислоты 1c, 5,9 г (7 ммоль) кислоты 1d, 0,1 г (1,7 ммол) КОН, 1 мл Н2О и 29 мл СН3СN. Анод – сплав платина-(10%)иридий (15 см2). Катод – нержавеющая сталь (2 см2). Плотность тока 51,6 мА.см-2. Ток 0,8 А. Температура электролиза 50оС. Теоретическое количество электричества в расчете на израсходование кислот (1c и 1d) составляет 0,32 А.ч. Всего пропущено 0,37 А.ч электричества. Исходное напряжение на электролизере 28 В. Конечное напряжение на электролизере после 28 минут электролиза составило 55 В.
Ректификацией органического слоя, выделенного из электролита (см. выше), получено 7,5 г смеси дибромидов 4, 5 и 6 (по данным ГЖХ 4 : 5 : 6 = 1 : 2 : 1) с суммарным выходом 74% по веществу и 64% по току.
Дальнейшей ректификацией продуктов реакции выделен аналитический образец 1,23-дибром-3,6,9,12,15,18,21-гептаоксаперфтор-4,7,10,11,14,17,20-гептаметилтрикозана 5 (смесь диастереомеров), т.кип. 150÷153oC/1 Torr. Вычислено для C23Br2F46O7, %: C, 19,41; F, 61,46. Найдено, %: С, 19,53; F, 61,37.
Спектр ЯМР 19F дибромида 5
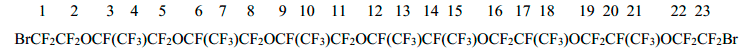
-71,85 (2F1+2F23); -80,66÷-86,32 (группа сигналов 35F2+4+5+7+8+10+11+13+15+16+18+19+21+22); -143,0 (2F12+14); -146,50÷-147,59 (5F3+6+9+17+20).
Масс-спектр 5 (M/Z, отнесение): 912[C15BrF31O4]+; 871[C14BrF30O4]+; 843[C14BrF28O4]+; 811[C15F29O5]+; 795[C15F29O4]+; 727[C12BrF24O3]+; 667[C12F25O3]+; 611[C12BrF22O3]+; 551[C10F21O2]+; 511[C8BrF16O2]+; 451[C8F17O2]+; 385[C8BrF16O2]+; 335[C6F13O]+; 313[C6F11O2]+; 285[C5F11O]+; 219[C4F9]+; 179[C2BrF4]+; 147[C3F5O]+; 131[C3F5]+; 100[C2F4]+; 69[CF3]+(100%).
Литература
- В.Ф. Черстков, В.А. Гринберг, С.Р. Стерлин, Ю.Б. Васильев, Л.С. Герман, Изв. АН СССР, Сер.хим., 1990, 10, 2448.
- F.L.M. Pattison, J.B. Stothers, R.G. Woolford, JACS, 1956, 78, 2255.
- В.G. Jager, H. Millauer, US pat. №5,468,352 (1995).
- М.А. Ефремова, Г.И. Каурова, Н.Б. Лесневская, А.А. Людикайнен, В.А. Маталин, Н.В. Пеганова, Н.В. Пузанова, Известия СПбГТИ (ТУ), 2011, 37(11), 102.
- Н.В. Пеганова, Г.И. Каурова, Н.Б. Лесневская и др., Журн.прикл.хим., 2009, 82(12), 1976.
- Н.А. Майорова, Н.Д. Каграманов, В.А. Гринберг, С.Р. Стерлин, Электрохимия, 2013, 49(2), 199.
- В.А. Гринберг, С.Р. Стерлин, Изв. РАН, Сер.хим., 2005, 8, 1884.
- D.C. Nonhebel, J.C. Walton, Free-Radical Chemistry. University Press. Cambridge. 1974, P. 62.
- Ф. Коттон, Дж. Уилкинсон, Современная неорганическая химия. Ч.1, Мир, М., 1969, С. 127.
- В.Ф. Черстков, В.А. Гринберг, С.Р. Стерлин, Ю.Б. Васильев, Л.С. Герман, Е.И. Мысов, Изв. АН СССР, Сер.хим., 1991, 5, 1134.
- С.М. Игумнов, С.Р. Стерлин, А.А. Тютюнов, З.А. Михайлова, Пат. РФ №2497801 (2013).
Статья рекомендована к публикации членом редколлегии к.х.н. А. А. Тютюновым
Fluorine Notes, 2017, 111, 1-2


