Поступило в редакцию: июнь 2016
УДК 542.97:547.464.6-38’161
Fluorine Notes, 2016, 106, 5-6
Термическое разложение 2-гидроперфтор-3-метилкротоноата серебра
М.Г. Медведевa, В.Ф. Черстковa, Н.Д. Каграмановa, A.A. Тютюновab, С.М. Игумновab, С.Р. Стерлинa
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
bЗАО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
e-mail: sterlins@yandex.ru
Аннотация: Показано, что 1,1,1,6,6,6-гексафтор-2,5-бис(трифторметил)-2,4-гексадиен - основной продукт термолиза 2-гидроперфтор-3-метилкротоноата серебра – в условиях реакции подвергается прототропной изомеризации и дегидрофторированию с образованием смеси полинепредельных соединений.
Ключевые слова: 4,4,4-трифтор-3-(трифторметил)кротоноат серебра; 1,1,1,6,6,6-гексафтор-2,5-бис(трифторметил)-2,4-гексадиен; тетракис(трифторметил)бутатриен; 1,2-ди(перфторпен-2-ил)ацетилен.
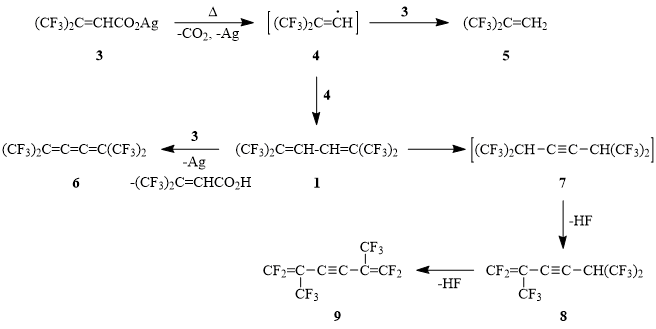
Ранее, в ходе исследований по синтезу гем-бис(трифторметил)-замещенных олефинов и диенов, было показано, что 4,4,4-трифтор-3-(трифторметил)-2-бутеналь взаимодействует с гексафторпропилидентрифенилфосфораном, генерируемым in situ, с образованием 1,1,1,6,6,6-гексафтор-2,5-бис(трифторметил)-2,4-гексадиена (1) [1].
Известно, что разложение серебряных солей α,β -ненасыщенных кислот общей формулы RFCF=CFCO2Ag (RF = i-C3F7; tert-C4F9) (2) при 210-220°С приводит к образованию соответствующих α-диенов с выходами 80-85% [2]. Можно было ожидать, что термолиз серебряной соли 4,4,4-трифтор-3-(трифторметил)кротоновой кислоты (3) [3] окажется удобным препаративным методом получения диена 1.
Оказалось, что термолиз соли 3 при 170-240°С/10-12 Торр приводит к образованию смеси продуктов, в которой, помимо ожидаемого диена 1, присутствуют соединения 5, 6, 8, 9, строение которых предложено на основании данных хроматомасс-спектроскопии. Сопоставление молекулярных ионов соединений 1, 6, 8, 9 приводит к очевидному выводу, что соединения 6-9 являются производными диена 1, образующиеся в результате либо его окисления (бутатриен 6) либо последовательного моно- и дидегидрофторирования (винилацетилен 8 и дивинилацетилен 9).
Отсюда следует, что основным продуктом термического разложения соли 3 действительно является α-диен 1, и сложный состав продуктов реакции определяется как окислением двух С-Н-связей в 2,3-положениях бутадиенового фрагмента молекулы под действием Ag+-ионов, так и прототропной миграцией атомов водорода с промежуточным образованием бис(гексафторизопропил)ацетилена 7 – предшественника ацетиленов 8-9.
Движущей силой прототропной аллильной перегруппировки α-диена 1 скорее всего является высокая поляризация двойных связей под действием четырех CF3-групп в 1,4-положениях бутадиенового фрагмента. Квантово-химический расчет показывает, что энтальпия образования ацетилена 7 в результате прототропной изомеризации диена 1 составляет 14 кДж/моль. Если учесть, что декарбоксилирование кротоноата 3 начинается при 170°С, образование ацетилена 7 в качестве интермедиата представляется весьма вероятным.
Схема 1
Экспериментальная часть
Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra).
Квантово-химические расчеты были выполнены методом TPSSh/6-311++G(d, p) с помощью программного комплекса GAMESS-US на суперкомпьютере BlueGene/P факультета ВМиК МГУ [4, 5]. По данным расчетов энтальпия изомеризации диена 1 в ацетилен 7 составляет 14 кДж/моль. Скошенная конформация соединения 7 оказалась наиболее низкой по энергии.
Термолиз 2-гидроперфтор-3-метилкротоноата серебра (3).
К раствору 16 г (71 ммоль) гидрата 4,4,4-трифтор-3-(трифторметил)кротоновой кислоты в 100 мл воды прибавили 3,76 г (35,5 ммоль) Na2CO3, по окончании выделения СО2 прибавили при перемешивании раствор 12,05 г (71 ммоль) AgNO3 в 20 мл воды, выпавший осадок экстрагировали эфиром (5x100 мл), экстракт упарили, высушили при 100°С/1-2 Торр над P2O5. Полученную соль 3 (19,2 г, 61 ммоль) нагревали при 170-240°С/10-12 Торр, собирая летучие продукты реакции в приемник (-78°С). По данным хроматомасс-спектроскопии полученный дистиллят (8,2 г) на ~90% является смесью соединений 1 : 5 : 6 : 8 : 9 в примерном соотношении 10 : 5 : 5 : 1 : 3.
Выделить аналитически чистые образцы соединений 5-9 не удалось. Следует отметить, что ректификация продуктов реакции сопровождается интенсивным осмолением.
Масс-спектр 1 (M/Z, отнесение): 326[M]+; 307[M-F]+; 287[M-H-2F]+; 257[M-CF3]+; 237[C7HF8]+; 219[C7H2F7]+; 207[C6H2F7]+; 191[C8F5]+(100%); 181[C7H2F5]+; 163[C4HF6]+; 113[C3HF4]+; 75[C3HF2]+; 69[CF3]+ (ср. с данными работ [1, 8]).
Масс-спектр 5 (M/Z, отнесение): 164[M]+; 163[M-H]+; 145[M-F]+(100%); 113[C3HF4]+; 95[M-CF3]+; 75[C3HF2]+; 69[CF3]+.
Масс-спектр 6 (M/Z, отнесение): 324[M]+; 305[M-F]+; 286[M-2F]+; 267[C8F9]+; 255[M-CF3]+(100%); 236[C7F8]+; 217[C7F7]+; 205[C6F7]+; 186[C6F6]+; 167[C6F5]+; 148[C6F4]+; 117[C5F3]+; 69[CF3]+ (ср. с данными работ [6, 7]).
Масс-спектр 8 (M/Z, отнесение): 306[M]+; 287[M-F]+; 267[C8F9]+; 237[M-CF3]+; 218[C7HF7]+; 199[C7HF6]+; 187[C6HF6]+; 168[C6HF5]+(100%); 148[C6F4]+; 137[C5HF4]+; 117[C5F3]+; 99[C5HF2]+; 93[C3F3]+; 75[M-CF3]+; 69[CF3]+.
Масс-спектр 9 (M/Z, отнесение): 286[M]+(100%); 267[M-F]+; 236[C7F8]+; 217[C7F7]+; 186[C6F6]+; 167[C6F5]+; 148[C6F4]+; 129[C6F3]+; 117[C5F3]+; 98[C5F2]+; 79[C5F]+; 69[CF3]+; 43[C2F]+.
Список литературы
- A. Haas, M. Lieb, J. Zwingenberger, Liebigs Ann., 1995, 2027-2035.
- V.F. Cherstkov, M.V. Galakhov, E.I. Mysov, S.R. Sterlin, L.S. German, Bull. Acad. Sci. USSR, Div. chem., sci., 1989, 38, 1219-1223.
- I.L. Knunyants, Ch’en Ch’ing-yun, N.P. Gambaryan, Zh. VKhO im. Mendeleeva, 1960, 5, 112-113.
- J. Tao, J.P. Perdew, V.N. Staroverov, G.E. Scuseria, Phys. Rev. Lett., 2003, 91, 146401.
- M.S. Gordon, M.W. Schmidt in Theory Appl. Comput. Chem. (Eds.: G.E. Scuseria, C.E. Dykstra, G. Frenking, K.S. Kim), Elsevier, Amsterdam, 2005, 1167–1189.
- P.A. Morken, D.J. Burton, Synthesis, 1994, 969-972.
- R.N. Warrener, E.E. Nunn, M.N. Paddon-Row, Tetrahedron Lett., 1976, 2639-2642.
- T.P. Forshaw, A.E. Tipping, J. Chem. Soc., C, 1971, 2404-2408.
Статья рекомендована к публикации членом редколлегии д.х.н. С.Р. Стерлиным
Fluorine Notes, 2016, 106, 5-6


