Поступило в редакцию: октябрь 2015
УДК 547.464.6; 547.433; 535.32; 535.34
Fluorine Notes, 2015, 102, 5-6
СИНТЕЗ И НЕКОТОРЫЕ СВОЙСТВА ТРЕТИЧНЫХ ПЕРФТОРИРОВАННЫХ ЭФИРОВ α-ФТОРАКРИЛОВОЙ КИСЛОТЫ
В.Э. Бойкоab,A.A. Тютюновab, А.В. Синькоab, С.М. Игумновab, Е.В. Хайдуковc, В.И. Соколовc
aФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
bЗАО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
cИнститут проблем лазерных и информационных технологий Российской академии наук, ул. Святоозерская, д. 1, 140700, Шатура, Моск. обл., Россия
e-mail: boykii@mail.ru
Аннотация: Была получена серия третичных перфторированных эфиров альфа-фторакриловой кислоты типа CH2=CF-CO2-C(CF3)2-(CF2)m-CF3 где m = 0, 1, 3, 5 имеющих степень фторирования от 83.3 до 90.9%. Соединения обладают высокой прозрачностью во всех трех телекоммуникационных диапазонах 0.85, 1.3 и 1.5 мкм. Показатель преломления мономеров уменьшается с ростом длины m алифатического перфторированного радикала и составляет 1.313 - 1.316.
Ключевые слова: Альфа-фторакрилаты, коэффициент поглощения, показатель преломления, интегральная оптика.
Полимеры на основе фторсодержащих акрилатов находят широкое применение в промышленности, науке и технике [1 - 17]. Одними из наиболее перспективных областей их применения являются волоконная и интегральная оптика, где акрилаты используются в качестве материалов для создания оптических волокон и волноводов, обеспечивающих высокоскоростные межсоединения в «телекоммуникационных» областях длин волн вблизи λ = 0.85, 1.3 и 1.55 мкм [4 - 9, 18 - 21]. При этом наибольшей оптической прозрачностью в вышеуказанных спектральных диапазонах обладают акрилаты с минимальным содержанием C-H связей, т.е. имеющие максимальную степень фторирования [22 - 26].
Для увеличения степени фторирования акриловых мономеров при сохранении их высокой активности в процессе радикальной УФ фотополимеризации ранее нами были разработаны методы синтеза цианоперфтор- и цианохлорперфторалкилакрилатов, а также трет-бутил-альфа-фторакрилатов [27, 28]. Следующим шагом к увеличению степени фторирования акриловых мономеров является переход к α-фторакрилатам перфторированных третичных спиртов с увеличенной длиной алифатического радикала в спиртовой части эфира. Для этого нами разработан метод синтеза новых, не описанных ранее мономеров гомологического ряда
CH2=CF-CO2-C(CF3)2-(CF2)m-CF3, (1)
где m = 0, 1, 3, 5, имеющих степень фторирования от 83.3 до 90.9%. Синтез α-фторакрилатов (1) осуществлен согласно приведенной ниже схеме 1 взаимодействием получаемых in situ калиевых солей перфтортретбутиловых спиртов, реакцией нуклеофильного присоединения перфторалкил(триметил)силанов к гексафторацетону в присутствии эквимолярного количества фтористого калия с 2,3-дихлор-2-фторпропионил хлоридом, и последующим дехлорированием.
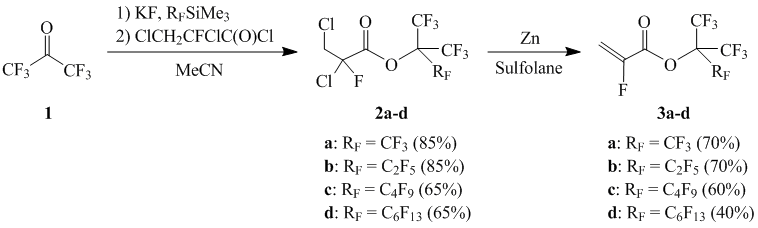
Схема 1
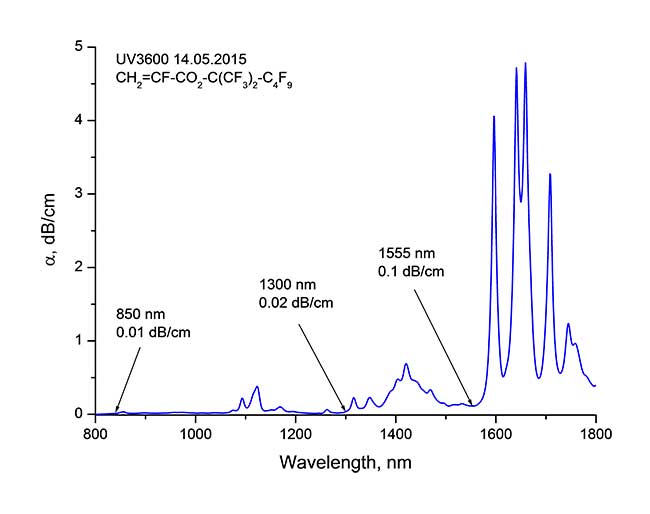
Проведенные исследования оптических свойств мономеров показали, что синтезированные α-фторакрилаты (1) обладают высокой прозрачностью во всех трех телекоммуникационных диапазонах 0.85, 1.3 и 1.5 мкм, что обусловлено их высокой степенью фторирования, достигающей 90.9%. Типичный спектр поглощения этих мономеров, выраженный в дБ/см, представлен на Рис. 1. Видно, что коэффициент затухания составляет 0.01 дБ/см (λ = 850 нм), 0.02 дБ/см (λ = 1300 нм) и 0.1 дБ/см (λ = 1550 нм) соответственно.
|
|
Рис. 1. Коэффициент затухания α [дБ/см] α-фтоакрилового мономера CH2=CF-CO2-C(CF3)2-C4F9 в телекоммуникационных диапазонах длин волн вблизи 0.85, 1.3 и 1.5 мкм. |
Показатель преломления nD на длине волны λ = 589.3 мкм и средняя дисперсия nF - nC мономеров (1) были измерены с помощью рефрактометра Аббе ИРФ454-Б2М и представлены в Табл. 1. Как следует из Табл. 1, показатель преломления мономеров уменьшается с ростом длины m алифатического перфторированного радикала (т.е. с увеличением степени фторирования) и составляет 1.313 - 1.316, что является рекордно низким значением для УФ фотоотверждаемых акрилатов. Показатели преломления гомополимеров, изготовленных из мономеров (1), несколько выше и лежат в пределах 1.343 – 1.349. Это связано с усадками и изменением химической структуры вещества в процессе радикальной полимеризации (раскрытием двойных C=C связей, образованием макромолекул полимера из молекул мономера и т.д.).
Табл. 1. Показатель преломления nD на длине волны λ = 589.3 мкм и средней дисперсия nF - nC фторсодержащих α-фторакриловых мономеров (1), измеренные при 20°C.
|
Химическая формула |
Степень фторирования, % |
nD |
nF - nF |
|
CH2=CF-COO-C(CF3)3 |
83.3 |
1.3160 ± 0.0002 |
6.521 × 10-3 |
|
CH2=CF-COO-C(CF3)2-(CF2)-CF3 |
85.7 |
1.3156 ± 0.0002 |
6.520 × 10-3 |
|
CH2=CF-COO-C(CF3)2-(CF2)3-CF3 |
88.9 |
1.3148 ± 0.0002 |
6.516 × 10-3 |
|
CH2=CF-COO-C(CF3)2-(CF2)5-CF3 |
90.9 |
1.3137 ± 0.0002 |
6.512 × 10-3 |
Синтезированные α-фторакриловые мономеры (1) обладают высокой активностью в процессе радикальной УФ фотополимеризации, которая может быть инициирована без добавления каких – либо фотоинициаторов под действием УФ излучения с длиной волны короче 260 нм. Данные мономеры пригодны для изготовления оптических волноводов методами прямого лазерного рисования или УФ фотолитографии.
Экспериментальная часть
ЯМР 1H, 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 300 и 282 MHz соответственно, внешний стандарт CDCl3. Химические сдвиги для 1H спектров приведены в м.д. относительно тетраметилсилана. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Чистота мономеров определялась методом газо-жидкостного хроматографического анализа (ГЖХ) на хроматографе Shimadzu 2010+, колонка Restek RTX-1701 (США) 14% цианопропилфенил, 86% полисилоксан, длина 30 м, 0,32 мм ID, 1 m df, детектор пламенно-ионизационный, газ-носитель азот.
Общий метод синтеза фторакриловых мономеров
К суспензии фтористого калия (30 г, 0,516 моль) в ацетонитриле (200 мл) при перемешивании и температуре -30÷-25оС прибавляют газообразный гексафторацетон (85 г, 0,512 моль) и RFSiMe3 (0,512 моль). После завершения экзотермической реакции, в результате которой температура реакционной смеси поднимается до 0÷5оС, смесь перемешивают при 15÷20оС в течение 2-3 часов, охлаждают до 0÷5оС и добавляют по каплям ClCH2CFClC(O)Cl (92 г, 0,513 моль). Смесь перемешивают при 15÷20оС в течение 2-3 часов, выливают в воду, нижний слой отделяют, промывают четыре раза водой, добавляют P2O5 (15 г) и перегоняют в вакууме (10-0,5 Торр). Продукт дополнительно очищают повторной перегонкой.
1,1,1,3,3,3-Гексафтор-2-(трифторметил)пропан-2-ил-2,3-дихлор-2-фторпропаноат (2a).
т.кип. 50-52оС/15 Торр
ЯМР 1H δ: 4,0÷4,2 (м, CH2Cl); ЯМР 19F δ: -125,4 (м, 1F, CFCl), -71,7 (м, 9F, CF3).
1,1,1,3,3,4,4,4-Октафтор-2-(трифторметил)бут-2-ил-2,3-дихлор-2-фторпропаноат (2b).
т.кип. 73-75оС/15 Торр
ЯМР 1H δ: 3,9÷4,2 (м, CH2Cl); ЯМР 19F δ: -125,4 (м, 1F, CFCl), -118,5 (м, 2F, CF2), -81,8 (м, 3F, CF3), -69,0, -68,6 (м, 6F, CF3).
1,1,1,3,3,4,4,5,5,6,6,6-Додекафтор-2-(трифторметил)гекс-2-ил-2,3-дихлор-2-фторпропаноат (2c).
т.кип. 110-113оС/15 Торр
ЯМР 1H δ: 3,9÷4,1 (м, CH2Cl); ЯМР 19F δ: -127,8 (м, 2F, CF2), -125,3 (м, 1F, CFCl), -122,2 (c, 2F, CF2), -113,8 (м, 2F, CF2), -83,5 (м, 3F, CF3), -68,6, -68,2 (м, 6F, CF3).
1,1,1,3,3,4,4,5,5,6,6,7,7,8,8,8-Гексадекафтор-2-(трифторметил)октан-2-ил-2,3-дихлор-2-фторпропаноат (2d).
т.кип. 100-103оС/0,5 Торр
ЯМР 1H δ: 4,0÷4,2 (м, CH2Cl); ЯМР 19F δ: -127,3 (м, 2F, CF2), -125,4 (м, 1F, CFCl), -122,2 (м, 4F, CF2), -121,5 (м, 2F, CF2), -113,8 (м, 2F, CF2), -83,6 (м, 3F, CF3), -68,6, -68,2 (м, 6F, CF3).
К суспензии цинковой пыли (9,81 г, 0,15 г-атом) активированной добавлением триметилхлорсилана (1 мл) в сульфолане (50 мл) в вакууме 10-0,5 Торр при перемешивании и температуре 30-40оС по каплям добавляется сложный эфир 2a-d (0,1 моль), продукт реакции отгоняется в охлаждаемый до 0оС приемник. Полученный продукт дополнительно очищается ректификацией. Чистота полученных мономеров по ГЖХ составляет 96-99%.
1,1,1,3,3,3-Гексафтор-2-(трифторметил)пропан-2-ил-2-фторакрилат (3a).
т.кип. 19-20оС/15 Торр
ЯМР 1H δ: 5,7÷6,2 (м, CH2=); ЯМР 19F δ: -119,4 (м, 1F, CF), -71,7 (м, 9F, CF3).
1,1,1,3,3,4,4,4-Октафтор-2-(трифторметил)бут-2-ил-2-фторакрилат (3b).
т.кип. 28-30оС/15 Торр
ЯМР 1H δ: 5,7÷6,2 (м, CH2=); ЯМР 19F δ: -119,4 (м, 1F, CF), -118,5 (м, 2F, CF2), -81,8 (м, 3F, CF3), -69,0, -68,6 (м, 6F, CF3).
1,1,1,3,3,4,4,5,5,6,6,6-Додекафтор-2-(трифторметил)гекс-2-ил-2-фторакрилат (3c).
т.кип. 70-71оС/15 Торр
ЯМР 1H δ: 5,7÷6,2 (м, CH2=); ЯМР 19F δ: -127,8 (м, 2F, CF2), -122,2 (c, 2F, CF2), -119,4 (м, 1F, CF), -113,8 (м, 2F, CF2), -83,5 (м, 3F, CF3), -68,6, -68,2 (м, 6F, CF3).
1,1,1,3,3,4,4,5,5,6,6,7,7,8,8,8-Гексадекафтор-2-(трифторметил)октан-2-ил-2-фторакрилат (3d).
т.кип. 60-63оС/0,5 Торр
ЯМР 1H δ: 5,7÷6,2 (м, CH2=); ЯМР 19F δ: -127,3 (м, 2F, CF2), -122,2 (м, 4F, CF2), -121,5 (м, 2F, CF2), -119,4 (м, 1F, CF), -113,5 (м, 2F, CF2), -83,6 (м, 3F, CF3), -68,9, -68,4 (м, 6F, CF3).
Работа выполнена при финансовой поддержке гранта РНФ № 14-19-01659.
Список литературы
- Акира О., Такахиро К. Заявка 60-78941 Япония//РЖХим. 1986, 78Н67.
- Акира О., Такахиро К Заявка 60-78942 Япония//РЖХим. 1987, 7Н68.
- Акира О., Такахиро К. Заявка 60-78943 Япония//РЖХим. 1986, 7Н69.
- Bosc Ό., Boutevin В., Pietrasanta Υ., Rousseau А. Заявка 2623510 Франция// РЖХим. 1990, 4С588.
- Jjaa S., Koji N., Maseru M., Takashi I. Заявка 61-121005 Япония//С. А. 1986. V. 105, 192481.
- Takashi I., Katsuhiko S., Ryuji M. et al. Заявка 61^240205 Япония//С. А. 1987. V. 106, 139496.
- Tategami Υ., Fujiia К., Furuta Μ., Tamura Т. Заявка 60-250309 Япония//С. А. 1986. V. 104, 226030 п.
- Joshiharu Т., Katsuramaru Т., Motonobu F., Tashibubnu Т. Заявка 61-208006 Япония//С. А. 1987. V. 106, 68407.
- Shigeru Μ., Masahiko О. Заявка 61-86448 Япония//С. А. 1986. V. 105, 157727.
- Акира О., Нобуюки Т., Такахиро К- Заявка 58-196218 Япония//РЖХим. 1985, 8Ф50.
- Akira О., Kazuo I. Пат. 158113 Европа//С. А. 1985. V. 104, 89225.
- Akira О., Tahashi Y., Naoaki I., Yasyfymi U. Пат. 180913 Европа//С. А. 1986. V. 105, 154307.
- Акира О., Наоси Я., Каотэру И., Харуси У. Заявка 62-127306 Япония//РЖХим. 1988, 17Т122.
- Акира О., Наофуми Я., Наонки И., Ясуся У. Заявка 61-111309 Япония//РЖХим. 1987, 100630.
- Акира О., Нобуюки Т. Заявка 61-141711 Япония//РЖХим. 1987, 12Т402.
- Акира О., Нобуюки Т. Заявка 61-186924 Япония//РЖХим. 1987, 20Т366.
- Сё Я-, Сигэаки К., Акира О., Кадзуо И. Заявка 62-33110 Япония//РЖХим. 1988,
- Богуславская Л. С, Самарина А. В., Лебедева В. И. и др.ЦПласт. массы. 1988. N 12. С. 15.
- Akira О., Nobuyuki Т., Sakahiro К. Пат. 128516 Европа//С. А. 1985. V. 102. 185964 h
- Akira О., Nobuyuki Т., Takahiro К. Пат. 128517. Европа//С. А. 1985. V. 102, 115070 g.
- Акира О., Такахиро Т., Такахиро К- Заявка 60-118808 Япония//РЖХим. 1987, 4161.
- Rouge D., Gault H.I/Compt. rend. 1960. V. 251. P. 95.
- Sedlak J. Пат. 3075002 США//С. A. 1963. V. 59. 5027 h.
- Bergmann E. D., Shahak /.//J. Chem. Soc. 1960. P. 5261.
- Ueda M., Yasawa М..//Fluorine chem. and its application. 1985. N 10. P. 1862.
- Tolman V., Spronglova P.//Ibid. 1983. V. 48. P. 319.
- Бойко В.Э., Молчанова С.И., Синько А.В., Соколов В.И., Тютюнов А.А., Хайдуков Е.В. , Игумнов С.М. // Fluorine notes, Номер 6(97) 2014
- Тютюнов A.A., Бойко В.Э., Синько А.В., Игумнов С.М., Молчанова С.И., Хайдуков Е.В., Соколов В.И. // Fluorine notes, Номер 6(97) 2014
Статья рекомендована к публикации членом редколлегии д.х.н. С.М. Игумновым
Fluorine Notes, 2015, 102, 5-6