Поступило в редакцию: сентябрь 2015
УДК 547.413.5
Fluorine Notes, 2015, 102, 1-2
Синтез новых фторалифатических функционализированных сульфонилбромидов и исследование их химических свойств
A.A. Тютюновab, Л.Ф. Ибрагимоваa, Н.Д. Каграмановa, Н.И. Делягинаa, В.Ф. Черстковa, С.Р. Стерлинa, С.М. Игумновab
1Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
2ЗАО НПО “ПиМ-Инвест”, 119991, Москва, ул. Вавилова, д. 28
e-mail: tuytuynov@rambler.ru
Аннотация: Показано, что фторалифатические сульфонилбромиды, содержащие терминальные функциональные группы, такие как алкоксикарбонильную, трифторвинильную или фторсульфонильную, являются удобными фторалкилирующими агентами, гладко присоединяясь к ненасыщенным соединениям углеводородного ряда в условиях фотохимического инициирования.
Ключевые слова: тетрафторэтан-β-сультон, этилбромдифторацетат, этилбромсульфонилдифторацетат, этоксикарбонилдифторметилирование, оксаперфторалкилсульфонилбромиды
Ранее показано, что перфторалкилсульфонилбромиды RFSO2Br могут использоваться для радикального перфторалкилирования непредельных, ароматических и гетероароматических соединений [1-5]. На основании этих данных мы предположили, что сульфонилбромиды – производные коммерчески доступных функционализированных фторалифатических бромидов – например, бромсульфонилдифторацетаты BrSO2CF2CO2R [R = Me (1a), Et (1b)], могли бы применяться в качестве реагентов для введения соответствующих фторалифатических групп.
Осуществить синтез бромсульфонилдифторацетилгалогенидов 2 реакцией тетрафторэтан-β-сультона (3) с безводным бромистым водородом – по аналогии с синтезом хлорсульфонилдифторацетилгалогенидов [6] – не удалось. При действии на сультон 3 безводного HBr в эфире с последующей обработкой реакционной смеси сухим метанолом была получена смесь метилбромдифторацетата (4) и дисульфида 5 в мольном соотношении 2:1.
Схема 1
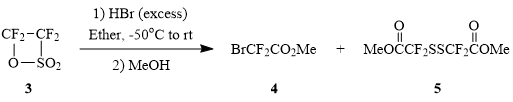
Проведение этой реакции в CH2Cl2 приводит к образованию сложной смеси продуктов, представленных на схеме 2:
Схема 2
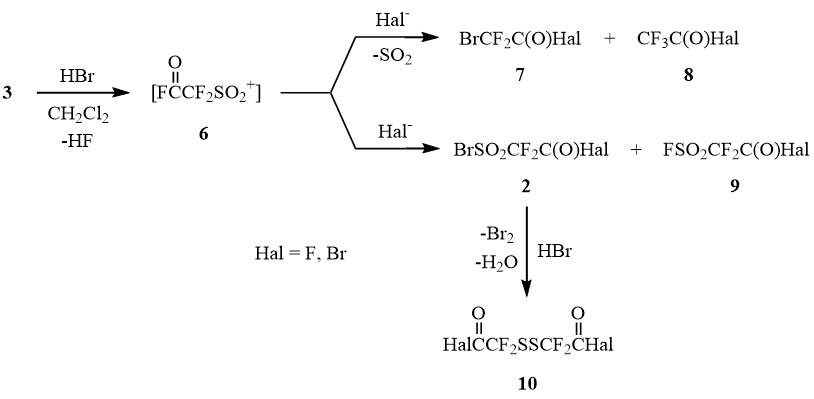
Очевидно, что различие в составе продуктов реакции отражает влияние растворителя на механизм раскрытия сультона 3. В неполярном растворителе – хлористом метилене – сультон 3 раскрывается преимущественно по электрофильному механизму с образованием сульфонильного катиона 6, который может, как подхватывать присутствующие в реакционной среде анионы (F-, Br-), давая продукты 2 и 9, так и подвергаться десульфодиоксидированию с образованием галогенангидридов бромдифторуксусной и трифторуксусной кислот 7 и 8. Предположение об образовании дисульфида 10 в результате восстановления сульфонилбромида 2 бромистым водородом подтверждает высокий выход 5 в реакции сультона 3 с AlBr3 в среде бромистого ацетила.
Схема 3
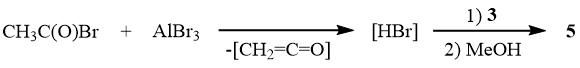
В пользу предложенной схемы свидетельствует как существенное увеличение выхода сульфонилбромидов 2 (до 40%), так и отсутствие дисульфида 10 среди продуктов реакции сультона 3 с HBr в присутствии брома, поддерживающего окислительную среду, а также состав продуктов реакции 3 с AlBr3 в среде бензоилбромида или дибромметана, где доминируют галогенангидриды 7 и 8, но отсутствуют галогенангидриды 2 и 10.
Образование сопоставимых количеств соединений 4 и 5 при проведении реакции 3 с HBr в эфире по всей вероятности отражает конкуренцию как нуклеофильного, так и электрофильного раскрытия сультона: в избытке эфира HBr дает диэтилоксонийбромид 11, взаимодействие которого с сультоном 3 приводит к промежуточному образованию сульфонилбромидов 2, количественно восстанавливающихся затем до дисульфидов 10. В то же время образование галогенангидридов бромдифторуксусной кислоты 7 вероятно связано с накоплением в реакционной массе воды и фтористого водорода, что приводит к генерации сульфонильного катиона 6, который в полярной среде элиминирует SO2 с последующим образованием бромдифторацетилгалогенидов 7.
Схема 4
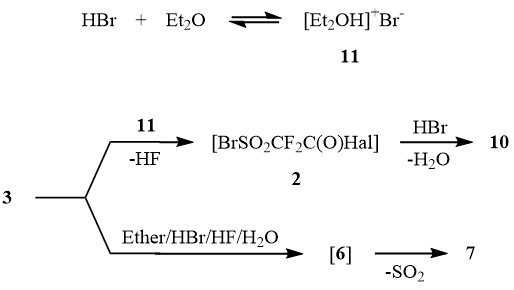
Из изложенных выше результатов следует, что получение производных бромсульфонилдифторуксусной кислоты 2 на основе сультона 3 вряд ли может рассматриваться как препаративный метод их синтеза. В то же время ранее было показано, что перфторалкансульфонилгалогениды гладко получаются галоидированием соответствующих сульфинатов металлов, образующихся при действии дитионита натрия [1] или сернистого ангидрида в присутствии Zn, Al, Mn или Cd на иод- или бромперфторалканы [7].
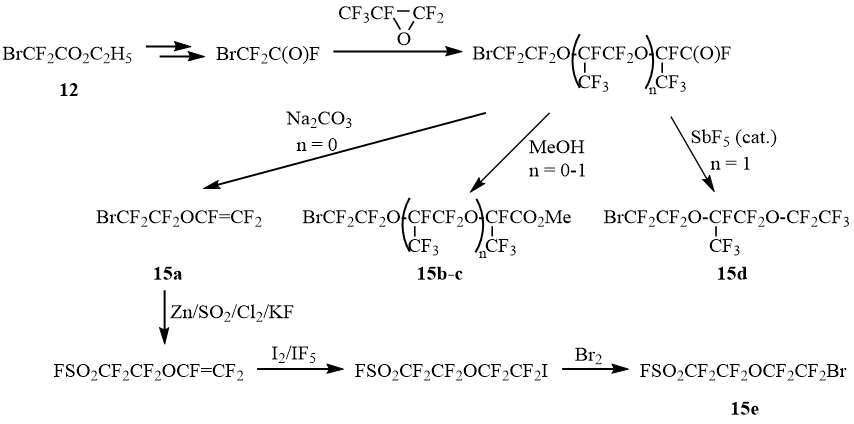
Принимая во внимание, что метилбромдифторацетат (4) и этилбромдифторацетат (12) являются коммерчески доступными продуктами, нами была предпринята попытка синтезировать этилбромсульфонилдифторацетат (1b) по методу [7].
Действительно оказалось, что реакция этилбромдифторацетата 12 с Zn/SO2 в ДМФА с последующим бромированием реакционной смеси приводит к образованию 1b с выходом 45%.
Схема 5
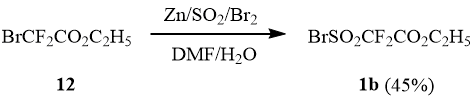
Предлагаемый метод синтеза сульфонилбромида 1b, благодаря доступности исходного бромдифторацетата 12, препаративно удобен и легко масштабируется, что в известной степени компенсирует невысокий выход целевого продукта.
Сульфонилбромид 1b устойчив при хранении в холодильнике при 4-8оС; при нагревании (100оС) или облучении солнечным светом в запаянной ампуле 1b подвергается десульфодиоксидированию на 4% за 4 часа и на 5% за 10-12 часов соответственно.
Попытка присоединения сульфонилбромида 1b к аллилтрифторацетату (13) при мольном соотношении 1b:13 = 1:1 в условиях термического инициирования (100оС/4 часа) привела к преимущественному десульфодиоксидированию 1b с образованием смеси эфира 12 и аддукта 14a:
Схема 6
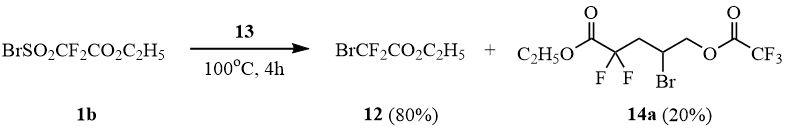
Дальнейшие исследования показали, что облучение смеси 1b:13 в мольном соотношении 1:3 солнечным светом в запаянной ампуле в течение 10-12 часов приводит к образованию аддукта 14a с 70% выходом.
Схема 7
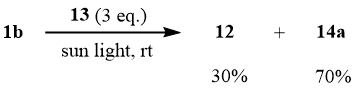
Аналогично были получены аддукты 14b-j сульфонилбромида 1b с другими непредельными соединениями углеводородного ряда. Строение и выходы полученных соединений приведены в таблице 1.
Таблица 1. Реакции этилбромсульфонилдифторацетата 1b с непредельными соединениями.
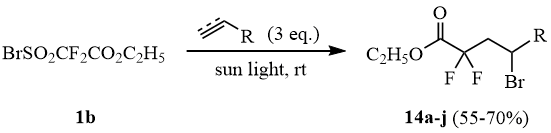
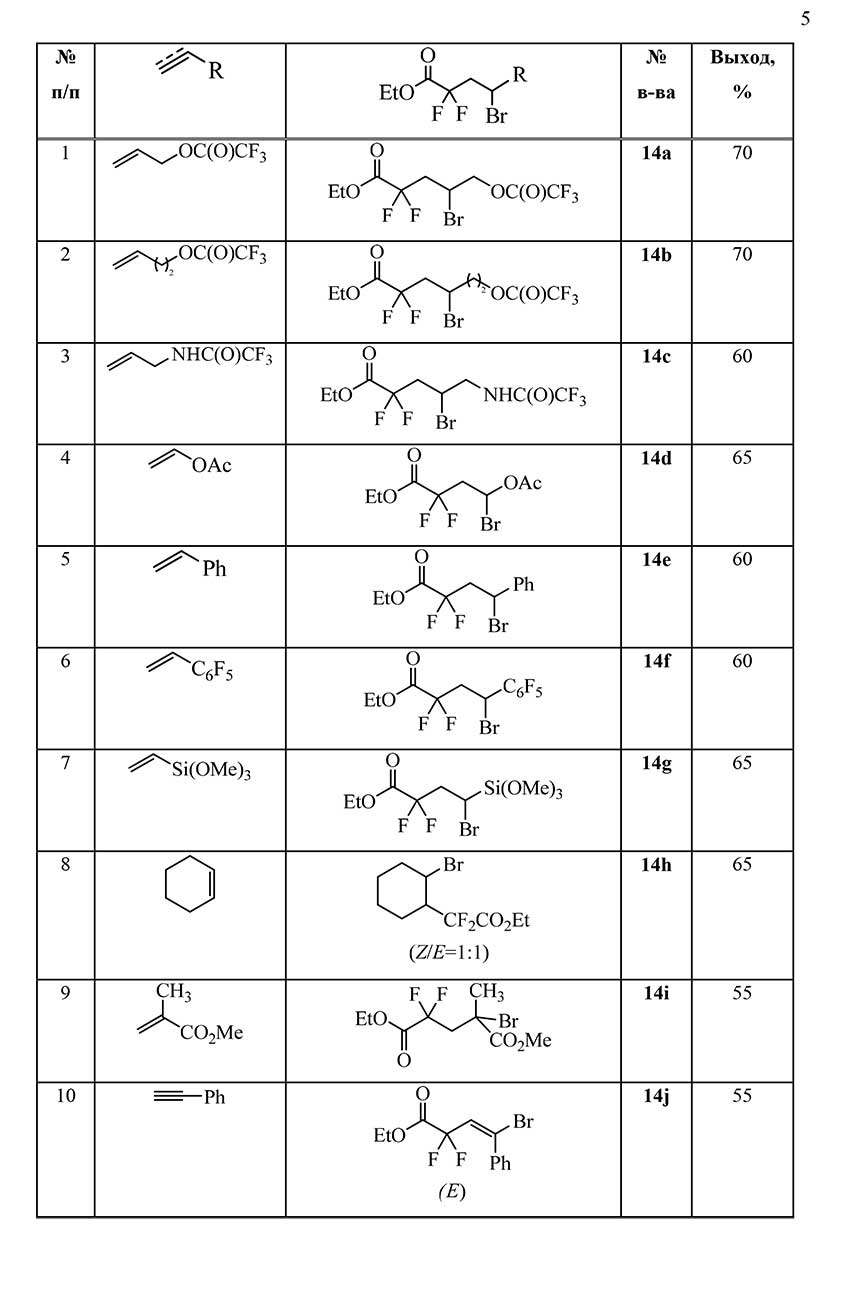
Проведенные эксперименты показали, что этилбромсульфонилдифторацетат 1 в мягких условиях на солнечном свету присоединяется к непредельным соединениям и может использоваться для введения этоксикарбонилдифторметильной группы в углеводородную цепь.
Близкой к сульфонилбромиду 1b реакционной способностью обладают также сульфонилбромиды 16a-e, полученные реакцией первичных фторалифатических бромидов 15a-e с Zn/SO2 и последующим бромированием образующихся сульфинатов цинка (схема 8). Сульфонилбромиды 16a-e присоединяются к аллилтрифторацетату (13) на солнечном свету, образуя аддукты 17a-e с выходами 60-70%:
Схема 8
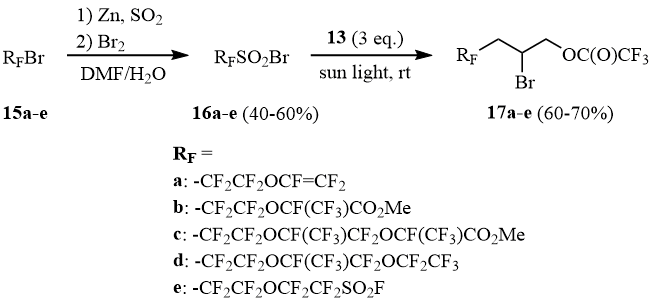
Исходные бромиды 15a-e получены на основе бромдифторацетата 12 последовательностью превращений, представленных на схеме 9 [8-11]:
Схема 9
В отличие от сульфонилбромидов 1b и 16b-e, которые на солнечном свету подвергаются десульфодиоксидированию с образованием бромидов 12 и 15b-e, сульфонилбромид 16a на солнечном свету превращается в смесь бромида 15a и циклического бромида 18:
Схема 10
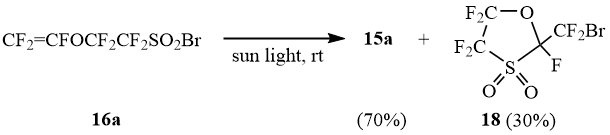
Таким образом, внедрение SO2 по C-Br- связи фторалифатических бромидов по сути является латентной формой ее активации, что позволяет компенсировать относительно низкую реакционную способность фторалифатических бромидов в реакциях радикального присоединения.
Экспериментальная часть
ЯМР 1H, 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 300 и 282 MHz, соответственно, внешний стандарт CDCl3. Химические сдвиги для 1H спектров приведены относительно остаточного сигнала растворителя (δ 7.26) и даются в м.д. относительно ТМС. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Слабопольные сдвиги имеют положительное значение. Спектры комбинационного рассеяния записаны на спектрометре Jobin Yvon LabRam. Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra).
Метод синтеза сультона 3 описан ранее [12-13].
Реакция тетрафторэтан-β-сультона (3) с HBr в эфире.
К эфирному раствору сухого HBr (18,36 г, 0,227 моль, в 100 г сухого эфира) при перемешивании и температуре -50÷-45оС добавляют по каплям тетрафторэтан- β-сультон (3) (14,55 г, 0,081 моль), температуру реакционной смеси повышают до 20÷25оС и смесь перемешивают при этой температуре в течение 30 минут. Далее смесь охлаждают до -20÷-15оС и прибавляют при перемешивании сухой метанол (15 мл), температуру смеси повышают до 20÷25оС и смесь перемешивают при этой температуре в течение 30 минут. Затем в вакууме 10-15 Торр отгоняют в охлаждаемую (до -78оС) ловушку летучие компоненты смеси. Полученный жидкий остаток (10,6 г) анализируют ЯМР 1H, 19F.
ЯМР 19F δ: -84, c, (5) (ср. [14]), -62, c, (4), мольное соотношение 5:4=1:2.
Полученную смесь промывают дважды холодной водой, нижний слой по данным ЯМР 1H, 19F содержит 5 и 4, что подтверждается данными хромато-масс-спектрометрии.
Масс-спектр бис(метоксикарбонилдифторметил)дисульфида (5) (M/Z, отнесение): 297[M+CH3]+, 282[M]+, 263[M-F]+, 235[C5H3F4O2S2]+, 218[M-2S]+(100%), 195[C5H6FO2S2]+, 181[C5H6FO4S]+, 154[C3H3FO2S2]+, 141[C3HF2OS]+, 124[C2HFOS2]+, 121[C3H2FO2S]+, 114[CF2S2]+, 109[C3F3O]+, 93[C3F3]+, 82[CF2S]+, 81[C2F3]+, 64[S2]+, 63[CFS]+, 59[C2H3O2]+, 45[CHS]+.
Реакция тетрафторэтан-β-сультона (3) с HBr в CH2Cl2.
К раствору безводного HBr (24 г, 0,3 моль) в CH2Cl2 (100 мл) при -50оС прибавляют по каплям тетрафторэтан- β-сультон (3) (18 г, 0,1 моль), по окончании прибавления реакционную смесь перемешивают 30 минут, затем прибавляют по каплям избыток сухого метанола, отогревают до комнатной температуры, реакционную массу выливают на лед, органический слой отделяют, промывают разбавленным водным раствором NaHCO3 и получают 12,4 г смеси эфиров 1a, 4, 5, FSO2CF2CO2Me и CF3CO2Me, идентифицированных методами ГЖХ, ЯМР 19F и хромато-масс-спектрометрии.
Реакция тетрафторэтан-β-сультона (3) с AlBr3 в CH3C(O)Br.
К раствору бромистого алюминия (5,4 г, 0,02 моль) в ацетилбромиде (75 г, 0,61 моль) при -50oC прибавляют по каплям тетрафторэтан- β-сультон (3) (18 г, 0,1 моль), перемешивают 30 минут, затем прибавляют по каплям избыток сухого метанола, отогревают до 20÷25oC, реакционную массу выливают на лед, органический слой отделяют, промывают разбавленным водным раствором NaHCO3 и получают 12,7 г эфира 5 (90%).
Сульфодиоксидирование этилбромдифторацетата (12).
Этилбромсульфонилдифторацетат (1b).
К охлажденному до 5оС раствору этилбромдифторацетата (12) (100 г, 0,49 моль) и SO2 (57,4 г, 0,896 моль) в DMF (350 мл) при перемешивании прибавляют Zn-порошок (14,65 г, 0,224 моль) и воду (4 мл), при этом температура смеси поднимается до 35÷45оС. Реакционную массу перемешивают на ледяной бане, охлаждая до 25÷30оС, перемешивают при этой температуре 1 час, охлаждают до 10÷15оС, прибавляют Zn-порошок (14,65 г, 0,224 моль) и воду (4 мл), при этом температура смеси поднимается до 30÷35оС. Затем реакционную массу охлаждают на ледяной бане до 25÷30оС, перемешивают при этой температуре 3 часа, охлаждают до -15÷-10оС и при перемешивании прибавляют по каплям бром (115 г, 0,72 моль). Температуру смеси поднимают до 5÷10оС, реакционную смесь выливают в ледяную воду (500 мл), добавляют при перемешивании соляную кислоту (100 мл), нижний слой отделяют, промывают разбавленной соляной кислотой, водой и перегоняют над P2O5 в вакууме, собирая фракцию 55-115oC/10 Торр.
Дальнейшей ректификацией получают 47 г (выход 45% с учетом конверсии 12), т.кип. 65-66оС/1,5 Торр. Найдено %: C, 17,93; H, 1,90; Br, 30,18; F, 14,20; S, 11,78. C4H5BrF2O4S. Вычислено (%): C, 17,99; H, 1,89; Br, 29,92; F, 14,23; S, 12,01. ЯМР 1H δ: 1,6 (т, 3H, CH3), 4,7 (кв, 2H, CH2); ЯМР 19F δ: -101 (с, CF2). Масс-спектр (M/Z, отнесение): 267[M+H]+, 239[C2H2BrF2O4S]+, 203[C4H6BrF2O2]+, 175[C3H6BrF2O]+, 59[C2H3O2]+(100%), 51[CF2H]+, 29[C2H5]+.
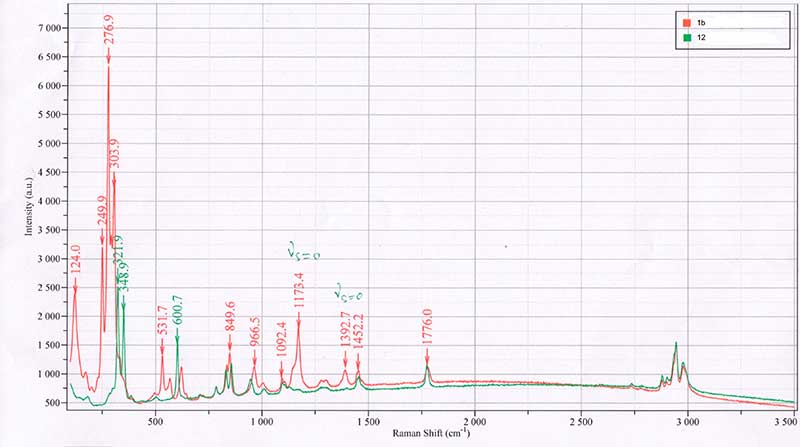
Рисунок 1. Спектры комбинационного рассеяния соединений 1b и 12.
Синтез соединений 14a-j (типовой эксперимент).
Смесь этилбромсульфонилдифторацетата (1b) (2 г, 7,5 ммоль) и олефина или фенилацетилена (22,5 ммоль) (таблица 1) помещают в пробирку из молибденового стекла (коэффициент заполнения 10%), закрытую пробкой, выдерживают в течение суток при естественной инсоляции (температура 25-30оС, пасмурная погода не оказывает существенного влияния на реакцию).
Летучие компоненты смеси отгоняют в вакууме 25÷50оC/15-0,1 Торр в ловушку (-78оС), получая в остатке аддукты 14a-j. Выходы приведены в таблице 1.
Этил-4-бром-2,2-дифтор-5-(2,2,2-трифторацетокси)пентаноат (14a).
Т.кип. 124-125оС/10 Торр. Найдено (%): C, 30,24; H, 2,94; F, 26,49. C9H10BrF5O4. Вычислено (%): C, 30,27; H, 2,82; F, 26,60. ЯМР 1H δ: 1,3 (т, 3H, CH3), 2,8 (дт, 2H, CH2CF2), 4,3 (кв, 2H, CH2CH3), 4,4 (м, 1H, CHBr), 4,6 (д, 2H, CH2O); ЯМР 19F δ: -108, -104 (ABкв, 2F, 2JFF = 282 Гц, CF2CO2Et), -77 (c, 3F, CF3). Масс-спектр (M/Z, отнесение): 357[M+H]+, 277[M-Br]+, 249[C7H6F5O4]+, 243[C7H10BrF2O2]+, 215[C6H10BrF2O]+, 195[C5H2BrF2O]+, 169[C4H4BrF2]+, 163[C7H9F2O2]+, 135[C5H5F2O2]+(100%), 115[C5H4FO2]+, 107[C4H5F2O]+, 91[C4H5F2]+, 90[C4H4F2]+, 71[C4H4F]+, 69[CF3]+, 51[CF2H]+.
Этил-4-бром-2,2-дифтор-6-(2,2,2-трифторацетокси)гексаноат (14b).
Т.кип. 145-147оС/10 Торр. ЯМР 1H δ: 1,3 (т, 3H, CH3), 2,1-2,5 (м, 2H, CH2CH2O), 2,6-3 (м, 2H, CH2CF2), 4,3 (м, 3H, CHBr, CH2CH3), 4,6 (м, 2H, CH2O); ЯМР 19F δ: -107,7, -103,3 (ABкв, 2F, 2JFF = 282 Гц, CF2CO2Et), -77 (c, 3F, CF3). Масс-спектр (M/Z, отнесение): 371[M+H]+, 370[M]+, 291[M-Br]+, 263[C9H12F5O3]+, 177[C8H11F2O2]+, 149[C6H7F2O2]+(100%), 129[C6H3F2O]+, 103[C5H7F2]+, 69[CF3]+.
Этил-4-бром-2,2-дифтор-5-(2,2,2-трифторацетамид)пентаноат (14c).
ЯМР 1H δ: 1,4 (т, 3H, CH3CH2), 2,85 (дт, 2H, CH2CF2), 3,85 (м, 1H, CHBr), 4 (м, 2H, CH2NH) 4,4 (кв, 2H, CH3CH2), 8,5 (м, 1H, NH); ЯМР 19F δ: -107,95, -103,05 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et), -77,5 (c, 3F, CF3). Масс-спектр (M/Z, отнесение): 356[M+H]+, 276[C9H11F5O3N]+, 248[C8H11F5O2N]+, 230[C7H5F5O3N]+, 214[C7H5BrO2N]+, 202[C6H3F5ON]+(100%), 182 [C6H2F4ON]+, 163[C6H2F3ON]+, 135[C4H4F3]+, 126[C3H3F3ON]+, 112[C2HF3ON]+, 69[CF3]+, 51[CHF2]+.
Этил-4-ацетокси-4-бром-2,2-дифторбутаноат (14d).
Т.кип. 125-127оС/10 Торр. ЯМР 1H δ: 1,5 (т, 3H, CH3CH2), 2,25 (c, 3H, CH3), 3,1-3,6 (м, 2H, CH2CF2), 4,6 (кв, 2H, CH3CH2), 7 (м, 1H, CHBr); ЯМР 19F δ: -107,4, -105,6 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et). Масс-спектр (M/Z, отнесение): 289[M+H]+, 209[C8H10F2O4]+, 167[C6H8F2O3]+(100%), 147[C6H7FO3]+, 51[CHF2]+, 43[C2H3O]+.
Этил-4-бром-2,2-дифтор-4-фенилбутаноат (14e).
ЯМР 1H δ: 0,9 (т, 3H, CH3CH2), 2,8-3.1 (м, 2H, CH2CF2), 3,75 (кв, 2H, CH3CH2), 5 (м, 1H, CHBr), 6,9-7,2 (м, 5H, C6H5); ЯМР 19F δ: -105,23, -104,57 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et). Масс-спектр (M/Z, отнесение): 227[M-Br]+, 207[C12H12FO2]+, 187[C12H11O2]+, 169[C7H6Br]+, 159[C10H4FO]+, 153[C9H7F2]+, 133[C9H6F]+, 131[C6H8FO2]+(100%), 115[C9H7]+, 104[C8H8]+, 103[C8H7]+, 51[CHF2]+.
Этил-4-бром-2,2-дифтор-4-(перфторфенил)бутаноат (14f).
Т.кип. 95оС/1,5 Торр. ЯМР 1H δ: 1,1 (т, 3H, CH3), 2,8-3,1 (м, 2H, CH2CF2), 4 (кв, 2H, CH3CH2), 5,3 (м, 1H, CHBr); ЯМР 19F δ: -164 (м, 2F, м-FC6F5), -156 (м, 1F, п-FC6F5), -143 (м, 2F, о-FC6F5), -109,4, -106,6 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et). Масс-спектр (M/Z, отнесение): 397[M+H]+, 317[M-Br]+(100%), 297[C12H7F6O2]+, 271[C10H2F7O]+, 269[C10F7O]+, 259[C7HBrF5]+, 249[C11H6F5O]+, 241[C7H2BrF4]+, 221[C9F6]+, 194[C8H3F5]+, 174[C8H2F4]+, 161[C7F4]+, 143[C7HF3]+, 105[C4H3F2O]+, 51[CHF2]+.
Этил-4-бром-2,2-дифтор-4-(триметоксисилил)бутаноат (14g).
ЯМР 1H δ: 1,4 (т, 3H, CH3СН2), 2,6-2,9 (м, 2H, CH2CF2), 3,4 (м, 1H, CHBr), 3,75 (с, 9Н, Si(OCH3)3), 4,4 (кв, 2H, CH3CH2); ЯМР 19F δ: -108,95, -104,05 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et). Масс-спектр (M/Z, отнесение): 319[C8H14BrF2O4Si]+(100%), 299[C8H13BrFO4Si]+, 271[C9H17F2O5Si]+, 251[C9H16BrFO5Si]+, 122[C5H2O2Si]+, 103[C4HF2O]+, 91[C3HF2O]+.
(Z, E) Этил-2-(2-бромциклогексил)-2,2-дифторацетат (14h).
ЯМР 1H δ: 1,25 (м, 3H, CH3СН2), 1,6-2,6 (м, 8H, Су), 4 (дт, 1H, CHCF2), 4,2-4,3 (м, 2H, CH3CH2), 4,5 (с, 1H, CHBr); ЯМР 19F δ: -116,5, -107,5 (АВкв, 2F, 2JFF = 282 Гц, Z-изомер), -111,31, -110,19 (АВкв, 2F, 2JFF = 282 Гц, CF2CO2Et, E-изомер). Масс-спектр (M/Z, отнесение): 285[M+H]+, 233[C8H7BrFO2]+, 205[M-Br]+(100%), 185[C10H14FO2]+, 177[C8H11F2O2]+, 157[C8H10FO2]+, 131[C7H9F2]+, 109[C6H2FO]+, 91[C6H3O]+, 81[C6H9]+, 77[C5HO]+, 51[CHF2]+.
(E) Этил-4-бром-2,2-дифтор-4-фенилбут-3-еноат (14j).
Т.кип. 110/1 Торр. ЯМР 1H δ: 0,9 (т, 3H, CH3CH2), 3,8 (кв, 2H, CH3CH2), 6,5 (т, 1H, CHCF2), 7,15 (м, 3H, м,п-HC6H5), 7,3 (м, 2H о-HC6H5); ЯМР 19F δ: -94,5 (д, 2F, 3JFH = 11 Гц, CF2CO2Et). Масс-спектр (M/Z, отнесение): 305[M+H]+, 285[M-F]+, 265[C12H10BrO2]+, 231[C9H6BrF2]+, 225[C12H11F2O2]+, 213[C9H7BrF]+(100%), 197[C11H11F2O]+, 169[C9H7F2O]+, 151[C9H5F2]+, 133[C9H6F]+, 102[C8H6]+, 91[C3HF2O]+, 76[C3H2F2]+, 75[C3HF2]+, 63[C2HF2]+, 50[CF2]+.
Общий метод синтеза сульфонилбромидов 16a-c и 16e.
К охлажденному до 5оС раствору бромида 15a-c или 15e (0,33 моль) и SO2 (38,4 г, 0,6 моль) в DMF (300 мл) при перемешивании прибавляют Zn-порошок (9,8 г, 0,15 моль) и воду (2,7 мл), при этом температура смеси поднимается до 35÷45оС. Реакционную массу перемешивают на ледяной бане, охлаждая до 25÷30оС, перемешивают при этой температуре 1 час, охлаждают до 10÷15оС, прибавляют Zn-порошок (9,8 г, 0,15 моль) и воду (2,7 мл), при этом температура смеси поднимается до 30÷35оС. Затем реакционную массу охлаждают на ледяной бане до 25÷30оС, перемешивают при этой температуре 3 часа, охлаждают до -15÷-10оС и при перемешивании прибавляют по каплям бром (76,8 г, 0,48 моль). Температуру смеси поднимают до 5÷10оС, реакционную смесь выливают в ледяную воду (500 мл), добавляют при перемешивании соляную кислоту (100 мл), нижний слой отделяют, промывают разбавленной соляной кислотой, перегоняют над P2O5 в вакууме и последующей ректификацией выделяют сульфонилбромиды 16a-c и 16e.
2-(Трифторвинилокси)тетрафторэтансульфонилбромид (16a).
Выход 60%, т.кип. 33-34оС/10 Торр. Найдено (%): C, 14,10; F, 39,04; S, 9,05. C4BrF7O3S. Вычислено (%): C, 14,09; F, 39,00; S, 9,40. ЯМР 19F δ: -137,1 (дд, 1F, 3JFF-trans = 112 Гц, 3JFF-cis = 68 Гц, OCF), -123,3 (дд, 1F, 2JFF = 90 Гц, =CF-trans), -115,8 (дд, 1F, 2JFF = 90 Гц, =CF-cis), -109,9 (с, 2F, CF2SO2Br), -82,9 (c, 2F, OCF2).
Метил-3-окса-5-бромсульфонилперфтор-2-метилвалерат (16b).
Выход 60%, т.кип. 52оС/1 Торр. ЯМР 1H δ: 4,1 (с, 3H, CH3); ЯМР 19F δ: -133,1 (м, 1F, CF), -110,2 (с, 2F, CF2SO2Br), -84,2 (c, 3F, CF3), -83,4, -75,2 (АВкв, 2F, 2JFF = 143 Гц, CF2O).
Метил-3,6-диокса-8-бромсульфонилперфтор-2,5-диметилкаприлат (16c).
Синтез сульфонилбромида 16c осуществляют по общему методу в 450 мл DMF на 0,33 моль 15c. Ректификацией выделяют фракцию 70-95oC/0,5 Торр, содержащую 70% 16c и 30% 15c.
Выход 50%. Для 16c: ЯМР 1H δ: 4,0 (с, 3H, CH3); ЯМР 19F δ: -146,5 (м, 1F, CFCF2), -133,6 (м, 1F, CFCO2Me), -110,3 (с, 2F, CF2SO2Br), -84,7 (м, 6F, CF3), -88÷-80 (м, 2F, CFCF2O), -78 (м, 2F, CF2CF2O).
3,6-Диоксаперфтор-4-метилоктансульфонилбромид (16d).
К охлажденному до 5оС раствору SO2 (38,4 г, 0,6 моль) в DMF (450 мл) при перемешивании прибавляют Zn-порошок (9,8 г, 0,15 моль) и воду (2,7 мл), при этом температура смеси поднимается до 35÷45оС. Реакционную массу перемешивают на ледяной бане, охлаждая до 10÷15оС, прибавляют Zn-порошок (9,8 г, 0,15 моль) и воду (2,7 мл), при этом температура смеси поднимается до 30÷35оС. Затем в реакционную смесь добавляют бромид 15d (96,2 г, 0,2 моль), нагревают при интенсивном перемешивании до 55÷60оС в течение 3-4 часов, охлаждают до -15÷-10оС и при перемешивании прибавляют по каплям бром (76,8 г, 0,48 моль). Температуру смеси поднимают до 5÷10оС, реакционную смесь выливают в ледяную воду (500 мл), добавляют при перемешивании соляную кислоту (100 мл), нижний слой отделяют, промывают разбавленной соляной кислотой, перегоняют над P2O5 в вакууме и последующей ректификацией выделяют сульфонилбромид 16d.
Выход 60%, т.кип. 57-58оС/15 Торр. ЯМР 19F δ: -147,1 (м, 1F, CF), -110,7 (с, 2F, CF2SO2Br), -90,9 (м, 2F, CF2O), -89,7 (м, 3F, CF3), -85,2 (м, 2F, CF2O), -82,4 (м, 3F, CF3), -78,4 (м, 2F, CF2O).
3-Окса-5-бромсульфонилперфторпентансульфонилфторид (16e).
Выход 40%, т.кип. 72-73оС/10 Торр. ЯМР 19F δ: -114,1 (м, 2F, CF2SO2F), -110,4 (с, 2F, CF2SO2Br), -83,5 (м, 2F, CF2O), -80,7 (м, 2F, CF2O), 43,9 (м, 1F, SO2F).
Синтез соединений 17a-e.
В условиях получения соединений 14a-j из сульфонилбромидов 16a-e и аллилтрифторацетата (13) получены аддукты 17a-e.
2-Бром-4,4,5,5-тетрафтор-5-трифторвинилоксипентилтрифторацетат (17a).
Выход 70%. ЯМР 1H δ: 2,75 (м, 2H, CH2CF2), 4,4 (м, 1H, CHBr), 4,6 (д, 2H, CH2O); ЯМР 19F δ: -137,6 (дд, 1F, 3JFF-trans = 112 Гц, 3JFF-cis = 68 Гц, OCF), -125,2 (дд, 1F, 2JFF = 90 Гц, =CF-trans), -118,9 (м, 2F, CF2), -117,3 (дд, 1F, 2JFF = 90 Гц, =CF-cis), -92,5 (с, 2F, CF2O), -77,5 (c, 3F, CF3). Масс-спектр (M/Z, отнесение): 351[M-Br]+, 333[C7H5BrF7O2]+, 313[C7H4BrF6O2]+, 297[C7H4BrF6O]+, 279[C7H3BrF5O]+, 269[C7HBrF3O3]+, 249[C7BrF2O3]+, 219[C5H4BrF4]+, 199[C5H3BrF3]+, 189[C5H5F4O3]+, 169[C4H4BrF2]+, 157[C5H5F4O]+, 155[C3H2BrF2]+, 145[C4H5F4O]+, 139[C5H3F4]+, 109[C4H4F3]+, 95[C3H5F2O]+, 77[C3H3F2]+, 69[CF3]+(100%), 51[CHF2]+.
Метил-3-окса-7-бром-8-трифторацетокси-2-трифторметил-2,4,4,5,5-пентафторкаприлат (17b).
Выход 70%. ЯМР 1H δ: 2,8 (м, 2H, CH2CF2), 3,95 (с, 3H, CH3), 4,5 (м, 1H, CHBr), 4,65 (м, 2H, CH2O); ЯМР 19F δ: -134,1 (м, 1F, CF), -118,8 (м, 2F, CF2CH2), -93,4, -86,0 (АВкв, 2F, 2JFF = 143 Гц, CF2O), -84,7 (c, 3F, CFCF3), -77,5 (c, 3F, CF3CO2). Масс-спектр (M/Z, отнесение): 523[M+СН3]+, 449[C9H5BrF11O3]+, 429[M-Br]+, 409[C11H7F10O5]+, 375[C10H4BrF11O4]+, 355[C10H3BrF10O4]+, 335[C10H2BrF9O4]+, 315[C9H7F8O3]+, 295[C9H6F7O3]+(100%), 275[C9H5F6O3]+, 233[C7H4F6O2]+, 199[C5H3BrF3]+, 169[C4H4BrF2]+, 151[C4H5BrF]+, 131[C4H4Br]+, 89[C4H3F2]+, 69[CF3]+, 59[C2H3O2]+.
Метил-3,6-диокса-10-бром-11-трифторацетокси-2,5-ди(трифторметил)-2,4,4,5,7,7,8,8-октафторундеканоат (17c).
Смесь стереоизомеров. Выход 60%. ЯМР 1H δ: 3,1 (м, 2H, CH2CF2), 4,2 (м, 3H, CH3), 4,7 (м, 1H, CHBr), 4,9 (м, 2H, CH2O); ЯМР 19F δ: -147,1 (м, 1F, CFCF2), -133,5 (м, 1F, CFCO2Me), -118,8 (м, 2F, CF2CH2), -88÷-80 (м, 4F, CF2OCFCF2O), -84,5 (с, 3F, CF3), -81,8 (с, 3F, CF3), -77,4 (м, 3F, CF3CO2). Масс-спектр (M/Z, отнесение): 595[M-Br]+, 540[C12H6BrF13O4]+, 521[C12H6BrF12O4]+, 461[C12H6F13O4]+, 441[C12H5F12O4]+, 325[C7H3F10O3]+, 297[C9H5F8O2]+, 199[C5H3BrF3]+, 150[C3F6]+, 131[C3F5]+(100%), 119[C5H2F3]+, 81[C2F3]+, 69[CF3]+, 59[C2H3O2]+, 51[CHF2]+, 39[C3H3]+.
6,9-Диокса-2-бром-7-трифторметил-4,4,5,5,7,8,8,10,10,11,11,11-додекафторундецилтрифторацетат (17d).
Выход 65%. ЯМР 1H δ: 3,1 (м, 2H, CH2CF2), 4,9 (м, 1H, CHBr), 5,1 (м, 2H, CH2O); ЯМР 19F δ: -147,1 (м, 1F, CF), -118,9 (м, 2F, CF2CH2), -90,5 (м, 2F, CF2O), -89,1 (с, 3F, CF3), -87,6 (м, 2F, CF2O), -84,9 (с, 2F, CF2O), -82,0 (м, 3F, CFCF3), -77,4 (c, 3F, CF3CO2). Масс-спектр (M/Z, отнесение): 615[M-F]+, 555[M-Br]+, 521[C10H5BrF15O2]+, 501[C10H5BrF14O2]+, 419[C10H2F14O2]+, 255[C7H3F8O]+, 219[C5H4BrF4]+, 199[C5H3BrF3]+, 169[C4H4BrF2]+, 155[C3H2BrF2]+, 139[C5H3F4]+, 119[C5H2F3(C2F5)]+, 95[C3H2F3]+, 89[C4H3F2]+, 77[C3H3F2]+, 69[CF3]+(100%), 51[CHF2]+.
3-Окса-7-бром-8-трифторацетокси-1,1,2,2,4,4,5,5-октафтороктансульфонилфторид (17e).
Выход 60%. ЯМР 1H δ: 3,1 (м, 2H, CH2CF2), 4,9 (м, 1H, CHBr), 5,1 (м, 2H, CH2O); ЯМР 19F δ: -118,9 (м, 2F, CF2CH2), -114,1 (с, 2F, CF2SO2F), -89,7 (м, 2F, CF2O), -83,9 (м, 2F, CF2O), -77,2 (c, 3F, CF3CO2), 43,2 (м, 1F, SO2F). Масс-спектр (M/Z, отнесение): 453[M-Br]+, 418[C7H4BrF9O3S]+, 398[C7H3BrF8O3S]+, 379[C7H3BrF7O3S]+, 335[C7H4BrF8O]+, 317[C7H4BrF7O]+, 273[C7H5F8O2]+, 253[C7H4F7O2]+, 233[C7H3F6O2]+, 213[C7H2F5O2]+, 199[C5H3BrF3]+, 183[C2F5O2S]+, 169[C4H4BrF2]+, 155[C3H2BrF2]+, 139[C5H3F4]+(100%), 119[C5H2F3]+, 117[C3H2Br]+, 109[C4H4F3]+, 100[C2F4]+, 95[C3H2F3]+, 89[C4H3F2]+, 69[CF3]+, 67[C4F]+, 51[CHF2]+, 39[C3H3]+.
2,4,4,5,5-Пентафтор-2-(бромдифторметил)-3-оксатиолан-1,1-диоксид (18).
ЯМР 19F δ: -128,1, -125,2 (ABкв, 2F, 2JFF = 214 Гц, CF2SO2), -126,8 (с, 1F, CFO), -87,4, -83,3 (ABкв, 2F, 2JFF = 90 Гц, CF2O), -68,2, -67,3 (ABкв, 2F, 2JFF = 14 Гц, CF2Br).
Список литературы
- W.-Y. Huang J.Fluor.Chem., 1992, 58, 1-8.
- W.-Y. Huang, J.-L. Chen ActaChim.Sinica, Engl.Ed., 1986, 4, 381-386.
- W.-Y. Huang, J.-L. Chen ActaChim.Sinica, Engl.Ed., 1988, 6, 150-154.
- Y.-F. Zhang, L. Lu, W.-Y. Huang ActaChim.Sinica, Engl.Ed., 1989, 7, 376-384.
- W.-Y. Huang, H.-Z. Zhang Chin.J.Chem., 1991, 9, 76-83.
- G.A. Sokol’skii, M.A. Belaventsev, I.L. Knunyants Bull.Acad.Sci.USSR, Div.chem.sci., 1967, 16, 1471-1474.
- C. Wakselman J.Fluor.Chem., 1992, 59, 367-378.
- S.M. Igumnov, G.I. Lekontseva, A.A. Shipigusev, V.F. Mukhametshin Russ.J.Appl.Chem., 2005, 78, 435-437.
- S.M. Igumnov, S.R. Sterlin, A.A. Tjutjunov, Z.A. Mikhajlova Patent RU N 2497801 (2013).
- . S.M. Igumnov, S.R. Sterlin, A.A. Tjutjunov Patent RU N 2503659 (2014).
- S.M. Igumnov, A.A. Tjutjunov Patent RU N 2475477 (2013).
- D.C. England, H. Oak U.S. Patent N 2,852,554 (1958).
- I.L. Knunyants, M.A. Dmitriev, G.A. Sokol’skii USSR Certificate of Authorship N 116578 (1958).
- W.R. Brasen, H.N. Cripps, C.G. Bottomley, M.W. Farlow, C.G. Krespan J.Org.Chem., 1965, 30, 4188-4193.
Статья рекомендована к публикации членом редколлегии д.х.н. проф. С.Р. Стерлиным
Fluorine Notes, 2015, 102, 1-2


